Aminoácidos e proteínas
-
Upload
luis-ribeiro -
Category
Documents
-
view
66.814 -
download
0
Transcript of Aminoácidos e proteínas

AminoácidosAminoácidosMolécula com um grupo ácido carboxílico e Molécula com um grupo ácido carboxílico e amina (amina (aminoamino ácidoácido).).Os aminoácidos constituem a unidade Os aminoácidos constituem a unidade estruturalestrutural das proteínas. das proteínas.Participam em Participam em funções biológicasfunções biológicas ao nível da ao nível da célula.célula.Dos 300 aminoácidos encontrados na natureza, Dos 300 aminoácidos encontrados na natureza, o ser humano apenas utiliza 20.o ser humano apenas utiliza 20.10 dos 20 L-10 dos 20 L-αα-aminoácidos não são sintetizados -aminoácidos não são sintetizados pelo ser humano nem por qualquer outro animal pelo ser humano nem por qualquer outro animal superior, tendo por isso que ser ingeridos, nas superior, tendo por isso que ser ingeridos, nas quantidades adequadas, através da alimentação quantidades adequadas, através da alimentação – – Aminoácidos essenciaisAminoácidos essenciais..

Aminoácidos (cont.)Aminoácidos (cont.)
Classificação nutricionalClassificação nutricionalAminoácidos não-essenciaisAminoácidos não-essenciais são aqueles os quais o são aqueles os quais o corpo humano pode sintetizar. São eles: corpo humano pode sintetizar. São eles: alaninaalanina, , asparaginaasparagina,,cisteínacisteína, , glicinaglicina, , glutaminaglutamina, , histidinahistidina, , prolinaprolina, , tiroxinatiroxina, , ácido ácido aspárticoaspártico, , ácido ácido glutâmicoglutâmico..Os Os aminoácidos essenciaisaminoácidos essenciais são aqueles que não são aqueles que não podem ser produzidos pelo corpo humano. Dessa forma, podem ser produzidos pelo corpo humano. Dessa forma, são somente adquiridos pela ingestão de alimentos, são somente adquiridos pela ingestão de alimentos, vegetais ou animais. São eles: vegetais ou animais. São eles: argininaarginina, , fenilalaninafenilalanina, , isoleucinaisoleucina, leucina, lisina, metionina, serina, treonina, , leucina, lisina, metionina, serina, treonina, triptofanotriptofano e valina. e valina.

Aminoácidos (cont.)Aminoácidos (cont.)
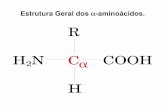
Com excepção da Com excepção da prolinaprolina, todos os , todos os aminoácidos apresentam esta estrutura aminoácidos apresentam esta estrutura geral.geral.À excepção da À excepção da glicinaglicina todos os a.a. todos os a.a. Possuem um carbono Possuem um carbono αα quiral (é um quiral (é um isómero enantiómero; possui actividade isómero enantiómero; possui actividade óptica).óptica).

Aminoácidos (cont.)Aminoácidos (cont.)Os Os aminoácidos das proteínasaminoácidos das proteínas têm têm todostodos a configuração L. Alguns a.a. a configuração L. Alguns a.a. DD livres ocorrem em tecidos vivos (livres ocorrem em tecidos vivos (D-serinaD-serina e e D-aspartato D-aspartato no tecido nervoso; no tecido nervoso; D-D-alanina alanina e e D-glutamato D-glutamato nas paredes nas paredes celulares de bactérias,…).celulares de bactérias,…).
CNH2
R1
CH3
H
CH3
C NH2H
R1
Configuração L Configuração D
A estrutura do grupo R confere aos a.a. as suas características específicas (polares vs apolares).

Aminoácidos (cont.)Aminoácidos (cont.)
Relativamente à estrutura do radical R os Relativamente à estrutura do radical R os aminoácidos podem ser classificados como:aminoácidos podem ser classificados como:- Apolares (hidrófobos);- Apolares (hidrófobos);- Polares (hidrofílicos) neutros.- Polares (hidrofílicos) neutros.Estes últimos podem ser subdivididos em 2 Estes últimos podem ser subdivididos em 2 grupos:grupos:
Ácidos (R contém grupo carboxilo);Ácidos (R contém grupo carboxilo); Básicos (R contém grupo amina).Básicos (R contém grupo amina).É a composição das cadeias laterais (R) que determina as É a composição das cadeias laterais (R) que determina as
propriedades do a.a. (ponto de fusão, solubilidade, etc).propriedades do a.a. (ponto de fusão, solubilidade, etc).

Aminoácidos (cont.)Aminoácidos (cont.)

Aminoácidos (cont.)Aminoácidos (cont.)

Aminoácidos (cont.)Aminoácidos (cont.)

Aminoácidos (cont.)Aminoácidos (cont.)As formas dos diferentes grupos As formas dos diferentes grupos ionizáveis existem em solução num ionizáveis existem em solução num equilíbrio protónico:equilíbrio protónico:
As espécies químicas que contêm igual número de grupos ionizáveis de carga oposta (carga global ZERO)
denominam-se zwiteriões.
Ác. Aspártico

Aminoácidos (cont.)Aminoácidos (cont.)
Os grupos contidos Os grupos contidos no radical R também no radical R também sofrem ionização.sofrem ionização.
O valor de pKO valor de pKaa é uma é uma
medida da tendência medida da tendência para sofrer ionização para sofrer ionização (menor pK(menor pKaa => maior => maior
tendência para tendência para libertar ião Hlibertar ião H++).).

Aminoácidos (cont.)Aminoácidos (cont.)
O ponto isoeléctrico O ponto isoeléctrico (pI)(pI) de um de um aminoácido ou proteína corresponde ao aminoácido ou proteína corresponde ao valor de valor de pHpH ao qual a molécula apresenta ao qual a molécula apresenta uma carga global nula.uma carga global nula.
O O pIpI é calculado como sendo o é calculado como sendo o valor valor médio entre os médio entre os pKapKa dos compostos dos compostos que dão origem à espécie neutraque dão origem à espécie neutra. .
No caso da alanina No caso da alanina pIpI será dado por será dado por

Aminoácidos (cont.)Aminoácidos (cont.)

Aminoácidos – Ligação PeptídicaAminoácidos – Ligação Peptídica

Aminoácidos – ExercíciosAminoácidos – Exercícios
1.1. Escreva as equações para as Escreva as equações para as dissociações da alanina, glutamato, dissociações da alanina, glutamato, histidina e lisina.histidina e lisina.
2.2. Calcule os Calcule os pIpI dos aminoácidos da alínea dos aminoácidos da alínea anterior.anterior.
3.3. Represente a equação química de Represente a equação química de formação do péptido N-Ala-His-C formação do péptido N-Ala-His-C assinalando a ligação peptíca.assinalando a ligação peptíca.Qual a carga global do péptido a Qual a carga global do péptido a pH = pH = 7,5?7,5?

ProteínasProteínas
As proteínas são polímeros de L-aminoácidos As proteínas são polímeros de L-aminoácidos associados por meio de ligações peptídicas. A sua associados por meio de ligações peptídicas. A sua estrutura está disposta segundo 4 níveis:estrutura está disposta segundo 4 níveis:
1.1. Estrutura primáriaEstrutura primária – Sequência de aminoácidos na – Sequência de aminoácidos na cadeia proteica;cadeia proteica;
2.2. Estrutura secundáriaEstrutura secundária – Disposição da estrutura – Disposição da estrutura envolvendo ligações entre a.a.’s próximos.envolvendo ligações entre a.a.’s próximos.
3.3. Estrutura terciáriaEstrutura terciária – Associação e disposição 3-D de – Associação e disposição 3-D de segmentos de estruturas secundárias.segmentos de estruturas secundárias.
4.4. Estrutura quaternáriaEstrutura quaternária – Agrupamento de estruturas – Agrupamento de estruturas terciáriasterciárias

Proteínas (cont.)Proteínas (cont.)
Estrutura primáriaEstrutura primária

Proteínas (cont.)Proteínas (cont.)
Estrutura secundáriaEstrutura secundária

Proteínas (cont.)Proteínas (cont.)
Estrutura terciáriaEstrutura terciária

Proteínas (cont.)Proteínas (cont.)Domínio da proteínaDomínio da proteína é uma secção desta com é uma secção desta com uma determinada estrutura terciária e que uma determinada estrutura terciária e que confere a capacidade para a realização de uma confere a capacidade para a realização de uma tarefa física/química específica ou para ligação tarefa física/química específica ou para ligação a um dado substrato, entre outras funções. A a um dado substrato, entre outras funções. A estrutura 3-D global de uma proteína denomina-estrutura 3-D global de uma proteína denomina-se se conformação conformação ((≠ configuração).≠ configuração).

Proteínas (cont.)Proteínas (cont.)
FoldingFolding de proteínas é o processo pelo qual de proteínas é o processo pelo qual as proteínas adquirem a estrutura terciária as proteínas adquirem a estrutura terciária que lhes é termodinamicamente mais que lhes é termodinamicamente mais favorável. É um processo por etapas em que favorável. É um processo por etapas em que as ligações mais adequadas vão sendo as ligações mais adequadas vão sendo estabelecidas e a proteína adquire a sua estabelecidas e a proteína adquire a sua estrutura funcional (conformação). estrutura funcional (conformação).
As ligações que se estabelecem são de As ligações que se estabelecem são de natureza covalente.natureza covalente.

Proteínas (cont.)Proteínas (cont.)Forças que influem na estabilidade da estrutura proteica:Forças que influem na estabilidade da estrutura proteica:- - Ligações por ponte de hidrogénioLigações por ponte de hidrogénio que se estabelecem que se estabelecem em qualquer ponto da cadeia onde as espécies químicas o em qualquer ponto da cadeia onde as espécies químicas o permitam.permitam.- - Interacções hidrofóbicasInteracções hidrofóbicas consiste no agrupamento de consiste no agrupamento de regiões hidrofóbicas da cadeia proteica de forma a regiões hidrofóbicas da cadeia proteica de forma a minimizar a sua interacção com o meio aquoso (factor minimizar a sua interacção com o meio aquoso (factor importante no importante no foldingfolding de proteínas). de proteínas).- - Interacções electrostáticasInteracções electrostáticas de atracção ou repulsão de atracção ou repulsão entre grupos com diferente carga eléctrica.entre grupos com diferente carga eléctrica.- - Interacções de Van der WaalsInteracções de Van der Waals devido à formação de devido à formação de dipolos instantâneos. Interacção de natureza electrostática dipolos instantâneos. Interacção de natureza electrostática mas menos intensa que a anterior. Verifica-se em regiões mas menos intensa que a anterior. Verifica-se em regiões das moléculas essencialmente apolares.das moléculas essencialmente apolares.

Proteínas (cont.)Proteínas (cont.)
Hélice Hélice αα – É um tipo de estrutura – É um tipo de estrutura secundária assumida pela cadeia de secundária assumida pela cadeia de aminoácidos que formam as aminoácidos que formam as proteínas e que resulta da formação proteínas e que resulta da formação de pontes de H entre um grupo de pontes de H entre um grupo carbonilo e o hidrogénio de grupos carbonilo e o hidrogénio de grupos amida.amida.Na natureza apresentam apenas Na natureza apresentam apenas uma orientação para a direita (uma orientação para a direita (right right handhand) – mais estável.) – mais estável.Estabilizadas por pontes de Estabilizadas por pontes de hidrogénio e interacções de Van der hidrogénio e interacções de Van der Waals.Waals.Os grupos hidrofóbicos orientam-se Os grupos hidrofóbicos orientam-se para o interior da hélice para o interior da hélice αα..Cada “volta” da estrutura helicoidal Cada “volta” da estrutura helicoidal acomoda, em média, 3,6 resíduos acomoda, em média, 3,6 resíduos de aminoácidos.de aminoácidos.Prolina, devido à sua estrutura Prolina, devido à sua estrutura fechada, desestabiliza a hélice fechada, desestabiliza a hélice αα..

Proteínas (cont.)Proteínas (cont.)
Ligação por ponte de hidrogénio

Proteínas (cont.)Proteínas (cont.)Folha Folha ββ – Estrutura secundária de uma cadeia – Estrutura secundária de uma cadeia proteica. Os a.a.’s estão dispostos em proteica. Os a.a.’s estão dispostos em zig-zagzig-zag com os grupos com os grupos RR de resíduos adjacentes a de resíduos adjacentes a apontar em sentido oposto.apontar em sentido oposto.Estabilidade é conferida por ligações por Estabilidade é conferida por ligações por ponte de H entre o oxig. carbonílico e o ponte de H entre o oxig. carbonílico e o hidrogénio da amida da ligação peptídica. hidrogénio da amida da ligação peptídica. Folha Folha ββ paralela paralela – cadeias adjacentes – cadeias adjacentes progridem no mesmo sentido (C-N ou vice-progridem no mesmo sentido (C-N ou vice-versa).versa).Folha Folha ββ anti-paralela anti-paralela - cadeias adjacentes - cadeias adjacentes progridem em sentido contrário.progridem em sentido contrário.

Proteínas (cont.)Proteínas (cont.)
Folha β

Proteínas (cont.)Proteínas (cont.)
Volta (turn) Volta (turn) ββ – a cadeia peptídica forma – a cadeia peptídica forma uma volta apertada estabilizada por uma volta apertada estabilizada por ligações de H entre o oxigénio carbonílico ligações de H entre o oxigénio carbonílico e o protão da amida.e o protão da amida.

Proteínas (cont.)Proteínas (cont.)Folha β paralela (a) e anti-paralela (b)

Proteínas (cont.)Proteínas (cont.)
Proteínas fibrosasProteínas fibrosasA cadeia polipeptídica está organizada relativamente à A cadeia polipeptídica está organizada relativamente à sua estrutura terciária, numa disposição paralela ao sua estrutura terciária, numa disposição paralela ao longo de um único eixo. São mecanicamente fortes e longo de um único eixo. São mecanicamente fortes e pouco solúveis em meio aquoso ou em soluções diluídas pouco solúveis em meio aquoso ou em soluções diluídas de sais. O seu papel é essencialmente estrutural (exºs.: de sais. O seu papel é essencialmente estrutural (exºs.: queratina, colagénio).queratina, colagénio).Proteínas globularesProteínas globularesSão proteínas em que a estrutura terciária assume uma São proteínas em que a estrutura terciária assume uma disposição esférica ou ovóide. Existem em maior disposição esférica ou ovóide. Existem em maior quantidade na natureza relativamente às proteínas quantidade na natureza relativamente às proteínas fibrosas (exºs: mioglobina, hemoglobina, albumina).fibrosas (exºs: mioglobina, hemoglobina, albumina).

Proteínas (cont.)Proteínas (cont.)
Proteína globular - Mioglobina
Proteína Fibrosa – Tripla hélice de colagénio

Proteínas (cont.)Proteínas (cont.)
• A estrutura, aos seus vários níveis, é influenciada pela composição da proteína em termos dos aminoácidos.
• Diferentes cadeias laterais R conferem diferentes propriedades á cadeia polipeptídica.

Proteínas (cont.)Proteínas (cont.)Ligação por ponte de enxofreLigação por ponte de enxofre
A ligação por ponte de enxofre é, tal como a A ligação por ponte de enxofre é, tal como a ligação peptídica, de natureza ligação peptídica, de natureza covalentecovalente..
É uma É uma ligaçãoligação formada num processo de formada num processo de oxidação-redução oxidação-redução entre resíduos do a.a. entre resíduos do a.a. CisteínaCisteína. O outro aminoácido contendo enxofre . O outro aminoácido contendo enxofre (metionina) não forma estas ligações.(metionina) não forma estas ligações.
Ocorrem essencialmente em meio extracelular Ocorrem essencialmente em meio extracelular (condições mais favoráveis ao processo de (condições mais favoráveis ao processo de oxidação).oxidação). R1 SH
R2 SH
R1S
R2
S+
H2O

Proteínas (cont.)Proteínas (cont.)
A CISTINA é um dipeptídeo formado por dois resíduos de cisteína, ligados por uma ponte de enxofre.
Cistina

Proteinas (cont.)Proteinas (cont.)Em resumo:Em resumo: A unidade estrutural básica das proteínas é constituída por A unidade estrutural básica das proteínas é constituída por
uma longa cadeia de L-aminoácidos. A classificação das uma longa cadeia de L-aminoácidos. A classificação das prot. pode ser feita com base na sua solubilidade, função, prot. pode ser feita com base na sua solubilidade, função, forma ou presença de um grupo prostético.forma ou presença de um grupo prostético.
Estrutura primária é estabilizada por ligações covalentes. Estrutura primária é estabilizada por ligações covalentes. Estruturas de ordem superior são estabilizadas por forças Estruturas de ordem superior são estabilizadas por forças mais fracas (ptes. de H, ligações iónicas, …).mais fracas (ptes. de H, ligações iónicas, …).
Estruturas secundárias: hélice Estruturas secundárias: hélice αα e folha e folha ββ.. FoldingFolding consiste no processo que dá origem à estrutura consiste no processo que dá origem à estrutura
terciária. O seu mecanismo é orientado por factores de terciária. O seu mecanismo é orientado por factores de estabilidade termodinâmica.estabilidade termodinâmica.
A estrutura terciária é a expressão das interacções dos A estrutura terciária é a expressão das interacções dos domínios da estrutura secundária.domínios da estrutura secundária.
Formas mais assumidas pela estrutura terciária: globular Formas mais assumidas pela estrutura terciária: globular (regulação/transporte) e fibrosa (estrutural). (regulação/transporte) e fibrosa (estrutural).

Proteinas (cont.)Proteinas (cont.)1. Discuta os potenciais contributos
das cadeias laterais dos seguintes aminoácidos para as interacções hidrofóbicas, de Van der Waals, ligações iónicas e de ponte de H numa proteína:
- Asp, Leu, Tyr e His.
2. A figura mostra que o a.a. Pro é o menos comum nas hélices α. Quais poderão ser as razões para este facto?

Proteinas (cont.)Proteinas (cont.)
3.3. Na figura, identifique a hélice direita Na figura, identifique a hélice direita e a hélice esquerda.e a hélice esquerda.
4.4. A proteína de hemoglobina no vírus A proteína de hemoglobina no vírus de de influenzainfluenza contém uma hélice contém uma hélice αα com 53 resíduos de aminoácidos.com 53 resíduos de aminoácidos.a) Qual o comprimento total da a) Qual o comprimento total da hélice (nm)?hélice (nm)?b) Quantas voltas tem?b) Quantas voltas tem?c) Cada resíduo, numa hélice c) Cada resíduo, numa hélice αα, está , está envolvido em duas ligações por pte. envolvido em duas ligações por pte. de H. Quantas, destas ligações, de H. Quantas, destas ligações, encontramos nesta hélice? encontramos nesta hélice?






![Proteínas - Joaquín Rodríguez Piaya · Preguntas de selectividad en Andalucía Proteínas Joaquín Rodríguez Piaya 1 Proteínas Año 2001 • Características [1,0] y propiedades](https://static.fdocument.org/doc/165x107/5ba4504e09d3f280548d1f78/proteinas-joaquin-rodriguez-preguntas-de-selectividad-en-andalucia-proteinas.jpg)