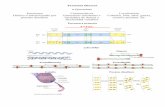
I-5 PROTEÍNAS - lourdes-luengo.es · I) Biomoléculas 5) Proteínas o carbono α. Por lo tanto,...
Transcript of I-5 PROTEÍNAS - lourdes-luengo.es · I) Biomoléculas 5) Proteínas o carbono α. Por lo tanto,...

I) Biomoléculas 5) Proteínas
I-5
PROTEÍNAS
CONCEPTO Y CARACTERÍSTICAS
Concepto: Se pueden definir como polímeros formados por la unión, medianteenlaces peptídicos, de unidades de menor masa molecular llamadas aminoácidos.
Son moléculas muy complejas. Su masa molecular es muy elevada, normalmente estácomprendida entre 6000 da y 10 6 da, son macromoléculas. Algunas proteínas estánconstituidas por la unión de varios polímeros proteicos que en ocasiones puedentambién contener otras moléculas orgánicas (lípidos, glúcidos, etc). En este últimocaso reciben el nombre genérico de prótidos.
Las proteínas son las moléculas orgánicas más abundantes en las células, más del50% del peso seco de la célula son proteínas. Están constituidas,fundamentalmente, por C, H, O y N y casi todas tienen también azufre. Algunastienen, además, otros elementos químicos y en particular: P, Fe, Zn o Cu. Elelemento más característico de las proteínas es el nitrógeno. Son los compuestosnitrogenados por excelencia de los seres vivos.
Las proteínas son moléculas específicas que marcan la individualidad de cada servivo. Son además de una gran importancia porque a través de ellas se va a expresarla información genética, de hecho el dogma central de la genética molecular nos dice:
DNA────RNA────Proteína
FUNCIONES GENERALES
Las proteínas están entre las sustancias que realizan las funciones más importantesen los seres vivos. De entre todas pueden destacarse las siguientes:
- De reserva. En general las proteínas no tienen función de reserva, pero puedenutilizarse con este fin en algunos casos especiales como por ejemplo en el desarrolloembrionario: ovoalbúmina del huevo, caseína de la leche y gliadina del trigo.
- Estructural. Las proteínas constituyen muchas estructuras de los seres vivos. Lasmembranas celulares contienen proteínas. En el organismo, en general, ciertasestructuras -cartílago, hueso- están formadas, entre otras sustancias, por proteínas.
J. L. Sánchez Guillén Página I-5-1

I) Biomoléculas 5) Proteínas
- Enzimática. Todas las reacciones que se producen en los organismos soncatalizadas por moléculas orgánicas. Las enzimas son las moléculas que realizan estafunción en los seres vivos. Todas las reacciones químicas que se producen en losseres vivos necesitan su enzima y todas las enzimas son proteínas.
- Homeostática. Ciertas proteínas mantienen el equilibrio osmótico del medio celular yextracelular.
- Transporte, de gases, como es el caso de la hemoglobina, o de lípidos, como laseroalbúmina. Ambas proteínas se encuentran en la sangre. Las permeasas, moléculasque realizan los intercambios entre la célula y el exterior, son también proteínas.
- Movimiento. Actúan como elementos esenciales en el movimiento. Así, la actina yla miosina, proteínas de las células musculares, son las responsables de la con-tracción de la fibra muscular.
- Hormonal. Las hormonas son sustancias químicas que regulan procesos vitales.Algunas proteínas actúan como hormonas, por ejemplo: la insulina, que regula laconcentración de la glucosa en la sangre.
- Inmunológica. Los anticuerpos, sustanciasque intervienen en los procesos de defensafrente a de los agentes patógenos, sonproteínas.
LOS AMINOÁCIDOS
Son las unidades estructurales queconstituyen las proteínas. Todos losaminoácidos que se encuentran en lasproteínas, salvo la prolina, responden a lafórmula general que se observa en la figura.
A partir de ahora nos referiremosexclusivamente a los aminoácidos presentesen las proteínas de los seres vivos. Estos,como indica su nombre, tienen dos gruposfuncionales característicos: el grupocarboxilo o grupo ácido (-COOH), y elgrupo amino (-NH2). La cadena carbonada delos aminoácidos se numera comenzando porel grupo ácido, siendo el carbono que tieneesta función el carbono número 1, el grupoamino se encuentra siempre en el carbono 2
J. L. Sánchez Guillén Página I-5-2
Fig. 1 Fórmula general de un amino-ácido.
Fig. 2 L-prolina; aminoácido polar noionizable. Es el único aminoácido que noresponde a la fórmula general.
COOH
HN C H
COOH
HN C H

I) Biomoléculas 5) Proteínas
o carbono α. Por lo tanto, los aminoácidostienen en común los carbonos 1 (grupocarboxilo) y 2 (grupo amino) diferenciándoseen el resto (R) de la molécula. En la fórmulageneral de la 1, R representa el resto de lamolécula. R puede ser desde un simple H- ,como en el aminoácido glicocola, a unacadena carbonada más o menos compleja enla que puede haber otros grupos aminos ocarboxilo y también otras funciones (alcohol,tiol, etc.). Las proteínas delos seres vivossólo tienen unos 20 aminoácidos diferentes,por lo que habrá únicamente 20 restosdistintos. Es de destacar el hecho de que entodos los seres vivos sólo se encuentren losmismos 20 aminoácidos. En ciertos casosmuy raros, por ejemplo en los venenos dealgunas serpientes, podemos encontrar otrosaminoácidos diferentes de estos 20 e inclusoaminoácidos que no siguen la fórmula general.
La mayoría de los aminoácidos puedensintetizarse unos a partir de otros, peroexisten otros, aminoácidos esenciales, queno pueden ser sintetizados y debenobtenerse en la dieta habitual. Losaminoácidos esenciales son diferentes paracada especie, en la especie humana, porejemplo, los aminoácidos esenciales sondiez: Thr, Lys, Arg, His, Val, Leu, Ileu, Met,Phe y Trp.
CLASIFICACIÓN DE LOS AMINOÁCIDOS
En función de sus característicasquímicas, los aminoácidos se clasifican en:
Grupo I: Aminoácidos apolares.Aminoácidos cuyo resto R no es polar. Esto es, no posee cargas eléctricas en R altener en él largas cadenas hidrocarbonadas. Estos aminoácidos, si están en granabundancia en una proteína, la hacen insoluble en agua.
Grupo II: Aminoácidos polares no ionizables. Poseen restos con cortas cadenashidrocarbonadas en las que hay funciones polares (alcohol, tiol o amida).Contrariamente al grupo anterior si una proteína los tiene en abundancia será soluble
J. L. Sánchez Guillén Página I-5-3
Fig. 3 L-leucina; aminoácido no polar.
COOH
H2N C CH2 CH
H
CH3
CH3
COOH
H2N C CH2 CH
H
CH3
CH3
Fig. 4 L-tirosina; aminoácido polar noionizable.
COOH
H2N C CH2
H
OH
COOH
H2N C CH2
H
OH
Fig. 5 L-Glutámico; aminoácido polarionizable ácido.
COOH
H2N C CH2 CH2 COOH
H
COOH
H2N C CH2 CH2 COOH
H
Fig. 6 L-Arginina; aminoácido polarionizable básico.
COOH
H2N C CH2 CH2 COOH
H
COOH
H2N C CH2 CH2 COOH
H

I) Biomoléculas 5) Proteínas
en agua.
Grupo III: Aminoácidos polares ácidos. Pertenecen aeste grupo aquellos aminoácidos que tienen más deun grupo carboxilo. En las proteínas, si el pH esbásico o neutro, estos grupos se encuentrancargados negativamente.
Grupo IV: Aminoácidos polares básicos. Son aquellosaminoácidos que tienen otro u otros grupos aminos.En las proteínas, estos grupos amino, si el pH esácido o neutro, están cargados positivamente.
ASIMETRÍA DE LOS AMINOÁCIDOS
Excepto en la glicocola, en el resto de losaminoácidos el carbono α (el carbono que lleva lafunción amino) es asimétrico. La molécula seráópticamente activa y existirán dos configuraciones:D y L. Normalmente en los seres vivos sóloencontramos uno de los isómeros ópticos. Porconvenio se considera que los aminoácidos presentesen los seres vivos pertenecen todos ellos a la serieL. No obstante, en los microorganismos (paredesbacterianas, antibióticos generados por bacterias)existen aminoácidos no proteicos pertenecientes a laserie D.
J. L. Sánchez Guillén Página I-5-4
Fig. 8 Ionización del grupoamino suplementario de unaminoácido polar ionizable ácido.
Fig. 9 Ionización del grupoamino suplementario de unaminoácido polar ionizable básico.
H2OOH-
COOH
H2N C CH2 CH2 CH2 CH2 NH2
H
COOH
H2N C CH2 CH2 CH2 CH2 NH2
H
COOH
H2N C CH2 CH2 CH2 CH2 NH3
H
COOH
H2N C CH2 CH2 CH2 CH2 NH3
H
COOH
H2N C CH2 COOH
H
COOH
H2N C CH2 COOH
H
COOH
H2N C CH2 COO
H
COOH
H2N C CH2 COO
H
H2OH3O+
Fig. 10 Asimetría de los aminoácidos. Todos los aminoácidos, excepto la glicocola, son asimétricos. Delas dos formas, la D y la L, en los seres vivos sólo existe, normalmente, la L.
C
C N
OOH
HR
H2
C
C
OOH
H
R
NH2
L aminoácidoD aminoácido

I) Biomoléculas 5) Proteínas
J. L. Sánchez Guillén Página I-5-5
COOH
H2N-C-CH3
H
COOH
H2N-C-CH3
H
COOH
H2N C CH2 CH
H
CH3
CH3
COOH
H2N C CH2 CH
H
CH3
CH3
COOH
H2N C CH
H
CH3
CH3
COOH
H2N C CH
H
CH3
CH3
COOH
H2N C CH CH2
H
CH3
CH3
COOH
H2N C CH CH2
H
CH3
CH3
COOH
H2N C CH2
H
COOH
H2N C CH2
H
COOH
H2N C CH2 CH2
H
S CH3
COOH
H2N C CH2 CH2
H
S CH3
Alanina-Ala Leucina-Leu Valina-Val
Isoleucina-Ile
Fenilalanina-Phe
Metionina-Met
Aminoácidos del Grupo I (apolares)
COOH
HN C H
COOH
HN C H
Prolina-Pro
COOH
H2N C CH2
H NH
COOH
H2N C CH2
H NH
Triptófano-Trp
Glicocola-Gly
Aminoácidos del Grupo II (polares no ionizables)
COOH
H2N C H
H
COOH
H2N C H
H
COOH
H2N C CH2 OH
H
COOH
H2N C CH2 OH
H
COOH
H2N C CH CH3
H OH
COOH
H2N C CH CH3
H OH
COOH
H2N C CH2
H
OH
COOH
H2N C CH2
H
OHCOOH
H2N C CH2 SH
HCOOH
H2N C CH2 C
H
O
NH2
COOH
H2N C CH2 C
H
O
NH2
Serina-Ser Treonina-Trp
Tirosina-Tyr
Asparragina-AsnCisteína-Cys
COOH
H2N C CH2 COOH
H
COOH
H2N C CH2 COOH
H
COOH
H2N C CH2 CH2 COOH
H
COOH
H2N C CH2 CH2 COOH
H
COOH
H2N C CH2
H NH
N
COOH
H2N C CH2
H NH
N
COOH
H2N C CH2 CH2 CH2 NH C NH2
H NH
COOH
H2N C CH2 CH2 CH2 NH C NH2
H NH
COOH
H2N C CH2 CH2 CH2 CH2 NH2
H
COOH
H2N C CH2 CH2 CH2 CH2 NH2
H
Aminoácidos del Grupo III (polares ionizables ácidos)
Aminoácidos del Grupo IV (polares ionizables básicos)
Aspártico-Asp
Glutámico-Glu
Histidina-His
Arginina-Arg
Lisina-Lys

I) Biomoléculas 5) Proteínas
EL ENLACE PEPTÍDICO
Cuando reacciona el grupo ácido de un aminoácido con el grupo amino de otroambos aminoácidos quedan unidos mediante un enlace peptídico. Se trata de unareacción de condensación en la que se produce una amida y una molécula de agua.La sustancia que resulta de la unión es un dipéptido.
CARACTERÍSTICAS DEL ENLACE PEPTÍDICO
10) El enlace peptídico es un enlace covalente que se establece entre un átomo decarbono y un átomo de nitrógeno. Es un enlace muy resistente, lo que hace posibleel gran tamaño y estabilidad de las moléculas proteicas.
20) Los estudios de Rayos X de las proteí nas han llevado a la conclusión de que el
J. L. Sánchez Guillén Página I-5-6
Fig. 12 Reacción de formación del enlace peptídico.
H N C C O H
H R1
H O
H N C C O H
H R2
H O
+
H N C C
H R1
H O
N C C O H
H R2
H O
H2O
Aminoácido 1 Aminoácido 2
dipéptido
Fig. 13 Características del enlace peptídico.

I) Biomoléculas 5) Proteínas
enlace C-N del enlace peptí dico se comporta en cierto modo como un doble enlace yno es posible, por lo tanto, el giro libre alrededor de él.
30) Todos los átomos que están unidos al carbono y al nitrógeno del enlacepeptídico mantienen unas distancias y ángulos característicos y están todos ellos enun mismo plano.
PÉPTIDOS, POLIPÉPTIDOS y PROTEÍNAS
Cuando se unen dos aminoácidos medianteun enlace peptídico se forma un dipéptido. Acada uno de los aminoácidos que forman eldipéptido les queda libre o el grupo amino oel grupo carboxilo. A uno de estos grupos sele podrá unir otro aminoácido formándose untripéptido. Si el proceso se repitesucesivamente se formará un polipéptido.Cuando el número de aminoácidos unidos esmuy grande, aproximadamente a partir de100, tendremos una proteína.
2 aa Dipéptido3 aa Tripéptidode 4 a 10 aa Oligopéptidode 10 a 100 aa Polipéptidomás de 100 aa Proteí na
Toda cadena polipeptídica tendrá en uno de sus extremos un aminoácido con elgrupo amino libre. Este será el aminoácido amino terminal (H-). En el otro extremo
J. L. Sánchez Guillén Página I-5-7
Fig. 14 Características del enlace peptídico.
Fig. 15 Modelo de esferas de la insulina,un péptido.

I) Biomoléculas 5) Proteínas
quedará libre el grupo carboxilo del últimoaminoácido, aminoácido carboxilo terminal(-OH). Toda cadena proteica tendrá por lotanto una polaridad indicada mediante unaH- y un -OH. Ejemplo:
H-Gly-Ala-Pro-Leu-Trp-Met-Ser-OH.
Muchas sustancias naturales de granimportancia son péptidos; por ejemplo: ciertashormonas, como la insulina, que regula lasconcentraciones de glucosa en la sangre yque está formada por dos cadenas de 21 y30 aminoácidos unidas por puentes disulfuro;la encefalina (5 aminoácidos) que se produceen las neuronas cerebrales y elimina lasensación de dolor o las hormonas del lóbuloposterior de la hipófisis: vasopresina yoxitocina (9 aa) que producen lascontracciones del útero durante el parto;también son péptidos algunos antibióticoscomo la gramicidina.
ESTRUCTURA O CONFORMACIÓN DE LASPROTEÍNAS
La conformación de una proteína es ladisposición espacial que adopta la molécula proteica. Las cadenas peptídicas, encondiciones normales de pH y temperatura,poseen solamente una conformación y éstaes la responsable de las importantesfunciones que realizan.
La compleja estructura de las proteínaspuede estudiarse a diferentes niveles. Asaber: primario, secundario, terciario y cua-ternario.
I) NIVEL O ESTRUCTURA PRIMARIA- Vienedada por la secuencia: orden que siguen losaminoácidos de una proteína. Va a ser de gran importancia, pues la secuencia es laque determina el resto de los niveles y como consecuencia la función de la proteína.
La alteración de la estructura primaria por eliminación, adición o intercambio de los
J. L. Sánchez Guillén Página I-5-8
Fig. 18 La insulina, una hormona decarácter peptídico, está formada por doscadenas polipeptídicas.
Fig. 17 Modelo de bolas de la ubicuitina,una proteína.
Fig. 16 Modelo de barras y esferas de laoxitocina, una hormona peptídica.

I) Biomoléculas 5) Proteínas
aminoácidos puede cambiar la configuracióngeneral de una proteína y dar lugar a unaproteína diferente. Como, además, lafunción de la proteína depende de suestructura, un cambio en la estructuraprimaria podrá determinar que la proteína nopueda realizar su función. Veamos, acontinuación, un ejemplo de estructuraprimaria:
H-Ala-Gly-Ser-Lys-Asp-Asn-Cys-Leu-Met-Ala-Ile-Trp-Gly-......-Pro-Asn-Glu-OH
II) NIVEL O ESTRUCTURA SECUNDARIA-Las característi cas de los enlacespeptídicos imponen determinadas restriccio-nes que obligan a que las proteínas adoptenuna determinada estructura secundaria.
Ésta puede ser en hélice α, hélice decolágeno o en conformación ß. Es dedestacar que las tres son configuraciones enhélice diferenciandose en el número deaminoácidos por vuelta (n) y en el diámetrode la hélice. En la hélice α, n=4; en la hélicede colágeno, n=3 y en la conformación ß,n=2. A continuación estudiaremos solo lahélice α y la conformación ß por ser lasconfiguraciones más frecuentes.
a) Estructura en hélice α. Se trata de laforma más simple y común. En este tipo deestructura la molécula adopta una disposiciónhelicoidal, los restos (R) de los aminoácidosse sitúan hacia el exterior de la hélice ycada 3,6 aminoácidos ésta da una vueltacompleta.
Este tipo de organización es muy estable,porque permite la formación de puentes dehidrógeno entre el grupo C=O de unaminoácido y el grupo N-H del cuartoaminoácido situado por debajo de él en lahélice.
b) Conformación ß. Se origina cuando la
J. L. Sánchez Guillén Página I-5-9
Fig. 20 1) Hélices alfa; 2) conformacionesbeta; 3) enlaces de hidrógeno; 4) puentesdisulfuro; 5) zonas irregulares.
Fig. 21 Hélice alfa. Mediante flechas seindican algunos enlaces de hidrógeno. R)restos de los aminoácidos.
Fig. 19 Modelo de cintas de laubicuitina.

I) Biomoléculas 5) Proteínas
molécula proteica, o una parte de la molécula,adoptan una disposición en zig-zag. La esta-bilidad se consigue mediante la disposiciónen paralelo de varias cadenas con estaconformación, cadenas que pueden pertene-cer a proteínas diferentes o ser partes deuna misma molécula. De esta manera puedenestablecerse puentes de hidrógeno entregrupos C=O y -N-H. Los restos van que-dando alternativamente hacia arriba y haciaabajo. No obstante, si la molécula presentapróximos entre sí restos muy voluminosos ocon las mismas cargas eléctricas sedesestabilizará.
Una molécula no tieneque estar constituidaexclusivamente por untipo de conformación. Lonormal es que lasmoléculas proteicaspresenten porciones conhélices α, otras partescon conformaciones ß ypartes que no tienen unaconformación definida yque se llaman zonasirregulares.
III) NIVEL O ESTRUCTURA TERCIARIA- Las proteínas no se disponen linealmente enel espacio sino que normalmente sufren plegamientos que hacen que la moléculaadopte una estructura espacial tridimensional llamada estructura terciaria. Los plieguesque originan la estructura terciaria se deben a ciertos aminoácidos, como: la prolina,la serina y la isoleucina, que distorsionan lahélice generando una curvatura.
La estructura terciaria se va a estabilizarpor la formación de las siguientes inte-racciones:
1) Enlaces o puentes de hidrógeno.2) Interacciones ácido base.3) Puentes disulfuro.
Estos últimos se forman entre grupos -SHpertenecientes a dos moléculas de cisteínaque reaccionan entre sí para dar cistina.
J. L. Sánchez Guillén Página I-5-10
Fig. 23 Conformación beta o lámina plegada beta. En la figura seobservan dos fragmentos de lámina plegada beta asociados por enlaces dehidrógeno.
Fig. 24 Estructura terciaria de unaproteína. a) conformaciones beta; b) hélicesalfa; c) zonas irregulares.
Fig. 22 Visión superior de una hélicealfa. Los números indican los aminoácidos.

I) Biomoléculas 5) Proteínas
-Cis-SH + HS-Cis- ----- -Cis-S-S-Cis-
En la estructura terciaria los restos se vana disponer en función de su afinidad con elmedio. En medio acuoso, los restoshidrófobos se sitúan hacia el interior de lamolécula mientras que los restos hidrófilos lohacen hacia el exterior.
Básicamente se distingen dos tipos deestructura terciaria: la filamentosa y laglobular, aunque muchos autores consideranque las proteínas filamentosas sonproteínas que carecen de estructuraterciaria.
Las proteínas con conformación filamentosasuelen tener función estructural, de protección o ambas a la vez y son insolubles enagua y en soluciones salinas. Por ejemplo, tienen esta conformación: la beta-queratina, el colágeno y la elastina.
Las proteínas con conformación globular suelen ser solubles en agua y/o endisoluciones salinas. Son globulares las enzimas, las proteínas de membrana ymuchas proteínas con función transportadora.
Las proteínas globulares suelen tener diferentes fragmentos con alfa-hélices yconformaciones beta, pero las conformaciones beta suelen disponerse en la periferia ylas hélices alfa en el centro de la molécula. Además, las proteínas globulares sedoblan de tal manera que, en solución acuosa, sus restos hidrófilos quedan hacia elexterior y los hidrófobos en el interior y, por el contrario, en un ambiente lipídico, losrestos hidrófilos quedan en el interior y loshidrófobos en el exterior.
IV) ESTRUCTURA CUATERNARIA- Cuandovarias cadenas de aminoácidos, iguales odiferentes, se unen para formar un edificioproteico de orden superior, se disponensegún lo que llamamos estructuracuaternaria. También se considera estructuracuaternaria la unión de una o variasproteínas a otras moléculas no proteicaspara formar edificios macromolécularescomplejos. Esto es frecuente en proteínascon masas moleculares superiores a 50.000
Cada polipéptido que interviene en laformación de este complejo proteico es unprotómero y según el número de protómeros
J. L. Sánchez Guillén Página I-5-11
Fig. 25 Estructura terciaria de unaproteína. a) hélices alfa b) conformacionesbeta; c) zonas irregulares.
Fig. 26 Los anticuerpos tienen estructuracuaternaria pues están formados por la unión,mediante puentes disulfuro, de cuatro protó-meros o dominios; dos de cadena larga y dosde cadena corta
Glúcido Glúcido

I) Biomoléculas 5) Proteínas
tendremos: dímeros, tetrámeros, pentámeros, etc.
La asociación o unión de las moléculas queforman una estructura cuaternaria, seconsigue y mantiene mediante enlaces dehidrógeno, fuerzas de Van der Waals,interacciones electrostáticas y algún que otropuente disulfuro.
Un ejemplo de estructura cuaternaria es lahemoglobina, formada por las globinas oparte proteica (dos cadenas alfa y doscadenas beta, con un total de 146aminoácidos) más la parte no proteica ogrupos hemo. O los anticuerpos, formadostambién por cuatro cadenas, dos cadenascortas y dos largas.
PROPIEDADES DE LAS PROTEÍNAS
Las propiedades de una proteína, incluso su carga eléctrica, dependen de los restoso radicales de los aminoácidos que quedan en su superficie y que podráninteraccionar mediante enlaces covalentes o no covalentes con otras moléculas. Acontinuación veremos las propiedades más importantes:
Solubilidad. Las proteínas solubles en agua, al ser macromoléculas, no formanverdaderas disoluciones sino dispersiones coloidales. Cada macromolécula proteica queda rodeadade moléculas de agua y no contacta con otras macromoléculas gemelas con lo que nopuede producirse la precipitación.
Especificidad. La especificidad de las proteínas puede entenderse de dos maneras.Por una parte, existe una especificidad de función. Esto es, cada proteína tiene unafunción concreta, diferente, normalmente, de la del resto de las moléculas protéicas.Esta es la razón de que tenganos tantas proteínas distintas, unas 100 000. Ahorabien, ciertas proteínas que realizan funciones similares en los seres vivos, porejemplo: la hemoglobina de la sangre, presentan diferencias entre las distintasespecies. Estas diferencias se han producido como consecuencia del proceso evolutivoy cada especie o incluso cada individuo, puede tener sus propias proteínasespecíficas. No obstante, estas diferencias se producen en ciertas regiones de laproteína llamadas sectores variables de las que no depende directamente se función.Mientras que otros sectores, de los que si depende la función de la proteína, tienensiempre la misma secuencia de aminoácidos. La especificidad de las proteínasdependerá por lo tanto de los sectores variables y a ellos se deben, por ejemplo, losproblemas de rechazos en los transplantes de órganos.
Por ejemplo: La insulina consta de 51 aminoácidos en todos los mamíferos, queestán distribuidos en dos cadenas, de 21 y 30 aminoácidos respectivamente, unidasmediante dos enlaces disulfuro; de éstos 51 aminoácidos, la mayoría son los mismos
J. L. Sánchez Guillén Página I-5-12
Fig. 27 Modelo de anticuerpo.

I) Biomoléculas 5) Proteínas
en todas las especies, pero unos pocos (tresde la cadena corta) varían de unas a otras.
Los diferentes papeles biológicos de éstasmoléculas van a depender de la forma queadopten en su conformación espacial.
DESNATURALIZACIÓN DE LAS PROTEÍNAS
Las alteraciones de la concentración, delgrado de acidez, de la temperatura (calor);pueden provocar la desnaturalización de lasproteínas. La desnaturalización es unapérdida total o parcial de los niveles deestructura superiores al primario y se debe ala desaparición de los enlaces débiles tipopuente de hidrógeno, Van der Waals, etc. yen realidad no afecta a los enlacespeptídicos y por tanto a la estructuraprimaria. Sin embargo al alterarse suconformación espacial, la proteína perderásu funcionalidad biológica.
En las proteínas globulares, solubles enagua, la desnaturalización está acompañadade una pérdida de la solubilidad y laconsiguiente precipitación de la disolución.
Puede existir una renaturalización casisiempre, excepto cuando el agente causantede la desnaturalización es el calor(coagulación de la leche, huevos fritos,"permanente" del cabello, etc.).
RELACIÓN ENTRE LA CONFORMACIÓN YLA ACTIVIDAD DE LAS PROTEÍNAS
La función de las proteínas depende de suconformación. Algunas proteínas, particular-mente las enzimas, tienen una o variaszonas en su molécula de las que depende sufunción llamadas: centro activo o locus. Elcentro activo de la proteína actúa uniéndosea la molécula sobre la que se va a realizar la tranformación, molécula que llamaremosligando, que debe encajar en el centro activo.
El ligando y el centro activo interaccionan mediante fuerzas químicas. Estasinteracciones se deben a que ciertos radicales de los aminoácidos de la proteína, que
J. L. Sánchez Guillén Página I-5-13
Fig. 29 Variación de la actividad de unaenzima con la temperatura. A partir de 451Cla enzima se desnaturaliza, por alterarse suconformación, y al destruirse el centro activodeja de actuar.
Act
ivid
ad e
nzim
átic
a
Temperatura óptima
Fig. 30 Variación en la actividad de unaenzima medida en función de la cantidad desubstrato (ligando) transformado a 37oC. En tse ha aumentado la temperatura hasta 70oC.
t
Varia
ción
de
la a
ctiv
idad
enz
imát
ica
tiempo
Fig. 28 Diferencias en la estructuraprimaria de la insulina de diferentesvertebrados.
B30A10A9A8
AlaValSerAlaVaca
AlaThrAsnHisPollo
AlaValGlyAlaCarnero
AlaIleGlyThrCaballo
ThrIleSerThrHombre
AlaIleSerThrCerdo
AminoácidosEspecies

I) Biomoléculas 5) Proteínas
están en el centro activo de la molécula, tienen afinidad química por determinadosgrupos funcionales presentes en el ligando. Algunas veces la unión proteína-ligandoes irreversible como ocurre con las reacciones antígeno-anticuerpo. Otras veces esperfectamente reversible.
Los aminoácidos cuyos restos constituyen el centro activo pueden estar muydistantes unos de otros en la secuencia primaria de la proteína, pero que debido alos pliegues y repliegues de la estructura terciaria, quedan localizados, espacialmente,muy próximos unos de otros y, sobre todo, formando una especie de hueco dondeencajará el ligando.
El resto de los aminoácidos de la proteínatienen como misión mantener la forma y laestructura que se precisa para que el centroactivo se encuentre en la posición correcta.Para que una proteína y un ligando se unano se reconozcan deben establecerse entreambas moléculas varios puntos de interaccióndel tipo enlaces débiles, especialmentefuerzas de Van der Waals, puentes dehidrógeno, etc.
La conformación de una proteína y por lotanto su centro activo y su función pueden alterarse si se producen cambios en lasestructura primaria. Así, por ejemplo, en la anemia falciforme, el 61 aminoácido deuna de las cadenas proteicas que forman la hemoglobina, el glutámico, ha sidosustituído por valina. Como consecuencia la hemoglobina pierde su funcionalidad y nopuede transportar convenientemente el oxígeno y los heritrocitos (glóbulos rojos)adquieren forma de hoz.
Como ya hemos visto, la conformación puede también alterarse si la proteína sedesnaturaliza por la acción de agentes como el calor y los ácidos y las bases fuertes.La desnaturalización irreversible destruye el centro activo y la proteí na no puede yarealizar su función.
J. L. Sánchez Guillén Página I-5-14
Fig. 31 Ajuste entre el ligando y elcentro activo de una enzima
coenzima
Ligando
enzima Centro activo