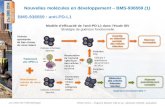
Chapitre 12 : Géométrie des molécules...
Transcript of Chapitre 12 : Géométrie des molécules...
Chapitre 12 : Géométrie des molécules organiques 1. Représentation des molécules 1.1. Isomérie
Le terme isomérie vient du grec ίσος (isos qui signifie « identique ») et μερος (meros qui signifie « partie »). L'isomérie a été remarquée la première fois en 1827, quand Friedrich Woehler a préparé l'acide cyanique (H-C=N=O) et a noté que, bien que sa composition élémentaires soit la même que celle de l'acide fulminique (H-N=C=O, préparé par Justus von Liebig l'année précédente), les propriétés chimiques de ces substances sont radicalement différentes. Cette découverte était en contraste avec les théories de l'époque dans le cadre desquelles l'on pensait que les propriétés d'une substance étaient entièrement déterminées par sa formule brute. On distingue principalement les isoméries de constitution et les stéréoisoméries (isoméries de configuration et de conformation).
Définition :
On parle d'isomérie lorsque deux molécules possèdent la même formule brute mais ont des formules semi-développées ou des formules développées différentes. Ces molécules, appelées isomères, ne diffèrent que par l’arrangement spatial de leurs atomes et ont des propriétés physiques, chimiques et biologiques différentes.
1.2. Formule topologique (Rappel de 2nde)
Parfois, les molécules sont très complexes et difficiles à représenter. On utilise alors une autre représentation qui s’appelle la formule topologique : les symboles atomes de carbone et des atomes d’hydrogène qui leur sont liés
ainsi que les liaisons C H ne sont pas représentées. Dans la formule topologique d’une molécule organique :
- La chaîne carbonée est représentée par des lignes brisées dont les extrémités et les sommets symbolisent chacun un atome de carbone ;
- Selon que la liaison entre deux atomes est simple ou multiple, la ligne est simple, double ou triple ;
- Tous les symboles des atomes sont représentés, sauf ceux des atomes de carbone et d’hydrogène qui leur sont liés.
Procédure pour trouver la formule topologique d’une molécule organique :
CH3 CH CH3
OH
OH
Formule semi-développée Chaîne carbonée Formule topologique
Exemple :
Formule semi-développée Formule topologique
C
C
C
CH
CH
CH
NH
NH
C
C
O
ONH2
NH
NH
O
ONH2
1.3. Représentation de Cram (Rappel de 1ère S)
En 1874, les chimistes J. van’t Hoff et J. A. Le Bel ont été les premiers à émettre l’hypothèse que le carbone est, dans de nombreuses molécules, au centre d’un tétraèdre. La représentation de Cram, née en 1953, permet de visualiser cette propriété en faisant appel aux règles de perspective :
Règle de représentation des molécules Exemple : le méthane
- liaison dans le plan de la figure : trait normal
- liaison en avant de ce plan : triangle plein
- liaison en arrière du plan : triangle hachuré
Exemples :
2. Isomérie de constitution
La constitution d'une molécule précise la nature et les modes d'union des atomes formant cette molécule, en incluant la multiplicité des liaisons (double, triple liaison,…) sans tenir compte de leur disposition dans l'espace.
Définitions :
L’isomérie de constitution (ou isomérie plane) correspond aux isomères ayant même formule brute mais des enchaînements d'atomes différents ; ils ne sont pas constitués des mêmes fonctions chimiques.
Isomérie de chaîne : elle représente les isomères qui diffèrent par leur chaîne carbonée (squelette). Ces isomères sont caractérisés par des propriétés chimiques identiques mais des propriétés physiques différentes ;
Isomérie de position : elle représente les isomères dont un groupement fonctionnel est placé sur des carbones différents de la chaîne carbonée : c’est la fonction qui se déplace à l'intérieur du squelette. Ces isomères sont caractérisés par des propriétés physiques différentes et des propriétés chimiques légèrement différentes ;
Isomérie de fonction elle représente les isomères dont les groupes fonctionnels sont différents, donc de propriétés physiques et chimiques différentes.
Exemples :
Isomères de chaîne (C4H10) CH3CH2CH2CH3
Butane CH3 C
HCH3
CH3
2- méthylpropane
Isomères de position (C3H7OH)
CH3 CH2 CH2 OH Propan-1-ol
Propan-2-ol
Isomères de fonction (C2H6O) CH3 CH2 OH
Éthanol
CH3 O CH3 Oxyde de diméthyle
3. Stéréoisomérie
L'étude structurale des stéréoisomères est l'objet de la stéréochimie, qu'on appelait autrefois la chimie dans l'espace et dont l'origine remonte aux travaux du chimiste hollandais J. H. van't Hoff et du chimiste français J. A. Le Bel qui émirent indépendamment en 1874 l'hypothèse du carbone tétraédrique.
CH3 CH
CH3
OH
C H
H
H
H
Définition :
La stéréoisomérie désigne la relation qu’il y a entre des molécules de constitution identique mais dont l'organisation spatiale des atomes est différente : elles ont même formule brute et même formule dévelppée ou semi-développée.
3.1. Stéréoisomérie de conformation 3.1.1. Définition
La conformation d'une molécule est la disposition spatiale que prennent les atomes ou les groupes d'atomes par suite de rotations autour de ses liaisons simples.
Définition :
Si deux molécules diffèrent par la position de leurs atomes dans l’espace lors d’une rotation autour d’une liaison
C C, il est impossible de les superposer : on dit qu’ils sont stéréoisomères de conformation.
On passe ainsi d’une conformation à l’autre sans rompre de liaison.
Exemples :
C1
C2
H
H
ClH
H
Cl
C1
C2
HH
Cl
HH
Cl
1,2-dichloroéthane
(conformation décalée)
1,2-dichloroéthane
(conformation éclipsée)
3.2. Stabilité d’une conformation
Toutes les conformations d’une molécule n’ont pas la même stabilité : la molécule adopte plus fréquemment une conformation dans laquelle les groupes d’atomes les plus volumineux sont le plus éloignés les uns des autres.
Exemple :
C CH
H
CH3H
H
OH
C CH
H
CH3
HH
OH
Propan-1-ol
(conformation décalée) Propan-1-ol
(conformation éclipsée)
La conformation la plus stable est celle dans laquelle les gros groupes sont le plus éloignés les uns des autres : la conformation décalée ici, car l’énergie potentielle de la molécule est minimale.
3.3. Conformations des molécules biologiques
La forme des molécules dans l’espace a une grande importance en biologie : pour accomplir leurs fonctions, les molécules doivent adopter des conformations leur permettant d’optimiser les interactions avec les autres molécules.
Les protéines sont des macromolécules biologiques constituées d’un enchainement d’acides -aminés, liés entre eux par des liaisons peptidiques :
L’ADN (Acide DésoxyriboNucléique) est une macromolécule existant sous différentes conformations.
Les protéines ne sont biologiquement actives que sous certaines conformations privilégiées bien précises.
4. Stéréoisomérie de configuration
La configuration d'une molécule est la disposition spatiale des atomes ou des groupes d'atomes de cette molécule.
Définition :
Si deux molécules diffèrent par la position de leurs atomes dans l’espace, il est impossible de les superposer : on dit qu’ils sont stéréoisomères de configuration (ou isomères optiques). On classe les isomères de configuration en deux grands groupes : les énantiomères et les diastéréoisomères.
Exemples :
C
I
BrCl
H
C
Cl
BrI
H
Bromo-chloro-iodométhane Bromo-chloro-iodométhane 4.1. Chiralité et énantiomérie
Définitions :
Une molécule est chirale, si elle n'est pas superposable à son image dans un miroir. Une molécule chirale possède deux formes énantiomères :
Centre chiral = atome sur lequel sont présents un ensemble d’atomes ou de groupes d’atomes dans une disposition non superposable à son image dans un miroir.
Des molécules énantiomères (du grec enantios qui signifie « opposé »), aussi appelés isomères optiques, sont deux molécules qui sont l'image l'une de l'autre par rapport à un miroir et qui ne sont pas superposables (= molécules chirales). On nomme énantiomérie la relation entre ces deux structures.
Exemples :
C
OH
CH3
HOOC
HC
OH
CH3
COOH
H
les mains sont chirales Une coquille d’escargot est chirale L’acide lactique est chiral
Miroir
Molécule chirale
Remarques :
- L’exemple classique de centre chiral est l’atome de carbone asymétrique (voir §3.2) ;
- Les énantiomères possèdent les mêmes propriétés physiques (température de changement d’état, masse volumique, etc.) et chimiques (ça dépend de l’environnement) à l’exception de leur action sur la lumière polarisée (appelée « activité optique ») mais possèdent des propriétés biologiques différentes ;
- Un mélange équimolaire de deux énantiomères est appelé mélange racémique. 4.2. Carbone asymétrique
Définition :
Un atome de carbone lié à quatre atomes ou groupes d’atomes différents est dit carbone asymétrique. On le note habituellement C*.
Règle 1 :
Le substituant prioritaire est celui dont l'atome directement lié (une liaison) au centre stéréogène possède le numéro atomique Z le plus grand.
Règle 1bis : Dans le cas d'isotopes : l'isotope de nombre de masse supérieur est prioritaire.
Règle 2 :
Quand deux substituants sont liés au centre stéréogène par des atomes identiques, on compare entre eux les atomes situés à la proximité suivante (deux liaisons) et on applique la règle 1 à cette proximité. S'ils sont identiques, on poursuit la comparaison dans les proximités suivantes de la ramification prioritaire.
Règle 3 : Les liaisons multiples sont comptées comme autant des liaisons simples et chaque atome engagé dans une liaison multiple est répété autant de fois qu'il est lié dans cette liaison.
Remarques :
- Une molécule possédant un seul atome de carbone asymétrique est toujours chirale : elle peut exister sous deux configurations différentes (deux stéréoisomères de configuration ou énantiomères), image l'une de l'autre dans un miroir ;
- Une molécule peut avoir plusieurs atomes de carbone asymétriques.
Exemple :
C*H
OH
CH3C2H5
C*H
OH
CH3H5C2
Le butan-2-ol possède un carbone asymétrique et donc deux énantiomères
4.3. Les diastéréoisomères
Définition
Les diastéréoisomères sont les stéréoisomères qui ne sont ni énantiomères ni stéréoisomères de conformation.
Les diastéréoisomères sont des stéréoisomères de configuration qui ne sont pas énantiomères.
Les diastéréoisomères sont des molécules qui ont le même enchaînement d’atomes, mais qui ne sont ni images l’une de l’autre dans un miroir plan, ni superposables, même après rotation autour de liaisons simples.
Diastéréoisomérie de configurations Z et E : lorsque, sur chacun des deux côtés d'une double liaison, on trouve deux groupes différents, on distingue deux configurations : Z et E. La libre rotation autour de la double liaison n'est pas possible, du fait de la présence d'une liaison π : il en résulte une molécule plane ayant deux configurations possibles. En utilisant l'ordre de priorité d'après les règles séquentielles Cahn Ingold et Prelog, on définit les deux isoméries :
Acide 3-aminobut-2-ènoïque
La configuration Z caractérise les diastéréoisomères dont les groupes prioritaires sont du même côté du plan formé par la double liaison (et perpendiculaire au plan de la molécule). L'abréviation Z vient de l'allemand zusammen qui signifie « ensemble ».
La configuration E caractérise les diastéréoisomères dont les groupes prioritaires sont du côté opposé l'un de l'autre par le plan formé par la double liaison. Le terme E vient de l'allemand entgegen qui signifie « opposé ».
Remarque : les diastéréoisomères présentent généralement des propriétés physiques, chimiques et biologiques différentes.
Chapitre 12 : Géométrie des molécules organiques
Les objectifs de connaissance :
- Connaître les règles de nomenclature des composés organiques (alcanes, alcools, aldéhydes, cétones, alcène, acides carboxyliques, esters, amines et amides) ;
- Connaître les groupes caractéristiques dans les alcools, aldéhydes, cétones, acides carboxyliques, esters, amines et amides ;
- On peut associer une onde à une particule (relation de De Broglie) ;
- Transferts d’énergie (émissions spontanée et stimulée d’énergie) ;
- Aspect probabiliste de certains phénomènes quantiques ;
- Fonctionnement du LASER et propriétés.
Les objectifs de savoir-faire :
- Utiliser la représentation de Cram d’une molécule organique ;
- Utiliser la représentation topologique d’une molécule organique.
Je dois savoir Oui Non
- Définition des mots : alcane, alcool, aldéhyde, cétone, ester, acide carboxylique, amine, amide,
groupe caractéristique, fonction, chaine carbonée.
- Associer un groupe caractéristique à une fonction organique. (cf. §2)
- Nommer une molécule organique. (cf. §2)




















![[] édité le 24 septembre 2016 ......rp (f)Montrer qu’il existe un polynôme S tel que n R = XpqS (g)En déduire que le coe cient de Xr dans n est égal à 2. Exercice 2 [ 02365](https://static.fdocument.org/doc/165x107/60dbc33b3e837373ba4d1a69/-dit-le-24-septembre-2016-rp-fmontrer-quail-existe-un-polynme.jpg)


![ABRÉVIATIONS - scolarite.fmp-usmba.ac.mascolarite.fmp-usmba.ac.ma/cdim/mediatheque/e_theses/132-09.pdf · d’hyperparathyroïdie ou de remodelage osseux élevé [9], et qu’il](https://static.fdocument.org/doc/165x107/5ec6eba358128a57c406f9d3/abrviations-dahyperparathyrodie-ou-de-remodelage-osseux-lev-9-et.jpg)