Serie sobre azúcares
-
Upload
rodolfo-alvarez-manzo -
Category
Education
-
view
1.699 -
download
0
Transcript of Serie sobre azúcares

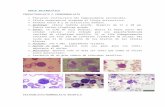
Ejercicios de Carbohidratos 1. Nombra al siguiente azúcar:
Solución: PASO A: Identifica los carbonos cuya configuración relativa son opuestos a los de la α-D-glucopiranosa:
PASO B. Identifica que azúcar de la tabla de aldohexosas posee una configuración relativa opuesta o inversa en los carbonos 2 y 4 con respecto a la D-glucosa:
El nombre es α-D-talopiranosa.
O
OH
HO
OHHO
OH
O
OH
HO
OHHO
OH
O
OH
HOO
HO
OH
α-D-glucopiranosa
αα
H23
46 D
inverso
inverso
2
4 4
2

2 Ejercicios de Carbohidratos
2. Representa a la β-L-galactopiranosa. Solución: PASO A: Identifica en la tabla de aldohexosas que carbonos tienen una configuración relativa opuesta entre la D-glucosa y la D-galactosa:
PASO B: Representa a la β-D-galactopiranosa tomando en consideración la estructura de la β-D-glucoopiranosa:
PASO C: traza la imagen especular de la β-D-galactopiranosa para obtener la representación de la β-L-glucopiranosa:
O
OH
HOO
HO OH
β-D-glucopiranosa
β
H23
46 D
O
OH
HOO
HO
OH
β-D-galactopiranosa
β
H
6inverso
O
OH
HOO
HO
OH
β-D-galactopiranosa
H
O
OH
OHO
HO
HO
β-L-galactopiranosa
H
4 4

3 Ejercicios de Carbohidratos
3. En un libro de texto aparece el siguiente disacárido. Nómbralo.
Solución: PASO A: “Hidroliza” a la molécula.
PASO B: Compáralos con la estructura de la D-glucopiranosa correspondiente (el anómero α o β de este compuesto).
PASO C: Identifica a los azúcares. En el caso del primero de ellos, la configuración relativa del carbono 4 es la contraria. De acuerdo con la tabla de aldohexosas, el epímero en el carbono 4 de la D -glucosa en la D-galactosa:
OOH
H HH
OHH
OHH
HO
OH H
OHH
OHH
OHH
HO
OOOH
H
OH
HH
OHH
OHH
HO
OH
OH
H
OHH
OHH
OHH
HO
+H2O
β-D-glucopiranosa
iguales
OHO
H
OH
HH
OHH
OHH
HO
OH
HO
H
OHH
OHH
OHH
HO
OH
HO
OH
HH
OHH
OHH
HO
β
234
D
inverso
α-D-glucopiranosa
OH
HO
H
OHH
OHH
OHH
HO
α23
4
D
β
α

4 Ejercicios de Carbohidratos
Por tanto, el primero de los azúcares se trata de la β-D-galactopiranosa. En el caso del segundo azúcar, éste se trata. Como se aprecia en la imagen, de la tomando en consideración la estructura de la α-D-glucoopiranosa. PASO D: Asigna el nombre. Considerando la estructura del compuesto
el nombre es β-D-galactopiranosil-(1→4)-α-D-glucopiranosa. 4. Representa a la lactulosa, O-β-D-galactopiranosil-(1→4)-β-D-fructofuranosa.
Solución: PASO A: Representa a la β-D-galactopiranosa y a la Β-D-fructofuranosa. Del ejercicio anterior tomamos a la primera de estas sustancias, y del archivo sobre azúcares la estructura de la segunda:
OOH
H HH
OHH
OHH
HO
OH H
OHH
OHH
OHH
HO
Oβ1 4
α
OHO OH
OH
OHOH
OH
HOO
HOHO
β-D-galactopiranosa β-D-fructofuranosa
β β
OH1
43
25
65
12
6
4
3
4 4

5 Ejercicios de Carbohidratos
PASO B: Ubica al carbono anomérico (el 1) de la β-D-galactopiranosa y al 4 de la Β-D-fructofuranosa. A continuación condensa ambas moléculas perdiendo una de agua; con ello estarás obteniendo la estructura de la lactulosa:
5. Representa los productos que se generan a partir de la D-xilosa cuando (a) se le oxida con reactivo de Tollens; (b) se le metila exhaustivamente con sulfato de dimetilo, (c) se le trata con tres equivalentes de fenilhidrazina, (d) se le trata con un exceso de NaIO4; (e) se homologa su cadena vía una síntesis de Kiliani-Fischer; (f) es sometido a una degradación de Ruff.
Solución:
Con el reactivo de Tollens se produce el ácido aldónico correspondiente: (a)
NOTA: esta reacción no es específica: el medio de reacción puede isomerizar al producto (esto es, la configuración relativa de los carbonos puede alterarse, obteniéndose así mezclas de compuestos) e, incluso, degradar la cadena. Esto mismo se observa con los reactivos de Fehling y Benedict. Para obtener
OHO OH
OH
OHOH
OH
HOO
HOHO
β-D-galactopiranosa β-D-fructofuranosa
β β
H O H
OHO
OH
OHOH
HOO
HOOH
β-D-galactopiranosil-(1 4)-β-D-fructofuranosa
β β
O
1
43
256
1
OH1
43
25
6
OH
51
2
6
4
32
3
4
5
6
OHHHHOOHH
OH
H O
OHHHHOOHH
OH
H O
TollensOHHHHOOHH
OH
O O
D-xilosa
aldonato derivado de la D-xilosa

6 Ejercicios de Carbohidratos
específicamente los productos de oxidación deseados pueden emplearse oxidantes alternativos: el agua de bromo y el ácido nítrico:
La mayor oxidación por parte del HNO3 es consecuencia de su potencial estándar de electrodo (Eº) más positivo (oxidante más fuerte).
Con el (CH3)2SO4 se metilan todos los hidroxilos (si se representa el azúcar en (b) la forma cíclica, recuerda que en ese caso el OH del carbono anomérico no se metila):
OHHHHOOHH
OH
H O
OHHHHOOHH
OH
O Oexclusivamente el aldonato derivado de la D-xilosa
Br2H2O
OHHHHOOHH
OH
H O
OHHHHOOHH
OH
HO Oexclusivamente el ácido aldárico derivado de laD-xilosa
HNO3
O
OHHHHOOHH
OH
H O
(CH3)2SO4exceso
OCH3HHCH3OOCH3H
OCH3
H O
D-xilosa

7 Ejercicios de Carbohidratos
Recuerda que el segundo equivalente de fenilhidrazina oxida al carbono 2: (c)
El HIO4 oxida a lo carbonos que poseen enlaces con oxígeno, siempre que (d) estos se encuentren enlazados entre sí. A continuación, cada línea representa una etapa de oxidación:
OHHHHOOHH
OH
H O
D-xilosa
HN NH2
OHHHHOOHH
OH
H NHN
H O H
HN NH2
(oxidación)
OHHOOHH
OH
H NHN
N
N
HH
H H H
+
HN NH2
H O H
NHHOOHH
OH
H NHN
HNosazona de
la D-xilosa
OHHHHOOHH
OH
H O
H H
O
H OH
O
H OH
O
H OH
O
H OH
O
4 HIO4
Originamente un aldehido, se oxida una vez, se transforma en ácido carboxílico.
Originamente un alcohol, se oxida dos veces, se transforma en ácido carboxílico.
Originamente un alcohol, se oxida dos veces, se transforma en ácido carboxílico.
Originamente un alcohol, se oxida dos veces, se transforma en ácido carboxílico.
Originamente un alcohol, se oxida una vez, se transforma en aldehido.

8 Ejercicios de Carbohidratos
Para el caso del alargamiento de la cadena vía Kiliani-Fischer: (e)
Para el caso de la degradación de Ruff: (f)
OHHHHOOHHOH
H O
D-xilosa, una aldopentosa
H-CN
OHHHHOOHHOH
HC
OH
N
OHHHHOOHHOH
HC
OH
N
H2
Pd/BaSO4
H2
Pd/BaSO4
OHHHHOOHHOH
H OH
OHHHHOOHHOH
HO H
N
H2O, H
H N H
H H
H2O, H
H N HH
H N HH
OHHHHOOHHOH
H OH
OHHHHOOHHOH
HO H
O
H
H
O
D-gulosa, una aldohexosa
D-idosa, una aldohexosa
OHHHHOOHHOH
H O
D-xilosa, una aldopentosa
Br2, H2O OHHHHOOHHOH
HO O
CaCO3 OHHHHOOHHOH
O O
2
Ca2+
CO2
H2O2Fe3+
OH
HHOOHHOH
+ CO32-
D-treosa, una aldopentosa