Los metales - UNAMdepa.fquim.unam.mx/amyd//archivero/003_ESTRUCTURA...los metales, es esencial...
Transcript of Los metales - UNAMdepa.fquim.unam.mx/amyd//archivero/003_ESTRUCTURA...los metales, es esencial...

1
26/11/08 ESTRUCTURA MOLECULAR 372
Los metalesLos metales• En química, un metal (del griego µεταλον) es
un elemento que forma cationes fácilmente yque tiene enlaces metálicos.
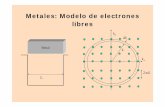
• Una manera de describir a los metales espensar en ellos como si fuesen un enrejadotridimensional (lattice) de iones positivosinmersos en un mar de electrones o si seprefiere rodeados por una nube de electronesdeslocalizados.
• Los metales además son uno de los tres tiposde elementos que se distinguen por suenergía de ionización y sus propiedades deenlace (además de los metaloides y los nometales).
26/11/08 ESTRUCTURA MOLECULAR 373
Los metalesLos metales• Una definición mas moderna del significado de
metal procedente de la teoría que mejor losexplica es: son elementos que tienen en suestructura electrónica bandas de conducción ybandas de valencia.
• Con esta definición, se amplía el concepto demetal, incluyendo otras sustancias además de losmetales a los polímeros metálicos y a los metalesorgánicos.
• La mayoría de los metales son inestablesquímicamente.
• Casi todos reaccionan con oxigeno a presión ytemperatura ambiente.
26/11/08 ESTRUCTURA MOLECULAR 374
Los metalesLos metales• Variando notablemente la escala de tiempo en que esto
ocurre.• Así, los metales alcalinos reaccionan muy rápidamente,
seguidos inmediatamente por los alcalinotérreos.• Los metales de transición tardan mucho más en oxidarse y
hay algunos de ellos cuya lentitud es prácticamenteinfinita.
• Algunos metales forman una barrera de óxido en susuperficie evitando con ello la corrosión.
• Una de las características de los metales es que puedencombinarse químicamente entre ellos mismos de manerano estequiométrica formando lo que conocemos con elnombre de aleación.
26/11/08 ESTRUCTURA MOLECULAR 375
Los metalesLos metales• Así, una aleación es una mezcla (estequiométrica o
no) de al menos dos elementos (uno de los cualeses necesariamente un metal).
• De los millones de ejemplos que pueden existir delas aleaciones las más comunes son las siguientes:– Acero (Hierro y carbón),– Latón (Cobre y cinc),– Bronce (Cobre y estaño),– Duraluminio (Aluminio y Cobre),– Acero inoxidable o stainless steel (Hierro, cromo,
carbón y Níquel),– Plata sterling (Plata y cobre),– Oro de 14 kilates (Oro y cobre)
• Hay aleaciones especiales con 10 elementos.

2
26/11/08 ESTRUCTURA MOLECULAR 376
Propiedades fPropiedades físísiicascas• Las más importantes son;
– Buenos conductores del sonido, el calor y laelectricidad (hay un acarreador)
– Son maleables (pueden laminarse)– Son dúctiles (pueden hacerse alambres)– Tienen lustre (brillan)– Son duros (casi todos)– Son densos
26/11/08 ESTRUCTURA MOLECULAR 377
OmnidireccionalidadOmnidireccionalidad• Los enlaces metálicos deben ser omnidireccionales.• Es decir no tienen requerimientos geométricos que deban
satisfacerse• Si pensamos en canicas sumergidas en agua dentro de una
caja, en principio podríamos empujarlas a cualquier lugardentro de la caja y el agua seguirá rodeándolas
• Debido a esta propiedad única del enlace metálico, estepuede mantener su existencia a pesar de que loempujemos o jalemos de cualquier manera.
26/11/08 ESTRUCTURA MOLECULAR 378
Las estructuras de los metalesLas estructuras de los metales• Este acomodo será el más sencillo posible
(piensen en las maneras que se puedenacomodar un conjunto de canicas o pelotas deping-pong).
• Se acercarán las unas alas otras hasta que lasinteracciones repulsivassean importantes.
• A este arreglo se le conocecomo arreglo empacadocerrado (close packing)
26/11/08 ESTRUCTURA MOLECULAR 379
Las estructuras de los metalesLas estructuras de los metales• Así cuando tenemos un conjunto de canicas las
podemos empujar en cualquier dirección
• Y si estuvieran rodeadas de agua, el agua sedesplazaría dejándolas pasar

3
26/11/08 ESTRUCTURA MOLECULAR 380
Las estructuras de los metalesLas estructuras de los metales• Este arreglo puede representarse de varias
maneras, la tres más importantes son estas:– Bolas y palos (Ball & Stick)
– Llenado espacial (Space filling)
– Cúbico cortado (Cut away cubic)
26/11/08 ESTRUCTURA MOLECULAR 381
Las estructuras de los metalesLas estructuras de los metales• Existen tres maneras en las que los átomos
metálicos puedenacomodarse entre sí.
– Cúbico centrado en el cuerpo
Body centered cubic (BCC)
– Cúbico centrado en la cara
Face centered cubic (FCC)
– Empaquetamiento hexagonal
Hexagonal close packed (HCP)
26/11/08 ESTRUCTURA MOLECULAR 382
Las estructuras de los metalesLas estructuras de los metales• Y la manera en que cada uno de los metales se
empaca es la que se muestra aquí:
26/11/08 ESTRUCTURA MOLECULAR 383
Los metales fundidosLos metales fundidos• En un metal fundido aunque la estructura
ordenada se ha roto, el enlace metálico aunestá presente.
• De hecho puede decirse que el enlacemetálico no se rompe por completo sinohasta que el metal hierve.
• Muchas de las propiedades que consideramospresentan específicamente los metales soncompatibles con el modelo de enlacesiguiente:– Se describe como la compartición de los
electrones libres por una lattice de átomosmetálicos.

4
26/11/08 ESTRUCTURA MOLECULAR 384
El enlace metEl enlace metáliálicoco– Los átomos metálicos típicamente tienen electrones de
valencia que se encuentran ligados débilmente a susnúcleos (energías de ionización pequeñas)
– De esta manera que pueden deslocalizarse formando unmar de electrones
– En el que se encuentran sumergidos los cores (kernels)de los átomos metálicos.
– Es decir de iones positivos.– El hecho de que la mayoría de los metales sea sólido y
que en general tengan puntos de fusión muy grandes,implica que el enlace entre ellos es fuerte.
– Debe explicar la manera en que los átomos metálicosestán unidos en un metal o una aleación.
26/11/08 ESTRUCTURA MOLECULAR 385
El enlace metEl enlace metáliálicoco• Además, dado que el enlace metálico es no
polar o muy poco polar (las diferencias deelectronegatividad entre los metales son muypequeñas y garantizan esto.)
• De manera que los electrones no tienenpreferencia por ninguno de los átomos de lalattice y por tanto se deslocalizan a lo largode toda la estructura cristalina del metal.
• Este tipo de enlace explica la mayoría de laspropiedades de los metales.
26/11/08 ESTRUCTURA MOLECULAR 386
El enlace metEl enlace metáliálicoco• Ahora bien para explicar mejor el comportamiento
del enlace metálico, presentaremos un ejemplo:• El sodio tiene una estructura electrónica1s22s22p63s1.
• Cuando dos átomos de sodio se juntan, el electrónde valencia de un átomo de sodio (3s1) comparte elespacio del electrón de valencia del siguiente átomoal superponerse los orbitales donde se encuentrancada uno.
• Dando como resultado la formación de un orbitalmolecular, de la misma manera que en que se formaun enlace covalente.
• Sin embargo hay una pequeña diferencia, es que enesta ocasión, cada átomo de sodio está tocando aotros 8 átomos vecinos y a cada uno de estos a suvez lo tocan otros 8 átomos
26/11/08 ESTRUCTURA MOLECULAR 387
El enlace metEl enlace metáliálicoco• Y así hasta que se toman en cuenta todos los átomos
del pedazo de metal que estamos analizando.• Es evidente que el número de orbitales
moleculares debe ser muy grande pues cadaorbital solo puede tener dos electrones.
• Y esto conduce a que los electrones se puedanmover libremente dentro de estos orbitalesmoleculares pues están deslocalizados y así cadaelectrón puede separarse de átomo.

5
26/11/08 ESTRUCTURA MOLECULAR 388
El enlace metEl enlace metáliálicoco• Ahora bien el metal se mantendrá unido gracias a
las fuerzas de atracción entre los núcleos positivosy los electrones deslocalizados.
• A esto se le llama el modelo de la lattice de ionespositivos en el mar de electrones.
26/11/08 ESTRUCTURA MOLECULAR 389
El enlace metEl enlace metáliálicoco• Este modelo
permiteexplicartanto laductilidadcomo lamaleabilidadde los metalesconsiderandoque los átomospueden deslizarseunos sobre otros
26/11/08 ESTRUCTURA MOLECULAR 390
El enlace metEl enlace metáliálicoco• Si ahora empleamos el mismo argumento con el
magnesio, nos encontraremos con que este metaltiene enlace más fuerte y por tanto un punto defusión mayor.
• El Mg tiene una capa de valencia con la estructura3s2.
• Cuando ambos electrones se deslocalizantendremos que ahora en el mar de electrones delMg hay el doble de electrones que en el Na.
• Y por lo tanto los cores de cada Mg tienen eldoble de la carga que los del Na.
• De esta manera, la interacción electrostática seráel cuádruple en el Mg, respecto a la del sodio.
26/11/08 ESTRUCTURA MOLECULAR 391
El enlace metEl enlace metáliálicoco• De manera más realista, debemos decir que cada
Mg tiene un protón más que el sodio y por tantohabrá mayor atracción.
• Además dado que el Mg tiene un radioligeramente menor que el Na, por tanto loselectrones deslocalizados o no, se verán másatraídos.
• En el caso de los metales de transición, nosencontramos que ahora los electrones de valenciaincluyen tanto a los electrones s como a los d.
• Dado que entre más electrones haya envueltos enel sistema, mayor será la atracción
• De manera que esto traerá como consecuenciaque los puntos de fusión sean mayores.

6
26/11/08 ESTRUCTURA MOLECULAR 392
El enlace metEl enlace metáliálicoco• La mayoría de los elementos y un gran número de
sustancias, tienen propiedades metálicas. O sea:– Estructuras tridimensionales infinitas– Números de coordinación grandes– Distancias interatómicas mayores que las de las
moléculas diatómicas– Conductividad térmica grande– Conductividad eléctrica grande– Lustre, ductilidad y maleabilidad– Propiedades magnéticas complejas
26/11/08 ESTRUCTURA MOLECULAR 393
El enlace metEl enlace metáliálicoco• La teoría más sencilla que explica algunas de estas
propiedades es la del mar de electrones.
• En esta teoría, imaginamos que una red decationes Mn+, en medio de un mar de electronesdeslocalizados.
• Este modelo puede racionalizar propiedades talescomo la maleabilidad o la ductilidad, ya que losátomos se pueden mover sin que haya repulsión,pues el mar de electrones actúa como unlubricante apantallando la carga de los cationes.
26/11/08 ESTRUCTURA MOLECULAR 394
El enlace metEl enlace metáliálicoco• Un compuesto iónico por lo contrario, al moverse
una hilera de átomos genera repulsión y así seproduce el rompimiento de la red.
• Con este mismo modelo, también se puedenvisualizar y explicar fácilmente las propiedadeseléctricas de los metales.
• Sin embargo, un tratamiento más detallado delenlace metálico requiere del modelo de orbitalesmoleculares para explicar estas mismaspropiedades.
26/11/08 ESTRUCTURA MOLECULAR 395
El enlace metEl enlace metáliálicoco• Para entender completamente las propiedades de
los metales, es esencial utilizar la teoría de losorbitales moleculares.
• En el caso de las moléculas covalentes simples,cuando dos átomos se ponían juntos, formanorbitales de enlace, de no enlace y de antienlacede diferente energía.
• Estos orbitales se describen por medio defunciones de onda.
• Y el punto esencial que se colige de la teoría esque en una molécula al combinar N orbitalesatómicos deben obtenerse N orbitales.

7
26/11/08 ESTRUCTURA MOLECULAR 396
El enlace metEl enlace metáliálicoco• Reglas derivadas de la teoría de orbitales
moleculares que nos ayudarán a derivar lasbandas que describen la estructura de lossólidos son:
1. Escoger los orbitales atómicos con los que seharán los orbitales moleculares. (Esto es elconjunto base o basis set)
2. Al combinar N orbitales deben obtenerse Norbitales
3. El principio de exclusión de Pauli implica quecada orbital molecular debe ocuparse porelectrones que tienen sus espines apareados
26/11/08 ESTRUCTURA MOLECULAR 397
El enlace metEl enlace metáliálicoco4. Al resolver la ecuación de Schröedinger se
pueden obtener soluciones que modelan losorbitales moleculares formados por orbitalesatómicos
5. Las áreas de interferencia constructiva entrelos orbitales atómicos producen lasuperposición de los orbitales dando a lugar ala acumulación de densidad electrónica.
6. Esto conduce a que el orbital molecularformado tenga menor energía que los que loforman. Manteniendo así a la moléculaunida.
26/11/08 ESTRUCTURA MOLECULAR 398
El enlace metEl enlace metáliálicoco7. En los orbitales de enlace la probabilidad de
encontrar al electrón en uno, ambos o entrelos átomos es muy grande.
8. Las áreas de interferencia destructiva entrelos orbitales atómicos producen que no hayasuperposición de los orbitales atómicos dandoa lugar a una reducción en la densidadelectrónica.
9. Conduciendo la formación de los orbitales deantienlace, los cuales tienen mayor energíaque los atómicos.
26/11/08 ESTRUCTURA MOLECULAR 399
El enlace metEl enlace metáliálicoco10. En un orbital de antienlace la probabilidad de
encontrar al electrón entre los átomos es 0(cero) en tanto que la de encontrarlo en unou otro es 1 (uno).
• Siguiendo las reglas anteriores es posibledeterminar la estructura electrónica decualquier material.
• Así al combinar dos orbitales atómicosobtenemos dos moleculares, así:

8
26/11/08 ESTRUCTURA MOLECULAR 400
El enlace metEl enlace metáliálicoco
Orbital de Orbital de antienlaceantienlace
Orbital de enlaceOrbital de enlace26/11/08 ESTRUCTURA MOLECULAR 401
El enlace metEl enlace metáliálicoco• Ahora, si en vez de dos átomos empleamos diez,
esto producirá diez orbitales moleculares, cincode enlace y cinco de antienlace.
• Si nos fijamos en la separación entre cadaconjunto de orbitales, se puede ver que conformese incrementa el número de orbitales molecularesal aumentar el número de átomos,
• Se observa que el espaciamiento entre el orbitalde menor energía de enlace y el de mayor energíade antienlace llegará a un máximo:
26/11/08 ESTRUCTURA MOLECULAR 402
El enlace metEl enlace metáliálicoco
Incremento en el nIncremento en el número de átomosúmero de átomos
26/11/08 ESTRUCTURA MOLECULAR 403
El enlace metEl enlace metáliálicoco• La estructura electrónica del metal más simple es
la del Li• Al vaporizarse,
el Li(s) producemoléculas de Li2.
• El enlace de estamolécula puededescribirsecon la TOM así:
• La energía dedisociación deeste sistema es relativamente débil.

9
26/11/08 ESTRUCTURA MOLECULAR 404
El enlace metEl enlace metáliálicoco• Consideremos ahora un cristal de n átomos (n=2,
6, 1020) donde los n orbitales 2s del Li, seencuentran a distancias en que se superponenpara dar como resultado n orbitales moleculares.
26/11/08 ESTRUCTURA MOLECULAR 405
El enlace metEl enlace metáliálicoco• Para cuando el número de orbitales moleculares
es de muy grande, (1020 orbitales moleculares deenlace y 1020 orbitales de antienlace):
• Se ha formadouna banda
• la de valencia
26/11/08 ESTRUCTURA MOLECULAR 406
El enlace metEl enlace metáliálicoco• Al considerar que los orbitales p del metal
también sesuperponeny por tantotambién secombinan,se tiene:
• Que ahorahay dosbandas
26/11/08 ESTRUCTURA MOLECULAR 407
El enlace metEl enlace metáliálicoco• Cuando la diferencia de energía entre las bandas
cambia, cambiarán las propiedades del metal.• Con lo cual se
explica elcomportamientode los metales y lossemiconductores

10
26/11/08 ESTRUCTURA MOLECULAR 408
El enlace metEl enlace metáliálicoco• Debido a que el número de átomos que
interactúan en un material es muy grande, losniveles energéticos están tan cercanos unos aotros, que podemos decir que tales nivelesforman una banda.
• La banda llena de mayor energía (la cual porcierto es análogo al orbital HOMO) se le conocecon el nombre de banda de valencia.
• La siguiente banda, que en general no tieneelectrones a menos de que se excite al sistema,(y que claro, es equivalente al orbital LUMO deuna molécula) se le llama banda de conducción.
26/11/08 ESTRUCTURA MOLECULAR 409
El enlace metEl enlace metáliálicoco• La energía que separa a ambas bandas se le da el
nombre de barrera energética Eg
• Una manera de representar a la barreraenergética y a las propias bandas es la que sepresenta a continuación.
• La manera en que se llenen estas bandas y eltamaño de la barrera energética determinará laspropiedades del material.
26/11/08 ESTRUCTURA MOLECULAR 410
El enlace metEl enlace metáliálicoco• Así, si el material es un metal, la barrera
energética entre la banda de valencia (llena) y lade conducción (vacía), es muy pequeña.
• Entonces, un número significativo de electronesse pueden excitar en la banda de valencia,pasando a la banda de conducción, creandoagujeros en la de valencia.
• Así, los electrones en la banda de conducción ylos agujeros en la banda de valencia puedenmoverse dentro del material, permitiendo conello la conducción de la electricidad.
26/11/08 ESTRUCTURA MOLECULAR 411
El enlace metEl enlace metáliálicoco• Un metal:

11
26/11/08 ESTRUCTURA MOLECULAR 412
El enlace metEl enlace metáliálicoco• En el caso de los materiales semiconductores,
la barrera energética aun es pequeña• Pero suficientemente grande como para que
el número de electrones que pueden excitarsetérmicamente y encontrarse en la banda deconducción sea relativamente pequeño.
• De manera que estos materiales conducirán laelectricidad exiguamente.
26/11/08 ESTRUCTURA MOLECULAR 413
El enlace metEl enlace metáliálicoco• Semiconductor
26/11/08 ESTRUCTURA MOLECULAR 414
El enlace metEl enlace metáliálicoco• Por último en el caso de los materiales aislantes,
la barrera energética es tan grande que no esposible promover a la banda de conducción pormedio de la energía térmica disponible
• De manera que los electrones no se puedenmover, haciendo que el material no conduzca lacorriente eléctrica.
26/11/08 ESTRUCTURA MOLECULAR 415
El enlace metEl enlace metáliálicoco• Aislante