1-Reacción con metales a) Na(s)+H 2 O = NaOH(ac)+½H 2 (g) agente oxidante H
-
Upload
juan-manuel-escobar-martinez -
Category
Documents
-
view
232 -
download
0
Transcript of 1-Reacción con metales a) Na(s)+H 2 O = NaOH(ac)+½H 2 (g) agente oxidante H


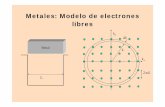
1-Reacción con metales

a) Na(s)+H2O = NaOH(ac)+½H2(g)
agente oxidante
H<0
0 1+ 2- 1+ 2- 1+ 0
agente reductor

b)Mg(s)+H2O(g) = MgO(s)+H2(g)
H<0
Calcula el valor de la variación de entalpía para
esta reacción química.

2-Reacción con no metales
C(s) + H2O = CO(g) + H2(g)
gas de agua
ΔH>0

3-Reacción con óxidos

a- Reacción con óxidos metálicos
BaO(s) + H2O = Ba(OH)2(ac)
Clasifica la reacción química en redox o no redox.

b- Reacción con óxidos no metálicos
P2O5 (s) +3H2O = 2H3PO4(ac)
Clasifica las sustancias señaladas atendiendo a su
composición.

El agua como disolvente

a) Disociación de sólidos iónicos en agua
NaCl

δ-
δ+
δ-
δ+
δ+
δ+
δ+
δ+
δ-
δ-
δ-
δ-
+
-
--
-
--
-
---
--
-
+
+
+
+
++
+
+
++
interacción ion-dipolo
sólido iónico
agua
δ-δ+
δ-
δ-
δ-
δ+
δ+
δ+
δ+
δ-
δ+
δ- δ-
δ-
δ-
δ-δ-
δ-
δ+
δ+
δ+
δ+
δ+
δ+
δ-δ+

Se orientan las moléculas
b) Proceso de ionización de moléculas polares en el agua
H-Cl δ+ δ-
δ+ δ-
δ+
OHH
δ+
δ+
δ-
HH
Oδ+
δ+
δ-
OH
H
OHH
δ+
δ+
δ-

H
δ+
δ-
δ+
OHH
δ+
δ+
δ-
HH
O
δ+δ-
δ+
OH
H
OHH
δ+
δ+
δ-
ClH-Cl
Se establecen interacciones dipolo-dipolo.
δ+
δ-

H
Cl-
δ+
δ+
δ-
OH
H
OHH
δ+
δ+
δ-
δ+
δ+
δ-
OHH
δ+
OH
Hδ+
δ-
δ+
δ+
O HH
δ+
δ+
δ-
OH
H
Se forman iones
hidratados
ion hidronio
ion cloruro
+
+
δ-

HCl (g) + H2O H3O+(ac) + Cl-(ac)
H+
cede H+ gana H+
ácido base
teoría ácido-base de Brönsted-Lowry

J. N. J. N. BrönstedBrönsted T. M. LowryT. M. Lowry
epígrafe 4.3
“Química 10º grado”





![τα βιβλία των επιτυχιών · 13 Εφαρμογή 1 Ποια η συγκέντρωση διαλύματος ΝaOH 12 % w/v; [Δίνεται: Μ r (NaOH) = 40] Λύση](https://static.fdocument.org/doc/165x107/5e3c7b769face049f60191ea/-13-1-ff.jpg)