tipi di legame nei solidi: covalente e ionico legami sp3 ... · legame metallico e legami ibridi -...
Transcript of tipi di legame nei solidi: covalente e ionico legami sp3 ... · legame metallico e legami ibridi -...

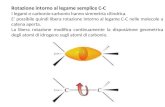
tipi di legame nei solidi:covalente e ionico
il legame è dovuto all’energia di attrazionecoulombiana di origine elettronica:
C
CC
CC
σσ
legami sp3 delcarbonio nel diamante
- legame ionico: derivadall’attrazione coulombiana fra
ioni → elettroni localizzati invicinanza degli ioni, simmetria
sferica intorno agli ioni, energia dilegame abbastanza alta,solido
indeformabile ma fragile, isolante
- legame covalente: di norma localizzatolungo la direzione interatomica (legame σ)
→ alta energia di legame,solido molto duro, indeformabile, isolante
cristallo di Na Cl
ClNa
Na
Cl
Cl
Na
Na

legame idrogeno elegame di van der Waals
legami idrogeno dellamolecola H2O nel ghiaccio
- legami ponte-idrogeno: formatida molecole polari con uno o più
atomi di idrogeno → l’idrogenoionizzato, con le sue piccole dimensioni
fa da “ponte” fra due ioni O
O
H
O
O
H
H
O
H
- legame molecolare o di van derWaals: deriva dall’attrazione
coulombiana fra dipoli creati perfluttuazione della “nuvola
elettronica” → energia di legamemolto debole, si forma solo a bassa
T, tipico di gas nobili
E ≈ 3 meV→ T=E/kB
T≈ 3·10-3/10-4
≈ 30 K

legame metallico elegami ibridi
- legame metallico: dovuto alla“nuvola di elettroni quasi liberi”→simmetria sferica intorno agli ioni
(sfere impacchettate), energie di legamemodeste, elettroni delocalizzati, solidi
duttili, buoni conduttori
struttura a sfere “impacchettate”tipica di molti metalli
- legame ibridi:compresenza di
legami di tipo diverso
cristallo di grafite: legamicovalenti σ -sp2 nel piano,
legami metallici π fra i piani
C
C
CC
C
C C

1 eV/at≈ 6 ·1023 eV/mol
≈105 J/mol≈ 25 kcal/mol
energie dicoesione
deglielementi

1 eV/at≈ 6 ·1023 eV/mol
≈105 J/mol≈ 25 kcal/mol
energie dicoesione disolidi ionici
*** calcolato con il modello diMadelung:- fra “primi vicini” attrazionecoulombiana con repulsione apiccole distanza;- fra “secondi vicini” repulsionecoulombiana;- fra “terzi vicini” attrazionecoulombiana; ...

reticolo: sequenza periodica di punti nello spazio che lo riempie senza lasciare dei vuoti
reticoli e strutture cristallini
cnbmalRrrrr
++=con l, m, n numeri interi
ar
br
cr
Rr
Rr
Rr
→ vettore del “reticolo diretto”
l=2m=4n=1

i 14 reticoli di Bravais

reticolo e basebase: gruppo di atomi che siripete con la sequenzaperiodica del reticolo
può essere: monoatomica→ metalli
biatomica → diamante, Na Cl
ClNa
NaCl
Na
Na
ClNa
ClNa
C
C
C
C
C
C

reticolo, base estruttura
cristallinabasepoliatomicadell’YBCO
yttrio
bario
rame
ossigeno
cella
reticolo+
base=
struttura

difetti reticolari
vacanza
dislocazione
impuritàsostitutiva
impuritàinterstiziale
atomointerstiziale

diffrazione di raggi X da un reticolo
θ
condizione di Bragg:la differenza di
cammino fra i dueraggi deve essere
multipla di λ2d sinθ = n λ

diffrazione di raggi X da un reticolo
λnRkRk =⋅−⋅rr
'ˆˆ
nknRkk p2)'( ==⋅− λrrr
Gnkkrrr
=− '
“vettore del reticolo reciproco”RR
G ˆp2=
r
altro modo di calcolare ladifferenza di cammino

il “reticolo reciproco”
vettore del“reticolo reciproco”
RR
G ˆp2=
r
kr
'kr
'kr
−
Gra
r
br
cr
R
con R=distanza fra i pianiR
Gp2
=r
modulo: direzione:
perpendicolare al piano
caG ˆˆˆ ×=
Gkkr
hrr
h =− )'(
impulso trasferito al reticolo:il reticolo può assorbiretrasferimenti di quantità dimoto solo in multipli interi diuno dei suoi vettori G
r

diffrattometri
cristallo singolo
polveri

raggi X e“reticolo reciproco” -G11
-G102θ10
2θ11
granelli dipolvere ruotati
G11
d11
G11
d10
G10 k-G10
k’
2θ10
massimo Gesplorabile =2k
G11 = √ 2 G10

diffrazione di Laue

spettro di diffrazione