Chemical Engineering Thermodynamics · PDF file`Entalpi Reaksi: ΔH dari suatu persamaan...
Transcript of Chemical Engineering Thermodynamics · PDF file`Entalpi Reaksi: ΔH dari suatu persamaan...

9/27/2011
1
Chemical Engineering ThermodynamicsChemical Engineering ThermodynamicsPrepared byPrepared by:: DrDr NNINIEKINIEK FajarFajar PuspitaPuspita M Eng AugustM Eng August 20201111Prepared byPrepared by:: Dr. Dr. NNINIEKINIEK FajarFajar PuspitaPuspita, M.Eng August, , M.Eng August, 20201111
2011Gs_III_Heat Effects2011Gs_III_Heat Effects
1
Lesson Topics Descriptions
Lesson 3ALesson 3A Internal Energy & E h l
Mendiskusikan definisi energi dalam dan entalpi untuk l b id l i d d Enthalpy real substances, gas-gas ideal, cairan dan padatan
incompresible.
Lesson 3BLesson 3B Thermo Properties: NIST WebBook
Mempelajari bagaimana menggunakan NIST Webbookuntuk mencapai data termodinamika.
Lesson 3CLesson 3C Heat Capacities Mempelajari 2 definisi kapasitas panas: kapasitas panas volume konstan dan kapasitas panas tekanan konstan.
L 3DL 3D H th ti l M l j i l hi t tik t k t k Lesson 3DLesson 3D Hypothetical Process Paths
Mempelajari alur proses hipotetik untuk menentukan perubahan sifat termal dari keadaan awal ke keadaan akhir.
Lesson 3ELesson 3E Phase Changes Mempelajari bahwa alur proses hipotetik untuk alat yang bermanfaat dalam mempertimbangakan perubahan sifat terkait dengan perubahan fase.
2

9/27/2011
2
Three Principle Phases, RevisitedThree Principle Phases, RevisitedIn Chapter 2, Lesson B, we discussed the difference between the three principle phases: gas, liquid, and solid. Just to refresh your memory, move the mouse pointer over the sketch of each phase to see a description of that phase.
We also learned that, in all the phases, molecules move randomly with three different types of motion: vibration, rotation and translation.
Molecules move randomly with three different types of motion: vibration, rotation and translation. Molecules are separated by large distances and travel a long way between collisions.
Molecules move randomly with all three types of motion, but they are much closer together and cannot travel very far between collisions
phase.
Atoms or molecules have all three types of motion, but they are very close together. As a result, they cannot travel far at all before they collide. Each molecule moves about within a small space and does not tend to wander.
The internal energy of the system is defined as the sum of the kinetic energies in the vibrational, rotational and translational motion of molecules.
closer together and cannot travel very far between collisions.
3
U(T,P) for Real SubstancesU(T,P) for Real Substances
Real Substances: Kenaikan T meningkatkan gerakan molekuler a.l. vibrasi, rotasi dan
l i d j k ikk Utranslasi, dan juga akan menaikkan U.Kenaikan P sedikit menurunkan U pada sebagian besar nilai T dan P.Fenomena ini terjadi karena interaksi molekuler yang kompleks.
UUUUEnergi Internal
sangat dipengaruhioleh T
Energi Internal kurang dipengaruhioleh P
U = U(T, P)
U as a Function of T at Constant P U as a Function of P at Constant T
TT PP4

9/27/2011
3
U(T) for Ideal GasesU(T) for Ideal Gases
Ideal Gases: Kenaikan T meningkatkan gerakan molekuler vibrasi, rotasi dan translasi.Kenaikan T juga menaikkan U.Perubahan P tidak mempengaruhi U karena tidak adanya interaksip g ymolekuler.U = U(T)
5
U(T) for Incompressible LiquidsU(T) for Incompressible LiquidsIncompressible Liquids & Solids :
Kenaikan T meningkatkan gerakan molekuler secara vibrasi, rotasi and translasi.Kenaikan T juga meningkatkan U.Perubahan P tidak mempengaruhi U karena volume molar dari senyawa incompressible tidak dipengaruhi oleh perubahan tekanan. Konsekuensinya, tidak ada perubahan pada ekstensinya dan sifat interkasi molekuler dankarena itu, U tidak berubah juga.
U = U(T)
6

9/27/2011
4
Internal Energy_Energi dalam(E dalam) adalah total energi kinetik (Ek) dan energi potensial (Ep) yang ada didalam sistem. Formula E = Ek + Ep. Namun karena besar energi kinetik dan energi potensial pada sebuah sistemNamun karena besar energi kinetik dan energi potensial pada sebuah sistemtidak dapat diukur, maka besar energi dalam sebuah sistem juga tidak dapatditentukan, yang dapat ditentukan adalah besar perubahan energi dalam(E) suatu sistem.Perubahan energi dalam dapat diketahui dengan mengukur kalor (q) dankerja (w), yang akan timbul bila suatu sistem bereaksi. Oleh karena itu, perubahan energi dalam dirumuskan dengan persamaan :
E = q - w.q q
Jika sistem menyerap kalor, q +. Jika sistem mengeluarkan kalor q –
w Jika sistem melakukan kerja, w+Jika sistem dikenai kerja oleh lingkungan, w-
7
Energi dalamJadi bila suatu sistemmenyerap kalor darilingkungan sebesar 10 kJ, dansistem tersebut juga
E = q - wj g
melakukan kerja sebesar 6 kJ, maka perubahan energidalam-nya akan sebesar 16 kJ.
q =+10 kJ w = - 6 kJ
w + (dilakukan)jika jumlah kalor yang masuk =jumlah kerja yang dilakukan,
PERUBAHANPERUBAHAN ENERGIENERGI DALAMDALAM BERNILAIBERNILAI 0 0
SISTEM
SISTEMq + (masuk)
q – (dikeluarkan)
dan
jika jumlah kalor yang dikeluarkan = jumlah kerja yang dikenakan pada sistem.
Artinya, tidak ada PERUBAHAN ENERGI DALAM yang terjadi pada sistem.
SISTEM w - (dikenakan)
8

9/27/2011
5
EnthalpyEntalpi adalah istilah dalam termodinamika yang menyatakan jumlah energiinternal dari suatu sistem termodinamika ditambah energi yang digunakanuntuk melakukan kerja. Entalpi tidak bisa diukur, tetapi nilai perubahannya bisa dihitung.Secara matematis, perubahan entalpi dapat dirumuskan sebagai berikut:ΔH = ΔU + PΔV
di mana:H = entalpi sistem (joule) U = energi dalam (joule) P k d (P ) P = tekanan dari sistem (Pa) V = volume sistem (m3)
http://id.wikipedia.org/wiki/Entalpi"9
Enthalpy reaksiEntalpi = H
= Kalor reaksi pada tekanan tetapPerubahan entalpi adalah
perubahan energi yang menyertai peristiwa perubahan kimiapada tekanan tetap.
a. Pemutusan ikatan membutuhkan energi (= endoterm)Contoh: H2 2H - A kJ ; ΔH= + A kJ
b. Pembentukan ikatan memberikan energi (= eksoterm)C h 2H H + A kJ ΔH A kJContoh: 2H H2 + A kJ ; ΔH = - A kJ
http://id.wikipedia.org/wiki/Entalpi"10

9/27/2011
6
Entalpi Pembentukan Standar ( ΔHf ):ΔH untuk membentuk 1 mol persenyawaan langsung dari unsur-unsurnyayang diukur pada 298 oK dan tekanan 1 atm.
Contoh: H2(g) + 1/2 O2(g) H20 (l) ; ΔHf = -241.8 kJ
11
Entalpi Penguraian Standar:ΔH dari penguraian 1 mol persenyawaan langsung menjadi unsur-unsurnya(= Kebalikan dari ΔH pembentukan).
Contoh: H2O (l) H2(g) + 1/2 O2(g) ; ΔH = +241.8 kJ
12

9/27/2011
7
Entalpi Pembakaran Standar (ΔHc ):ΔH untuk membakar 1 mol suatu senyawa dengan O2 dari udara yang diukur pada keadaan standar (298 oK dan tekanan 1 atm).
Contoh: CH4(g) + 2O2(g) CO2(g) + 2H2O(l) ; ΔHc = -802 kJ
13
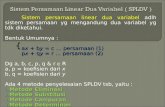
Entalpi Reaksi:ΔH dari suatu persamaan reaksi, di mana zat-zat yang terdapat dalampersamaan reaksi dinyatakan dalam satuan mol dan koefisien-koefisien
k i h b l t d hpersamaan reaksi harus bulat sederhana.
Contoh: 2Al + 3H2SO4 Al2(SO4)3 + 3H2 ; ΔH = -1468 kJ
http://wps.prenhall.com/wps/media/objects/3080/3154819/blb0507.html14

9/27/2011
8
Entalpi Netralisasi:ΔH yang dihasilkan (selalu eksoterm) pada reaksi penetralan asam ataubasa.
Contoh: NaOH(aq) + HCl(aq) NaCl(aq) + H2O(l) ; ΔH = - 890.4 kJ/mol
Hukum Lavoisier-Laplace:"Jumlah kalor yang dilepaskan pada pembentukan 1 mol zat dari unsur-unsurya = jumlah kalor yang diperlukan untuk menguraikan zat tersebutmenjadi unsur-unsur pembentuknya.“Contoh:N2(g) + 3H2(g) 2NH3(g) ; ΔH = - 92.220 J2NH3(g) N2(g) + 3H2(g) ; ΔH = + 92.220 J
15
Table: Enthalpy of Formation (ΔHf)
http://wps.prenhall.com/wps/media/objects/3080/3154819/blb0507.html16

9/27/2011
9
Table: Enthalpy of Formation (Hf), Gibbs Function (G), and Absolute Entropy (S) of Various Substances at 298 oK dan tekanan 1 atm
Hf G SSubstance Formula
Hf dan G (kJ/kmol) ; S (kJ/kmol.oK)
http://schoolworkhelper.net/2010/07/standard-enthalpies-of-formation/17
Table: Enthalpy of Formation (Hf), Gibbs Function (G), and Absolute Entropy (S) of Various Substances at 298 oK dan tekanan 1 atm
Hf G SSubstance Formula
http://schoolworkhelper.net/2010/07/standard-enthalpies-of-formation/
Hf dan G (kJ/kmol) ; S (kJ/kmol.oK)
18

9/27/2011
10
Determine the standard heat of each of the following reactions at 298.15 K (25°C)
Ref. Smith V Ness p. 14419
20

9/27/2011
11
21
Definition of EnthalpyDefinition of Enthalpy
Enthalpy, H, is a thermodynamic property, or state variable, and it is defined by:
H U PV
EnthalpyEnthalpy(kJ)(kJ)
Molar EnthalpyMolar Enthalpy(kJ/mole)(kJ/mole)
Differential FormDifferential Form Integral FormIntegral Form
H = U + PV.
(kJ/mole)(kJ/mole)
Specific EnthalpySpecific Enthalpy(kJ/kg)(kJ/kg)
22

9/27/2011
12
H(T,P) for Real SubstancesReal Substances
U is a strong function of TU is a weak function of PU is a weak function of PH is a function of both T & P
Note : At most, but not all values of T & P, H increases as P increases
23
H(T) for Ideal GasesIdeal GasesMolar enthalpy:
Specific enthalpy:
Since U of an ideal gas is a function of T only and R and MW are constants, H of an ideal gas is also a function of T only.
24

9/27/2011
13
H(T,P) for Incompressible Liquids and Solids
U is a function of T only, but
H is a function of TH is a function of Tand also a weak function of P
25
Lesson Summary_Lesson 2ACHAPTER 3, LESSON A - INTERNAL ENERGY & ENTHALPYIn this lesson we studied the functional dependence of internal energy, U, on both T and P.
We considered three cases: real gases, ideal gases, and liquids and solids.
Next, we defined a new state variable called enthalpy, H.
We then considered and discussed the functional dependence of enthalpy on both T and P.
The conclusions that we drew from these two studies are summarized in the table, below.
REAL GASES - U is a strong function of T and a weak function of P.H is a function of both T and P.
IDEAL GASES - U is a function of T only.H is a function of T only.y
IncompressibleLiquids and Solids - U is a function of T only.
H is a function of both T and P.
In the next lesson, we will learn how to obtain values for both specific and molar internal energy and enthalpy from tables of data and databases.
26

9/27/2011
14
Sample Data from NIST WebBook
27
Thermophysical Properties of Fluid Systems
DensityEnthalpy
•Choose the chemical species for which you want data.Enthalpy
Specific volumeEntropyCp Internal energyCvSpeed of Sound
(Example: Water)•Choose the system of units that you would like to use.(Example: K, MPa, kJ...)•Choose the type of thermodynamic data you want to obtain.(Example: Saturation Properties - Temperature Increments)Ch d d h h •Choose a standard state convention, which we
call a reference state. (We will learn more about reference states later in this lesson.)•When you have finished steps 1-4 click the "Press to Continue" button.
28

9/27/2011
15
Liquid phase dataData on saturation curve
29
What is a Reference State ?
Every table or graph of thermodynamic data has a standard state convention or a reference state associated with it. But why ? It is not possible to determine the absolute value of U or H. We can only measure changes in U or H. In this regard, enthalpy and internal energy are much like altitude.The altitude of a mountain and the altimeters on airplanes are referenced to mean sea level. referenced to mean sea level.
A reference state is also needed when tabulating the measured changes in U or H. A reference state is usually specified by the temperature, pressure, and the phase at which either U or H is zero.
Then, U and H of every other state is equal to the change in U or H as the substance changes from the reference state to the state of interest
30

9/27/2011
16
Review : U & H as Functions of T & PIn this part of the lesson, we will plot enthalpy and internal energy data from the NIST WebBook. We will compare the results to what we expect for an incompressible liquid and for an ideal gas.Recall the conclusions we reached in the previous lesson:
31
Enthalpy & Internal Energy for Real Substances
Now, we can obtain data from the NIST WebBook for water to show the trends observed for a real liquid. We will obtain two tables of data:
1 Units: oC atm kg/m3 kJ/kg 1. Units: oC, atm, kg/m3, kJ/kg Type of data: Isothermal properties Standard State: ASHRAE Convention
T = 30oC, P = 1 to 10 atm by 0.5 atm
2. Units: oC, atm, kg/m3, kJ/kg Type of data: Isobaric properties Standard State: ASHRAE Convention
P = 1 atm, T = 5 to 95oC by 5oC
If you like, go ahead and obtain the data from NIST WebBook and plot the data in Excel to see the expected trends.
ASHRAE_American Society for Heating Refrigeration Air Conditioning Engineer
32

9/27/2011
17
http://www.spiraxsarco.com/resources/steam-engineering-tutorials/steam-engineering-principles-and-heat-transfer/entropy-a-basic-understanding.asp
33
The temperature/enthalpy diagramThe enthalpy/pressure diagram
NIST Thermodynamic Data for SubcooledWater
Subcooled liquid tables for water obtained from the NIST WebBookThe tables were imported into Excel and edited.
34

9/27/2011
18
U(P) & H(P) for Subcooled Water at Constant T
35
Comparison of Real and Incompressible Substances
Real Liquid (water) Incompressible Liquid( li id i l t l i ibl )(no liquid is completely incompressible)
Incompressible Liquid: U at constant T is not a function of P. H increases as P increases.Real Liquid : U can increase slightly, or like water, U can decrease slowly as P increases.
H increases as P increases.36

9/27/2011
19
U(T) and H(T) for Liquid Water at Constant P
Why does it seem like internal energy and enthalpy are the same here?
37
Comparison of U & H at Constant P
Why does it seem like internal energy and enthalpy are the same here?
38

9/27/2011
20
Thermodynamic Properties of an Ideal GasIdeal Gases U is a function of T only.
H is a function of T only.Now let's obtain data from the NIST WebBook for hydrogen and compare the trends we observe to the behavior we would expect for an ideal gas.1. Units: oC, atm, kg/m3, kJ/kg Type of data: Isothermal properties Standard State: ASHRAE Convention
T = 30oC, P = 1 to 10 atm by 0.5 atm2. Units: oC, atm, kg/m3, kJ/kg Type of data: Isobaric properties Standard State: ASHRAE Convention
P = 1 atm, T = 5 to 95oC by 5oCIf you like, go ahead and obtain the data from NIST WebBook and plot the data in Excel to see the expected trends.
39
Thermodynamic Properties of HydrogenThermodynamic data for hydrogen obtained from the NIST WebBook , then imported into Excel and edited.
40

9/27/2011
21
U and H of Hydrogen at Constant THydrogen data obtained from NIST WebBook , then imported into Excel, edited, and plotted.
To an accuracy of three significant figures in and ,
hydrogen can be considered an ideal gas over this range of P. 41
U and H of Hydrogen at Constant PHydrogen data obtained from NIST WebBook , then imported into Excel , edited, and plotted.
Does this plot show the expected trends for an ideal gas at constant pressure?42

9/27/2011
22
Comparison of U & H at Constant PDoes this plot show the expected trends for an ideal gas at constant pressure?
Internal energy is a function of temperature. plus RT/MW gives the specific enthalpy
43
Does this plot show the expected trends f id l t for an ideal gas at constant pressure?The difference between the H and the U curves grows linearly as temperature increases.Conclusion:Hydrogen does y gbehave like an ideal gas at1 atm between 5oC and 95oC
44

9/27/2011
23
Lesson Summary_Lesson 3BCHAPTER 3, LESSON B -THERMO PROPERTIES: NIST WEBBOOKIn this lesson we learned that NIST WebBook is a valuable tool to determine thermodynamic properties. First we showed, step-by-step, how to locate the NIST website and the NIST WebBook within the websitewebsite and the NIST WebBook within the website.
Be sure to bookmark the link to the Thermophysical Properties of Fluid Systems at http://webbook.nist.gov/chemistry/fluid/.
We considered how to specify what information we want to obtain such as the chemical species, phase, units for properties, and the reference state. We learned that a reference state is needed when tabulating the measured changes in internal energy or enthalpy. Often a reference state is fixed by the temperature, pressure, and phase.
We then plotted enthalpy and internal energy data obtained from the NIST WebBook for an incompressible liquid, an ideal gas, and a real substance. From this we reinforced internal energy and enthalpy trends we learned in lesson B.
We will be using NIST WebBook to obtain most of the data for this course. In the next lesson, we will learn how to use NIST WebBook to obtain data on a new property called heat capacity.
45
The Relationship Between Heat and Temperature
When heating a substance, we must add a certain amount of heat to raise the temperature a specified amount. This capacity to take in heat is unique to each substance and is defined with the symbol C.
Ch3, Lesson C, Page 1 - The Relationship Between Heat and TemperatureIf we add a Joule of energy to one gram of liquid water at 20oC it will raise the temperature to about 20.2oC.If we add 1 Joule of energy to one gram of liquid mercury at 20oC it will raise the temperature to about 27oC.If we add 1 Joule of energy to one gram of air at 20oC it will raise If we add 1 Joule of energy to one gram of air at 20oC it will raise the temperature to about 21oC.This capacity for absorbing heat is called the heat capacity or the specific heat.Flip the page and we’ll show you the formal definitions for heat capacity and specific heat.Then, we’ll show you how to use them to solve problems
46

9/27/2011
24
Definition of Constant V and P Heat Capacities
The molar heat capacity of a substance is defined as the energy required to raise the temperature of a mole of a substance by one degree. The specific heat of a substance is defined as the energy required to raise the temperature of a unit mass of a substance by one degree.
47
Ideal Gas Specific HeatsRecall from the previous lesson that the internal energy of an ideal gas is a function of T only: and Therefore, the heat capacities (or specific heats) for ideal gases reduce to:
Often, ideal gas specific heats and heat capacities are approximated as polynomials in terms of T:
where a, b, c, and d are constants for a given substance
48

9/27/2011
25
Gibbs Phase Rule
where:
oF = C - P + 2
oF is the number of degrees of freedom or the number of intensive propertiesthat can be independently specified. All other intensive properties are then fixed and can be determined. C is the number of different chemical substances in the system.P is the number of distinct phases within the system.Intensive Properties: Do not depend on the size of the system.Examples include:
Extensive Properties: Do depend on the size of the systemExtensive Properties: Do depend on the size of the system.Examples include:Since we are dealing with pure substances that exist in a single-phase,(C = 1 and P =1),Therefore: oF = 1 - 1 + 2 = 2
We only need to fix or specify 2 state variables in order to completely define the state of our system.
49
Change in U as a Function of Ideal-Gas Cv
50

9/27/2011
26
Change in H as a Function of Ideal-Gas Cp
51
Cp and Cv Relationship for an Ideal Gas
52

9/27/2011
27
Cp and Cv for Liquids & Solids
53
Ideal-Gas Cp Data from NIST WebBook
Here is our heat capacity polynomial
When you scroll down a bit farther on the Results Page of the NIST Webbook, you will find the constants for the heat capacity polynomial for Ammonia shown in a table like this:54

9/27/2011
28
3C-1 : Enthalpy Change of Ammonia Using the IG Heat Capacity
Determine the enthalpy change and internal energy change of ammonia in J/mole, as it is heated from 350 oK to 600 oK, using the ideal gas heat capacity given by the Shomate Equation.capacity given by the Shomate Equation.
55
56

9/27/2011
29
57
Isothermal Vaporization of WaterExample #3C-1
The temperature of 10 lbm of water is held constant at 205°F.The pressure is reduced from a very high value until vaporization is complete. Determine the final volume of the steam in ft3. 2C-1 : Specific Volume of Saturated Mixtures 4 ptsCalculate the specific volume for the following situations:
a.) Water at 200oC and 80% quality
b.) Freon 12 at -60oC and 90% quality
c.) Ammonia at 500 kPa and 85% quality
Read : This is an exercise designed to drive home the meaning and use of the new concept of the quality of a saturated mixture. It is crucial to
f remember that if a quality is given, then the system contains a saturated mixture and you probably need to look up properties of both the saturated liquid and the saturated vapor.
58

9/27/2011
30
Given : a.) Water :
T 200 oC T 200 oC x 0.80 kg vap/kg tot
b.) R-12 : T -60 oCx 0.90 kg vap/kg tot
c.) NH3 : P 500 kPaP 500 kPax 0.85 kg vap/kg tot
Find : V ??? m3/kg for each of the three parts of this problem.
59
Solution Part a.) Data from the Saturation Temperature Table of the Steam Tables at 200oC:
Vsat liq 0.001156 m3/kg q
Vsat vap 0.1274 m3/kg P* 1554 kPa
The key equation for this problem is the relationship between the properties of a saturated mixture and the properties of saturated liquid and vapor and the quality.
Eqn 1
Now, we can plug numbers into Eqn 1 to answer this part of the question. V 0 1022 3/k V 0.1022 m3/kg Notice that I kept 4 significan figures in this answer istead of the usual 2 or 3 because there are 4 significant digits in the sat'd liquid and sat'd vapor values.Perhaps I should have only retained 2 significant digits because there only appear to be 2 significant digits in the quality. I have assumed that there are more than 2, really 4 or more, digits in the quality. This may not be a good assumption.
60

9/27/2011
31
Part b.) Data from the Saturation Temperature Table of the R-12 Tables at -60oC:
Vsat liq 0.000637 m3/kg Vsat vap 0.63791 m3/kg sat vap gP* 22.6 kPa
Now, we can plug numbers into Eqn 1 to answer this part of the question. V 0.57418 m3/kg Significant figures are a bit tricky here.
Part c.) Data from the Saturation Pressure Table of the Ammonia Tables at 500 kPa:
Vsat liq 0.00158 m3/kg Vsat vap 0.25032 m3/kg sat vap gTsat 4.1396 oC Now,
we can plug numbers into Eqn 1 to answer this part of the question. V 0.21301 m3/kg
Significant figures are a bit tricky here as well.
61
Lesson Summary_Lesson 3CCHAPTER 3, LESSON C - HEAT CAPACITIESIn this lesson, we learned about new properties called heat capacity and specific heat.Heat capacity is the energy required to raise the temperature of a mole of a substance by one degree. Specific heat is the energy required to raise the temperature of a unit mass of a substance by one degree by one degree. Next, we studied the heat capacity of an ideal gas. We used the superscript o to identify heat capacities that apply only to ideal gases. We derived the following relationships for ideal gases:
Ideal-gas heat capacities are often expressed as polynomials, such as:
where a, b, c, and d are constants for a given substance.Next, we considered the heat capacities of liquids and solids.We found that over a moderate range of temperatures and pressures.Finally, we learned how to obtain heat capacity polynomials for a variety of substances from theNIST WebBook.
62

9/27/2011
32
What is a State ?Gibbs Phase RuleoF = C - P + 2F = derajat kebebasanC Jumlah senyawa kimia didalam At a given state all the properties
Initial State1C = Jumlah senyawa kimia didalamsistemP = Jumlah fase dalam sistem
At a given state all the properties of a system are fixed and can be measured or calculated
Ch3, Lesson D, Page 1 - What is a State ?Chapter 1
menjelaskan keadaan yang diberikanseluruh sifat materi didalam batasan sitsem yang ditetapkan
Chapter 2Gibbs Phase Rule untuk menetapkan berapa banyak sifat-sifat intensifuntuk menspesifikasi keadaan sistem
63
What is a State ?
Untuk menggunakan Gibbs Phase Rule, harus tahu spesies kimia apayang ada dalam sistem dan juga fase apa yang ada dalam sistem.Jika jumlah sifat-sifat intensif yang telah dispesifikasi= jumlah derajatkebebasan maka sifat-sifat intensif sistem tersebut dapat ditentukan.Jika air murni ada dalam sistem, maka
C=air murni = 1P = fase = cair = 1F=C-P+2=1-1+2 = 2
F 2 d t di ifik i 2 i b l i t ifF=2 dapat dispesifikasi 2 variabel intensif.Yaitu T dan PKarena bermanfaat dan mudah untuk mengukur. Kemungkinan juga densitas dan entalpi spesifik karena juga sifatintensif.
64

9/27/2011
33
What Happens When a Property of a State Changes ?
When the value of a When the value of a property changes, the system is at a new state1
2
At a given state all the properties of a system are fixed and can be measured or calculated
Initial State
Ch3, Lesson D, Page 2 - What Happens When a Property of a State Changes ?If any property of the system changes then If any property of the system changes, then the system is in a different state.
65
What is a Process Path ?Process Path: A process path is the actual series of states that the system passes through as it moves from the initial state to the final state during a processg p
Initial State
When the value of a property changes, the system is at a new state
Ch3 Lesson D Page 3 What is a Process Path ?
At a given state all the properties of a system are fixed and can be measured or calculated.
Ch3, Lesson D, Page 3 - What is a Process Path ?A system can continue to change one or more of its properties. As it does so, it moves from one state to another. The series of states through which a system moves. During a process, a system moves from an initial state to a final state, but its properties do not abruptly jump from the values at the initial state and instantly take the values associated with the final state. The properties of the system change smoothly as the process progresses from the initial state to the final state. The series of states in which the system exists during the process is called the process path.
66

9/27/2011
34
State Variables & Hypothetical Process Paths
Process Path A process path is the actual series of states that the system passes through as it moves from the initial state to the final state during a process
Final State
state during a process.The system occupies an infinite number of states between the initial state and the final state. We use a smooth curve to represent the smooth path.
Initial State Changes in state variables are not path dependent. Therefore, when solving problems we can choose any path that connects the initial and final states.The trick is to choose a path that makes the problem easy to solve. This path is called a hypothetical process path (HPP).
67
You Must Be Able to …
Final State
Initial State 1. Ideal Gases2. Liquids and solids for which 3. Real substances for which tables
f h dof thermodynamic properties are available.
68

9/27/2011
35
Ideal Gas: Change in H Using an HPP
What hypothetical process pathwill allow us to easily calculate the change in enthalpy of the air?
Let's consider a process in which air changes from the initial state to the Let s consider a process in which air changes from the initial state to the final state, as shown in the diagram above.Determine the change in the molar enthalpy of the air for this process.
69
HPP for an Ideal Gas
70

9/27/2011
36
Change in H for an Ideal Gas at Constant T
Therefore, state 1 is an ideal gas state.From state 1 to state 2, the pressure decreases but we are t t t at constant
temperature.Recall from Lesson A that for an ideal gas:
71
Change in H for an Ideal Gas at Constant T
From state 3 to state 4 the pressure increases but we are at constant temperature.
Therefore, state 4 is also an ideal gas state72

9/27/2011
37
Change in H for an Ideal Gas at Constant P
From state 2 to state 3, the temperature increases at constant pressure.
Therefore:
Step 2-3 involves an ideal gas being heated from 25oC to 125oC at a constant pressure. That’s exactly like what we studied in the previous lesson ! So, ΔH-wiggle 2-3 is just the integral of the ideal gas Cp from T2 to T3. Now, all we need to do is obtain ideal gas Cp data for air. Does that sound familiar ?
73
Heat Capacity Polynomial Data from NIST WebBook
74

9/27/2011
38
Summary of HPP for an Ideal Gas
75
Ideal Gas HPP Simplification
Ch3, Lesson D, Page 13 - Ideal Gas HPP SimplificationSo, we figured out that for a process in which the initial and final states are both ideal gas states, changes in pressure have no affect on the change in enthalpy. Therefore, to determine ΔH-wiggle for these processes, all we need to do is integrate the ideal gas heat capacity from the initial temperature to the final temperature. Cool. That’s not so hard. What do we do if one or more of our states is NOT an ideal gas state ? Flip the page and we will begin to deal with that problem.
76

9/27/2011
39
Properties of Solids & Liquids
77
HPP's for Liquids and Solids
78

9/27/2011
40
Heat Capacities of Solids and Liquids
Solids and Liquids:
If a polynomial for the heat capacity is available is is generally of the form:
Often, just one value of is known. In this case
use the known value as79
Thermodynamic Properties of Real Substances
The best way to determine a value for a change in any property is to look up the value of the property for the initial and final states in a thermodynamic table and calculate the difference between themcalculate the difference between them.
In this course, this is the only method presented that is applicable for non-ideal gases !
Final State
Use themodynamic tables for liquids whenever possible because they are more accurate than the methods discussed on the previous three pagesHow much error is involved if we assume a gas to be ideal when it is not ?
Initial State
80

9/27/2011
41
Change in H for a Real Gas: Steam
Ch3, Lesson D, Page 18 - Change in H for a Real Gas: SteamLet’s consider a process in which steam is compressed from 100 kPa to 1 MPa.During this process, the temperature of the steam rises from 100oC to 200oC.By now, you probably have some intuition about the temperatures and pressure at which gases can be assumed to y ow, you p obab y ave so e tu t o about t e te pe atu es a p essu e at w c gases ca be assu e to be ideal.If you check the molar volumes at the initial and final states, you will see that the initial state can be safely assumed to be an ideal gas state, but the final state CANNOT.The easiest way to determine ΔH-hat for this process is just to look up H-hat for the initial and final states in the NIST WebBook, and that is exactly what you should do in practice.But just to make a point, let’s construct an HPP and do a little extra work on this problem. We might find something interesting.Flip the page and let’s see.
81
HPP for a Real Substance
82

9/27/2011
42
Summary of the Solution for a Real Substance
83
What If We Treated Steam as an Ideal Gas?
84

9/27/2011
43
Error from the Ideal Gas Assumption
85
Lesson Summary_Lesson 3DCHAPTER 3, LESSON D - HYPOTHETICAL PROCESS PATHSWe began this lesson by refreshing your memory about states and defined a process path as the actual series of states that the system passes through as it moves from the initial state to the final state during a g gprocess. We emphasized that state variables are not dependent on the actual process path and therefore a hypothetical process path (HPP) can be used to determine changes in thermodynamic properties during a process. We focused on determining the change in enthalpy and internal energy for processes. You must be able to determine and for:1. Ideal Gases2 Li id d lid f hi h 2. Liquids and solids for which 3. Real substances for which tables of thermodynamic properties are available.
For ideal gases, all you need to do is integrate Cv or Cp from T1 to T2 to determine ΔU or ΔH. We found that Cp data for solids and liquids is limited and Cv data is not available at all. For liquids, the Cp equation is often linear and for solids, a single Cv value is the norm.
86

9/27/2011
44
HPP's for Phase Changes
In the previous lesson, we used hypothetical process paths to make it easier to determine the change in the properties of an ideal gas, liquids and solids for which is constant and real substances for which we liquids and solids for which is constant, and real substances for which we have thermodynamic tables.
Final State
PHASE CHANGE
BUT only in one phase !
Initial State
PHASE CHANGE
In this lesson, we will learn how to use hypothetical process paths to determine the change in properties associated with a phase change.
87
What is Enthalpy of Vaporization ?
Vaporization (or boiling): Saturated Liquid Saturated Vapor
Condensation: Saturated Vapor Saturated LiquidCondensation: Saturated Vapor Saturated Liquid
Enthalpy of Vaporization( latent heat of vaporization):the amount of energy that must be added to the system to be added to the system to convert 1 mole of saturated liquid into 1 mole of saturated vapor
88

9/27/2011
45
Is the Heat of Vaporization ConstantWould it take the same amount of energy to boil 1 kg of water at sea level it would at an elevation of 14,000 ft?What is the Heat of Vaporization is at the critical point ?
Berapa banyak energi yang harus diberikan untukmenguapkan a kg cairjenuh jika proses terjadipadaT & P kritis ?
89
Saturation, Vaporization and Vapor Pressure
The latent heat of vaporizationdidefiniskan sebagai jumlah energi yang diinginkan untukmenguapkan cairan secara sempurna pada Tsat (temperatur jenuh) dan P* (uap atau tekanan jenuh).
Tsat = Saturation temperatureP* = Vapor pressure or saturation pressure
90

9/27/2011
46
Heat of Vaporization from the NIST WebBook
In Chapter 3, Lesson C we learned how to obtain data (including enthalpy) from NIST WebBook
To determine the latent heat of vaporizationwe the difference between the two enthalpy values.
91
Vaporization of Subcooled WaterSubcooled Liquid : T < Tsat
or: P > P*
92

9/27/2011
47
Heat Liquid Water to the Tsat
Evaluated at:
Integration using Excel, followed by a unit conversion, yields
93
Enthalpy Change for Vaporization of Subcooled Water
We determined the latent heat of vaporizationof water at 100oC and 1 atm on page 5 of this lesson:
On the previous page, we determined the enthalpy change associated with heating of water from 75oC to 100oC at a constant pressure of 1 atm:
The total change in enthalpy associated with the change from State 1 to State 3 is the sum of these two values:94

9/27/2011
48
Vaporization of Subcooled Water: Shortcut Method
Since we have NIST WebBookas a tool, we can determine the enthalpy at State 1 and State 3 and then determine the difference. We get the following values:
Enthalpy of Vaporization
The change in enthalpy is:
This is the same answer obtained from using the hypothetical process path ! 95
The Clapeyron Equation
For many processes, such as distillation, it is very important to know how vapor pressure, P*, depends on temperature, T.The Clapeyron Equation provides such a thermodynamic relationship The Clapeyron Equation provides such a thermodynamic relationship.
Where:
The equation also allows us to determine the the latent heat of vaporization when we know , P*, and T for the phase change96

9/27/2011
49
The Clausius-Clapeyron Equation
We will start with the Clapeyron Equation
At moderate pressure, not close to the critica point, Therefore:
If we also assume we have an ideal gs because we are at moderate pressure, we can substitute:
A little algebra and calculus helps us put the equation into a form that we can easily integrate:
Integrating, we obtain the Clausius-Clapeyron Equation:
97
Using The Clausius-Clapeyron Equation
98

9/27/2011
50
Other Latent HeatsThis lesson has focused on vaporization because it is the most important phase change in this course.HPP's can be used in the same way to calculate the change in properties that occur when melting and sublimation phase changes occur in a process. Latent Heat of Vaporization
amount of energy absorbed during vaporizationamount of energy released during condensation
Latent Heat of Fusionamount of energy absorbed during meltingamount of energy absorbed during meltingamount of energy released during freezing
Latent Heat of Sublimationamount of energy absorbed during sublimationamount of energy released during desublimation
99
Lesson Summary_Lesson 3ECHAPTER 3, LESSON E - PHASE CHANGES
Pada pelajaran ini, kami belajar bagaimana variabel keadaan berubah selama perubahan fase. Kami menggunakan alur proses hipotetik (hypothetical process paths_HPP's) untuk membantumenetapkan perubahan-perubahan dalam sifat termodinamis selama proses perubahan fase. p p p p pKami menentukan perubahan dalam entalpi karena variabel tersebut merupakan variabelkeadaan didalam proses perubahan fase.
Kami fokus belajar pada proses penguapan. Panas laten penguapan yaitu jumlah energi yang harus menjadi input agar supaya menguapkan a mol atau a kg cairan. Sumber data panaspenguapan yatiu
NIST dll dan data dari NIST WebBook menunjukkan bahwa ΔHvap turun sebagaimanakenaikan temperatur terhadap Tc.
Kami menggunakan HPP dan NIST WebBook untuk menghitung perubahan entalpi terkaitd i j h d i di i d k 2 t k ik b b ddengan penguapan cair jenuh dan cair dingin dengan menggunakan 2 teknik yang berbeda.
Kemudian, kami mendiskusikan hubungan antara Tsat, P* dan ΔHvap. Kami mulai dariClapeyron Equation dan turunan Clausius-Clapeyron Equation.
Kami mendiskusikan penggunaan-penggunaan Clausius-Clapeyron Equation danmemperkenalkan perhitungan untuk memprediksi tekanan uap jenuh sebagai fungsi T.
2 perubahan fase yang umum : sublimation dan fusion.
100