STRUKTURA ATOMAopstahemija.tmf.bg.ac.rs/Nikolić/Opsta hemija 1/06_Struktura atoma_… · Sr ‐po...
Transcript of STRUKTURA ATOMAopstahemija.tmf.bg.ac.rs/Nikolić/Opsta hemija 1/06_Struktura atoma_… · Sr ‐po...

STRUKTURA ATOMA
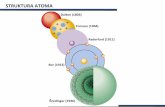
Dalton (1803)
Tomson (1904)
Raderford (1911)
Bor (1913)
Šredinger (1926)

STRUKTURA ATOMA
TALASNO‐MEHANIČKI MODEL ATOMA
Hipoteza de BroljaElektroni i fotoni imaju dvojnu prirodu:
talasnu i korpuskularnu.
E = hν E = mc2
mch
λ =
vmh
=λ
Talasna dužina elektrona
ee n λ = 2rπ
Elektron je stojeći talas
n ‐ broj talasnih dužina
r
talasna dužinaλ
Da bi bio stojeći talas n mora biti ceo broj

STRUKTURA ATOMA
Hajzenvergov princip neodređenosti
Nemoguće je istovremeno odrediti brzinu i položaj elektrona
Δx Δp = Δx Δmev > h
Maks Born
Ako odlučimo da odredimo energiju elektrona sa velikom pouzdanošću, moramo prihvatiti da njegov položaj možemo znati sa velikom nepouzdanošći.
Verovatnoća nalaženja elektrona u određenom delu prostora.
neodređenost položaja neodređenost momenta kretanja

STRUKTURA ATOMA
ŠREDINGEROVA JEDNAČINA
08
2
2
2
2
2
2
2
2
=−+∂∂
+∂∂
+∂∂
ψ)VE(hmπ
zψ
yψ
xψ
Daje vezu između položaja i energije elektrona.
Da bi se rešila jednačina u trodimenzionom prostoru moraju se uzeti tri međusobno zavisne konstante (kvantizovane) i to su: n, l i ml.
Orbitala – talasna funkcija koja je dobijena za kombinaciju tri kvantna broja.
Matematički model koji opisuje talasnu prirodu elektrona.
ψ – talasna funkcija koja određuje amplitudu talasa.
Prostor oko jezgra sa najvećom verovatnoćom nalaženja elektrona.Iz nje se dobija

Radijalna funkcija raspodele verovatnoće nalaženja elektronaili
radijalna gustina elektrona.
STRUKTURA ATOMA
Verovatnoća nalaženja elektrona ili gustina elektrona u jedinici zapremine.
Verovatnoća nalaženja elektrona ili gustina elektrona u delu sferne ljuske oko jezgra (zapremine 4πr2dr)
ψ2
ψ24πr2
ψ = 0 i ψ2 = 0 čvorovi talasne funkcije

r(pm)r(pm)
STRUKTURA ATOMA
r90 – elektron provodi 90 % vremena u sferi poluprečnika r90.
OBLICI 1s‐, 2s‐ I 3s‐ ORBITALA
Gustina
elektrona
Radijalana
gustina
elektrona
ψ2
4πr2
Rastojanje
Radijalana gustina elektrona
a0 = 52,9 pm

STRUKTURA ATOMA
OBLICI 1s‐, 2s‐ i 3s‐ ORBITALA (l = 0)
Radijalna gustina (4πr2ψ
2 )
Rastojanje od jezgra, r
Čvorovi talasne funkcije
Broj sfernih čvorova = n ‐ 1
čvor
čvor
Gustina elektrona s orbitala
čvor
čvor

r
ψ
r
ψ
STRUKTURA ATOMA
OBLIK p‐ORBITALA (l = 1)
r
ψ2
+
-
yz ‐ čvorna ravan xz ‐ čvorna ravan xy ‐ čvorna ravan
px pzpy

STRUKTURA ATOMA
OBLIK d‐ORBITALA
l = 2 ml = ‐2, ‐1, 0, 1, 2
Imaju dve čvorne ravniOrbitale se nalaze između ovih ravni.

STRUKTURA ATOMA
OBLIK f‐ORBITALA
l = 3 ml = ‐3, ‐2, ‐1, 0, 1, 2, 3
Prikaz jedne od 7 f‐orbitala, koje su komplikovanog oblika.

STRUKTURA ATOMA
Važi PAULIJEV PRINCIP ISKLJUČENJA
POPUNJAVANJE ATOMSKIH ORBITALA ELEKTRONIMA
2s 2p1s2 2 59F
valentni elektroni(u podnivoima najvišeg n)
valentna ljuska(orbitale sa valentnim e–)
Elektronska konfiguracija elementa

STRUKTURA ATOMA
Energije atomskih orbitala
Zeff – efektivno naelektrisanje jezgra
Elektron oseća manje privlačno dejstvo jezgra zbog prisustva ostalih elektrona.
2s elektroni više prodiru ka jezgru i osecaju veće Zeffod 2p elektrona → osecaju veću privalačnu silu, zato imaju manji sadržaj energije.
Energija
Energija
Radijalna gustina (4πr2ψ
2 )

STRUKTURA ATOMA
POPUNJAVANJE ATOMSKIH ORBITALA ELEKTRONIMA
PRINCIP MINIMUMA ENERGIJEPri popunjavanju orbitala elektron zauzima najniži raspoloživi energetski nivo.
Najpre se popunjava orbitala čiji je zbir kvantnih brojeva (n+l) manji.
n+l=1n+l=2
n+l=3n+l=4
n+l=5n+l=6
n+l=7
– za isto n energija raste u nizu
s < p < d < f (tj. l = 0, 1, 2, 3)
– 3s‐ i 3p‐orbitale
(3+0) < (3+1) → prvo se popunjavaju 3s‐orbitale
– 3d‐ i 4s‐orbitale
(3+2) > (4+0) → prvo se popunjavaju 4s‐orbitale
– 4s‐ i 3p‐orbitale
(4+0) = (3+1)→prvo se popunjavaju orbitale samanjim n (3p)

STRUKTURA ATOMA
2He: 1s23Li: 1s22s1 4Be: 1s22s2
5B: 1s22s22p1
6C: 1s22s22p2
7N: 1s22s22p3
8O: 1s22s22p4
10Ne: 1s22s22p6
9F: 1s22s22p5
‐u osnovnom stanju‐
1
2
3
4
1s2s
2p3s
3p
3d4s
4p
4d
4f
E n e r g i j a

STRUKTURA ATOMA
1
2
3
4
1s2s
2p3s
3p
3d4s
4p
4d
4f
E n e r g i j a
12Mg: 1s22s22p63s218Ar: 1s22s22p63s23p620Ca: 1s22s22p63s23p64s230Zn: 1s22s22p63s23p64s23d10
19K i 20Ca ‐ po sadržaju energije 4s < 3d

STRUKTURA ATOMA
Rubidijum i stroncijum
37Rb i 38Sr ‐ po sadržaju energije 5s < 4d
Cezijum i barijum
55Cs i 56Ba ‐ po sadržaju energije 6s < 5d
Francijum i radijum
87Fr i 88Ra ‐ po sadržaju energije 7s < 6d
Preskakanja se javljaju i kod drugih atoma:

STRUKTURA ATOMA
Sa porastom n – energetski nivoi se približavaju i preklapaju.
Porast ene
rgije
24Cr: 1s22s22p63s23p64s23d4Očekivano:
24Cr: 1s22s22p63s23p64s13d5Stvarno:
29Cu: 1s22s22p63s23p64s23d9Očekivano:
Stvarno: 29Cu: 1s22s22p63s23p64s13d10
Polupopunjena 3d‐orbitala Cr i potpuno popunjena 3d‐orbitala Cu energetski su stabilnije.

STRUKTURA ATOMA
POPUNJAVANJE ATOMSKIH ORBITALA ELEKTRONIMA
ili ( )
prikazivanje orbitala prikazivanje elektronau orbitalama
5B: 1s22s22p1
5B: (↑↓) (↑ )( )( )(↑↓)
1s 2s 2p
Prikazivanje el. konfiguracije preko orbitalnog dijagrama.

STRUKTURA ATOMA
HUNDOVO PRAVILO maksimalnog multipliciteta
POPUNJAVANJE ATOMSKIH ORBITALA ELEKTRONIMA
Degenerisane orbitale se popunjavaju tako što se u svaku prvo smesti elektron istog spina, a zatim se popunjavaju elektronima suprotnog spina.
6C: (↑↓)(↑↓) (↑ )(↑ )( )
6C: (↑↓)(↑↓) (↑ )( )( )1s 2s 2p

STRUKTURA ATOMA
7N: (↑↓) (↑↓) (↑ )(↑ )(↑ )
8O: (↑↓) (↑↓) (↑↓)(↑ )(↑ )
1s22s22p3
9F: (↑↓) (↑↓) (↑↓)(↑↓)(↑ )
10Ne: (↑↓) (↑↓) (↑↓)(↑↓)(↑↓)
1s22s22p4
1s22s22p5
1s22s22p6
Atom Orbitalni dijagram Elektronskakonfiguracija
1s 2s 2p
HUNDOVO PRAVILO maksimalnog multipliciteta

STRUKTURA ATOMA
7N: (↑↓) (↑↓) (↑ )(↑ )(↑ )
8O: (↑↓) (↑↓) (↑↓)(↑ )(↑ )
9F: (↑↓) (↑↓) (↑↓)(↑↓)(↑ )
10Ne: (↑↓) (↑↓) (↑↓)(↑↓)(↑↓)
1s22s22p3
1s22s22p4
1s22s22p5
1s22s22p6
Atom Orbitalni dijagram Elektronskakonfiguracija
1s 2s 2p
nespareni elektronispareni elektroni

STRUKTURA ATOMA
8O: (↑↓) (↑↓) (↑↓)(↑↓)( ) 1s22s22p4
1s 2s 2p
8O: (↑↓) (↑↓) (↑↓)(↑ )(↑ ) 1s22s22p4
paramagnetičan
dijamagnetičan
Paramagnetna svojstva imaju supstance sa nesparenim elektronima (slabo ih privlači magnetno polje).Dijamagnetna svojstva imaju supstance sa sparenim elektronima (blago ih odbija magnetno polje).

STRUKTURA ATOMA
10Ne: 1s22s22p6
16S: 1s22s2 3p43s22p6 [Ne] 3p43s2
3d8
18Ar: 1s22s22p63s23p6
28Ni: 1s22s2 3p63s22p6 4s2 [Ar] 3d84s2
Skraćena elektronska konfiguracija

STRUKTURA ATOMA
Grupa 1 Grupa 2
3Li [He] 2s1 4Be [He] 2s2
11Na [Ne] 3s1 12Mg [Ne] 3s2
19K [Ar] 4s1 20Ca [Ar] 4s2
37Rb [Kr] 5s1 38Sr [Kr] 5s2
55Cs [Xe] 6s1 56Ba [Xe] 6s2
Svi elementi u određenoj grupi Periodnog sistema imaju isti raspored elektronau podnivoima najvišeg glavnog kvantnog broja