Termodinamica
-
Upload
deivis-rmp -
Category
Documents
-
view
165 -
download
0
description
Transcript of Termodinamica
-
Termodinmica
Mquina trmica tpica donde puede observarse la entrada des-de una fuente de calor (caldera) a la izquierda y la salida a undisipador de calor (condensador) a la derecha. El trabajo se ex-trae en este caso mediante una serie de pistones.
La termodinmica (del griego o, termo, quesignica calor[1] y , dnamis, que signicafuerza)[2] es la rama de la fsica que describe los esta-dos de equilibrio a nivel macroscpico.[3] Constituye unateora fenomenolgica, a partir de razonamientos deduc-tivos, que estudia sistemas reales, sin modelizar y sigueun mtodo experimental.[4] Los estados de equilibrio seestudian y denen por medio demagnitudes extensivas ta-les como la energa interna, la entropa, el volumen o lacomposicin molar del sistema,[5] o por medio de mag-nitudes no-extensivas derivadas de las anteriores como latemperatura, presin y el potencial qumico; otras mag-nitudes, tales como la imanacin, la fuerza electromo-triz y las asociadas con la mecnica de los medios con-tinuos en general tambin pueden tratarse por medio dela termodinmica.[6]
La termodinmica ofrece un aparato formal aplicablenicamente a estados de equilibrio,[7] denidos comoaquel estado hacia el que todo sistema tiende a evo-lucionar y caracterizado porque en el mismo todas laspropiedades del sistema quedan determinadas por facto-res intrnsecos y no por inuencias externas previamenteaplicadas.[5] Tales estados terminales de equilibrio son,por denicin, independientes del tiempo, y todo el apa-rato formal de la termodinmica todas las leyes y varia-bles termodinmicas, se denen de tal modo que podradecirse que un sistema est en equilibrio si sus propie-dades pueden describirse consistentemente empleando lateora termodinmica.[5] Los estados de equilibrio son ne-cesariamente coherentes con los contornos del sistema ylas restricciones a las que est sometido. Por medio de
los cambios producidos en estas restricciones (esto es, alretirar limitaciones tales como impedir la expansin delvolumen del sistema, impedir el ujo de calor, etc.), elsistema tender a evolucionar de un estado de equilibrioa otro;[8] comparando ambos estados de equilibrio, la ter-modinmica permite estudiar los procesos de intercam-bio de masa y energa trmica entre sistemas trmicosdiferentes.Como ciencia fenomenolgica, la termodinmica no seocupa de ofrecer una interpretacin fsica de sus magni-tudes. La primera de ellas, la energa interna, se acep-ta como una manifestacin macroscpica de las leyesde conservacin de la energa a nivel microscpico, quepermite caracterizar el estado energtico del sistemamacroscpico.[9] El punto de partida para la mayor partede las consideraciones termodinmicas son los que pos-tulan que la energa puede ser intercambiada entre siste-mas en forma de calor o trabajo, y que slo puede ha-cerse de una determinada manera. Tambin se introduceuna magnitud llamada entropa,[10] que se dene comoaquella funcin extensiva de la energa interna, el volu-men y la composicin molar que toma valores mximosen equilibrio: el principio de maximizacin de la entro-pa dene el sentido en el que el sistema evoluciona deun estado de equilibrio a otro.[11] Es la mecnica esta-dstica, ntimamente relacionada con la termodinmica,la que ofrece una interpretacin fsica de ambas magni-tudes: la energa interna se identica con la suma de lasenergas individuales de los tomos y molculas del sis-tema, y la entropa mide el grado de orden y el estado di-nmico de los sistemas, y tiene una conexin muy fuertecon la teora de informacin.[12] En la termodinmica seestudian y clasican las interacciones entre diversos sis-temas, lo que lleva a denir conceptos como sistema ter-modinmico y su contorno. Un sistema termodinmicose caracteriza por sus propiedades, relacionadas entre smediante las ecuaciones de estado. stas se pueden com-binar para expresar la energa interna y los potencialestermodinmicos, tiles para determinar las condicionesde equilibrio entre sistemas y los procesos espontneos.Con estas herramientas, la termodinmica describe cmolos sistemas responden a los cambios en su entorno. Estose puede aplicar a una amplia variedad de ramas de laciencia y de la ingeniera, tales como motores, cambiosde fase, reacciones qumicas, fenmenos de transporte, eincluso agujeros negros.
1
-
2 1 HISTORIA DE LA TERMODINMICA
1 Historia de la termodinmica
La historia de la termodinmica como disciplina cient-ca se considera generalmente que comienza con Otto vonGuericke quien, en 1650, construy y dise la prime-ra bomba de vaco y demostr las propiedades del vacousando sus hemisferios deMagdeburgo. Guericke fue im-pulsado a hacer el vaco con el n de refutar la suposicinde Aristteles que la naturaleza aborrece el vaco. Pocodespus de Guericke, el fsico y el qumico Robert Boy-le estudi y mejor los diseos de Guericke y en 1656,en coordinacin con el cientco Robert Hooke, constru-y una bomba de aire. Con esta bomba, Boyle y Hookeobservaron una correlacin entre la presin, temperaturay volumen. Con el tiempo, se formularon la ley de Boy-le, indicando que para un gas a temperatura constante, lapresin y el volumen son inversamente proporcionales yotras leyes de los gases.En 1679, un asociado de Boyle, Denis Papin basndoseen estos conceptos, construy un digestor de vapor, queera un recipiente cerrado con una tapa de cierre hermticoen el que el vapor connado alcanzaba una alta presin,aumentando el punto de ebullicin y acortando el tiempode coccin de los alimentos.En 1697, el ingeniero Thomas Savery, a partir de los dise-os de Papin, construy el primer motor trmico, seguidopor Thomas Newcomen en 1712. Aunque estos primerosmotores eran toscos y poco ecientes, atrajeron la aten-cin de los cientcos ms destacados de la poca.En 1733, Bernoulli us mtodos estadsticos, juntocon la mecnica clsica, para extraer resultados de lahidrodinmica, iniciando la mecnica estadstica.En 1781 los conceptos de capacidad calorca y calor la-tente, fueron desarrollados por el profesor Joseph Blackde la Universidad de Glasgow, donde James Watt traba-j como fabricante de instrumentos. Watt consult conBlack en las pruebas de la mquina de vapor, pero fueWatt quien concibi la idea del condensador externo, au-mentando grandemente la eciencia de la mquina de va-por.En 1783, Lavoisier propone la teora del calrico.En 1798 Benjamin Thompson, conde de Rumford, de-mostr la conversin del trabajo mecnico en calor.Sobre la base de todo este trabajo previo, Sadi Carnot, elpadre de la termodinmica ", public en 1824 Reexio-nes sobre la energa motriz del fuego, un discurso sobre laeciencia trmica, la energa, la energa motriz y el mo-tor. El documento describe las relaciones bsicas ener-gticas entre la mquina de Carnot, el ciclo de Carnot yenerga motriz, marcando el inicio de la termodinmicacomo ciencia moderna.El primer libro de texto sobre termodinmica fue escri-to en 1859 por William Rankine, quien originalmente seform como fsico y profesor de ingeniera civil y mec-
Nicolas Lonard Sadi Carnot, considerado como el padre de latermodinmica "
nica en la Universidad de Glasgow. La primera y segun-da leyes de la termodinmica surgieron simultneamen-te en la dcada de 1850, principalmente por la obras deGermain Henri Hess, William Rankine, Rudolf Clausius,James Prescott Joule y William Thomson (Lord Kelvin).Los fundamentos de la termodinmica estadstica seestablecieron por los fsicos como James Clerk Max-well, Ludwig Boltzmann, Max Planck, Rudolf Clausius,Johannes van der Waals y J. Willard Gibbs.Desde 1873 hasta el 76, el fsico matemtico estadou-nidense Josiah Willard Gibbs public una serie de tresartculos, siendo la ms famosa Sobre el equilibrio de lassustancias heterogneas. Gibbs demostr cmo los pro-cesos termodinmicos, incluyendo reacciones qumicas,se podran analizar grcamente. Mediante el estudiode la energa, la entropa, volumen, potencial qumico,la temperatura y la presin del sistema termodinmico,se puede determinar si un proceso se produce espont-neamente. La termodinmica qumica y la sicoqumicafueron desarrolladas adems por Walther Nernst, PierreDuhem, Gilbert N. Lewis, Jacobus Henricus van 't Ho, yThophile de Donder, entre otros, aplicando los mtodosmatemticos de Gibbs.Tambin fueron de importancia para la termodinmicalos desarrollos en termometra y manometra.
-
2.3 Segunda ley de la termodinmica 3
2 Leyes de la termodinmica
2.1 Principio cero de la termodinmicaEste principio o ley cero, establece que existe una deter-minada propiedad denominada temperatura emprica ,que es comn para todos los estados de equilibrio termo-dinmico que se encuentren en equilibrio mutuo con unodado.En palabras llanas: Si pones en contacto un objeto conmenor temperatura con otro con mayor temperatura, am-bos evolucionan hasta que sus temperaturas se igualan.Tiene una gran importancia experimental pues permiteconstruir instrumentos que midan la temperatura de unsistema pero no resulta tan importante en el marco te-rico de la termodinmica.El equilibrio termodinmico de un sistema se dene co-mo la condicin del mismo en el cual las variables empri-cas usadas para denir o dar a conocer un estado del sis-tema (presin, volumen, campo elctrico, polarizacin,magnetizacin, tensin lineal, tensin supercial, coorde-nadas en el plano x, y) no son dependientes del tiempo. Eltiempo es un parmetro cintico, asociado a nivel micros-cpico; el cual a su vez est dentro de la fsico qumica yno es parmetro debido a que a la termodinmica solo leinteresa trabajar con un tiempo inicial y otro nal. A di-chas variables empricas (experimentales) de un sistemase las conoce como coordenadas trmicas y dinmicas delsistema.Este principio fundamental, an siendo ampliamenteaceptado, no fue formulado formalmente hasta despusde haberse enunciado las otras tres leyes. De ah que re-cibiese el nombre de principio cero.
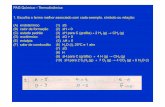
2.2 Primera ley de la termodinmicaTambin conocida como principio de conservacin de laenerga para la termodinmica, establece que si se realizatrabajo sobre un sistema o bien ste intercambia calor conotro, la energa interna del sistema cambiar.Visto de otra forma, esta ley permite denir el calor co-mo la energa necesaria que debe intercambiar el sistemapara compensar las diferencias entre trabajo y energa in-terna. Fue propuesta por Nicolas Lonard Sadi Carnot en1824, en su obra Reexiones sobre la potencia motriz delfuego y sobre las mquinas adecuadas para desarrollaresta potencia, en la que expuso los dos primeros princi-pios de la termodinmica. Esta obra fue incomprendidapor los cientcos de su poca, y ms tarde fue utilizadapor Rudolf Clausius y Lord Kelvin para formular, de unamanera matemtica, las bases de la termodinmica.La ecuacin general de la conservacin de la energa es lasiguiente:
Eentra Esale = Esistema
Que aplicada a la termodinmica teniendo en cuenta elcriterio de signos termodinmico, queda de la forma:
U = QW
Donde U es la energa interna del sistema (aislado), Q esla cantidad de calor aportado al sistema y W es el trabajorealizado por el sistema.Esta ltima expresin es igual de frecuente encontrarlaen la forma U = Q + W. Ambas expresiones, aparen-temente contradictorias, son correctas y su diferencia esten que se aplique el convenio de signos IUPAC o el Tra-dicional (vase criterio de signos termodinmico).
ilustracin de la segunda ley mediante una mquina trmica
2.3 Segunda ley de la termodinmicaEsta leymarca la direccin en la que deben llevarse a cabolos procesos termodinmicos y, por lo tanto, la imposibi-lidad de que ocurran en el sentido contrario (por ejem-plo, que una mancha de tinta dispersada en el agua puedavolver a concentrarse en un pequeo volumen). Tambinestablece, en algunos casos, la imposibilidad de conver-tir completamente toda la energa de un tipo a otro sinprdidas. De esta forma, la segunda ley impone restric-ciones para las transferencias de energa que hipottica-mente pudieran llevarse a cabo teniendo en cuenta s-lo el primer principio. Esta ley apoya todo su contenidoaceptando la existencia de una magnitud fsica llamadaentropa, de tal manera que, para un sistema aislado (queno intercambia materia ni energa con su entorno), la va-riacin de la entropa siempre debe ser mayor que cero.Debido a esta ley tambin se tiene que el ujo espontneode calor siempre es unidireccional, desde los cuerpos demayor temperatura hacia los de menor temperatura, hastalograr un equilibrio trmico.
-
4 2 LEYES DE LA TERMODINMICA
La aplicacin ms conocida es la de las mquinas trmi-cas, que obtienen trabajo mecnico mediante aporte decalor de una fuente o foco caliente, para ceder parte deeste calor a la fuente o foco o sumidero fro. La diferen-cia entre los dos calores tiene su equivalente en el trabajomecnico obtenido.Existen numerosos enunciados equivalentes para denireste principio, destacndose el de Clausius y el de Kelvin.
2.3.1 Enunciado de Clausius
Diagrama del ciclo de Carnot en funcin de la presin y elvolumen.
En palabras de Sears es: No es posible ningn procesocuyo nico resultado sea la extraccin de calor de un re-cipiente a una cierta temperatura y la absorcin de unacantidad igual de calor por un recipiente a temperaturams elevada.
2.3.2 Enunciado de KelvinPlanck
Es imposible construir una mquina trmica que, operan-do en un ciclo, no produzca otro efecto que la absorcinde energa desde un depsito, con la realizacin de unacantidad igual de trabajo. Sera correcto decir que Esimposible construir una mquina que, operando cclica-mente, produzca como nico efecto la extraccin de calorde un foco y la realizacin equivalente de trabajo. Varacon el primero, dado a que en l, se puede deducir quela mquina transforma todo el trabajo en calor, y, que elresto, para otras funciones... Este enunciado arma la im-posibilidad de construir una mquina que convierta todoel calor en trabajo. Siempre es necesario intercambiar ca-lor con un segundo foco (el foco fro), de forma que partedel calor absorbido se expulsa como calor de desecho alambiente. Ese calor desechado, no pude reutilizarse paraaumentar el calor (inicial) producido por el sistema (eneste caso la mquina), es a lo que llamamos entropa.
2.3.3 Otra interpretacin
Es imposible construir una mquina trmica cclica quetransforme calor en trabajo sin aumentar la energa ter-modinmica del ambiente. Debido a esto podemos con-cluir, que el rendimiento energtico de una mquina tr-mica cclica que convierte calor en trabajo, siempre sermenor a la unidad, y sta estar ms prxima a la unidad,cuanto mayor sea el rendimiento energtico de la misma.Es decir, cuanto mayor sea el rendimiento energtico deuna mquina trmica, menor ser el impacto en el am-biente, y viceversa.
2.4 Tercera ley de la termodinmicaAlgunas fuentes se reeren incorrectamente al postuladode Nernst como la tercera de las leyes de la termodi-nmica. Es importante reconocer que no es una nocinexigida por la termodinmica clsica por lo que resultainapropiado tratarlo de ley, siendo incluso inconsisten-te con la mecnica estadstica clsica y necesitando el es-tablecimiento previo de la estadstica cuntica para servalorado adecuadamente. La mayor parte de la termodi-nmica no requiere la utilizacin de este postulado.[13]El postulado de Nernst, llamado as por ser propuestoporWalther Nernst, arma que es imposible alcanzar unatemperatura igual al cero absolutomediante un nmero -nito de procesos fsicos. Puede formularse tambin comoque a medida que un sistema dado se aproxima al cero ab-soluto, su entropa tiende a un valor constante especco.La entropa de los slidos cristalinos puros puede consi-derarse cero bajo temperaturas iguales al cero absoluto.Es importante remarcar que los principios o leyes de latermodinmica son vlidas siempre para los sistemas ma-croscpicos, pero inaplicables a nivel microscpico. Laidea del demonio de Maxwell ayuda a comprender los l-mites de la segunda ley de la termodinmica jugando conlas propiedades microscpicas de las partculas que com-ponen un gas.
2.5 SistemaSe puede denir un sistema como un conjunto de mate-ria, que est limitado por una supercie, que le pone elobservador, real o imaginaria. Si en el sistema no entrani sale materia, se dice que se trata de un sistema cerra-do, o sistema aislado si no hay intercambio de materiay energa, dependiendo del caso. En la naturaleza, encon-trar un sistema estrictamente aislado es, por lo que sabe-mos, imposible, pero podemos hacer aproximaciones. Unsistema del que sale y/o entra materia, recibe el nombrede abierto. Ponemos unos ejemplos:
Un sistema abierto: se da cuando existeun intercambio de masa y de energa conlos alrededores; es por ejemplo, un coche.
-
3.2 Estado de un sistema 5
Le echamos combustible y l desprendediferentes gases y calor.
Un sistema cerrado: se da cuando noexiste un intercambio de masa con el me-dio circundante, slo se puede dar un in-tercambio de energa; un reloj de cuerda,no introducimos ni sacamos materia del. Solo precisa un aporte de energa queemplea para medir el tiempo.
Un sistema aislado: se da cuando noexiste el intercambio ni de masa y energacon los alrededores; Cmo encontrarlo sino podemos interactuar con l? Sin em-bargo un termo lleno de comida calientees una aproximacin, ya que el envase nopermite el intercambio de materia e in-tenta impedir que la energa (calor) sal-ga de l. El universo es un sistema aisla-do, ya que la variacin de energa es ceroE = 0:
2.6 Medio externoSe llama medio externo o ambiente a todo aquello queno est en el sistema pero que puede inuir en l. Porejemplo, consideremos una taza con agua, que est sien-do calentada por un mechero. Consideremos un sistemaformado por la taza y el agua, entonces el medio est for-mado por el mechero, el aire, etc.
3 Equilibrio trmicoToda sustancia por encima de los 0 kelvin (273,15 C)emite calor. Si dos sustancias en contacto se encuentrana diferente temperatura, una de ellas emitir ms calor ycalentar a la ms fra. El equilibrio trmico se alcanzacuando ambas emiten, y reciben la misma cantidad decalor, lo que iguala su temperatura.
Nota: estrictamente sera la misma cantidad de calorpor gramo, ya que una mayor cantidad de sustanciaemite ms calor a la misma temperatura.
3.1 Variables termodinmicasLas variables que tienen relacin con el estado internode un sistema, se llaman variables termodinmicas ocoordenadas termodinmicas, y entre ellas las ms im-portantes en el estudio de la termodinmica son:
la masa el volumen la densidad
la presin la temperatura
En termodinmica es muy importante estudiar sus pro-piedades, las cules podemos dividirlas en dos:
propiedades intensivas: son aquellas que no depen-den de la cantidad de sustancia o del tamao de unsistema, por lo que su valor permanece inalterado alsubdividir el sistema inicial en varios subsistemas,por este motivo no son propiedades aditivas.
propiedades extensivas: son las que dependen de lacantidad de sustancia del sistema, y son recproca-mente equivalentes a las intensivas. Una propiedadextensiva depende por tanto del tamao del siste-ma. Una propiedad extensiva tiene la propiedad deser aditiva en el sentido de que si se divide el sistemaen dos o ms partes, el valor de la magnitud extensi-va para el sistema completo es la suma de los valoresde dicha magnitud para cada una de las partes.
Algunos ejemplos de propiedades extensivas son la ma-sa, el volumen, el peso, cantidad de sustancia, energa,entropa, entalpa, etc. En general el cociente entre dosmagnitudes extensivas nos da una magnitud intensiva, porejemplo la divisin entre masa y volumen nos da la den-sidad.
3.2 Estado de un sistemaUn sistema que puede describirse en funcin de coorde-nadas termodinmicas se llama sistema termodinmicoy la situacin en la que se encuentra denido por dichascoordenadas se llama estado del sistema.
3.3 Equilibrio trmicoUn estado en el cual dos coordenadas termodinmicasindependientes X y Y permanecen constantes mientrasno se modican las condiciones externas se dice que seencuentra en equilibrio trmico. Si dos sistemas se en-cuentran en equilibrio trmico se dice que tienen la mis-ma temperatura. Entonces se puede denir la tempera-tura como una propiedad que permite determinar si unsistema se encuentra o no en equilibrio trmico con otrosistema.El equilibrio trmico se presenta cuando dos cuerpos contemperaturas diferentes se ponen en contacto, y el quetiene mayor temperatura cede energa trmica en formade calor al que tiene ms baja, hasta que ambos alcanzanla misma temperatura.Algunas deniciones tiles en termodinmica son las si-guientes.
-
6 7 VASE TAMBIN
3.4 Foco trmicoUn foco trmico es un sistema que puede entregar y/orecibir calor, pero sin cambiar su temperatura.
3.5 Contacto trmicoSe dice que dos sistemas estn en contacto trmico cuan-do puede haber transferencia de calor de un sistema aotro.
4 Procesos termodinmicosSe dice que un sistema pasa por un proceso termodin-mico, o transformacin termodinmica, cuando al menosuna de las coordenadas termodinmicas no cambia. Losprocesos ms importantes son:
Procesos isotrmicos: son procesos en los que latemperatura no cambia.
Procesos isobricos: son procesos en los cuales lapresin no vara.
Procesos iscoros: son procesos en los que el volu-men permanece constante.
Procesos adiabticos: son procesos en los que nohay transferencia de calor alguna.
Procesos diatrmicos: son procesos que dejan pa-sar el calor fcilmente.
Procesos isoentrpicos: procesos adiabticos y re-versibles. Procesos en los que la entropa no vara.
Por ejemplo, dentro de un termo donde se colocan aguacaliente y cubos de hielo, ocurre un proceso adiabtico,ya que el agua caliente se empezar a enfriar debido alhielo, y al mismo tiempo el hielo se empezar a derretirhasta que ambos estn en equilibrio trmico, sin embargono hubo transferencia de calor del exterior del termo alinterior por lo que se trata de un proceso adiabtico.
5 Rendimiento termodinmico oeciencia
Un concepto importante en la ingeniera trmica es el derendimiento. El rendimiento de una mquina trmica sedene como:
=jEsalidajjEentradaj
donde, dependiendo del tipo de mquina trmica, estasenergas sern el calor o el trabajo que se transeran endeterminados subsistemas de la mquina.
5.0.1 Teorema de Carnot
Nicolas Lonard Sadi Carnot en 1824 demostr que elrendimiento de alguna mquina trmica que tuviese lamxima eciencia posible (a las que en la actualidad sedenotan con su nombre) y que operase entre dos termos-tatos (focos con temperatura constante), dependera slode las temperaturas de dichos focos. Por ejemplo, el ren-dimiento para un motor trmico de Carnot viene dadopor:
mC = 1 TfTc
donde Tc y Tf son las temperaturas del termostato ca-liente y del termostato fro, respectivamente, medidas enKelvin.Este rendimiento mximo es el correspondiente al de unamquina trmica reversible, la cual es slo una idealiza-cin, por lo que cualquier mquina trmica construidatendr un rendimiento menor que el de una mquina re-versible operando entre los mismos focos.
m:t:reversible > m:t:irreversible
6 Diagramas termodinmicos Diagrama PVT Diagrama de fase Diagrama p-v Diagrama T-s
7 Vase tambin Ludwig Boltzmann calor y temperatura (continuacin del estudio de latermodinmica)
caos constante de Boltzmann criterio de signos termodinmico energa entalpa entropa exerga neguentropa
-
7 sistmica termoqumica transmisin de calor Fluctuacin cuntica
8 Referencias
8.1 Notas[1] termo-, Diccionario de la lengua espaola (22. edi-
cin), Real Academia Espaola, 2001, http://lema.rae.es/drae/?val=termo-.
[2] dinmico, Diccionario de la lengua espaola (22. edi-cin), Real Academia Espaola, 2001, http://lema.rae.es/drae/?val=din%C3%A1mico.
[3] Callen, H., Thermodynamics and an Introduction to Ther-mostatistics, 2nd Ed., Rivas, 1986
[4] Ver R.RIVAS, 1986.
[5] Callen, H., Thermodynamics and an Introduction to Ther-mostatistics, 2nd Ed., Wiley, 1985
[6] Asaro, R., Lubarda, V., Mechanics of Solids and Mate-rials, Cambridge University Press (2006)
[7] Reif, F., Fundamentals of Statistical and Thermal Physics,McGraww-Hill, New York, 1985, pag. 3
[8] Cfr.Callen, H., 1985; Reif, F., 1985
[9] Reif, F., Fundamentals of Statistical and Thermal Physics,McGraw-Hill, New York, 1985
[10] La entropa se dene en termodinmica clsica para sis-temas que se encuentran en equilibrio termodinmico yfuera de l no tiene sentido.
[11] Cfr. Callen, H., 1985
[12] Cfr. Reif, F, 1985
[13] Callen, Herbert B. Termodinmica: Introduccin a las teo-ras fsicas de la termosttica del equilibrio y de la termodi-nmica irreversible. Editorial AC, libros cientcos y tc-nicos, Madrid. ISBN 8472880427.
8.2 Bibliografa Boltzmann, Ludwig (1986). Escritos de mec-
nica y termodinmica. Alianza Editorial. ISBN842060173X.
Prez Cruz, Justo R. (2005). La Termodinmica deGalileo a Gibbs. Fundacin Canaria Orotava de His-toria de la Ciencia. ISBN 978-84-609-7580-9.
Planck, Max (1990). Treatise on Thermodynamics.Dover Publications. ISBN 048666371X.
Zemansky, Mark W. (1985). Calor y termodin-mica. Madrid: McGraw-Hill. ISBN 84-85240-85-5.
Callen, Herbert B. (1985). Thermodynamics andan Introduction to Thermostatistics. John Wiley &Sons.
Reif, Federick (1985). Fundamentals of Statisticaland Thermal Physics. McGraw-Hill.
9 Enlaces externos
Wikimedia Commons alberga contenido multi-media sobre TermodinmicaCommons.
Wikcionario tiene deniciones y otra informa-cin sobre termodinmica.Wikcionario
Wikiversidad alberga proyectos de aprendizajesobre Termodinmica.Wikiversidad
-
8 10 TEXT AND IMAGE SOURCES, CONTRIBUTORS, AND LICENSES
10 Text and image sources, contributors, and licenses10.1 Text
Termodinmica Fuente: http://es.wikipedia.org/wiki/Termodin%C3%A1mica?oldid=80082117 Colaboradores: AstroNomo, Mave-ric149, 4lex, Loqu, Fibonacci, Sabbut, Moriel, Frutoseco, JorgeGG, Alberto Salguero, Vivero, Zwobot, Bernardogu ar, Comae, Af3, Das-mandr, Fformica61, Interwiki, Noilegrus, Sms, Rsg, Tano4595, Murphy era un optimista, Joselarrucea, Schummy, Renabot, Richy, FAR,Stoker, Marhaiden, Deleatur, RobotJcb, Internete, Hispa, Arona, Rembiapo pohyiete (bot), Miaow Miaow, LP, Caiser, Magister Mathe-maticae, Ppfk, RobotQuistnix, Alhen, Superzerocool, Chobot, Caiserbot, Yrbot, Amads, Seanver, BOT-Superzerocool, Oscar ., Maleiva,.Sergio, MI GENERAL ZAPATA, Gaeddal, GermanX, CleverChemist, Equi, Beto29, The Photographer, Locucho, Patrickpedia, No squ nick poner, Sargentgarcia89, Baneld, Ceancata, Gtz, Jos., Maldoror, Tomatejc, Paintman, Chayinator, Fev, BOTpolicia, Siquisai,CEM-bot, Dontworry, Ketakopter, JMCC1, Alexav8, Retama, Davius, FrancoGG, Rafa606, Thijs!bot, Alvaro qc, Quezadav, Tortillovsky,Mahadeva, Drake 81, RoyFocker, Clementito, Will vm, Edgardavid, Carlosgarcia956, Isha, THergenhahn, MSBOT, Gusgus, Rrmsjp,JAnDbot, Kved, Integral triple, Ingolll, BetBot, Muro de Aguas, Gsrdzl, Rjgalindo, TXiKiBoT, Netito777, Rei-bot, Amanuense, Bedwyr,Chabbot, Idioma-bot, Alesico, Plux, Oscarp, Jorge C.Al, El oso negro, Octubre1987, Ralphloren171, AlnoktaBOT, VolkovBot, Snake-yes, Technopat, C'est moi, Seanmup, Campeador 690, Mgsanchezs, AshlyFuller, Matdrodes, Fernando Estel, BlackBeast, AlleborgoBot,3coma14, Altayre, Muro Bot, Elsebapizarro, Srbanana, Marcos.moya, Jmvgpartner, SieBot, Mushii, Cobalttempest, Drinibot, BOTarate,Mel 23, OboeCrack, Manw, Correogsk, Corroc, Belb, Ivanics, Javierito92, Rtewter25, HUB, Bachtold, StarBOT, Antn Francho, Nicop,Quijav, Eduardosalg, Botelln, Leonpolanco, Mar del Sur, Botito777, Petruss, Mon VaMpL, Poco a poco, Tlaoakaiser, Lluvia, Atila rey,Rge, Raulshc, Aipni-Lovrij, Camilo, UA31, AVBOT, Ellinik, LucienBOT, MastiBot, Nestor Makhno, Angel GN, Ialad, Diegusjaimes,Davidgutierrezalvarez, MelancholieBot, Joelcuervo, Arjuno3, Andreasmperu, Luckas-bot, Roinpa, Jotterbot, Dangelin5, Espince, Estela-margentina12, Leiro & Law, Yonidebot, Draxtreme, ArthurBot, Ruy Pugliesi, SuperBraulio13, Almabot, Ortisa, Manuelt15, Xqbot, Jkbw,Jmcastano, Nicadapa, MythicalDragon, FrescoBot, Ricardogpn, Jsportillo, Kismalac, Igna, Botarel, AstaBOTh15, RubiksMaster110, Pan-derine!, TobeBot, Halfdrag, RedBot, Augusto yakoby, Vubo, BF14, FAL56, Lungo, Dannyd1351, PatruBOT, CVBOT, Andres.ordonez,TjBot, Tarawa1943, Dark Bane, Eclypse-gt, Foundling, GrouchoBot, Adriansm, Wikilptico, Angiolo, Miss Manzana, Axvolution, Emaus-Bot, Ganiserb, Burny, Savh, Edumape, HRoestBot, Allforrous, Africanus, Grillitus, Rubpe19, Emiduronte, Jcaraballo, ChuispastonBot,El insasiable negro, Waka Waka, Techgenius, WikitanvirBot, CarlosVillamar, Antonorsi, MerlIwBot, Edc.Edc, Roberrpm, Renly, Jx3m,Kurasak, Jaimegc1227, Travelour, MagnusA.Bot, Gins90, MetroBot, Ljruizor, Cyberdelic, Bambadee, Acratta, Dunraz, LlamaAl, Creo-sota, Andrs Jaimes Carvajal, Helmy oved, Roscri, Eibols8, Syum90, MaKiNeoH, Pollisimo22, Legobot, Endranze, Lautaro 97, Jose nnnn,Stiven522, Balles2601, Eat Cereal, Topojoropo, Isotopito, Martintxoz, Bekinaram, Alberto Crista, JacobRodrigues, JLCianci, Diego Villa-nueva, Timoteo herrera, Fisimat, Sharon pearol, Rockeman, Geraldine27, Jarould, Matiia, Aliruderalis, Metalero98, Macoxs y Annimos:751
10.2 Images Archivo:Carnot2.jpgFuente: http://upload.wikimedia.org/wikipedia/commons/e/ec/Carnot2.jpg Licencia: Public domainColaboradores:
? Artista original: ? Archivo:Carnot_cycle_p-V_diagram.svg Fuente: http://upload.wikimedia.org/wikipedia/commons/0/06/Carnot_cycle_p-V_diagram.
svg Licencia: CC-BY-SA-3.0 Colaboradores: ? Artista original: ? Archivo:Commons-logo.svg Fuente: http://upload.wikimedia.org/wikipedia/commons/4/4a/Commons-logo.svg Licencia: Public domain
Colaboradores: This version created by Pumbaa, using a proper partial circle and SVG geometry features. (Former versions used to be slightlywarped.) Artista original: SVG version was created by User:Grunt and cleaned up by 3247, based on the earlier PNG version, created byReidab.
Archivo:HeatEngine.svg Fuente: http://upload.wikimedia.org/wikipedia/commons/5/53/HeatEngine.svg Licencia: CC BY-SA 3.0 Cola-boradores:
Maquina_termica.png Artista original: Maquina_termica.png: gonfer Archivo:Triple_expansion_engine_animation.gif Fuente: http://upload.wikimedia.org/wikipedia/commons/8/8a/Triple_expansion_
engine_animation.gif Licencia: CC BY 2.5 Colaboradores: Trabajo propio, created using XaraXtreme Artista original: Emoscopes Archivo:Wikiversity-logo-Snorky.svg Fuente: http://upload.wikimedia.org/wikipedia/commons/1/1b/Wikiversity-logo-en.svg Licen-
cia: CC BY-SA 3.0 Colaboradores: Trabajo propio Artista original: Snorky Archivo:Wiktionary-logo-es.png Fuente: http://upload.wikimedia.org/wikipedia/commons/0/06/Wiktionary-logo-es.png Licencia: CC
BY-SA 3.0 Colaboradores: originally uploaded there by author, self-made by author Artista original: es:Usuario:Pybalo
10.3 Content license Creative Commons Attribution-Share Alike 3.0
Historia de la termodinmica Leyes de la termodinmica Principio cero de la termodinmica Primera ley de la termodinmica Segunda ley de la termodinmica Enunciado de Clausius Enunciado de KelvinPlanck Otra interpretacin
Tercera ley de la termodinmica Sistema Medio externo
Equilibrio trmico Variables termodinmicas Estado de un sistema Equilibrio trmico Foco trmico Contacto trmico
Procesos termodinmicos Rendimiento termodinmico o eficiencia Teorema de Carnot
Diagramas termodinmicos Vase tambin Referencias Notas Bibliografa
Enlaces externos Text and image sources, contributors, and licensesTextImagesContent license