Peptide Si Proteine 2006-2007(1)
-
Upload
cirnatu-dana -
Category
Documents
-
view
307 -
download
6
Transcript of Peptide Si Proteine 2006-2007(1)

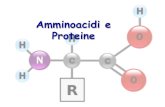
Peptide şi proteinePeptidele sunt compuşi de dimensiuni variate ce rezultă după legarea aminoacizilor prin
legături amidice substituite, legături peptidice. Acestea se formează prin eliminarea apei între grupa -carboxil a unui aminoacid şi grupa -amino a altui aminoacid:
Formarea legăturii peptidice este o reacţie de condensare care, din punct de vedere termodinamic, favorizează formarea reactanţilor. De aceea, în organisme, reacţia devine posibilă după activarea grupei carboxil pentru ca eliminarea grupei hidroxil să se facă mai rapid.
Un lanţ polipeptidic este constituit din secvenţa repetitivă –NH–Cα–CO-, atomii de H legaţi la N şi atomii de O fiind în conformaţie trans, aranjament trans repetitiv (Fig.1).
Fig.1 Aranjamentul trans repetitiv al legăturii peptidice (după Garrett R.H. şi Grisham C.M., 1995)
În peptide, restul de aminoacid de la capătul cu grupa amino liberă este restul amino-terminal (N-terminal), iar cel de la capătul unde este grupa carboxil liberă, restul carboxil-terminal (C-terminal). Prin convenţie, peptidele se scriu cu capătul N terminal în stânga.
Caracteristicile legăturii peptidiceLegătura peptidică este reprezentată, de obicei, ca o legătură simplă între grupa carbonil şi
azotul amidic. Prin determinări experimentale, s-a stabilit că legătura peptidică are caracter parţial de legătură dublă (Fig.2).
Rezonanţa legăturii peptidice are următoarele consecinţe: reduce rotirea liberă în jurul legăturii peptidice; cei 6 atomi ce compun grupa peptidică tind să fie coplanari formând planul amidic; lungimea legăturii C-N este intermediară între legăturile C–N şi C=N; legătura peptidică are aproximativ 40% caracter de dublă legătură; unitatea peptidică are caracter polar în condiţii de pH extreme.
Clasificarea peptidelorÎn funcţie de numărul de aminoacizi conţinuţi, peptidele se pot clasifica astfel:
oligopeptide, atunci când numărul este redus, între doi şi zece aminoacizi; polipeptide, dacă numărul aminoacizilor este mai mare
1

Deşi termenii proteine şi polipeptide se confundă uneori, în general moleculele cu greutatea moleculară sub 10000 daltoni sunt considerate polipeptide. Proteinele pot fi formate şi prin unirea a mii de resturi de aminoacizi.
Fig.2. Rezonanţa legăturii peptidice (a, b), planul amidic (c) (după Nelson D.L. şi Cox M.M., 2000)
Resturile amino şi carboxil terminale din peptide ionizează ca şi în cazul aminoacizilor liberi, doar că vor avea constante de ionizare diferite. La proprietăţile acido-bazice ale unei peptide contribuie şi grupele amino şi carboxil suplimentare ce pot ioniza. Ca şi aminoacizii liberi, şi peptidele au un pH izoelectric (pI) caracteristic, definit ca valoarea pH la care suma sarcinilor electrice pozitive este egală cu suma sarcinilor electrice negative, la care nu se deplasează în câmp electric (astfel că nu pot fi separate prin electroforeză, metodă de separare pe baza încărcării electrice diferite sub acţiunea unui câmp electric exterior aplicat probei).
Stabilirea structurii peptidelorHidroliza peptidelor şi proteinelor duce la obţinerea unor amestecuri de aminoacizi în
proporţii variate. Unele conţin toţi cei 20 de aminoacizi codificaţi genetic, în timp ce din altele lipsesc anumiţi aminoacizi. De exemplu, colagenul este o proteină în care predomină secvenţe de tipul (Gly-X-Pro), conţinând şi resturi numeroase de hidroxilisină şi hidroxiprolină; histonele, proteinele bazice ce neutralizează acizii nucleici, conţin cantităţi mari de arginină şi lisină; protaminele, de tipul salminei şi clupeinei din sperma unor peşti, nu conţin aminoacizi cu sulf şi aromatici, mioglobina nu conţine cisteină, etc. Condiţiile de hidroliză pot fi diferite: hidroliză acidă, metoda cea mai folosită, prin fierbere cu HCl 6N la 110oC, timp de 24, 48
sau 72 ore, în eprubete etanşeizate; hidroliză bazică, prin fierbere cu NaOH 2N la 100 oC, între 4-8 ore; hidroliză enzimatică sub acţiunea secvenţială a unor enzime proteolitice care scindează specific anumite legături peptidice (pepsina, tripsina, etc.). În acest caz, amestecul se poate impurifica prin produşii rezultaţi la autoliza enzimei.
Amestecul de aminoacizi rezultat este fracţionat prin metode diferite şi fiecare fracţiune se determină cantitativ. Metodele cele mai utilizate sunt cele cromatografice, cromatografia de lichide de înaltă performanţă (HPLC) sau cea de schimb ionic.
2

Analiza aminoacizilor dintr-un hidrolizat nu dă informaţii despre secvenţa proteică, adică despre ordinea în care sunt legaţi aceştia în lanţul polipeptidic. Secvenţa de aminoacizi este singura trăsătură distinctivă a oricărei peptide, ordinea de legare a aminoacizilor fiind codificată de secvenţa de unităţi din ADN.
Stabilirea secvenţei proteice se bazează pe principiile folosite de F. Sanger pentru indicarea succesiunii aminoacizilor din structura insulinei (1953).
Etapele secvenţializării unei polipeptide sunt următoarele:a. Determinarea compoziţiei în aminoacizi după hidroliza acidă a polipeptidei şi separarea prin cromatografie de schimb ionic sau HPLC a aminoacizilor pentru a stabili tipul şi concentraţia;b. Identificarea treptată a aminoacidului de la capătul N-terminal prin reacţii specifice;c. Identificarea aminoacizilor de la capătul C-terminal prin reacţii specifice.
În cazul peptidelor mici, aceste reacţii pot fi realizate automat, secvenţializarea făcându-se cu eficienţă relativ crescută. Cu cât peptida este mai lungă, eficienţa se reduce şi, de aceea, pentru analiza polipeptidelor şi proteinelor este necesară scindarea enzimatică a acestora în fragmente mai mici. În cazul în care polipeptida conţine legături disulfurice între resturile de cisteină, acestea sunt oxidate sau reduse cu diferiţi reactivi (ditiotreitol, acid periodic etc.).
Amestecurile rezultate la hidroliza enzimatică sunt secvenţializate ulterior şi apoi se analizează ordinea obţinută pentru diferitele fragmente (Fig.3).
Fig.3. Analiza secvenţei proteice (după Nelson D.L. şi Cox M.M., 2000)Cunoaşterea secvenţei de aminoacizi este importantă pentru a stabili compoziţia şi
proprietăţile polipeptidelor.Peptide cu activitate biologicăPeptidele naturale au funcţii biologice extrem de importante, indiferent de lungimea lor. În tabelul 1 sunt prezentate câteva exemple de oligo - şi polipeptide cu activitate biologică
semnificativă. Unele peptide naturale din ciupercile otrăvitoare sunt toxice pentru organism.De asemenea, există o serie de peptide de sinteză importante ca antibiotice, îndulcitori
sintetici (aspartam sau NutraSweet – esterul metilic al L-aspartil-L-fenilalaninei).
3

Tabel 1 Peptide cu activitate biologicăPeptid Denumire Funcţia biologică
Dipeptide Carnozina (β-alanil-histidină) Sistem tampon în muşchi NeurotransmiţătorAntioxidant etc
Tripeptide Glutation (γ-glutamil-cisteinil-glicină)Factorul hipotalamic TRH (piroglutamil-histidil-prolinamidă)
Antioxidant intracelularStimulează eliberarea TSH hipofizar
Pentapeptide Leu-encefalineMet-encefaline
Se leagă pe receptorii pentru opiacee
Nonapeptide Ocitocina (oxitocina)
VasopresinaBradikinina
Contracţia musculaturii netede a uteruluiHormon antidiuretic, hipertensivAcţiune vasodilatatoare
Decapeptide Angiotensina I Acţiune hipertensivăControlează secreţia de aldosteron
Polipeptide Hormonul melanocitostimulator (de ex. α – MSH-13 aminoacizi)Glucagon (29 aminoacizi)Calcitonină (32 aminoacizi)Insulină (51 aminoacizi)
Stimulează sinteza şi dispersia pigmenţilor de melaninăHormon hiperglicemiantHormon hipocalcemiantHormon hipoglicemiant
Carnozina. Carnozina sau β-alanil histidina este o dipeptidă localizată mai ales în muşchi (se găseşte în carnea proaspătă), fiind sistem tampon local, neurotransmiţător, antioxidant etc.
Glutationul (γ-glutamil-cisteinil-glicina) a fost izolat pentru prima dată din drojdii. Ulterior a fost descoperit şi în celulele animale, în hematii.
Proprietăţile glutationului derivă din faptul că are grupa –SH (tiol) care se poate oxida sub acţiunea unor compuşi variaţi ca structură. Glutationul intervine în atenuarea acţiunii toxice a peroxizilor, de exemplu peroxidul de hidrogen, H2O2. În felul acesta poate să intervină ca antioxidant în prevenirea stresului oxidativ implicat în diferite afecţiuni.
Reacţia se desfăşoară în prezenţa glutation peroxidazei, al cărei mecanism este prezentat schematic astfel:
4

Importantă pentru metabolismul glutationului este şi reacţia catalizată de glutation reductază:
glutation redus glutation oxidat
Sistemul glutation – enzime glutation dependente protejează hematiile, împiedicând liza acestora ca rezultat al acţiunii peroxizilor.
Peptide antibiotice. Sunt eliberate de bacterii, Streptomicete, ciuperci. Pot fi homomerice sau heteromerice, prezentând numai aminoacizi de tip L sau şi aminoacizi de tip D. (Tabel 2).
Tabel 2 Exemple de polipeptide antibioticePolipeptide antibiotice Caracteristici
Funcţii biologiceGramicidina (15 aa) Izolată din Bacillus brevis
Intervine în transportul membranar al unor cationiSe administrează în infecţii intestinale, pe plăgi infectate
Ciclosporina (11 aa) Peptid ciclic fungic util ca agent imunosupresor folosit pentru a evita respingerea grefelor de organe.
Valinomicina (10 aa) Peptid ciclic ce permite trecerea ionului de potasiu prin membrana mitocondrială. Utilă la studiul canalelor ionice membranare
Cicloserina Izolată din Streptomyces orchidaceus sau de sinteză.Are eficienţă slabă, folosindu-se mai ales pentru tratamentul tuberculozei pulmonare, în formele rezistente la HIN, în infecţii urinare rezistente la antibiotice, în lepră.
Azaserina In tratamentul cancerului.Bacitracine Bacitracina A (10 aa)
Izolate din Bacillus licheniformis; mai multe tipuri A,B,GUtilă în inhibarea cocilor Gram pozitivi, streptococ β-hemolitic. Are toxicitate renală
Polimixine Izolate din Bacillus polymyxa au acţiune asupra bacililor şi cocilor Gram negativi.Utilă în afecţiuni ale tractului intestinal, pielii, ochiului, cavităţii pleurale. Nu se absorb prin mucoase şi piele.Sunt neuro şi hepatotoxice
Cefalosporine Peptide izolate din Cefalosporium acremonium sau de sinteză. Utilizate în diverse infecţii
5

Clasificarea proteinelorProteinele pot fi alcătuite din unul sau mai multe lanţuri polipeptidice identice sau diferite
(proteine monomerice, respectiv multimerice). Fiecare unitate se numeşte protomer, numărul acestora fiind, de obicei, par. Asocierea protomerilor se face necovalent.
Lungimea lanţurilor polipeptidice ale proteinelor variază între 100 şi 1800 aminoacizi (cât are miozina din muşchi, una dintre cele mai lungi proteine). Masa medie a unei proteine este aproximativ 31,7 KDa, corespunzând unui lanţ cu aproximativ 280 resturi de aminoacizi (Tab.3).
Datorită marii varietăţi structurale şi funcţionale, criteriile de clasificare a proteinelor sunt numeroase: compoziţie, solubilitate, formă spaţială, funcţiile biologice, origine.
Tabel 3 Caracteristicile unor proteineMasa moleculară
(Da)Număr
aminoaciziNumăr lanţuri
Citocrom c (uman) 13000 104 1Ribonucleaza A (pancreas bovin) 13700 124 1Lizozim (albuş de ou) 13930 129 1Mioglobina (inimă de cal) 16890 153 1Chimotripsina (pancreas bovin) 21600 241 3Hemoglobina (umană) 64500 574 4Albumina serică (umană) 68500 609 1ARN polimeraza (E.coli) 450000 4158 5
Există proteine simple sau holoproteine care conţin numai resturi de aminoacizi (de ex. chimotripsina, ribonucleaza, albumina). Alte proteine sunt considerate proteine conjugate sau heteroproteine (heteroproteide) deoarece conţin permanent ataşate părţii proteice o grupă neproteică (grupă prostetică). Aceeaşi proteină poate conţine mai multe tipuri de grupe prostetice, reunind caracteristicile mai multor clase de heteroproteine. Acestea se clasifică pe baza naturii grupei prostetice (Tabel 4).
Tabel 4 Proteine conjugate (heteroproteine)Heteroproteină Grupa prostetică Exemple
Glicoproteine Lanţ oligoglucidic Imunoglobuline, glicoforina Lipoproteine Lipide β-lipoproteinaNucleoproteine Acizi nucleici RibonucleoproteineCromoproteine Grupare colorată (de ex. hem) Hemoglobina, flavoproteineFosfoproteine Resturi fosforice CaseinaMetaloproteine Metale Xantinoxidaza (Fe, Mo)
Calmodulina (Ca)Feritina (Fe)Alcool dehidrogenaza (Zn)
În funcţie de forma adoptată, proteinele pot fi globulare (cele care au o formă aproape sferică) şi fibrilare (ce tind să aibă o structură liniară, filiformă) (Tabel 5). Solubilitatea acestora este diferită: cele fibrilare sunt insolubile în apă şi soluţii de electroliţi diluate, în timp ce proteinele globulare sunt solubile, deoarece în acestea radicalii hidrofobi sunt „împachetaţi” în interiorul structurii. Majoritatea heteroproteinelor sunt proteine globulare.
Tabel 5 Proteine globulare şi fibrilareProteine globulare Proteine fibrilare
Albumină serică, ovalbumină KeratineGlobuline Miozina Histone ColagenProtamine Elastina
6

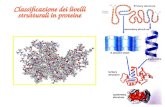
Structura proteinelorAranjamentul spaţial al proteinelor este complex şi, fie că sunt alcătuite dintr-un singur lanţ
polipeptidic sau din mai multe lanţuri polipeptidice, proteinele prezintă mai multe nivele de organizare: structură primară, secundară, terţiară şi cuaternară (Fig.4).
Structura primară descrie tipul, numărul şi ordinea în care se leagă covalent aminoacizii pentru a forma un lanţ polipeptidic. Structura secundară se referă la aranjamentele stabile, repetitive ale lanţului polipeptidic. Structura terţiară descrie modul de aglomerare tridimensională a unei polipeptide, iar cea cuaternară reprezintă aranjamentul spaţial al proteinelor multimerice.
Fig. 4 Nivele de organizare structurală a proteinelor (după Nelson D.L. şi Cox M.M., 2000)
Structura primarăStructura primară se referă la numărul, natura şi succesiunea aminoacizilor dintr-un lanţ
polipeptidic (Fig.5) Legătura caracteristică acestui tip de structură este legătura peptidică ce uneşte resturile aminoacil între ele, într-o ordine stabilită de succesiunea de nucleotide din ADN.
Importanţa cunoaşterii structurii primare a proteinelor a) Prin compararea structurii primare a proteinelor care îndeplinesc aceleaşi funcţii
biologice la organisme diferite s-a observat o omologie de secvenţă proteică, stabilindu-se gradul de varietate structurală.
Citocromul c, o proteină transportoare de electroni din membrana internă mitocondrială, ce conţine aproximativ 100 aminoacizi, este un exemplu tipic de omologie, formele existente la diferite organisme prezentând în 28 de poziţii aminoacizi invariabili la toate speciile (Fig.5), fundamentali pentru funcţia biologică îndeplinită.
Fig.5. Reprezentarea schematică a citocromului c (după Garrett R.H. şi Grisham C.M., 1995). Aminoacizii inscripţionaţi sunt cei invariabili.
b) Proteinele care îndeplinesc funcţii biologice asemănătoare prezintă adesea un grad înalt de similitudine a structurii (până la aproximativ 25% identitate de aminoacizi), ceea ce demonstrează originea filogenetică comună. De exemplu, mioglobina şi hemoglobina care, deşi diferite structural în ansamblu, au secvenţe comune ce le permit să îndeplinească acelaşi rol biologic, fixarea O2. Omologia structurală permite stabilirea originii într-un precursor comun chiar şi pentru proteine care îndeplinesc funcţii biologice diferite (de exemplu, tripsina, chimotripsina au activitate enzimatică similară trombinei, dar substraturile folosite sunt diferite).
7

c) Cunoaşterea structurii primare face posibilă şi caracterizarea structurii unei proteine anormale. Apariţia unei mutaţii în ADN duce la sinteza unei proteine anormale care nu mai are funcţiile proteinei iniţiale, deoarece are substituiţi anumiţi aminoacizi.
Substituirea unui aminoacid poate fi conservativă (substituirea se face cu un aminoacid cu aceeaşi polaritate) sau neconservativă (se substituie cu un aminoacid de altă natură).
Cel mai cunoscut exemplu este cel al modificărilor hemoglobinei (Tabel 6). Hemoglobina S, una din hemoglobinele anormale, are valină în locul acidului glutamic din
poziţia 6 a catenei β. Ca urmare are proprietăţi diferite de ale hemoglobinei normale, hematia ia formă de seceră şi apare un tip particular de anemie (siclemie sau anemie falciformă).
d) Pe baza asemănării structurii primare care se răsfrânge asupra proprietăţilor esenţiale ale unei polipeptide, unele proteine de natură animală pot fi folosite în tratamentul unor afecţiuni umane (de ex., insulina bovină sau porcină folosită în tratamentul diabetului zaharat, înaintea obţinerii insulinei recombinate).
Tabel 6 Modificări structurale ale hemoglobinei (adapta după Dickerson şi Geis, 1983)Hemoglobina anormală Aminoacid normal Aminoacid substitut
Modificări în catena αTorinoTarrant
G-GeorgiaModificări în catena β
SGenova
M-MilwakeeHiroshima
Fenilalanină 43Acid aspartic 126
Prolină 95
Acid glutamic 6Leucină 28Valină 67
Histidină 146
ValinăAsparagină
Leucină
ValinăProlină
Acid glutamicAcid aspartic
Structura spaţială a proteinelor Proteinele native nu există ca lanţuri polipeptidice complet întinse, ci sub forma unor
aranjamente compacte ce influenţează funcţiile biologice ale acestora. Aceste aranjamente spaţiale sunt stabilizate prin interacţiuni necovalente: legături de hidrogen, interacţiuni hidrofobe, interacţiuni electrostatice, forţe Van der Waals. Structura secundară
Orice lanţ polipeptidic adoptă o structură tridimensională specifică determinantă pentru funcţiile biologice. Datorită legăturilor peptidice, catena polipeptidică poate prezenta anumite conformaţii. Legătura peptidică, având caracter de dublă legătură, nu permite decât rotirea legăturii dintre Cα şi grupa -C=O din legătura peptidică şi dintre Cα şi –NH-. Catena se poate dispune elicoidal sau în planuri pliate, aranjamentul spaţial rezultat stabilizându-se prin legături de hidrogen între grupele –NH- şi -C=O adiacente.
Structura rezultată reprezintă structura secundară care este caracterizată de mai multe modele, principalele fiind modelul α –helix, modelul în planuri β-pliate şi modelul β-turn. Modelul α –helix
Conform acestui model, propus de L. Pauling şi R. Corey în 1951, lanţul polipeptidic se răsuceşte elicoidal în jurul unui ax imaginar, radicalii aminoacizilor orientându-se în exteriorul elicei. Studiile cristalografice ale lui M. Perutz au confirmat prin difracţia razelor X în cristale existenţa acestui model în α-keratină şi au stabilit câteva caracteristici:
fiecare spiră conţine 3,6 resturi de aminoacizi; fiecare aminoacid se întinde pe 1,5 Å de-a lungul axei helixului; pasul elicei este de 5,4 Å; diametrul helixului este de 6 Å; legăturile ce stabilizează structura sunt legăturile de hidrogen intracatenare (fiecare
grupă - CO este legată prin legături de hidrogen de grupa –NH- de la al 4-lea aminoacid pe verticală, legăturile de hidrogen formate fiind paralele cu axa helixului).
8

Formarea numărului optim de legături de hidrogen care stabilizează structura este unul din motivele pentru care α –helixul este conformaţia care se adoptă cel mai uşor.
Aminoacizii naturali pot să formeze elice răsucite spre dreapta sau spre stânga, dar în proteine s-a identificat numai α-helix răsucit spre dreapta (Fig.6). Unii aminoacizi împiedică formarea modelelor tipice structurii secundare (de ex., prolina, glicocolul, cei cu R acid şi bazic).
Fig.6. Reprezentarea grafică a α-helixului (după Garrett R.H. şi Grisham C.M., 1995) S-a observat şi faptul că acest model poate să apară în polipeptide ce conţin numai L- sau
numai D-aminoacizi, însă nu şi atunci când conţin ambele tipuri sterice. Proteina reprezentativă pentru α-helix este α-keratina.
Celelalte proteine au α-helix în proporţie variată alternând cu zone neelicoidale (mioglobina şi hemoglobina 76-78%, ovalbumina 31% ). Modelul în planuri pliate β
Structura în foaie pliată a fost postulată tot de R. Corey şi L. Pauling (1951) şi a fost găsită în numeroase proteine. Conform acestui model fiecare foaie pliată poate fi privită ca o catenă polipeptidică în zig-zag, cu atomii de carbon situaţi la locul de pliere.
Fig.7. Reprezentarea modelului în foaie pliată β (după Garrett R.H. şi Grisham C.M., 1995): orientare paralelă; b) orientare antiparalelă
Modelul în foaie pliată β poate avea două orientări: paralelă, când lanţurile adiacente sunt orientate în aceeaşi direcţie şi antiparalelă, dacă lanţurile sunt orientate în direcţii diferite (Fig.7). Modelul se caracterizează prin următoarele:
9

legăturile de hidrogen ce stabilizează structura se formează mai ales intercatenar; în orientarea paralelă radicalii hidrofobi sunt dispuşi de o parte şi de alta a lanţului, pe când în orientarea antiparalelă radicalii sunt dispuşi pe o singură faţă; proteinele cu această structură conţin aminoacizi cu radical mai puţin voluminos (alanina, glicina), mai ales dacă este necesară asocierea mai multor lanţuri într-o proteină.
Aranjamentul antiparalel este caracteristic β-keratinei din pene, fibroinei din mătase, Apare în proporţii variate în alte proteine (imunoglobuline, enzime).Multe proteine au atât α-helix, cât şi planuri pliate β.
Deoarece majoritatea proteinelor adoptă o formă aproape sferică, lanţul polipeptidic trebuie să aibă capacitatea de a se întoarce şi a se reorienta astfel încât să poată forma structura globulară compactă necesară. Zona de răsucire se caracterizează printr-un model particular, model β-turn.
Lanţul polipeptidic formează prin legături de hidrogen un “laţ” strâns între grupa -C=O a unui rest de aminoacid şi grupa –NH- aflată la al treilea aminoacid distanţă faţă de acesta. Proteina poate astfel să-şi schimbe direcţia (Fig. 8). În acest model predomină mai ales glicina şi prolina, glicina fiind cel mai potrivit pentru o astfel de structură datorită absenţei radicalului.
Fig.8. Reprezentarea modelului β-turn Structura terţiară
Aranjamentul tridimensional complet al unui lanţ polipeptidic reprezintă structura terţiară. Aceasta include relaţia geometrică dintre diferitele segmente aflate la distanţă mare în lanţul polipeptidic şi cea dintre radicalii aminoacizilor din lanţ.
Nu se cunoaşte care este regula conform căreia se dispun proteinele, dar se poate considera că acestea se pliază astfel încât să se formeze structurile cele mai stabile (cu cea mai mică energie liberă Gibbs). Stabilitatea este dată de formarea unui număr mare de legături de hidrogen şi de reducerea suprafeţei accesibile solvenţilor din mediu. Radicalii hidrofobi se dispun la interior, iar cei polari la exterior, stabilizându-se astfel prin solvatare cu apă.
Legăturile care stabilizează structura terţiară sunt: legătura disulfurică, stabilită între radicalii tiol ai cisteinei (apare, mai ales, la proteinele care conţin resturi numeroase de cisteină), specifică acestui tip de structură; legături ionice între grupe încărcate pozitiv (arginină, lisină) şi negativ (aspartat, glutamat); legături de hidrogen între radicalii cu grupe hidroxil (serină, treonină), amidă (glutamină, asparagină); interacţiuni hidrofobe între aminoacizii nepolari (valină, leucină, fenilalanină, alanină).
Structura cuaternarăAcest nivel structural se referă la aranjamentul adoptat de proteinele constituite din mai
multe lanţuri polipeptidice (denumite protomeri) care se asociază necovalent într-un ansamblu, multimer. Numărul subunităţilor poate varia de la două la câteva sute. Dacă numărul monomerilor este mic, ansamblul se numeşte oligomer.
Monomerii, identici sau diferiţi, sunt inactivi, iar oligomerul este activ. Monomerii adoptă conformaţii globulare independente şi interacţionează necovalent ulterior.
De obicei, numărul monomerilor este par (Tabel 7).
10

Legăturile prin care se stabilizează ansamblul oligomer sunt diferite: interacţiuni van der Waals, interacţiuni hidrofobe, legături de hidrogen, legături ionice.
Nu toate proteinele prezintă structură cuaternară. De exemplu: unele proteine fibrilare, mioglobina şi albumina care conţin un singur lanţ polipeptidic, etc.
Prima proteină a cărei structură cuaternară a fost descrisă este hemoglobina, o heteroproteină tetramerică cu masa 64,5 kDa, alcătuită dintr-o componentă proteică, globina, ce conţine două tipuri de lanţuri, α (cu 141 aminoacizi) şi β (cu 146 aminoacizi), şi o grupă neproteică, hemul. Subunităţile hemoglobinei sunt dispuse în perechi simetrice α β (Fig.9).
Tabel 7 Exemple de proteine multimericeProteină Număr de protomeri
Alcool dehidrogenazăAldolazăGlutation reductazăImunoglobulineLactat dehidrogenazăInsulinăHemoglobinăProteina din învelişul poliovirusuluiCeruloplasmină
2324464608
Fig.9. Reprezentarea schematică a hemoglobinei şi mioglobinei(după Garrett R.H. şi Grisham C.M., 1995)
Există câteva motive principale pentru care monomerii se agregă ca multimeri. Stabilitatea. Raportul suprafaţă-volum devine mai mic pe măsură ce raza particulei creşte, deci vor avea loc interacţiuni mai puţine; Economia şi eficienţa genetică. Este necesară o cantitate mai mică de ADN pentru a codifica un monomer decât pentru a codifica un lanţ cu dimensiunea oligomerului (cu aceeaşi masă). Pentru proteine mai lungi, erorile genetice ar fi mai mari; Asocierea situsurilor catalitice. Situsurile catalitice ale protein - enzimelor se pot constitui prin contribuţia mai multor monomeri; Cooperativitatea. Proteinele multimerice prezintă mai multe situsuri de legare a aceluiaşi compus ce modulează activitatea (denumit ligand). Dacă legarea ligandului la un situs
11

influenţează legarea sa la celelalte, apare fenomenul de cooperativitate ce poate fi pozitivă sau negativă. Cooperativitatea este unul din mecanismele reglării proceselor biochimice.
Structurile primară şi secundară apar atât la proteinele fibrilare, cât şi la cele globulare, pe când structurile terţiară şi cuaternară sunt întâlnite mai ales la proteinele globulare şi la heteroproteine. Unele asocieri ale proteinelor fibrilare, cum ar fi în cazul colagenului şi al α-keratinei, pot fi considerate modele particulare ale structurilor terţiară şi cuaternară.
Funcţiile proteinelorPrincipalul element definitoriu pentru funcţiile pe care le îndeplinesc proteinele din diverse
medii este structura acestora. În funcţie de structura tridimensională, proteinele pot fi grupate în proteine fibrilare şi proteine globulare.
Caracteristicile structurale şi funcţiile unor proteine fibrilareProteinele fibrilare furnizează exemple particulare pentru studiile privind interrelaţia
structură – funcţii biologice. Conţin lanţuri polipeptidice cu secvenţe proteice regulate organizate aproximativ paralel în lungul unui ax, formând fibre lungi sau foi mari; Au rezistenţă mecanică ridicată; Sunt insolubile în apă şi soluţii saline diluate; Au rol structural, furnizând rezistenţă şi protecţie celulelor şi ţesuturilor, unele reprezintă adevărate „motoare celulare” (de ex., miozina ce intervine în contracţia musculară); Au structură primară, secundară (organizată majoritar într-un singur tip de model) şi modalităţi specifice de aranjament terţiar şi cuaternar. .
Proteine fibrilare cu funcţii biologice importante sunt: - α-keratina (din unghii, păr, lână, copite, gheare, reprezentativă pentru modelul α-helix)- β-keratina (găsită mai ales în pene, reprezentativă pentru modelul în foaie pliată β)- colagenul (constituent major al ţesutului conjunctiv animal: tendoane, cartilaje, oase,
dinţi, vase de sânge, piele)- miozina (din fibrele musculare)- elastina (din tunica medie a aortei, din plămâni, ligamente, piele
α-Keratina. Structura primară constă din secvenţe repetitive de 7 aminoacizi (a-b-c-d-e-f-g)n, în care resturile a şi d sunt aminoacizi nepolari, iar e şi g sunt polari. Această structură regulată face helixul instabil, însă lanţul se răsuceşte în două şi rezultă perechi care stabilizează structura (Fig.10a). Se formează legături disulfurice între resturi de cisteină din fibre adiacente ceea ce determină rigiditatea întregii structuri, făcând-o inextensibilă şi insolubilă, proprietate importantă pentru structurile ce conţin α-keratină. Numărul şi poziţia legăturilor disulfurice determină modul de încreţire a părului, lânii. Mai multe „cozi răsucite” de α-keratină din firul de păr se asociază pentru a forma protofilamente (cu diametrul 20-30 Å) şi protofibrile (diametrul 40-50 Å). Patru protofibrile (32 de lanţuri catene de α-keratină) se combină pentru a forma filamente intermediare din care se va forma firul de păr (Fig.10b).
β-Keratina are o structură primară asemănătoare α-keratinei, însă cu aranjarea catenelor sub forma unor perechi de planuri β pliate împachetate. În condiţii de umiditate, α-keratina îşi modifică modul de aranjare şi se transformă în β-keratină.
Elastina este proteina fibrilară din tunica medie a aortei, din plămâni, ligamente, piele. Elastina se deosebeşte puţin de colagen prin aminoacizii conţinuţi. Nu are hidroxilisină şi conţine foarte puţine resturi de hidroxiprolină. Proporţia de prolină (aproximativ 10%) şi glicină este mai mare decât în colagen, conţinând totodată şi foarte multe resturi de aminoacizi nepolari.
Se sintetizează sub formă de proelastină în fibroblaste, aceasta fiind secretată în mediul extracelular unde se formează elastina.
Are o structură neordonată, foarte mobilă, care îi conferă elasticitate. Este rezistentă la acţiunea agenţilor chimici, dar hidrolizată de elastaza din extracte pancreatice.
12

Elastina formează agregate bimoleculare prin unirea covalentă a lanţurilor prin intermediul resturilor de lisină formându-se o punte între gupa amino a unui rest de lisină şi grupa carbonil a unui rest de lisină dezaminat oxidativ şi transformat în lisilaldehidă.
Frecvent pot să apară structuri rezultate prin participarea a trei resturi de lisilaldehidă şi a unui rest lisil care duc la formarea desmozinei. Prin intermediul ei şi al izodesmozinei, izomerul său, se pot forma punţi de legătură între catenele de elastină care asigură capacitatea de alungire şi scurtare, deci elasticitatea acesteia.
În condiţii patologice, elastinei din ţesuturi i se pot asocia lipide.
Fig.10 a) Reprezentarea schematică a α-keratinei; b) Asocierea unităţilor structurale din firul de păr (după Nelson D.L. şi Cox M.M, 2000)
Caracteristicile structurale şi funcţiile unor proteine globulareMajoritatea proteinelor din organisme sunt proteine globulare caracterizate prin organizare
structurală tridimensională diferită de cea a proteinelor fibrilare, catenele polipeptidice fiind pliate într-o formă compactă, aranjament ce le conferă diversitate structurală şi posibilitatea îndeplinirii unor funcţii biologice extrem de variate (Tabel 9).
Sunt structuri dinamice prezentând diferite mişcări ale unor atomi singulari, grupe de atomi sau chiar ale unor segmente ale moleculei. Modificările conformaţionale implică mişcări foarte rapide (10-9–10-3sec) realizate ca răspuns la un stimul specific sau ca urmare a interacţiunilor dintre proteine;
Au structură primară, secundară, terţiară şi cuaternară, cu mici excepţii; În funcţie de tipul de structură secundară adoptat, proteinele globulare pot fi clasificate
în: proteine cu α-helix (globina, hemaglutinina, miohemeritrina, proteina din virusul mozaicului tutunului), cu foaie β pliată paralelă sau mixtă (enzime precum: piruvat kinaza, triozofosfat izomeraza, hexokinaza), cu foaie β pliată antiparalelă (papaina, inhibitorul tripsinei, glutation reductaza) şi proteine mici bogate în sulf sau metale (fosfolipaza A2, insulina, ferredoxina). În general, proteinele native conţin mai multe tipuri de structură secundară, unul fiind predominant.
Se dispun spaţial astfel încât să adopte o formă aproape sferică.
Tabel 9 Exemple de proteine globulare şi funcţiile lor biologiceFuncţie biologică Exemple
EnzimeTransportori HormoniProteine de rezervăProteine ce leagă O2
ImunologicFactori de coagulare
Tripsina, chimotripsina, lizozim, alcool dehidrogenaza, etc Albumina serică, globuline (ceruloplasmina, transferina etc)TSH, insulină, parathormonFaseolină, zeină, ovalbuminăMioglobină, hemoglobinăImunoglobuline, proteinele din veninTrombină
13

Primele date despre structura terţiară a proteinelor globulare au fost obţinute de J. Kendrew şi colaboratorii săi, referitor la mioglobină. Aceasta este alcătuită dintr-un singur lanţ polipeptidic cu 153 aminoacizi legat de o grupă neproteică, hemul, ce conţine un ion de fier. Catena polipeptidică organizată secundar se pliază în spaţiu, astfel încât să creeze un buzunar hidrofob care să includă hemul pentru a proteja ionul Fe2+ (Fig.11).
Fig.11. Reprezentarea schematică a mioglobinei
Majoritatea proteinelor globulare sunt alcătuite astfel încât la interior să fie dispuşi radicalii aminoacizilor hidrofobi (Leu, Ileu, Val, Phe, Met), iar resturile ionizabile să fie expuse la suprafaţă. Apa nu poate pătrunde în interiorul moleculei. Structurile proteinelor mici se stabilizează mai ales prin legături covalente (disulfurice, legături specifice între hem şi partea proteică) şi, mai puţin, prin legături de hidrogen şi interacţiuni ionice.
Pe măsură ce creşte complexitatea unei proteine, caracterizarea structurii terţiare a acesteia capătă alte aspecte. Fiecare proteină este organizată prin asocierea unor module ce reprezintă modul de relaţionare a unor elemente de structură secundară în spaţiu. Modulele proteice pot să apară într-o mare diversitate de proteine sau pot să se repete de mai multe ori în aceeaşi proteină.De exemplu, modulul imunoglobulinic apare nu numai în imunoglobuline, ci şi în alte proteine cu rol în recunoaşterea celulară şi în unii factori de creştere. Alte module importante sunt: modulul cu acid γ-carboxiglutamic (în factori de coagulare, proteina C reactivă), modulul fibronectinei, modulul EF hand (din proteinele ce leagă calciu)etc.
Proteinele care au mai mult de câteva sute de aminoacizi se pliază în două sau mai multe unităţi globulare stabile denumite domenii. Diferitele domenii pot să aibă funcţii distincte (să interacţioneze specific cu liganzi sau cu alte proteine), să fie delimitate în lobi separaţi, să-şi păstreze structura tridimensională chiar dacă sunt separate de restul proteinei.
Nu toate proteinele globulare se pliază spontan pe măsură ce sunt sintetizate. Celulele conţin proteine care uşurează procesul de pliere şi de formare a conformaţiei native a proteinei, conformaţia cu cea mai mică energie liberă Gibbs (proteine de folding).
Acestea sunt reprezentate de: Proteine ce asistă procesul de pliere (chaperonele moleculare); Enzime ce catalizează reacţii de izomerizare.
Chaperonele sunt proteine ce interacţionează cu polipeptidele parţial sau impropriu pliate şi asigură condiţiile necesare plierii.
Au fost caracterizate două clase de astfel de molecule, ce se găsesc la toate organismele de la bacterii la mamifere.
Proteinele de şoc termic (heat shock protein, Hsp) au, în general, o masă de 70 kDa (sunt cunoscute ca Hsp70) şi abundă în celulele aflate în condiţii de stres termic. Se leagă la zonele bogate în reziduuri hidrofobe şi previn agregarea necorespunzătoare. De asemenea, ele blochează plierea unor proteine ce trebuie să fie transportate prin membrane (de exemplu,
14

precursorii unor proteine destinate mitocondriilor şi cloroplastelor, ce trebuie să străbată membrana acestor organite). Legarea Hsp 70 la proteine se face cu consum de ATP.
Chaperoninele, (Hsp60) sunt complexe proteice cu masa 60 kDa necesare pentru plierea proteinelor celulare care nu se pliază spontan.
În procesul de pliere a unor proteine sunt necesare două sisteme enzimatice care catalizează reacţii de izomerizare.
Izomerazele disulfurice sunt enzime care catalizează formarea şi ruperea legăturilor disulfurice până la atingerea conformaţiei native, precum şi eliminarea intermediarilor cu legături disulfurice încrucişate.
Peptid-prolil cis-trans izomerazele catalizează interconversia izomerilor cis-trans ai legăturilor la care participă prolina.
Procesul de pliere a proteinelor este mult mai complex fiind obiectul studiului a numeroase laboratoare şi în prezent.
Corelaţii clinice. Plierea proteinelor este extrem de importantă şi orice pas ce se desfăşoară necorespunzător poate avea efecte nedorite. Se consideră că proteinele pliate incorect sunt cauza unor boli degenerative ale creierului la mamifere. De exemplu, encefalopatia spongiformă (boala vacii nebune), boala Creutzfeldt-Jakob sunt cauzate de astfel de modificări care determină o degenerescenţă vacuolară la nivelul scoarţei cerebrale. Aceste boli sunt determinate de modificări ale conformaţiei unei proteine mici (28 kDa), denumită prion (se mai numesc şi boli prionice), ce se găseşte în creierul normal. Forma normală a proteinei (PrP) este convertită într-o conformaţie alterată (PrPsc) şi interacţiunea celor două determină alterarea formei normale iniţiind un proces în lanţ ce afectează masa cerebrală.
Imunoglobulinele. Vertebratele posedă un sistem imun complex ce elimină substanţele şi organismele străine. Ele au anumite celule, limfocitele B (derivate, în principal din măduva osoasă la animale şi din bursa lui Fabricius la păsări), care sintetizează anticorpi (imunoglobuline) care recunosc antigenele (compuşii străini de diferite tipuri). Expunerea la antigene determină răspunsul imun.
Anticorpii sunt proteine conjugate (glicoproteine) globulare care persistă în concentraţie scăzută pentru mai mulţi ani. Pătrunderea antigenului şi legarea la suprafaţa limfocitelor determină proliferarea acestora şi producerea anticorpilor.
Formarea complexului antigen-anticorp determină precipitarea antigenului şi îl marchează pentru distrugere, generând răspunsul primar.
Imunoglobulinele sunt de mai multe tipuri: A, D, E, G, M. Sunt oligomeri în formă de Y, alcătuiţi din cel puţin două lanţuri uşoare (L, light, Mr 23000 Da) şi două lanţuri grele (H, heavy, Mr 53000 – 75000 Da) identice, unite între ele prin punţi disulfurice. Fiecare clasă de imunoglobuline are un anumit tip de lanţ greu (α, δ, ε, γ, μ) şi unul din cele două tipuri de lanţuri uşoare existente (κ şi λ). La om sunt mai frecvente lanţurile κ. Funcţia fiecărei clase de imunoglobuline este determinată de lanţurile grele.
Fiecare lanţ poate fi divizat conceptual în domenii cu structură şi funcţie specifice (Fig.17). Imunoglobulinele IgG, D şi E au structuri tetramerice similare. Lanţurile uşoare au două domenii, iar cele grele au patru – cinci domenii.
Jumătatea dinspre capătul C-terminal a lanţului L reprezintă regiunea constantă (CL), iar cea dinspre capătul N-terminal regiunea variabilă (VL). Un sfert din lanţul H, începând de la capătul N-terminal, reprezintă regiunea variabilă a acestuia (VH), restul de trei sferturi fiind format din trei regiuni constante la lanţurile α, δ, γ (CH1, CH2, CH3) şi patru la lanţurile ε, μ. Lanţurile diferă între ele prin domeniile constante şi variabile.
Domeniile N-terminale, domeniile variabile ale ambelor tipuri de lanţuri, determină situsul de legare specifică a antigenului. Digestia unei imunoglobuline cu papaină produce două fragmente de legare a antigenului (Fab) şi un fragment cristalizabil (Fc). Fc este responsabil de funcţiile efectoare specifice fiecărei clase de imunoglobuline. Regiunea în care acţionează papaina se numeşte regiune balama.
15

Fig.13. Reprezentarea schematică a imunoglobulinei G
Determinanţii antigenici sunt grupele -OH, -NH2, - COOH, -SH. Interacţiunea anticorpilor cu antigenul se stabileşte prin legături de hidrogen şi prin forţe electrostatice.
Imunoglobulinele Ig M sunt atât monomeri (forma legată de membrană) cât şi pentameri (forma secretată) şi reprezintă primul tip de anticorp sintetizat de limfocitele B, cu rol în răspunsul primar. Imunoglobulinele Ig G, D şi E au structuri tetramerice similare, fiind monomeri. IgA se găseşte mai ales în secreţii (salivă, lacrimi, lapte) putând fi monomer, dimer sau trimer. IgE joacă rol în răspunsul alergic, interacţionând cu leucocitele bazofile şi cu mastocitele din ţesuturi, funcţionând ca receptor al antigenului.
Datorită specificităţii de legare la un anumit antigen, anticorpii se folosesc în laborator pentru detectarea unor cantităţi mici de compuşi biologici din lichide şi ţesuturi, metodele fiind cunoscute ca metode imunologice (tehnicile ELISA, Western blotting, imunohistochimia etc.).
Solubilitatea proteinelorProteinele sunt polielectroliţi cu un număr şi tipuri diferite de grupe ionizabile. Sarcina netă
a unei molecule proteice şi atracţia ei faţă de o altă moleculă sunt în funcţie de pH-ul şi tăria ionică a mediului (mărime ce caracterizează sarcinile din mediu în funcţie de concentraţie).
Solubilitatea celor mai multe proteine (proteine globulare) în soluţii apoase poate fi pusă pe seama interacţiunilor hidrofile dintre moleculele polare ale apei şi grupele ionizate ale moleculelor proteice (- COO-, - NH3
+).Reactanţii care modifică tăria ionică şi constanta dielectrică a unei soluţii apoase
afectează solubilitatea proteinelor.Adăugarea unor solvenţi organici (etanol, acetonă), la o temperatură scăzută, scade
constanta dielectrică a mediului, determinând creşterea atracţiei dintre moleculele proteice: F =( e1 x e2) / D, unde F = forţa de atracţie; e1 şi e2 = sarcinile electrice, iar D
= constanta dielectrică.Moleculele precipită şi, dacă se lucrează la o temperatură care să nu permită denaturarea
ireversibilă, proteina îşi păstrează proprietăţile. Sărurile neutre de amoniu, sodiu, magneziu pot să modifice solubilitatea proteinelor. La
concentraţii mici de sare, solubilitatea proteinelor creşte (efect salting in), iar dacă se măreşte concentraţia sării, se va ajunge la o valoare la care, datorită deshidratării puternice, moleculele se vor agrega şi vor precipita (salting out).
16

Precipitarea în aceste condiţii este reversibilă. Desalefierea moleculelor proteice se face prin dializă sau prin gel-filtrare, iar solvenţii se evaporă.
Fiecare tip de proteină precipită la o anumită concentraţie de sare sau de solvent şi, de aceea, precipitarea cu săruri neutre sau cu solvenţi nepolari poate fi folosită la fracţionarea amestecurilor proteice, cum ar fi de exemplu separarea proteinelor plasmatice.
Modificarea pH-ului determină precipitarea proteinelor. Ea este maximă atunci când se atinge valoarea pH-ului izoelectric, pH -ul la care numărul sarcinilor pozitive este egal cu cel al sarcinilor negative.
Precipitarea la punctul izoelectric (pI) este, de asemenea, o metodă de separare a proteinelor. La pH izoelectric încărcarea electrică a proteinelor este redusă.
Denaturarea proteinelorProteinele în forma lor naturală sunt denumite proteine native. Orice modificare a
structurii native a unei proteine se numeşte denaturare. Aceasta este cauzată adesea de modificările structurii secundare, terţiare sau cuaternare a proteinelor.
Denaturarea proteinelor poate fi însoţită de următoarele consecinţe: diminuarea solubilităţii cu precipitarea proteinei; creşterea numărului de grupe –SH libere, datorită ruperii punţilor disulfurice; modificarea vâscozităţii şi a presiunii osmotice; creşterea susceptibilităţii la hidroliza enzimatică şi pierderea activităţii biologice.
Denaturarea proteinelor poate fi determinată de diferiţi factori: factori fizici: căldură (>500C), agitare, raze X, radiaţii UV, ultrasunete; factori chimici: solvenţi organici, săruri neutre, acizi minerali, alcalii, acizi organici, detergenţi, uree, guanidină, etc.
În cazul unora dintre aceşti agenţi (uree, guanidină), denaturarea nu este completă fiind afectate numai legăturile de hidrogen, interacţiunile hidrofobe dintre lanţurile polipeptidice, iar la diminuarea efectului agentului denaturant structura nativă se reface (Fig.12).
Fig.12. Denaturarea – renaturarea proteinelor
Proprietăţile electrochimice ale proteinelorSarcina netă a unei proteine depinde de pH-ul mediului în care este dizolvată. Pe baza
acestei proprietăţi, proteinele pot fi caracterizate prin diferite metode: electroforeză, focalizare izoelectrică, Western blotting.
La aplicarea unui câmp electric unei soluţii tamponate ce conţine un amestec de proteine, acestea se vor deplasa diferenţiat în funcţie de încărcarea electrică specifică.
La electroforeză în diferite condiţii experimentale, pentru a evita precipitarea proteinelor trebuie să se lucreze în afara intervalului ce cuprinde valorile punctelor izoelectrice. Punctele izoelectrice ale proteinelor sunt cuprinse între 3 şi 8 şi, de aceea, electroforeza proteinelor se face la pH > 8, când toate proteinele sunt anioni şi se deplasează spre anod.
17