Ασθενη Οξεα και Βασεις - Χημεια Γ Λυκειου - Βιβλίο...
-
Upload
kostaskalamatianos -
Category
Documents
-
view
993 -
download
3
description
Transcript of Ασθενη Οξεα και Βασεις - Χημεια Γ Λυκειου - Βιβλίο...

KΕΦΑΛΑΙΟ 2: ΟΞΕΑ – ΒΑΣΕΙΣ ΚΑΙ ΙΟΝΤΙΚΗ ΙΣΟΡΡΟΠΙΑ
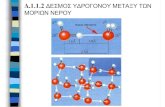
Σχήμα 2-8: α) Απεικόνιση του πλήρους ιοντισμού του ισχυρού οξέος ΗΧ σε ιόντα Η+ και X- όταν διαλύεται στο νερό (παρατηρείστε ότι δεν υπάρχουν μόρια του οξέος ΗΧ στο νερό καθώς ιοντίζονται πλήρως) β) Διαγραμματική απεικόνιση του πλήρους ιοντισμού του ισχυρού οξέος ΗΧ σε ιόντα Η+ και X- όταν διαλύεται στο νερό. Πριν τον ιοντισμό μόνο μόρια του οξέος ΗΧ βρίσκονται στο διάλυμα20 με συγκέντρωση C mol/ℓ (υποδηλώνεται στο διάγραμμα με την απεικόνιση μίας μπάρας για την συγκέντρωση του ΗΧ). Μετά τον ιοντισμό μόνο τα ιόντα του οξέος Η+ και X- βρίσκονται στο διάλυμα (υποδηλώνεται + -
mol/ℓ αφού με δύο μπάρες στο διάγραμμα για τις συγκεντρώσεις των Η και X ) και έχουν συγκέντρωση
το οξύ ιοντίζεται πλήρως και η αντίδραση είναι 1:1 (1 mol ΗΧ που ιοντίζεται δίνει 1 mol Η+ και 1 mol X-). αρα ρόλη Για παρπλήρωςπρακτικ του [ΗCl] είναι πρακτικά μηδενική). Παρατηρείστε ότι το γεγο ς αυτό υποδηλώνεται στην χημική ισορροπία στο Σχήμα 2-4 με τον σχεδιασμό μεγαλύτερου βέλους για την αντίδραση από αριστερά πρ χέση με τίδρασης από δεξιά προς τα ριστερά. Μία απεικόνιση του ιοντισμού υ ισχυρού ενική του μορφή δίνεται στο
H2O
CΠ τη είστε ότι οι μπάρες των συγκεντρώσεων του οξέος και των ιόντων του έχουν το ίδιο ύψος υποδηλώνοντας ότι
η ποσότητα του οξέος μετατρέπεται πλήρως στα ιόντα του.
άδειγμα το HCl στο Σχήμα 2-4 στην σελίδα 217 είναι ένα παράδειγμα ισχυρού οξέος που διΐσταται όταν διαλύεται στο νερό δίνοντας H3O+ και Cl-. To διάλυμα σε κατάσταση ιοντικής ισορροπίας ά δεν έχει καθόλου μόρια ΗCl (η συγκέντρωσηνό
ος τα δεξιά σε σ το βέλος της αν ενός τέτοιο οξέος στην γα
Σχήμα 2-8.
Ασθενή οξέα και βάσεις (ασθενείς ηλεκτρολύτες) είναι εκείνα που διίστανται μερικώς σε ιόντα όταν διαλύονται στο νερό. Στο διάλυμα στην χημική (ιοντική) ισορροπία υπάρχει κυρίως συγκέντρωση του ηλεκτρολύτη και σε μικρότερο βαθμό των ιόντων που προκύπτουν από την διάσταση του. Για παράδειγμα όταν το HCN, πού είναι ένα ασθενές οξύ, διαλυθεί στο Η2Ο διίσταται κατά ένα μικρό μέρος στα ιόντα του σύμφωνα με την αμφίδρομη αντίδραση21:
HCN + H3O + CN
ιση υ ιοντισμού ενός τέτοιου ασθενούς οξέος στην γενική του μορφή δίνεται στο Σχήμα 2-9. ώς εξηγείται όμως ότι ακόμη και ένα ασθενές οξύ, όπως το HCN για παράδειγμα, ιοντίζεται σε μικρό βαθμό όταν διαλυθεί στο νερό; πορούμε να θεωρήσουμε ότι τα μόρια μέσα στο διάλυμα λόγω της θερμικής ενέργειας που έχουν κινούνται
ενέργεια ώστε να μπορούν να αποβάλλουν Η+.
+ -
Στην χημική (ιοντική) ισορροπία στο διάλυμα υπάρχουν οι παρακάτω ουσίες (ιόντα): κυρίως [HCN] και [H2O] και λιγότερο [H3O+] και [CN-] (η χημική ισορροπία είναι μετατοπισμένη προς τα αριστερά). Μία απεικόντοΠ
Μδιαρκώς και συγκρούονται μεταξύ τους. Κάποιες από αυτές τις συγκρούσεις δίνουν σε ορισμένα μόρια του HCN αρκετή κινητική ενέργεια ώστε να μπορούν να αποβάλλουν ένα πρωτόνιο (Η+) το οποίο παίρνει το νερό και σχηματίζεται H3O+. Όσο ισχυρότερο είναι ένα οξύ τόσο περισσότερα μόρια αποκτούν αρκετή κινητική
20 Ο ιοντισμός των ισχυρών οξέων μπορούμε να θεωρήσουμε ότι γίνεται ταχύτατα στο νερό και διαρκεί τόσο όσο η διάλυσή τους. 21 Το βέλος από αριστερά προς τα δεξιά έχει σχεδιασθεί μικρότερο από ότι από δεξιά προς τα αριστερά για να υποδηλώσει ότι στην χημική ισορροπία η αντίδραση είναι μετατοπισμένη προς τα αριστερά.

KΕΦΑΛΑΙΟ 2: ΟΞΕΑ – ΒΑΣΕΙΣ ΚΑΙ ΙΟΝΤΙΚΗ ΙΣΟΡΡΟΠΙΑ
Oπως ήδη έχει παρουσιασθεί παραπάνω τα οξέα και οι βάσεις έχουν διαφορετική τάση να δίνουν ή να δέχονται H+ αντίστοιχα και επομένως παρουσιάζουν διαφορές ως προς το πόσο ισχυρά ή ασθενή22 είναι.
α 2-9
226
Σχήμ : α) Απεικόνιση του μερικού ιοντισμού του ασθενούς οξέος ΗΑ σε ιόντα Η+ και Α- ό ύεται στο νερό ότι στο νερό στην χημική ισορροπία υπάρχει κυρίως
ταν διαλ(παρατηρείστε το οξύ ΗΑ και μικρός αριθμός ιόντων Η+ και Α-). Τα
ματική απεικόνιση του μερικού ιοντισμού
στο διάγραμμα για τις συγκεντρώσεις των ΗΑ, Η+ και Α-). Παρατηρείστε ότι οι πάρες της συγκέντρωσης του οξέος ΗΑ πριν τον ιοντισμό και μετά τον ιοντισμό έχουν περίπου το ίδιο ύψος για να
ος
ηλεκτρολύτη (α) ορίζεται ως το πηλίκο του αριθμού των mol (ή g ή
άμενα mol ηλεκτρολύτη στο H2O / συνολικά mol του ηλεκτρολύτη στο Η2Ο]
περισσότερα μόρια του ΗΑ παραμένουν στην μη ιοντισμένη μορφή β) Διαγραμ+ -του ασθενούς οξέος ΗΑ σε ιόντα Η και Α όταν διαλύεται στο νερό. Πριν τον ιοντισμό μόνο μόρια του οξέος ΗΑ
βρίσκονται στο διάλυμα με συγκέντρωση C mol/ℓ (υποδηλώνεται στο διάγραμμα με την απεικόνιση μίας μπάρας για την συγκέντρωση του ΗΑ). Μετά τον ιοντισμό στο διάλυμα βρίσκονται κυρίως μόρια του ΗΑ και μικρός αριθμός των ιόντων Η+ και Α- (υποδηλώνεται με τρεις μπάρεςμυποδηλωθεί ότι το οξύ ιοντίζεται σε μικρό βαθμό. Πώς όμως μπορούμε να κατατάξουμε τα οξέα και τις βάσεις ως πρ την ισχύ τους; Ποιοι «δείκτες» μπορούν
χρησιμοποιηθούν; ναΔύο από τους «δείκτες» που χρησιμοποιούνται για την κατάταξη των οξέων-βάσεων ως προς την ισχύ τους είναι:
Ο βαθμός ιοντισμού (διάστασης) (α)
Η σταθερά ιοντισμού (διάστασης) (k)
βαθμός ιοντισμού23 ενόςΟμορίων) που ιοντίζονται προς τον συνολικό αριθμό των mol (ή g ή μορίων) του ηλεκτρολύτη.
= [διιστα[2.1]
βαθμός ιοντισμού (α) εξαρτάται από τους παρακάτω παράγοντες24: Οi) Φύση του ηλεκτρολύτη: Η μοριακή δομή του ηλεκτρολύτη (τρόπος που ενώνονται τα άτομα του) και κυρίως το μέγεθος και η ηλεκτραρνητικότητα του ατόμου που συγκρατεί το υδρογόνο στον ηλεκτρολύτη αθορίζουν σημαντικά την ισχύ του. κ
22 Μπορούμε να θεωρήσουμε ότι τα ισχυρά οξέα είναι εκείνα που έχουν ασθενή δεσμό με το Η τους (τείνουν εύκολα να το χάσουν). Τα ασθενή οξέα είναι εκείνα που έχουν ισχυρό δεσμό με το Η τους (τείνουν δύσκολα να το χάσουν). 23 Ο βαθμός ιοντισμού αποτελεί μέτρο («δείκτη») της ισχύος των ηλεκτρολυτών αρκεί να γίνεται αυτή η σύγκριση των ηλεκτρολυτών στον ίδιο διαλύτη, στην ίδια θερμοκρασία, στην ίδια συγκέντρωση και χωρίς να υπάρχει κοινό ίον. Οι ισχυροί ηλεκτρολύτες έχουν α=1 ενώ οι ασθενείς α<1. 24 Ο βαθμός ιοντισμού είναι ένα μέτρο της ισχύος των ηλεκτρολυτών αλλά εξαρτάται από πολλούς παράγοντες. Ενας καλλίτερος δείκτης της ισχύος των ηλεκτρολυτών είναι η σταθερά ιοντισμού k.

Ενότητα 2.1.3 : Οξέα και Βάσεις: Ιοντισμός οξέων και βάσεων – Ιοντική ισορροπία
227
ια παράδειγμα: Το ΗΙ είναι ποιο ισχυρό οξύ από το ΗF γιατί η ατομική ακτίνα του Ι είναι μεγαλύτερη από του F και έτσι ο δεσμός Η-I εί εσμα είναι το Η να αποσπάται ευκολότερα ως Η+ από το ΗΙ και έτσι το οξύ να είναι ισχυρότερο.
Γναι ασθενέστερος από του Η-F. Το αποτέλ
Φύση του διαλύτηii) : Στο νερό τόσο το HCl όσο και το ΗClO διί πλήρως στα ιόντα4 στανται τους και ομένως και τα δύο συμπεριφέρονται σαν ισχυρά οξέα. Εάν ως διαλύτης αντί του νερού χρησιμοποιηθεί ιαιθυλεθέρας (C2H5OC2H5) το HC ριφέρεται σαν ασθενές οξύ) ενώ το ΗClO4 διίσταται πλήρως (συμπε
επδ l διίσταται μερικώς στα ιόντα του (συμπε
ριφέρεται σαν ισχυρό οξύ). iii) Θερμοκρασία: Όσο αυξάνει η θερμοκρασία τόσο η τιμή του (α) α ξάνει καθώςυ η αντίδραση ιοντισμού ναι ενδόθερμη δραση. εί αντί
iv) Συγκέντρωση του ηλεκτρολύτη: Όσο αυξάνει η συγκέντρωση του ηλεκτρολύτη τόσο η τιμή του (α) ελαττώνεται. v) Παρουσία κοινού ιόντος: Η παρουσία κοινού ιόντος μειώνει την τιμή του (α).
H
H σταθερά ιοντισμού (ka) είναι η σταθερά ισορροπίας25 για την αμφίδρομη αντίδραση του ιοντισμού ενός ασθενούς οξέος στο νερό και είναι ίση με την τιμή του κλάσματος:
k = [ +] [A-] / [HA] 26 [2.2] a 3O
για την γενική αντίδραση διάστασης ασθενούς οξέος HA + H O H O2 3
[B] [2.3]
+ + A- και
kb = [HB+] [OH-] /
για την γενική αντίδραση διάστασης ασθενούς βάσης Β + H O ΗΒ+ + ΟΗ- 2
(όπου [H3O+], [A-], [HA], [HB+], [OH-], [B] οι συγκεντρώσεις των ουσιών/ιόντων H3O, A-, HA, HB+
αντίστοιχα, εκφρασμένες σε mol/ℓ). , OH-, B
ς από μία σταθερές ιοντισμού γιατί ιοντίζονται σε δύο ή περισσότερα βήματα. Tα οξέα αυτά ονομάζονται γενικά πολυπρωτικά οξέα. Όσα από αυτά ιοντίζονται σε δύο βήματα
Η2CO3 (aq)
H σταθερά ιοντισμού ενός ασθενούς οξέος (ka) ή ασθενούς βάσης (kb) σε αραιά υδατικά διαλύματα εξαρτάται μόνο από την θερμοκρασία27. Συγκεκριμένα, αυξάνει με την αύξηση της θερμοκρασίας καθώς η αντίδραση ιοντισμού είναι ενδόθερμη. Oρισμένα οξέα έχουν περισσότερε
ονομάζονται διπρωτικά, όσα σε τρία τριπρωτικά κλπ. Για παράδειγμα το ανθρακικό οξύ Η2CO3 είναι ένα διπρωτικό οξύ και ιοντίζεται σε δύο βήματα ως εξής:
Η+(aq) + HCO3- (aq) ka1 = 4,3 . 10-7
HCO3- (aq) Η+(aq) + CO3
-2 (aq) ka2 = 5,6 . 10-11
25 Σύντομη επανάληψη των βασικών αρχών και σχέσεων που ισχύουν σε κατάσταση χημικής ισορροπίας δίνονται στο Ενθετο 4. 26 Στην σχέση δεν γράφεται η συγκέντρωση του Η2Ο αφού σε αραιά υδατικά διαλύματα θεωρείται σταθερή και ίση με 55,5 Μ. 27 Για σταθερή θερμοκρασία βλέπουμε ότι η σταθερά ιοντισμού ka και η kb δεν αλλάζει ενώ ο βαθμός ιοντισμού (α) αλλάζει. Για τον λόγο αυτό μέτρο της ισχύος των ηλεκτρολυτών είναι κυρίως η σταθερά ιοντισμού. Οσο μεγαλύτερη είναι η σταθερά ιοντισμού τόσο ποιο ισχυρό είναι το οξύ ή η βάση και επομένως τοσο σε μεγαλύτερο βαθμό διίσταται στα ιόντα του στο νερό.

KΕΦΑΛΑΙΟ 2: ΟΞΕΑ – ΒΑΣΕΙΣ ΚΑΙ ΙΟΝΤΙΚΗ ΙΣΟΡΡΟΠΙΑ
Tιμές για τις σταθερές ιοντισμού γνωστών οξέων και βάσεων στους 25 °C δίνονται στον Πίνακα 2-7 στην σελίδα 260. Μέτρο («δείκτης») της ισχύος των ίναι: ηλεκτρολυτών ε ► Ο βαθμός ιοντισμού ενός ηλεκτρολύτη (α) ο οποίος εξαρτάται από την θερμοκρασία, την φύση του διαλύτη, την φύση και την συγκέντρωση του ηλεκτρολύτη. ► Η σταθερά ιοντισμού k η οποία σε αραιά διαλύματα εξαρτάται μόνο από την θερμοκρασία Aς δούμε όμως την λύση μίας άσκησης όπου ζητείται ο βαθμός ιο ντισμού (α) ενός οξέος ενώ είναι γνωστά η σταθερά ιοντισμού ka του οξέος και η αρχική του συγκ .
έντρωση
Άσκη ειγμαση – Παράδ #2-5
Ποιος είναι ο βαθμός διαστάσεως του οξικού οξέος (ΗC2H3O2) στις κάτω συγκεντρώσεις και σε παραθερμοκρασία 25 °C; α) 1 Μ28 β) 0,1 Μ γ) 0,01 Μ Δίνεται ότι η ka ≈ 1,8 . 10-5 και (1,8)1/2 = 1,3 και (10-5) 1/2 = 3,2 . 10-3 και (10-7) 1/2 = 3,2 . 10-4
Λύση: ο οξικό οξύ είναι ένα ασθενές οξύ στο νερό. Αυτό υποδηλώνει και η σταθερά ιοντισμού του29 (kα<1). H Ταντίδραση ιοντισμού του οξικού οξέος στο νερό δίνεται από:
228
Η H O + H H O+ + CC2 3 2 2O 3 2 3 2H O -
Σε όλες τις περιπτώσεις μπορούμε να θεωρήσουμε ότι το ΗC2H3O2 ως ασθενές οξύ ιοντίζεται ελάχιστα και ότι πρακτικά η αρχική του συγκέντρωση δεν μεταβάλλεται. Έτσι: α) Γράφουμε την αντίδραση και τις συγκεντρώσεις των αντιδρώντων και προϊόντων: ΗC2H3O2 + H2O H3O + C+ -
2H3O2
Αρχικά ρώσεις 1 Μ 0 0 Οι αρχικές συγκεντ
Μεταβολή x δρασαν- M +x M +x M Έστω ότι x mol αντέ
Στην χημ. ισορροπία (1-x) M ≈ 1 M (0+x) = x M (0+x) = x M Θεωρούμε ότι τα x mol που αντέδρασαν είναι x<<1
και ότι
(1-x) M ≈ 1 M.
Αντικαθιστ ων στην ώντας στην ν και προϊόντσταθερά ιοντισμού τις συγκεντρώσεις των αντιδρώντωισορροπία έχουμε:
ka = [H3O+] [C2H3O2-] / [ΗC2H3O2] = x . x / 1 = 1,8 . 10-5 ⇒
x = 1,8 . 10 ⇒ x = [H3O ] = [C2H3O2 ] = (1,8) . (10 ≈ 4,2 . 10 M 2 -5 + - 1/2 -5)1/2 -3
Aπό την σχέση [2.1] για τον βαθμό διάστασης (α) βρίσκουμε:
α = [διιστάμενα ηλεκτ 2 ηλεκτρολύτη 2O] = mol ρολύτη στο H O / συνολικά mol του στο Η= 4,2 . 10-3 mol [H3O+] /ℓ / 1 mol ΗC2H3O2/ℓ = 4,2 . 10-3
28 Η Μορι ματος σε ακότητα ή μοριακή συγκέντρωση (Μolarity M) εκφράζει τον αριθμό των mol του διαλυμένου σώένα λίτρο διαλύματος π.χ διάλυμα ΚΟΗ 2Μ ⇒ Το 1 ℓ διαλύματος περιέχει 2 mol KOH 29 Στα ισχυρά οξέα και στις ισχυρές βάσεις η σταθερά ιοντισμού είναι μεγάλη ( ka≥ 1 και kb ≥ 1). Στην περίπτωση αυτή θεωρούμε ότι η αντίδραση στην ισορροπία είναι μετατοπισμένη προς τα δεξιά ή ότι στην ισορροπία υπάρχουν συγκεντρώσεις μόνο των προιόντων.

Ενότητα 2.1.3 : Οξέα και Βάσεις: Ιοντισμός οξέων και βάσεων – Ιοντική ισορροπία
229
β) Για την περίπτωση που η αρχική συγκέντρωση του [ΗC2H3O2] = 0,1 M εργαζόμαστε με τις ίδιες παραδοχές όπως στην περίπτωση (α) παραπάνω και αντικαθιστούμε στις σχέσεις όπου [ΗC2H3O2] = 0,1 Μ αντί για 1 Μ. Έτσι προκύπτει:
ka = [H3O+] [C2H3O2-] / [ΗC2H3O2] = x . x / 0,1 = 1,8 . 10-5 ⇒
x2 = 1,8 . 10-6 ⇒ x = [H3O+] = [C2H3O2
-] = (1,8)1/2 . (10-6)1/2 ≈ 1,3 . 10-3 M Aπό την η [2.1] για τον βαθμό διάστασης (α) βρίσκουμε: σχέσ
α = [διϊστάμενα mol ηλεκτρολύτη στο H2O / συνολικά mol του ηλεκτρολύτη στο Η2O] = = 1,3 . 10-3 mol [H3O+] /ℓ / 0,1 mol ΗC2H3O2/ℓ = 1,3 . 10-2
γ) Στην περίπτωση αυτή όμοια με παραπάνω αντικαθιστώντας όπου [ΗC2H3O2] = 0,01 M :
ka = [H3O+] [C2H3O2-] / [ΗC2H3O2] = x . x / 0,01 = 1,8 . 10-5 ⇒
x2 = 1,8 . 10-7 4,1 . 10-4 M ⇒ x = [H O3
+] = [C H O2 3 2-] = (1,8)1/2 . (10-7)1/2 ≈
Aπό την σχέση [2.1] για τον βαθμό διάστασης (α) βρίσκουμε:
α = [διιστάμενα mol ηλεκτρολύτη στο H2O / συνολικά mol του ηλεκτρολύτη στο Η O] = 2= 4,1 . 10-4 mo ℓ / 0,01 mol = 4,1 . 10-2l [H3O+] / ΗC2H3O2/ℓ
Πα ερή θερμοκρασία η k της αντίδ ς δεν αλλάζει έστω ν αλλάζει ρατηρούμε ότι σε σταθ ραση και αη αρχική σ ωση του οξέος (ηλεκτρολύτη). Αντίθ βαθμός διαστάσεω άνει όταν υγκέντρ ετα ο ς αυξελαττώνεται η αρχική συγκέντρωση του οξέος (ηλεκτρολύτη) ακόμα και όταν παραμένει σταθερή η θερμοκρασία. Στην συγκεκριμένη περίπτωση ο βαθμός διαστάσεως (α) γίνεται περίπου 10 φορές μεγαλύτερος (α στην περίπτωση (γ) / α στην περίπτωση (α) = 4,1 . 10-2 / 4,2 .10-3 = 9,8 ) καθώς η αρχική συγκέντρωση του [ΗC2H3O2] ελαττώνεται κατά 100 φορές δηλαδή από 1 Μ σε 0,01 Μ. ΕΝΘΕΤΟ 4: ΧΗΜΙΚΗ ΙΣΟΡΡΟΠΙΑ H έννοια της χημικής ισορροπίας θεμελ 30 γίνει κατανοητή καλλίτερα είναι από τις ιώδεις στην χημεία . Για ναας πάρουμε το παρακάτω παρ α mol H2 και α mol I2 στους άδειγμα. Όταν σε ένα κλειστό δοχείο διοχετευθούν440 °C μετά από λίγο και σε σταθερή θερμοκρασία παρατηρούμε ότι 0,8α mol H2 και 0,8α mol I2 αντιδρούν και παράγονται 1,6α mol HI σύμφωνα με την αντίδραση:
H2 + I2 → 2ΗΙ (Σύνθεση του ΗΙ) (1)
30 Γενικά η έννοια της ισορροπίας είναι θεμελιώδης σε όλες τις επιστήμες. Ηδη γνωρίζετε τις παρακάτω δύο χαρακτηριστικές περιπτώσεις ισορροπίας από την φυσική και την χημεία αλλά και την καθημερινή ζωή: i) Όταν ένα υγρό τοποθετηθεί μέσα σε ένα κλειστό δοχείο μόριά του περνούν από την υγρή στην αέρια κατάσταση. Μετά από κάποιο χρόνο αποκαθίσταται ισορροπία και όσα μόρια περνούν στην αέρια φάση (εξάτμιση) τόσα επιστρέφουν στην υγρή κατάσταση (συμπύκνωση). Ενώ αρχικά η πίεση που εξασκούν οι ατμοί του υγρού στο δοχείο αυξάνει στην ισορροπία παραμένει σταθερή. ii) Oταν ένα στερεό διαλύεται μέσα σε ένα υγρό μετά από κάποιο χρόνο αποκαθίσταται ισορροπία και όσα μόρια στερεού διαλύονται τόσα μόρια του καθιζάνουν (πέφτουν) στον πυθμένα. Ενώ αρχικά η συγκέντρωση του διαλυτοποιημένου στερεού στο υγρό αυξάνει στην ισορροπία παραμένει σταθερή.