SENYAWA KHITIN DAN KAJIAN AKTIVITAS - USU...
Transcript of SENYAWA KHITIN DAN KAJIAN AKTIVITAS - USU...

2002 digitized by USU digital library 1
SENYAWA KHITIN DAN KAJIAN AKTIVITAS ENZIM MIKROBIAL PENDEGRADASINYA
YURNALIZA, S.Si., M.Si.
Fakultas Matematika Dan Ilmu Pengetahuan Alam Program Studi Biologi
Universitas Sumatera Utara
PENDAHULUAN Khitin merupakan homopolimer dari β-1,4 N-setil-D-glukosamin dan merupakan polimer ke dua terbanyak di alam setelah selulosa. Senyawa ini dapat ditemukan pada cangkang udang kepiting, Molusca, seranggga, Annelida, dan beberapa dinding sel jamur dan alga. Meskipun sumber khitin di alam bermacam-macam, namun sampai saat ini sumber utama yang praktis dieksplorasi adalah cangkang udang yang secara ekonomis potensial.
Khitin memiliki bentuk yang padat dan bersifat tidak larut dalam air atau pelarut organik biasa. Namun khitin dapat dimodifikasi secara kimiawi menjadi turunan-turunannya yang mempunyai sifat-sifat khas dan kegunaannya sendiri. Khitin dapat dihidrolisis secara enzimatis oleh enzim khitinase, menghasilkan monomer β-1,4 N-setil-D-glukosamin. Khitinase dapat dihasilkan oleh beberapa macam bakteri,, aktinomisetes, jamur dan tumbuhan. Khitinase juga disintesis oleh protozoa, saluran pencernaan nematoda, polikhaeta dan Molusca. Khitinase juga ditemukan dalam lendir pencernaan burung-burung pemakan seranga, lendir pencernaan dan pangkreas ikan, amfibia dan reptil pemakan serangga. Meskipun khitinase tersebar luas di alam ,namun khitinase murni secara komersial diproduksi dari mikroorganisme. I. SENYAWA KHITIN A. Sejarah penemuan Khitin Pada tahun 1811, seorang ilmuan Prancis Hendri Baraconnot berhasil mengisolasi khitin untuk pertama kali dari jamur, dan diberi nama fungine. Kemudian tahun 1823, Odier menemukan senyawa yang sama dari kutikula serangga dan diberi nama khitin (bahasa Yunani) yang artinya sampul atau baju (Winterowd & Sanford, 1995). Odier menduga bahwa pada mushroom dan serangga memiliki komponen struktural yang sama (Richards, 1951). Tahun 1859 Rouget menemukan modifikasi khitin yang akhirnya oleh Hoppe-Seiler (1894) diberi nama khitosan. Sejak saat itu penelitian khitin dan khitosan berkembang sampai pertengahan abad 1900-an. Tahun 1930-an G.W. Rigby, karyawan Dupont menpatentan khitin dan khitosan beserta cara isolasi dan preparasinya dari kulit udangg serta pemanfaatannya dalam industri. B. Struktur dan Sumber–Sumber Khitin di Alam
Khitin dibangun oleh unit-unit monomer N-asetilglukosamin (GlcNAc) yang tersusun linear dengan ikatan β (1,4) (Gambar 1). Rantai khitin antara satu dengan yang lainnya berasosiasi dengan ikatan hidrogen yang sangat kuat antara gugus N-H dari satu rantai dan gugus C=O dari rantai yang berdekatan. Ikatan hidrogen menyebabkan khitin tidak dapat larut dalam air dan membentuk formasi serabut (fibril). Berdasarkan pola penyusunan rantai polimernya, khitin fibril dibedakan menjadi tiga jenis yaitu α-khitin, β-khitin dan γ-khitin. Pada α-khitin rantai-rantai polimer yang berdekatan tersusun secara antiparalel. Bentuk ini banyak ditemukan pada jamur dan arthropoda. Jenis β-khitin mempunyai rantai polimer yang tersusun

2002 digitized by USU digital library 2
paralel, sedangkan γ-khitin fibrilnya masing-masing tersusun dari tiga rantai, dua rantainya tersusun paralel dan rantai ketiga antiparalel (Cabib, 1987). Gambar 1. Unit khitin (Cabib, 1987).
Khitin berbentuk padat, amorf, tidak berwarna, tidak larut dalam air, asam
encer, alkohol dan semua pelarut organik lainnya, tetapi khitin dapat larut dalam fluoroalkohol dan asam mineral pekat (Richards, 1951). Koloidal khitin adalah khitin yang banyak digunakan sebagai substrat dalam medium fermentasi. Senyawa ini diperoleh dengan menghidrolisis secara parsial khitin dengan larutan asam klorida (HCl) 10 N (Inbar & Chet, 1991 ; Chernin et al., 1995 ; Haran et al., 1995).
Khitin merupakan polisakarida kedua terbanyak di alam setelah selulosa dan di alam setiap tahunnya dihasilkan sekitar 108 ton khitin (Muzzarelli, 1985). Khitin dapat ditemukan pada eksoskeleton serangga, molusca, Coelenterata, Nematoda, Crustaceae dan dinding sel jamur dan alga tertentu.
Khitin pada jamur berbentuk fibril yang memiliki panjang yang berbeda tergantung pada spesies dan lokasi selnya. Pada Saccharomyces cereviceae, mikrofibril khitinnya memiliki panjang 60 nm dan terdapat khusus pada sekat primer (Cabib, 1987). Pada serangga lebih dari 80 % komponen kutikulanya adalah khitin (Berkeley, 1979) . Pada Crustaceae, khitin melekat pada suatu matriks dari CaCO3 dan fosfat. Pada serangga matriksnya adalah proteinaceous yaitu suatu protein yang sudah mengalami pentaninnan (Cabib, 1987).Khitin pada alga terutama ditemukan pada diatomae laut yaitu Thallassiosira fluviatilis dan Cyclotella cryptica dengan kandungan 10 – 15 % berat kering.
Pada bakteri, aktinomisetes dan jamur klas Oomycetes tidak ditemukan khitin. Tetapi khitin merupakan komponen utama penyusun dinding sel jamur klas Basidiomycetes, Phycomycetes, Ascomycetes dan Lichens.
Meskipun sumber khitin bermacam-macam, namun secara komersial khitin dieksplorasi dari cangkang udang-udangan dan Crstacea. Sebanyak 50 – 60 % dari limbah udang, dihasilkan 25 % Khitin dari 32 % berat kering limbah tersebut.
Khtin merupakan bahan dasar uuntuk bahan-bahan kimia yang diperlukan secara luas di berbagai bidang seperti biokimia, obat-obatan, pangan, gizi, enzimologi, industri kertas, tekstil dan film. Khitin juga sebagai sumber N-asetilglukosamin yang dipakai sebagai pengawet dan antibiotik. Khitosan sebagai derivat khitin dipakai dalam pengolahan limbah dan pengikatan logam (Muzarelli, 1985).
C. Biosintesis Khitin pada Jamur
Biosintesis khitin pada jamur terjadi karena pertumbuhan hifa yang meliputi pemanjangan dinding primer dan kemudian dilanjutkan dengan biosintesis

2002 digitized by USU digital library 3
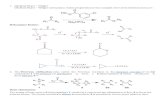
komponen dinding sel. Langkah-langkah biosintesis khitin diawali dengan perubahan glukosa-6-fosfat menjadi uridin difosfat N-asetilglukosamin (UDP-GlcNAc) sebagai prekursor khitin (Gambar 2). Enzim yang berperan dalam mengubah UDP-GlcNAc menjadi molekul khitin adalah khitin sintetase yang terdapat dalam vesikel sitoplasmik (sitosom) (Carlile dan Watkinson, 1994).
Pada jamur sebagaimana organisme eukariotik lain, vesikel sitoplasmiknya berperan dalam pembentukan dinding sel. Vesikel ini membawa material permukaan berupa prekursor, produk atau enzim yang dibutuhkan untuk pembentukan dinding. Ada dua vesikel yang berperan pada pembentukan dinding sel jamur yaitu 1). Makrovesikel disebut juga vesikel dinding atau vesikel sekretori. Vesikel ini berperan dalam sintesis polimer polisakarida nonfibrilar. 2). Mikrovesikel atau disebut juga sitosom, berperan dalam sintesis polisakarida mikrofibrl (khitin).
Khitin dibuat in-situ yaitu pebentukannya terjadi di luar sitoplasma oleh enzim yang dibawa oleh sitosom. Khitin sintetase yang ada dalam sitosom adalah enzim yang tidak aktiv (zimogen) dan protease yang ada di permukaan sel (periplasma) akan mengaktivkan zimogen ini dan dimulai lagi pembentukan mikrofibril khitin (Bartnicki-Garcia, 1989).
Khitin pada jamur berbentuk mikrofibril yang memiliki panjang yang berbeda tergantung pada spesies dan lokasi selnya. Mikrofibril merupakan struktur utama dari struktur dinding sel jamur dan terdiri atas jalinan rantai-rantai polisakarida yang saling bersilangan membentuk anyaman. Jalinan ini kuat berikatan pada matriks. Kandungan khitin pada jamur bervariasi dari 4 – 9 % berat kering sel, tergantung spesies atau strain jamurnya (Rajarathnam et al., 1998). Khitin adalah komponen utama penyusun dinding sel jamur kelas Ascomycetes, Basidiomycetes, dan Deuteromycetes. Pada dinding sel jamur Fusarium dari kelas Deuteromycetes dijumpai sebanyak 39 % khitin dari berat kering sel (Griffin, 1981). Khitin pada dinding sel jamur Fusarium sukar didegradasi karena dinding selnya dilapisi oleh protein dan lipid, yang menghalangi aktivitas enzim hidrolitik (Sivan & Chet, 1989).

2002 digitized by USU digital library 4
Gambar 2. Jalur sintesis khitin ( ) dan teori siklus N-asetilglukosamin (-->)
1) Enzim fosfo-gluko-isomerase; 2) glutamine-fruktose-6-fosfat - amino-transferase; 3) glukosamine-fosfate-asetil-transferase;
4) asetil-glucosamine fosfomutase; 5) UDP-asetil-glukosamine pirofosforilase 6) khitin sintetase ; 7) khitinase; 8) N-asetil-glukosamine kinase (Carlile & Watkinson, 1994).

2002 digitized by USU digital library 5
II. ENZIM KHITINASE Khitinase [Poli {1,4-β (2 asetamido–2–deoksi–D-glukosaminide)} glikano hidrolase] adalah enzim yang menghidrolisis ikatan β-1,4-asetamido–2-deoksi-D- glikosida dari khitin dan khitodekstrin (Bielka et al., 1984). A. Tata nama enzim khitinase.
Sistim tata nama enzim khitinase masih banyak menimbulkan kerancuan. Harman et al. (1993) serta Sahai dan Manocha (1993) membagi khitinase dalam tiga tipe yaitu :
a. Endokhitinase (EC. 3.2.1.14) yaitu : enzim yang memotong secara acak ikatan β- 1,4 bagian internal mikrofibril khitin (Gambar 3). Produk akhir yang terbentuk berupa oligomer pendek N-asetilglukosamin (GlcNAc) yang mempunyai berat molekul rendah seperti khitotetraose, khitotriose dengan didominasi oleh di-asetilkhitobiose. Produk yang dihasilkan bersifat mudah larut.
b. Eksokhitinase (belum memiliki nomor entry dalam Enzyme Nomenclature) dinamakan juga khitobiosidase atau khitin–1,4-β-khitobiosidase, yaitu enzim yang mengkatalisis secara aktiv pembebasan unit-unit diasetilkhitobiose tanpa ada unit-unit monosakarida atau oligosakarida yang dibentuk (Gambar 3). Pemotongan hanya terjadi pada ujung non reduksi mikrofibril khitin dan tidak secara acak.
Aktivitas enzim
Gambar 3. Mekanisme kerja enzim eksokhitinase dan endokhitinase (Sahai & Manocha, 1993)
c. β-1,4–N asetilglukosamidase (EC. 3.2.1.30) adalah suatu enzim khitinolitik yang bekerja pada pemutusan diasetilkhitobiose, khitotriose dan khitotetraose dengan menghasilkan monomer-monomer GlcNAc. B. Metode pemekatan cairan enzim dan pengukuran aktivitas khitinase
Enzim yang berada pada cairan kultur belum 100 % terdiri atas protein enzim yang diinginkan, sehingga perlu pemurnian untuk memisahkannya dari senyawa-senyawa lain. Tahap awal dalam pemurnian enzim adalah pemekatan medium

2002 digitized by USU digital library 6
kultivasi. Pemekatan dapat dilakukan dengan beberapa cara yaitu : ultrafiltrasi, liofiliasi dan mengendapkan protein dengan ammonium sulfat, aseton, etanol, atau polietilen glikol (PEG) (Scopes, 1994).
Pemekatan enzim khitinase dari Streptomyces dengan ammonium sulfat pada kejenuhan 70 % dan etanol dingin, dapat meningkatkan kemurnian enzim berturut-turut 5 dan 3,5 kali dibanding enzim kasarnya (Lloyd et al., 1965). Singh et al. (1999) menyatakan bahwa protein khitinase dari Streptomyces sp. 385 yang dipekatkan dengan polietilen glikol (PEG), kemurniannya meningkat sebanyak 11,9 kali dibanding enzim kasarnya.
Pengendapan protein dengan ammonium sulfat adalah cara yang paling banyak digunakan. Hal ini disebabkan karena ammonium sulfat mudah didapatkan, harganya relatif murah, bersifat menstabilkan enzim serta dapat mencegah aktivitas enzim proteolitik. Garam ammonium sulfat konsentrasi 2 - 3 M dapat menstabilkan enzim selama beberapa tahun. Kelemahannya adalah tidak dapat mengendapkan seluruh protein yang telah larut dan bila mengandung logam maka akan dapat merusak enzim (Scopes, 1994).
Pengukuran aktivitas khitinase dalam memecah khitin dapat dilakukan dengan beberapa cara seperti yang disebutkan dalam Jeaniaux (1966) dan Cabib (1987) yaitu :
a. Berdasarkan pengurangan substrat. 1). Metode viskosimetri yaitu aktivitas khitinase terhadap khitosan, glikol
khitin atau karboksimetilkhitin yang ditunjukkan oleh terjadinya pengurangan viskositas substrat.
2). Metode turbidimetri (nephelometri) yaitu mengukur variasi turbiditas suspensi koloidal khitin selama khitinolisis. Pengukuran ini bersifat cepat dan akurat tapi tidak cocok untuk enzim dengan aktivitas rendah. Contoh pada pengukuran aktivitas enzin endokhitinase. Unit aktivitas enzim endokhitinase diukur sebagai persen pengurangan kerapatan atau turbiditas relatif dari suspensi yang sama antara yang berisi enzim dengan akuades. Satu unit endokhitinase didefinisikan sebagai jumlah enzim yang dibutuhkan untuk mereduksi turbiditas suspensi khitin 5 % (Harman et al., 1993 ; Chernin et al., 1995).
b. Berdasarkan pembentukan produk akhir yaitu GlcNAc (Metode Reissig, 1955). GlcNAc yang dibebaskan dari khitin ditentukan secara kolorimetrik dengan p-dimetilaminobenzaldehida. Satu unit aktivitas khitinase dinyatakan sebagai µmol GlcNAc yang dibebaskan selama 1 jam dalam kondisi yang ditetapkan.
c. Spectrometer Assay yaitu menggunakan kromogen 3,4, dinitrophenil tetra N-asetilkhitotetraose.
d. Radiometer Assay.
III. MIKROORGANISME PENGHASIL KHITINASE Sebagian besar mikroorganisme tanah dan air adalah pendegradsai khitin
yang baik. Di dalam tanah setiap gramnya mengandung 106 mikroorganisme yang mampu mengolah khitin. Sebanyak 90-99 % dari organisme tersebut adalah aktinomisetes dan selebihnya bakteri dan jamur. Genus aktinomisetes yang dapat memanfaatkan khitin sebagai sumber karbon dan nitrogennya yaitu : Streptomyces, Nocardia, Streptosporangium, Micromonospora dan Actinoplanes (Alexander, 1977).
Di antara ke lima genus aktinomisetes khitinolitik tersebut, kemampuan khitinolitik genus Streptomyces banyak mendapat perhatian peneliti. Hal ini karena Streptomyces adalah genus aktinomisetes dengan jumlah terbanyak di tanah. Hampir semua anggota genus Streptomyces menghasilkan khitinase. Jenis-jenis Streptomyces yang telah diketahui mampu menghasilkan khitinase yaitu S.

2002 digitized by USU digital library 7
antibioticus (Jeaniaux, 1966), S. alboflavus, S. albus, S. rubrireticuli, S. griseus, S. scabies (Waksman, 1967), S. orientalis (Tominanga & Tsujisaka, 1976), S. lividans (Miyashita et al., 1991), S. olivaceoviridis (Schrempf, 1995) dan S. tendae (Bormann, 1999).
Jenis bakteri dan jamur penghasil khitinase dapat dilihat pada Tabel 1 .
Tabel 1. Mikroorganisme penghasil khitinase
Bakteri Jamur
Vibrio parahaemaluticus Vibrio alginolyticus Flavobacterium indolthecium Serratia marcencens Enterobacter liquefaciens Bacillus cereus Klebsiella sp Micrococcus colpogenes Bacillus cereus Clostridium sp Pseudomonas sp Aeromonas sp
Mortierella sp Mucor subtillisimum Aspergillus fumigtus Trichoderma viridae
Pada jamur berfilamen dan kamir, khitinase merupakan bagian integral dalam
proses morfogenesis dinding sel. Selain itu khitinase juga mengawali peristiwa interaksi inang-parasit dari mikoparasit biotrop dan nekrtotrop, jamur entomopatogen dan jamur Vesikular Arbuskular Mikorhiza (VAM). Khitinase yang dihasilkan mikroorganismememiliki berat molekull yang berkisar antara 20.000 – 120.000. Pada bakteri berat molekulnya antara 60.000 – 110.000, sedangkan aktinomisetes yaitu 30.000 atau lebih rendah. Pada jamur berat molekulnya lebih tinggi dari 30.000. A. Biosintesis Enzim Khitinase Pada Mikroorganisme
Pengaturan biosintesis enzim khitinase melalui sistem represor-induser. Khitin dan produk hasil degradasinya (oligomer/monomer) berperan sebagai induser sedangkan substrat seperti selulosa, xilan, pektin, lignin dan sebagainya tidak dapat menginduksi khitinase (Sahai & Manocha, 1993). Glukosamin dapat menginduksi khitinase karena pada khitosan (khitin yang mengalami deasetilasi) masih terdapat sekitar 10 – 20 % residu asetil (Sahai & Manocha, 1993).
Pengaturan sintesis khitinase dipengaruhi juga oleh produk akhir (katabolit) berupa GlcNAc dan glukosa. Kedua jenis gula sederhana ini merupakan represor katabolit bagi spesies Trichoderma harzianum (Ulhoa & Peberdy, 1993) dan Stachybotrys elegans (Tweddell et al., 1994). Pada Streptomyces lividans kehadiran glukosa dalam medium menghambat sintesis enzim khitinase (Saito et al., 1998).
Khitin yang dipreparasi dengan hidrolisis parsial dengan HCl 10 N akan menghasilkan koloidal khitin yang mampu menginduksi khitinase kompleks seperti N-asetilglukosaminidase, endokhitinase dan khitobiosidase pada Aeromonas caviae (Inbar & Chet, 1991), Enterobacter agglomerans (Chernin et al., 1995) dan Trichoderma harzianum (Haran et al., 1995).
Faktor lain yang menginduksi sintesis khitinase adalah kemampuan sel mikroorganisme untuk mengenal struktur fisik khitin seperti susunan rantai, contoh mekanisme sintesis khitinase pada Streptomyces olivaceoviridis. Mikroorganisme ini memproduksi protein seperti lektin (lectin-like protein) yang mengikat secara khusus pada kristal α-khitin. Sel juga dapat mengenal derajat deasetilasi dari jumlah

2002 digitized by USU digital library 8
glukosamin dan GlcNAc relatif yang dibebaskan selama degradasi khitin. Kehadiran komponen lain seperti protein yang berikatan kovalen dengan partikular khitin dapat dikenal secara langsung oleh sensor protein membran paling luar. Untuk memisahkan enzim proteolitik ini, S. olivaceoviridis menghasilkan khitinase dengan domain enzimatik tambahan seperti protease. S. olivaceoviridis menghasilkan 59 kDa protein dan terdiri atas 47 kDa khitinase dan 12 kDa proteinase. Jadi efisiensi penggunaan khitin juga membutuhkan beberapa enzim selain khitinase (Schrempf, 1995).
B. Sistim Khitinolitik Aktinomisetes
Sistim khitinolitik aktinomisetes terutama pada Streptomyces terdiri atas beberapa enzim yang memiliki sifat yang berbeda. Pada S. lividans telah diidentifikasi sebanyak 4 macam khitinase (khitinase A, B, C dan D) dengan berat molekul masing-masing 36, 46, 65 dan 41 kDa. Produksi keempat enzim ini diinduksi oleh adanya khitin dan dihambat oleh adanya glukosa dan gliserol (Miyashita et al., 1991). Khitinase A, B, C dan D masing masing memiliki pH optimal pada pH 3 ; 5 ; 6,5 dan 6,5.
Jeaniaux (1966) menyatakan bahwa khitinase pada Streptomyces aktiv pada suasana asam, yaitu pada pH antara 5 – 6, sedangkan suhu optimal untuk aktivitas khitinase berada pada suhu 40 0C (Kamel et al.,1993).
Dalam sistim khitinolitik Streptomyces dihasilkan protein lain yang bukan enzim yaitu protein pengikat khitin (chitin-binding protein) yang mampu berikatan kuat dengan struktur α-khitin, khitosan dan dinding sel jamur (Bormann et al., 1999). Protein ini telah diisolasi dari Streptomyces yaitu CHB1 dan CHB2 (Schnellmann et al., 1994) dan AFP1 (Bormann et al., 1999). CHB dihasilkan oleh Streptomyces. olivaceoviridis, berat molekulnya 12 kDa dan tidak bersifat antijamur. Sedangkan AFP1 yang dihasilkan S. tendae bersifat antijamur, dengan berat molekul 9,8 kDa.
C. Sistim Khitinolitik Pada Jamur Khitinase jamur terdapat ekstraseluler dalam ruang periplamik dan membran plasma. Enzim ini ditemukan mendegradasi khitin yang baru terbentuk secepat pembentukan khitin itu sendiri oleh enzim khitin sintetase. Aktivitas khitinase distimulasi dengan memberikan protease tripsin pada mikrosom dan inaktivasi terjadi setelah perlakuan dengan phospolipid. Hal ini menunjukkan bahwa enzim berinteraksi dengan phospolipid komersialuntuk aktivitasnya. Aktivitas khitinase jamur ditemukan pada fraksi subselular yang berbeda dibandingkan dengan pembentukan mikrosom. Pada Neurrospora crassa aktivitas khitinase terjadi pada fraksi membran tapi kebanyakan aktivitas didistribusikan ke dinding sel atau fraksi sitosool lainnya sebanyak 30 % dan 50 % dan sebaliknya. Khitinase juga terdapat pada dinding sel Aspergillus nidulans, dalam sitosol dan fraksi membran dari C. cucurbitarum dan P. articulosus, dalam fraksi membran, sitosol dan dinding sel dari M. rouxii dan periplasmik dan vakuola serta dinding sel dari S. cereviceae. Khitinase jamur bersifat aktiv pada pH asam, memiliki temperatur optimal yang tinggi, tingkat kestabilan yang tinggi, dan mempunyai aktivitas endokhitinase dan eksokhitinase. Aktivitas enzim ini dihambat oleh tembaga dan garam merkuri, tidak memiliki kofaktor ionik dan secara kompetitif dihambat oleh allosamin. Penghambatan kompetitif dari seluruh khitinase disebabkan oleh chitobionolactone oxime. Morfogenesis dinding sel jamur merupakan hasil dari keseimbangan aktivitas sintesis dari khitin sintetase dan lisis dari khitinase. Pada beberapa hal, aktivitas

2002 digitized by USU digital library 9
khitinase maksimal terjadi pada saat konyugasi dengan aktivitas khitin sintetase maksimal selama pertumbuhan. Aktivitas khitinolitik dari beberapa entomopatogen penting untuk pertumbuhan dan secara potensial dibutuhkan untuk penetrasi. Pada tiga jenis entomopatogen Beauveria bassiana, Metarhizium anisopliae dan Vertillissin lecanii yang tumbuh pada kutikula belalang sebagai sumber karbon memberikan aktivitas endokhitinase, ß-1,4 N-Asetilglukosaminidase dan enzim hidrolitik lain. Khitinase dan enzim litik lainnya dilibatkan dalam kolonisasi antara tumbuhan inang dengan jamur mikorhiza vesikular arbuskular (VAM), ordo Endogonales klas Zygomycetes. Walaupun jamur VAM bersifat simbion obligat, jamur ini menghasilkan peroksidase dan khitinase pada akar mikorhizal dari Allium porrum. Mikoparasit daei beberapa strain Trichoderma spp. berkorelasi dengan kehadiran enzim litik seperti khitinase dan ß-1,3 glukanase. Kedua enzim ini diinduksi oleh strain yang berbeda dari Trichoderma harzianum pada media pertumbuhan yang diberikan dinding sel Rhizoctonia solani dan Sclerotium rolfsii sebagai sumber karbon tunggal. Penghambatan perkecambahan spora dan pemanjangan kecambah dari 9 jenis jamur yang memiliki khitin disebabkan oleh aktivitas endokhitinase dan eksokhitinase dari T. harzianum strain P1. Peningkatan secara sinergis dari aktivitas antijamur dihasilkan jika dua enzim dikombinasikan. Endokhitinase lainnya dipurifikasi dari Gliocladium virens yang memiliki aktivitas antijamur terhadap B. cinerea walaupun dengan kemampuan yang rendah. Aktivitas litik dari Trichoderma-Rhizoctonia dan Trichoderma-Sclerotium berkorelasi dengan tingkat pengendaliannya secara invivo. Sivan dan Chet (1989) mendemonstrasikan bahwa ß-1,3-glukanase dan khitinase dihasilkan oleh T. Harzianum. Khitinase ekstraseluler dari Trichoderma sp. membebaskan oligomer dari N-asetilglukosamin dari F. oxysporum f. sp. radicis-lycopersici ke dalam medium, sejak 48 jam setelah inokulasi. Ekspresi gen khitinase pada jamur dan mikroorganisme lainnya dikontrol oleh sistim represor-induser. Khitin dan produk hasil degradasi (oligomer) berperan sebagai induser. Glukosa merupakan represor pada A. album, B.bassiana dan M. anisoplae. Aktivitas khitinase yang tinggi hanya ditemukan pada kultur yang diberi khitin sebagai sumber karbon, tetapi bukan selulosa, khitosan atau khitobiose. Sebaliknya ditemukan bahwa GlcNAc tidak meningkatkan produksi enzimm pada T.harzianumm, GlcNAc dan glukosa menghambat sintesis khitinase dan ß-1,4 N-asetilglukosaminidase. IV. PENUTUP Khitin sebagai polimer yang terdapat melimpah di tanah, memiliki struktur dan karakteristik yang unik. Banyak hewan dan mikroorganisme (seperti jamur, dan alga) menjadi penyumbang ketersedian khitin di dalam tanah. Keberadaan senyawa ini di tanah merupakan sesuatu hal yang menarik. Dalam industri khitin memiliki banyak kegunaan yang dapat dimanfaatkan oleh manusia. Polimer khitin bersifat tidak mudah larut dalam pelarut biasa dan di alam terdapat bermacam-macam mikroorganisme, tumbuhan dan hewan yang memilki kemampuan untuk mendegradasi senyawa ini. Enzim khitinase yang dihasilkan mikroorganisme, tumbuhan dan hewan tersebut merupakan enzim yang mampu merombak polimer khitin menjadi unit monomer N-asetil glukosamin. Mikroorganisme pendegradasi khitin terbanyak adalah aktinomisetes, kemampuan khitinolitik genus Streptomyces banyak mendapat perhatian peneliti, hal ini karena Streptomyces adalah genus aktinomisetes dengan jumlah terbanyak di tanah. Genus aktinomisetes dapat memanfaatkan khitin sebagai sumber karbon dan nitrogennya sedangkan aktivitas khitinase pada tumbuhan lebih ditujukan pada kemampuan organisme ini melindungi dirinya dari serangan jamur atau serangga patogen.

2002 digitized by USU digital library 10
DAFTAR PUSTAKA Alexander, M. 1977. Introduction to Soil Microbiology. Second edition. John Willey
and Sons, New York. Bartnicki-Garcia, S. 1989. The Biocheical Cytology of Chitin and Chitosan Synthesis
in Fungi, Dalam G. Skjak, B. T. Anthonsen and P.A. Sanford (Eds). Procedings of the 4th International Conferenceon Chitin and Chitosan. Elsevier. Applied Science, Barking-UK.
Berkeley, R. C. W. 1979. Chitin, Chitosan and Their Degradative Enzymes. Dalam R.
C. W. Berkeley, G. W. Gooday and D.C. Ellwood (Eds.) Microbial Polysaccharides and Polysaccharases pp. 205 – 236. Academic Press, London.
Bielka, H., H. B. F. Dixon, P. Karlson, C. Liebeeg, N. Sharon, F. J. Van Lenten, S. F.
Velix, J. F. G. Vliegenhart and E. C. Webb. 1984. Enzyme Nomenclature. Academic Press, Inc. Newyork.
Bormann, C., D. Baier, I. Horr, C. Raps, J. Berger, G. Jung and H. Schwarz. 1999.
Characterization of a Novel, Antifungal, Chitin-binding Protein from Streptomyces tendae TU 901 that Interferes with Growth Polarity. J. Bacteriol. 181 : 7421 – 7429.
Cabib, E. 1987. The Synthesis and Degradation of Chitin. Dalam A. Meister (Ed)
Advances in Enzymology. Vol. 59, pp. 59 – 101. An Interscience Publication John Willey and Sons Inc., New York.
Carlile, M. J. and S.C. Watkinson. 1994. The Fungi. Academis Press, Harcourt Brace
and Company Publishers, London. Chernin, L., Z. Ismailo, S. Haran and I. Chet. 1995. Chitinolytic Enterobacter
agglomerans Antagonistic to Fungal Plant Pathogens. Appl. Environ. Microbiol. 61 : 1720 – 1726.
Griffin, D. H. 1981. Fungal Physiology. John Wiley and Sons, New York. Haran, S., H. Schickler, A. Oppenheim and I. Chet. 1995. New Components of
Chitinolitic System of Trichoderma harzianum. Mycol. Res. 94 : 441-446. Harman, G. E., C.K. Hayes, M. Lorito, R. M. Broadway, A. Di Pietro, C. Peterbauer
and A. Tronsmo. 1993. Chitinolytic Enzymes of Trichoderma harzianum : Purification of Chitobiosidase and Endochitinase. Phytopathology 83: 313-318.
Inbar J. and Chet I. 1991. Evidence That Chitinase Produced By Aeromonas caviae Is
Involved In The Biological Control Of Soil-Borne Plant Pathogens By This Bacterium. Soil. Biol. Biochem. 23 : 973-978.
Jeaniaux, C. 1966. Chitinases, Dalam E, F. Neufeld and V. Ginburg (Eds.) Complex
Carbohydrates, Methods in Enzymology. Vol. VII, pp. 644 – 650. Academic Press, New York.
Kamel, Z., N. Heikel and F. Fahmy. 1993. Extracellular Chitinase from Streptomyces
Species and Its Antifungal Activity. Acta Pharmaceutica Turcica 35 : 135-143.

2002 digitized by USU digital library 11
Lloyd, A. B., R. L. Noveroske and J. L. Lockwood. 1965. Lysis of Fungal Mycelium by
Streptomyces spp. and Their Chitinase Systems. Phytopathology 55 : 871–875.
Miyashita, K., T. Fujii and Y. Sawada. 1991. Molecular Cloning and Characterization
of Chitinase Genes from Streptomyces lividans 66. J. Gen. Microbiol. 137 : 2065 - 2072.
Muzzarelli, R. A. A. 1985. Chitin, Dalam G. O. Aspinal (Ed.) The Polysaccharides. Vol.
3, pp. 417 – 450. Academic Press Inc., New York. Rajarathanam, S., M. N. J. Shashirekha and Z. Bano. 1998. Biodegradative and
Biosinthetic Capacities of Mushrooms : Present and Future Strategies. Crit. Rev. in Biotechnol. 18 : 91 – 236.
Richards, A. G. 1951. The Integument of Arthropods. The Chemical Components and
Their Properties : The Anatomy and Development and Permeability. University of Minnesota Press, Minneapolis.
Sahai , A. S. and M. S. Manocha. 1993. Chitinases of Fungi and Plants : Their
Involvement in Morphogenesis and Host-Parasite Interaction. FEMS Microbiol. Rev. 11 : 317 – 338.
Saito, A., T. Fujii, T, Yoneyama and K. Miyashita. 1998. glkA is Involved in Glucose
Repression of Chitinase Production in Streptomyces lividanns. J. Bacteriol. 180: 2911-2914.
Schrempf, H. 1995. The Chitinolytic System of Streptomyces olivaceoviridis. Dalam
S. B Petersen., B. Svenson and S. Pedersen (Eds.). Progress In Biotechnology. Carbohydrate Bioenginering. Vol. 10, pp. 71 – 75. Elsevier Science. B. V. Amsterdam.
Schnellmann, J., A. Zeltins, H. Blaak and H. Schrempf. 1994. The Novel Lectin-like
CHB 1 is Encoded by a Chitin-inducible Streptomyces olivaceoviridis gene and Binds Specifically to Crystalline a-Chitin of Fungi and Other Organism. Mol. Microbiol. 13 : 807 – 819.
Scopes, R. K. 1994. Protein Purification, Principles and Practice. Third edition.
Springer-Verlag, New York. Singh, P.P., Y. C. Shin, C. S. Park and Y. R. Chung. 1999. Biological Control of
Fusarium Wilt of Cucumber by Chitinolytic Bacteria. Phytopathology 89: 92-99.
Sivan, A and I. Chet. 1989. Degradation of Fungal Cell Walls by Lytic Enzymes of
Trichoderma harzianum. J. Gen. Microbiol. 135 : 675 – 682. Tweddel, R. J., S. H. Jabaji-Hare and P. M. Charest. 1994. Production of Chitinases
and Glucanases by Stachybotrys elegans, a Mycoparasite of Rhizoctonia solani. Appl. Environ. Microbiol. 60: 489-495.

2002 digitized by USU digital library 12
Waksman, S. A. 1967. The Actinomycetes, A Summary of Current Knowledge. The Ronald Press Company, New York.
Winterowd, J. G. and P. A. Sandford. 1995. Chitin and Chitosan, Dalam A. M.
Stephen (Ed.) Food Polysaccharides and Their Applications. pp. 441 – 456. Marcel Dekker Inc., New York.