KWANTITATIEVE BEPALING VAN ADRENALINE EN … · Ze stimuleren adrenerge α- en β-receptoren op tal...
Transcript of KWANTITATIEVE BEPALING VAN ADRENALINE EN … · Ze stimuleren adrenerge α- en β-receptoren op tal...
UNIVERSITEIT GENT
FACULTEIT FARMACEUTISCHE WETENSCHAPPEN
Vakgroep Bioanalyse
Laboratorium voor Medische Biochemie en Klinische Analyse
Academiejaar 2008-2009
KWANTITATIEVE BEPALING VAN ADRENALINE EN
NORADRENALINE IN PLASMASTALEN VAN PATIËNTEN
ONDER ANESTHESIE VIA HILIC-MS/MS
Maaike GODEFROID
Eerste Master in de Geneesmiddelenontwikkeling
Promotor
Prof. Dr. Apr. J. Van Bocxlaer
Commissarissen
Prof. Dr. B. De Spiegeleer
Dr. Apr. C. Van Poucke
AUTEURSRECHT
“De auteur en de promotor geven de toelating deze masterproef voor consultatie beschikbaar
te stellen en delen ervan te kopiëren voor persoonlijk gebruik. Elk ander gebruik valt onder de
beperkingen van het auteursrecht, in het bijzonder met betrekking tot de verplichting
uitdrukkelijk de bron te vermelden bij het aanhalen van de resultaten uit deze masterproef.”
28-05-2009
Promotor Auteur
Prof. Dr. Apr. J. Van Bocxlaer Maaike Godefroid
DANKWOORD
Vooreerst zou ik mijn promotor, Prof. Dr. Apr. J. Van Bocxlaer, willen bedanken
voor de kans om in zijn laboratorium kennis en ervaring op te doen
en voor de waardevolle ondersteuning bij het schrijven van deze thesis.
Verder wens ik in het bijzonder mijn begeleidster, Ing. Sofie Vande Casteele,
te bedanken voor het niet aflatende enthousiasme
bij de begeleiding van het experimenteel onderzoek
en voor het geduld bij het evalueren van deze thesis.
Vervolgens gaat mijn dankbaarheid ook uit naar Dr. Apr. Koen Boussery,
Dr. Apr. Ruben t'Kindt, Apr. Julie De Smet, Apr. Lies De Bock,
Wim Goeteyn en Nadine Cloetens, alsook naar mijn medethesisstudentes Els, Charlotte en
Léonie, voor hun dagelijkse hulp en voor de prettige sfeer in het laboratorium.
Ten slotte wens ik ook mijn familie en vrienden,
mijn ouders en David in het bijzonder,
te bedanken voor hun dagelijkse steun en luisterend oor.
INHOUDSOPGAVE
1. INLEIDING...........................................................................................................................1
1.1. ADRENALINE EN NORADRENALINE.......................................................................1
1.2. ANESTHESIESTUDIE...................................................................................................2
1.3. ANALYSE VAN ADRENALINE EN NORADRENALINE..........................................4
1.3.1. Extractie...................................................................................................................4
1.3.2. Chromatografie en detectie: klassieke methoden.................................................8
1.3.3. Chromatografie en detectie: nieuwe methode......................................................9
1.3.3.1. Chromatografie................................................................................................9
1.3.3.2. Ionisatie..........................................................................................................11
1.3.3.3. Massa-analyse en detectie..............................................................................12
2. OBJECTIEVEN..................................................................................................................15
2.1. KEUZE SPE-KOLOMMETJE......................................................................................15
2.2. OPTIMALISATIE SPE-PROCEDURE VOOR WATERSTALEN...............................16
2.3. OPTIMALISATIE SPE-PROCEDURE VOOR PLASMASTALEN............................16
3. MATERIAAL EN METHODEN.......................................................................................17
3.1. EXTRACTIE.................................................................................................................17
3.2. CHROMATOGRAFIE...................................................................................................22
3.3. MASSA-ANALYSE EN DETECTIE............................................................................24
4. RESULTATEN EN DISCUSSIE........................................................................................26
4.1. GESILYLEERDE PROEFBUIZEN..............................................................................26
4.2. KEUZE SPE-KOLOM...................................................................................................27
4.2.1. Omkeerfase SPE....................................................................................................27
4.2.2. 'Weak' kationuitwisseling en 'strong' kationuitwisseling..................................27
4.2.3. Gemengde pakking...............................................................................................28
4.2.4. Besluit.....................................................................................................................29
4.3. OPTIMALISATIE SPE-PROCEDURE OASIS® WCX VOOR WATERSTALEN.....30
4.3.1. Elutiestap...............................................................................................................30
4.3.2. Wasstappen............................................................................................................32
4.4. OPTIMALISATIE SPE-PROCEDURE OASIS® WCX VOOR PLASMASTALEN. .38
4.4.1. Testen van de SPE-procedure op plasmastalen..................................................38
4.4.2. Verdere opzuivering plasmastaal.........................................................................40
4.4.3. Verdere aanpassing procedure............................................................................42
4.4.3. Vooropzuivering plasmastaal...............................................................................46
4.5. SAMENVATTING.........................................................................................................47
5. CONCLUSIES.....................................................................................................................49
6. LITERATUURLIJST.........................................................................................................50
LIJST MET GEBRUIKTE AFKORTINGEN
ACTH: Adrenocorticotroop Hormoon
CA: Catecholamines
CID: Collision Induced Dissociation
COMT: Catechol-o-methyltransferase
DOPA: Dihydroxyphenylalanine
ECD: Electrochemical detection/ Elektrochemische detectie
ESI: Electrospray ionisatie
FA: Formic acid
FLD: Fluorescence Detection/ Fluorescentiedetectie
GC: Gaschromatografie
HILIC: Hydrophilic Interaction Liquid Chromatography
HPLC: High Performance/Pressure Liquid Chromatography (Hoge druk vloeistofchromato-
grafie)
IL-1 β: Interleukine-1 β
IL-6: Interleukine-6
IS: Interne standaard
LLE: Liquid-Liquid Extraction (vloeistof-vloeistof extractie)
MAO: Monoamine Oxidase
MeOH: Methanol
MRM: Multiple Reaction Monitoring
MS: Massaspectrometer
MS/MS: Tandemmassaspectrometrie
NOR: N Ohne Radikal
NP: Normal Phase (normaalfase)
NPC: Normal Phase Chromatography (normaalfase chromatografie)
RP: Reversed Phase (omkeerfase)
RPC: Reversed Phase Chromatography (omkeerfase chromatografie)
SPE: Solid Phase Extractie (vaste fase extractie)
SSI: Surgical Stress Index (chirurgische stressindex)
SSR: Surgical Stress Response (chirurgische stressrespons)
TNF α: Tumor Necrosis Factor α
1
1. INLEIDING
1.1. ADRENALINE EN NORADRENALINE
Adrenaline of epinefrine en noradrenaline of norepinefrine spelen een centrale rol in
het sympathisch zenuwstelsel als neurotransmitters en als hormonen (Peaston & Weinkove,
2004). Ze stimuleren adrenerge α- en β-receptoren op tal van cellen, waardoor ze een effect
hebben op een groot aantal in-vivo mechanismen, onder andere cardiovasculaire en metabole
processen. Activatie van α-receptoren geeft meestal een stimulerende respons, behalve ter
hoogte van het gastro-intestinaal systeem. Activatie van β-receptoren geeft meestal een
remmende respons, behalve ter hoogte van het hart.
Adrenaline induceert samen met noradrenaline de 'fight or flight'-respons, waarbij het
lichaam voorbereid wordt op actie en gevaar. De toevoer van zuurstof en glucose naar de
hersenen en spieren stijgt, het hartritme verhoogt, de bronchi zetten uit en vasoconstrictie
treedt op in de huid en het gastro-intestinaal systeem. Zowel adrenaline als noradrenaline
spelen ook een rol in verschillende pathologieën, zoals feochromocytoom (tumor van de
chromaffiene cellen) en neuroblastoom (neuro-endocriene tumor) (Tsunoda, 2006).
Adrenaline (C9H13NO3) en noradrenaline (C8H11NO3) worden beiden gevormd uit
dihydroxyphenylalanine (DOPA), een aminozuur. Ze worden vooral aangemaakt in de
hersenen, het bijniermerg en de sympathische neuronen (Peaston & Weinkove, 2004). Bij hun
vrijstelling wordt een deel verwijderd door neuronale en extra-neuronale re-uptake, waardoor
slechts een kleine fractie in de circulatie terechtkomt. De concentraties van adrenaline en
noradrenaline in het bloed zijn dan ook laag (pg-ng per ml). Metabolisatie gebeurt door twee
enzymen, monoamine oxidase (MAO) en catechol-O-methyltransferase (COMT). Dit leidt tot
een reeks van metabolieten.
Chemisch gezien zijn het catecholamines (CA): monoamines gelinkt aan een
benzeenring met twee vicinale hydroxylgroepen (catechol) (Peaston & Weinkove, 2004). Het
enige verschil in structuur tussen beide is dat de aminogroep van noradrenaline niet
gesubstitueerd is met een methylgroep, vandaar de benaming noradrenaline (NOR = N Ohne
Radikal). Door de ringstructuur zijn adrenaline en noradrenaline fluorescent, maar ook
2
gevoelig aan licht en oxidatie. Bovendien zijn ze thermolabiel en worden ze in alkalisch
milieu afgebroken. In tegenstelling tot noradrenaline is adrenaline slecht oplosbaar in water.
Beiden zijn goed oplosbaar in waterige oplossingen van organische zuren. De pKa van de
aminogroep van adrenaline bedraagt 10,32. De aminogroep van noradrenaline is zuurder met
een pKa van 8,58 (chem.sis.nlm.nih.gov). De structuur van adrenaline en noradrenaline wordt
weergegeven in Figuur 1.1.
FIGUUR 1.1.: STRUCTUUR VAN ADRENALINE EN NORADRENALINE.
1.2. ANESTHESIESTUDIE
De studie die in deze masterproef besproken wordt, is een rechtstreeks gevolg van een
studie die uitgevoerd wordt door de afdeling anesthesie in het Universitair Ziekenhuis in
Gent. Daar wordt een vergelijking gemaakt van de stressrespons tijdens een operatie met
anesthesie met enerzijds een hoge dosis opiaten (pijnstillers) en een lage dosis hypnotica en
anderzijds een lage dosis opiaten en een hoge dosis hypnotica. Dit gebeurt door het meten van
endocrinologische en immunologische merkers en het bepalen van de surgical stress index
(SSI) of chirurgische stressindex tijdens de anesthesie.
Tijdens een operatie worden twee soorten geneesmiddelen gebruikt om de kwaliteit
van de anesthesie te optimaliseren: hypnotica voor de sedatie en opiaten om de chirurgische
stress te blokkeren. Deze twee soorten geneesmiddelen werken synergistisch, dus er worden
algemeen twee technieken toegepast: de combinatie van een hoge dosis opiaten en een lage
dosis hypnotica, en de combinatie van een lage dosis opiaten en een hoge dosis hypnotica.
Er werd reeds gepubliceerd dat hoge dosissen opiaten chirurgische stress kunnen
blokkeren (Myre et al., 2003). Echter, te hoge dosissen kunnen het herstel vertragen. Te lage
dosissen kunnen dan weer aanleiding geven tot chirurgische stress. Veel stress tijdens
3
anesthesie kan een slechter herstel na de operatie tot gevolg hebben. Er is dus nood aan een
parameter die toelaat de chirurgische stress te bepalen tijdens anesthesie. Het zou interessant
kunnen zijn om te zoeken naar een verband tussen de verschillende stressmerkers en de
plasmaconcentratie van opiaten. Het zou ook relevant kunnen zijn een verband te vinden
tussen de mate van stress en de concentraties van stresshormonen tijdens een operatie.
Tijdens een operatie treden er complexe endocriene, hemodynamische,
immunologische, metabole en inflammatoire responsen op. Deze surgical stress response
(SSR) of chirurgische stressrespons wordt gemedieerd door de hypothalame-hypofysaire-
bijnier-as, die het autonoom zenuwstelsel activeert (Struys et al., 2007). Dit veroorzaakt onder
andere een verhoogde concentratie van circulerende stresshormonen (adrenocorticotroop
hormoon (ACTH), cortisol, groeihormoon en catecholaminen) en een verhoogde vrijstelling
van verschillende mediatoren, waaronder cytokinen. De inflammatoire cytokinen, zoals
Tumor Necrosis Factor α (TNF α), Interleukine-1 β (IL-1 β) en Interleukine-6 (IL-6), zijn
belangrijke mediatoren van de pathofysiologische veranderingen ten gevolge van een operatie
en hebben ook een invloed op het immuunsysteem. Het primaire doel van al deze reacties is
homeostase en bevorderen van het herstel. Ze hebben echter ook negatieve gevolgen, zoals
verhoogde zuurstofconsumptie van de hartspier, verhoogd katabolisme, verminderde
immuniteit en slechte klinische uitkomst.
De grootte van de SSR is evenredig met de grootte van de verwonding, de duur van de
operatie, de hoeveelheid bloedverlies tijdens de operatie, de keuze van anesthesietechniek en
de ernst van de postoperatieve pijn (Struys et al., 2007). Het is belangrijk om de SSR zoveel
mogelijk te onderdrukken om het klinisch verloop na de operatie te verbeteren en dus de
hospitalisatieduur verminderen. Om de SSR te bepalen worden bloedstalen genomen voor,
tijdens en na de operatie en worden de glycemie en hormoon- en cytokineconcentraties
bepaald. Ook wordt de gemiddelde telomeerlengte van ontstekingscellen bepaald. Telomeren
zijn de uiteinden van ons genetisch materiaal. Hun lengte is een maat voor de ouderdom van
deze cellen. Hoe hoger de chirurgische stress, hoe lager deze gemiddelde lengte. Ook wordt
de SSI bepaald. Dit is een parameter die berekend wordt aan de hand van het hartritme en het
meten van de saturatie (zuurstofgehalte in het bloed).
4
Het zou interessant zijn om een verband te vinden tussen de SSR en de concentraties
van opiaten, van de endocrinologische merkers en van de immunologische merkers in het
bloed. Myre et al. (2003) hebben bijvoorbeeld al een verband aangetoond tussen de
plasmaconcentraties van adrenaline en noradrenaline en de plasmaconcentraties van opiaten
tijdens een operatie. Opiaten onderdrukken de hypothalame-hypofysaire-bijnier-as en de
sympathische activiteit op een dosisafhankelijke manier. Dit wil zeggen dat hoge dosissen van
opiaten de sympathische activiteit beter onderdrukken dan lage dosissen. Voor adrenaline, dat
enkel vrijgesteld wordt door de bijnieren na stimulatie van de hypothalame-hypofysaire-
bijnier-as, wordt een lagere plasmaconcentratie gemeten bij toediening van hogere dosissen
opiaten. De vrijstelling van noradrenaline echter wordt niet beter onderdrukt door hogere
dosissen opiaten. Dit is te wijten aan een lokale vrijstelling van noradrenaline. De
plasmaconcentraties van adrenaline en noradrenaline tijdens een operatie zouden dus een
goede parameter zijn voor het bepalen van de SSR.
De bepaling van die plasmaconcentraties is echter een probleem. De klassieke
analysemethoden voor adrenaline en noradrenaline in plasmastalen (onder andere
elektrochemische detectie) blijken niet in staat om de concentraties in deze stalen te bepalen
(zie paragraaf 1.3.2.). Ook door aanpassingen van de bestaande technieken kunnen de
concentraties niet gemeten worden. Er is dus een specifiekere en meer gevoelige techniek
vereist om deze bepalingen te kunnen uitvoeren. De dienst anesthesie van het UZ Gent heeft
hierbij contact opgenomen met het laboratorium voor Medische Biochemie en Klinische
Analyse met de vraag een techniek te ontwikkelen voor deze toepassing.
1.3. ANALYSE VAN ADRENALINE EN NORADRENALINE
1.3.1. Extractie
De analyse van adrenaline en noradrenaline in plasmastalen brengt veel problemen
met zich mee. De concentraties die moeten bepaald worden zijn zeer laag en daarbij komt nog
dat de componenten moeten geëxtraheerd worden uit een zeer complexe matrix (Unceta et
al., 2001). Er zijn ook tal van metabolieten aanwezig in de matrix en adrenaline en
noradrenaline zijn chemisch instabiel. Er is dus een zeer effectieve en grondige
staalvoorbereiding nodig. Die staalvoorbereiding is nodig om proteïnen, lipiden en zo
5
mogelijk interfererende stoffen (zoals metabolieten) te verwijderen, dit laatste om de
selectiviteit van de analyse te verhogen. Het is de bedoeling dat de gewenste componenten
met een zo hoog mogelijk rendement worden geëxtraheerd om een adequate gevoeligheid te
bekomen voor de analyse.
Klassiek gebeurt zo'n extractie door adsorptie van adrenaline en noradrenaline op
alumina of op boorzuurgel (Raggi et al., 1999). Deze methode is echter niet selectief genoeg
en geeft een klein extractierendement. Extractie kan ook gebeuren met organische solventen
(liquid-liquid extraction (LLE) of vloeistof-vloeistofextractie). Hierbij wordt gebruik gemaakt
van twee onmengbare vloeistoffasen waartussen de componenten zich gaan verdelen. De ene
fase is een apolaire (organische) fase en de andere is een polaire (waterige) fase. Het is de
bedoeling dat de doelanalyten oplossen in de ene fase en de ongewenste verbindingen in de
andere. Dit is natuurlijk niet kwantitatief: er stelt zich een evenwicht in waarbij de gewenste
componenten steeds in meer of mindere mate in beide fasen aanwezig zijn (Majors, 2009).
Dit kan echter gemoduleerd worden door bijvoorbeeld een gericht aanpassen van de pH. In
het geval echter van adrenaline en noradrenaline blijken de verbindingen te polair te zijn om
op die wijze overgebracht te worden van een water- naar een organische fase. Ook deze
techniek geeft dus een heel beperkt extractierendement. Daarbij komt nog dat deze methode
tijdrovend is en vaak grote hoeveelheden solvent vereist.
Daarom wordt vaak, en ook in deze studie, gebruik gemaakt van solid-phase extraction
(SPE) of vaste-fase extractie. SPE is een snelle en efficiënte extractietechniek waarbij een
staal op een kolommetje, gevuld met een welbepaalde pakking, wordt gebracht. Afhankelijk
van de samenstelling van de solventen die op de kolom gebracht worden, vertonen bepaalde
componenten interactie met de pakking of niet (zie Figuur 1.2.).
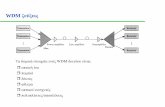
FIGUUR 1.2.: SOLID-PHASE EXTRACTIEKOLOM. FRITS ZIJN KLEINE FILTERSCHIJFJES
DIE DE PAKKING OP ZIJN PLAATS HOUDEN. (www.aquaculture.ugent.be)
6
De procedure bestaat essentieel uit 4 stappen. In de eerste stap wordt de pakking
geconditioneerd en geëquilibreerd. Hierbij wordt de pakking bevochtigd en geactiveerd. In de
tweede stap wordt het staal, waaruit bepaalde componenten moeten geïsoleerd worden, op het
kolommetje gebracht. Door interactie met de pakking worden de gewenste componenten
weerhouden, terwijl de rest van het staal over de kolom vloeit zonder interactie te vertonen
met de vaste fase. De derde stap is een wasstap, waarbij ongewenste componenten, die toch
op de pakking achtergebleven zijn, bijvoorbeeld door aspecifieke interacties, weggespoeld
worden. In de vierde en laatste stap worden de doelanalyten afgeëlueerd en opgevangen. De
techniek kan ook gerobotiseerd worden: dit gaat veel sneller en levert uniformere resultaten
op.
Afhankelijk van het soort pakking spreekt men van omkeerfase, normaalfase,
ionenuitwisselings en adsorptie SPE (www.sigmaaldrich.com). In deze studie zal gebruik
gemaakt worden van omkeerfase en ionenuitwisselings SPE. Bij omkeerfase SPE is de
stationaire fase (pakking) apolair (gemodificeerde silica met hydrofobe groepen), terwijl de
mobiele fase polair is. Interacties met de stationaire fase komen tot stand door middel van
hydrofobe bindingskrachten, zoals Van der Waalse krachten. Er kunnen ook secundaire
interacties optreden met residuele silanolgroepen (polaire interacties). De residuele
silanolgroepen zullen vanaf een pH 4 en hoger geïoniseerd zijn: de fase kan dus ook de
eigenschappen bezitten van een kationuitwisselaar. Het gewenste analyt is meestal matig tot
niet polair. Om het analyt te laten afelueren, wordt een niet-polair solvent gebruikt om de
krachten tussen het analyt en de stationaire fase te doorbreken. Als het analyt hiermee niet
goed wil afelueren, kan dit te wijten zijn aan secundaire polaire interacties. In deze situatie
kan methanol helpen om die interacties te verstoren. Wanneer de silanolgroepen geïoniseerd
zijn, kan een pH-aanpassing van de elutievloeistof nodig zijn om deze interacties te verstoren.
Hierbij kan zure of basische methanol van pas komen.
Bij ionenuitwisselings SPE bestaat de stationaire fase uit gemodificeerde silica met
geladen functionele groepen. Die kunnen positief (anionuitwisseling) of negatief geladen
(kationuitwisseling) zijn. Door interactie met deze geladen groepen worden de gewenste
componenten weerhouden. Er moet gewerkt worden bij een pH waarbij zowel het analyt als
de functionele groepen op de pakking (tegengesteld) geladen zijn, anders zal er geen interactie
optreden. Er kunnen ook nog secundaire apolaire interacties optreden met de apolaire delen
7
van de functionele groepen of secundaire polaire en kationuitwisselingsinteracties met
silanolgroepen. De gewenste component wordt afgeëlueerd door de pH aan te passen of door
een solvent met hoge ionensterkte. Er kan een verdere onderverdeling gemaakt worden in
'strong' en 'weak' ionenuitwisseling. Bij 'strong' ionenuitwisseling hebben de functionele
groepen van de stationaire fase een zeer lage (kationuitwisseling) of een zeer hoge
(anionuitwisseling) pKa en zijn ze geladen over een breed pH-interval (www.pall.com). Bij
'weak' ionenuitwisseling zijn ze geladen over een smal pH-interval. Deze laatste techniek
wordt gebruikt voor de isolatie van sterke analytionen, die anders niet goed losgemaakt
zouden kunnen worden van het sorbent.
Na de extractie moet het eluaat, dat de gewenste analyten bevat, meestal verder
aangeconcentreerd worden. Dit is met name voor adrenaline en noradrenaline nodig wegens
de zeer lage concentraties waarin deze aanwezig zijn in de plasmastalen van patiënten. Hierbij
wordt klassiek een evaporatietechniek gebruikt. Dit vormt hier echter een probleem, omdat
adrenaline en noradrenaline thermolabiel zijn. Een deel van het analyt (dat al in lage
concentratie aanwezig is) gaat dan verloren door thermische degradatie. Na de SPE-procedure
wordt het eluaat in deze studie rechtstreeks geïnjecteerd. De elutievloeistof die bij SPE
gebruikt wordt, moet dus compatibel zijn met het chromatografisch systeem. In deze studie
(er wordt gebruik gemaakt van een HILIC-kolom voor de chromatografische scheiding) vormt
dit echter geen probleem, omdat het chromatografisch eluens voor een groot deel bestaat uit
organische solventen (Xu et al., 2007).
Een andere manier van aanconcentreren is 'in-line trapping'. Hierbij wordt het SPE-
eluaat geïnjecteerd op een kolom met een 'weak' kationuitwisselingspakking. De
trappingkolom wordt voor de chromatografische kolom geplaatst. Het is de bedoeling dat de
analyten voldoende weerhouden worden op de pakking zodat daar geen verlies van de
componenten optreedt. Daarna kunnen die weer losgemaakt worden van de pakking met het
chromatografisch eluens. De analyten worden dan over de chromatografische kolom geleid
voor scheiding. Een beperking van trapping is het ladingsvolume van de trappingkolom: dat
mag niet te groot zijn. Het is hier dus aangewezen om het volume van het SPE-eluaat zo klein
mogelijk te houden.
8
1.3.2. Chromatografie en detectie: klassieke methoden
Er zijn al heel wat technieken ontwikkeld om adrenaline en noradrenaline in
plasmastalen te analyseren. De meest gebruikte is hoge druk vloeistofchromatografie met
elektrochemische detectie (HPLC-ECD). Voordelen van deze techniek zijn de selectiviteit en
de gevoeligheid zonder dat derivatisatie nodig is (Tsunoda, 2006). Deze techniek is gebaseerd
op het meten van een stroom die ontstaat door oxidatie of reductie van een component aan een
elektrode. Elektrochemische detectie kan amperometrisch of coulometrisch gebeuren.
Nadelen van deze techniek zijn echter de lage betrouwbaarheid door vervuilde elektroden
(Gu et al., 2008), lange analysetijd en interferentie door co-eluerende substanties
(De Jong et al., 2007). In de anesthesiestudie treedt er interferentie op tussen anesthetica
toegediend tijdens de operatie en de interne standaard gebruikt voor kwantificatie van
adrenaline en noradrenaline (Müssig et al., 2006).
Een tweede techniek die veel gebruikt wordt, is hoge druk vloeistofchromatografie
met fluorescentiedetectie (HPLC-FLD). Wanneer gebruik gemaakt wordt van de natieve
fluorescentie van de CA’s, is de techniek wel gevoelig, maar de specificiteit is gelimiteerd
doordat vele andere componenten in plasma absorptie- en emissiemaxima hebben bij dezelfde
golflengten als CA’s. Er zou dus een heel specifieke staalvoorbereiding nodig zijn om op deze
manier CA’s te bepalen (Peaston & Weinkove, 2004). De CA’s kunnen ook omgezet worden
tot fluorescente derivaten door middel van trihydroxyindole of ethyleendiamine (pre-column
of post-column). Dit verhoogt de gevoeligheid, maar de specificiteit is nog altijd laag door
interferentie met andere stoffen. Daarbij komt nog dat derivatisatie zeer arbeidsintensief is.
Andere methoden die regelmatig gebruikt worden zijn gaschromatografie met
massaspectrometrische detectie (GC-MS) wegens de gevoeligheid en sensitiviteit
(De Jong et al., 2007), maar ook hier is arbeidsintensieve derivatisatie nodig om adrenaline en
noradrenaline aan gaschromatografie te kunnen onderwerpen. Ook HPLC in combinatie met
chemiluminescentiedetectie wordt gebruikt, omdat deze detectiemethode selectiever en
gevoeliger is dan fluorescentiedetectie (Tsunoda, 2006). Bij deze techniek komt energie vrij
bij een chemische reactie onder de vorm van licht. Als alternatief voor
vloeistofchromatografie wordt soms ook capillaire elektroforese als scheidingstechniek
toegepast.
9
1.3.3. Chromatografie en detectie: nieuwe methode
Een methode die de laatste jaren meer en meer toegepast wordt voor de bepaling van
CA’s in plasma is hoge druk vloeistofchromatografie met tandem-massaspectrometrische
detectie (HPLC-MS/MS). Het is een snelle en gevoelige techniek (Xu et al., 2007) waarmee
ook structurele informatie kan bekomen worden (Gu et al., 2008). Koppeling van MS-detectie
aan HPLC levert een zeer specifieke techniek op; om voldoende gevoeligheid te verkrijgen is
een goede staalvoorbereiding wel noodzakelijk (Tsunoda, 2006).
1.3.3.1. Chromatografie
Oorspronkelijk werd een omkeerfase-kolom (RP) gebruikt voor de scheiding van de
CA’s. Bij RP-chromatografie (RPC) wordt gebruik gemaakt van een apolaire stationaire fase
en een polaire mobiele fase. Dit levert echter te weinig retentie op van de polaire CA’s op de
hydrofobe pakking van de kolom. In een poging dit te verhelpen, worden er modificaties van
de apolaire stationaire fase uitgevoerd (voornamelijk door het binden van polaire groepen op
de stationaire fase), maar ook dat is onvoldoende om de retentie significant te verbeteren
(Hemstrom & Irgum, 2006). Te weinig retentie is te wijten aan solvolytische factoren: polaire
stoffen kunnen interacties (ionair, dipolair, waterstofbrug) aangaan met het polaire eluens (ze
lossen dus op), terwijl ze dit met de apolaire stationaire fase niet kunnen. Die componenten
gaan dus onmiddellijk elueren, zonder dat er scheiding optreedt. Verder is er ook het probleem
van peak tailing (Roemling & Itoh, 2007).
Ook een normaalfase-kolom (NP) is niet echt geschikt voor deze bepaling. Bij NP-
chromatografie (NPC) treedt er scheiding op tussen een polaire stationaire fase en een
apolaire mobiele fase (dikwijls op basis van hexaan). Er treedt hier wel retentie op van polaire
CA’s, maar die hebben dan een lage oplosbaarheid in de apolaire mobiele fase, waardoor ze
moeilijk afgeëlueerd kunnen worden. Bovendien is de bereiding van het eluens moeilijker,
omdat de hoeveelheid water onder controle moet gehouden worden (Hemstrom & Irgum,
2006). NPC is slecht reproduceerbaar (Guo & Gaiki, 2005) en ook de koppeling aan MS is
hier een probleem wegens slechte ionisatie van de componenten door het volledig organische
eluens (zie verder).
10
Daarom wordt in deze studie gebruik gemaakt van hydrophilic interaction liquid
chromatography (HILIC). Deze techniek lijkt op NPC qua stationaire fase (polair), maar qua
mobiele fase lijkt het meer op RPC. Typische stationaire fasen zijn silica of polymeerpartikels
met functionele groepen. De mobiele fase bestaat uit mengsels van acetonitrile, methanol of
aceton (watermengbaar organisch deel) en water of waterige buffers (waterig deel) (Roemling
& Itoh, 2007).
Er kan zowel met een gradiënt als isocratisch gewerkt worden. Wanneer er gewerkt
wordt met een gradiënt, wordt er gestart met een hoog percentage organische fase en wordt er
geëindigd met een hoog percentage waterige fase. Dit is het omgekeerde van gradiëntelutie bij
RPC. De elutievolgorde van componenten bij HILIC is dus min of meer het tegenovergestelde
van die bij RPC. HILIC werkt bijgevolg het beste voor de scheiding van polaire
componenten, vermits die niet goed gescheiden worden op RPC (Hemstrom & Irgum, 2006).
Het retentiemechanisme bij HILIC is gebaseerd op de stelling dat het waterige deel
van de mobiele fase een laag vormt bovenop de polaire stationaire fase. Er treedt dus
verdeling op van de analyten tussen de waterige laag en de organische, relatief apolaire
mobiele fase (Hemstrom & Irgum, 2006). Op deze manier treedt er retentie op van polaire
componenten, maar is de mobiele fase nog voldoende polair om die componenten te kunnen
oplossen voor elutie (in tegenstelling tot de mobiele fase in NPC, zie hoger). De elutie wordt
dus gedreven door het waterige deel van de mobiele fase. De meest voorkomende interacties
zijn waterstofbrugvorming en dipool-dipoolinteracties (Roemling & Itoh, 2007).
Bij HILIC bestaat de mobiele fase voor een groot deel uit organische solventen.
Hierdoor is deze techniek zeer geschikt voor koppeling aan tandem-MS-detectie, want er
treedt efficiënte verdamping op van het solvent tijdens ionisatie (zie verder). Dit verhoogt de
gevoeligheid van de bepaling (Roemling & Itoh, 2007). HILIC geeft dikwijls aanleiding tot
smallere pieken in chromatogrammen, waardoor de signaal-ruisverhouding verbetert
(Xu et al., 2007). De combinatie van HILIC met MS/MS-detectie levert dus een zeer
gevoelige en selectieve techniek op voor de bepaling van CA’s in plasma.
11
1.3.3.2. Ionisatie
Na elutie van de kolom moeten de gescheiden componenten in de gasfase gebracht en
geïoniseerd worden vooraleer ze met MS kunnen geanalyseerd worden. Hiervoor wordt
electrospray ionisatie (ESI) gebruikt. Dit is een zachte ionisatietechniek bij atmosferische
druk. Het eluaat afkomstig uit de HPLC wordt door een fijn, roestvrij stalen capillair, waarop
een hoge spanning zit (2-5 kV), gepompt. In deze studie wordt een positieve spanning
gebruikt (positieve ionisatie modus). Hierdoor krijgen de moleculen in het eluaat een
positieve lading. Die ontstaat met behulp van het eluens door protonatie of het binden van een
kation aan het analyt. Door het potentiaalverschil tussen het capillair en een tegenelektrode
(ingang van de massaspectrometer) ontstaat er op de tip van het capillair een elektrisch veld.
Onder invloed van dit elektrisch veld bewegen anionen in het eluaat naar de wand van het
capillair toe, terwijl de kationen zich voortbewegen in de richting van de tegenelektrode en
een druppel vormen aan de tip van het capillair (Manisali et al., 2006).
Die druppel neemt de vorm aan van een kegel, de zogenaamde 'Taylor cone'. Wanneer
de elektrostatische repulsie tussen (positief) geladen moleculen aan het oppervlak van de
Taylor cone de oppervlaktespanning benadert, wordt de Rayleigh-limiet bereikt. Hierbij
worden geladen druppeltjes uit de tip geduwd (spray), die zich dan verder bewegen in de
richting van de tegenelektrode. Wanneer het solvent uit de druppeltjes verdampt, komen de
ladingen in de druppeltjes dichter bij elkaar te zitten, waardoor de elektrostatische repulsie
tussen de ladingen weer stijgt. Wanneer opnieuw de Rayleigh-limiet bereikt wordt, spatten de
druppeltjes uit elkaar in kleinere druppeltjes (Coulombic fission). Die druppeltjes gaan door
verdere verdamping van het solvent op hun beurt ook uit elkaar spatten, zodat er telkens
kleinere druppeltjes ontstaan. Uiteindelijk ontstaan er enkelvoudige ionen in de gasfase
(Manisali et al., 2006).
De manier waarop gasfase-ionen uit deze druppeltjes ontstaan, kan verklaard worden
door twee modellen. Volgens het 'charged residue model' ontstaan de gasfase-ionen door
opeenvolgende fissies, waardoor uiteindelijk druppeltjes ontstaan met één geladen molecule.
Volgens het 'ion evaporation mechanism' worden gesolvateerde ionen uit de druppeltjes in de
gasfase gestoten, doordat de potentiële energie van de ionen aan het oppervlak groot genoeg is
voor evaporatie. Het wordt aangenomen dat beide modellen naast elkaar doorgaan.
12
Het volledige proces wordt voorgesteld op Figuur 1.3.
FIGUUR 1.3.: MECHANISME VAN ELECTROSPRAY IONISATIE. (www.chm.bris.ac.uk)
De verdamping van het solvent wordt bevorderd door een stroom van warm N2-gas,
het desolvatiegas. Het vernevelingsgas daarentegen is een stroom van N2-gas die ervoor zorgt
dat de spray in de juiste richting gaat. De spray komt langs de sample cone, die de gasfase-
kationen wegtrekt, terwijl grote druppeltjes, niet-vluchtig materiaal en deeltjes rechtdoor
gaan. De ionen volgen dan een z-vormige baan en gaan via hexapolen naar de eigenlijke
massa-analysator. Een schematisch overzicht hiervan wordt gegeven in Figuur 1.4.
FIGUUR 1.4.: SCHEMATISCH OVERZICHT VAN EEN ELECTROSPRAY BRON (Z-SPRAY®).
(www.spectroscopynow.com)
1.3.3.3. Massa-analyse en detectie
Het MS-toestel dat hier gebruikt wordt, is een triple quadrupool-toestel, waarbij een
quadrupool, een hexapool en een quadrupool achtereenvolgens dienst doen als massafilters.
Een combinatie van elektrische spanning en radiofrequentiespanning zorgt voor de scheiding
13
van ionen volgens hun massa-ladingverhouding (m/z-waarde) (Micromass® Quattro Ultima™
Operator Training Course). De scheiding gaat door onder vacuüm. Een schema van de triple
quadrupool MS wordt gegeven in Figuur 1.5.
FIGUUR 1.5.: SCHEMA VAN DE TRIPLE QUADRUPOOL MASSASPECTROMETER.
(www.drugdiscoveryonline.com)
In deze studie zijn de te analyseren componenten gekend en zijn ook hun
massaspectrometrische eigenschappen (moleculair ion, fragmentionen,...) gekend. Er kan dus
gewerkt worden in de zogenaamde Multiple Reaction Monitoring (MRM)-modus van het
toestel (zie Figuur 1.6.). Dit houdt in dat een precursorion (het moleculair ion)
gefragmenteerd wordt tot productionen (tandem-MS) en dat slechts één production of een
paar productionen, die typisch zijn voor de te analyseren component, gedetecteerd worden.
FIGUUR 1.6.: MULTIPLE REACTION MONITORING. (www.waters.com)
De eerste quadrupool wordt zodanig ingesteld dat enkel het precursorion wordt
doorgelaten. De hexapool doet dienst als een botsingscel: door middel van een botsingsgas
(argongas) treedt er collision-induced dissociation (CID) op van het precursorion, waardoor er
een aantal productionen ontstaan. De tweede quadrupool laat in deze studie twee productionen
per component door, die specifiek zijn voor die componenten. De ionen worden gedetecteerd
met behulp van een fotomultiplier, die het signaal van de ionen meet en versterkt via een
elektrische stroom. Het verkregen signaal (maat voor de relatieve ionenstroom) wordt dan
14
uitgezet ten opzichte van de tijd, waardoor een chromatogram bekomen wordt. Kwantificatie
gebeurt aan de hand van de piekoppervlakten na het opstellen van een ijklijn.
Deze techniek is zeer gevoelig en selectief. Doordat beide quadrupolen gebruikt
worden als massafilters, worden er ionen geselecteerd die specifiek zijn voor adrenaline en
noradrenaline. Er wordt dus ook geen tijd verspild aan de analyse van ionen die niet relevant
zijn. Door koppeling aan een HPLC-toestel stijgt de selectiviteit, want het is zeer
onwaarschijnlijk dat twee componenten dezelfde retentietijd én dezelfde m/z-waarde voor het
precursorion hebben én ook aanleiding geven tot productionen met dezelfde m/z-waarde.
15
2. OBJECTIEVEN
Het doel van deze studie is de ontwikkeling van een kwantitatieve bepalingsmethode
voor adrenaline en noradrenaline in plasmastalen van patiënten onder anesthesie. De
concentratie van adrenaline en noradrenaline wordt bepaald om de mate van stress te kunnen
bepalen die patiënten tijdens anesthesie ondervinden. Om dit te kunnen doen, wordt een
extractieprocedure ontwikkeld, gekoppeld aan een HILIC-MS/MS analyse. In vorig
onderzoek werd de extractie uitgevoerd door middel van SPE op Discovery® DSC-18 SPE-
kolommetjes (omkeerfase pakking). De bedoeling van dit onderzoek is de optimalisatie van
de extractieprocedure met behulp van SPE.
2.1. KEUZE SPE-KOLOMMETJE
Met de Discovery® DSC-18 SPE-kolommetjes werden reeds verschillende testen en
extracties uitgevoerd. Het elutievolume bedroeg bij dit type kolommetje echter 1 ml. Dit
volume is voor deze analyse te groot (de concentratie van de analyten hierin is te laag), omdat
de methode uiteindelijk geschikt moet zijn om zeer lage concentraties van adrenaline en
noradrenaline (pg/ml-range) te meten in patiëntenstalen. Het eluaat moet dus verder
aangeconcentreerd worden om de kwantificatielimiet te kunnen bereiken bij de analyse van de
patiëntenstalen.
Er kan geen evaporatietechniek gebruikt worden voor het verder aanconcentreren van
het eluaat, omdat adrenaline en noradrenaline thermolabiel zijn. Een deel van de analyten (die
al in lage concentratie aanwezig zijn in plasma) zou dus verloren gaan door thermische
degradatie. Trapping is hier ook niet mogelijk: een volume van 1 ml is te groot om praktisch
trapping te kunnen uitvoeren. Het is dus aangewezen het elutievolume zo klein mogelijk te
houden. Daarom moet overgegaan worden naar een ander SPE-kolommetje. Er worden
verschillende kolommetjes getest, zowel met een gelijkaardige (omkeerfase) pakking als met
een ionenuitwisselingspakking, om te onderzoeken of het mogelijk is hiermee een kleiner
elutievolume te bekomen. Liefst wordt een zo klein mogelijk elutievolume
(< 200 µl) bekomen zodat trapping overbodig is. Er wordt in dit onderzoek echter in eerste
instantie gestreefd naar een volume van 500 µl.
16
2.2. OPTIMALISATIE SPE-PROCEDURE VOOR WATERSTALEN
Voor het nieuwe SPE-kolommetje moet een optimale extractieprocedure opgesteld
worden. Dit wordt gedaan aan de hand van waterstalen, omdat hierbij ook de opbrengstap en
wasstappen kunnen opgevangen worden om eventuele verliezen van analyten te detecteren.
Het is de bedoeling een zo hoog mogelijk extractierendement te bekomen in een zo klein
mogelijk elutievolume.
2.3. OPTIMALISATIE SPE-PROCEDURE VOOR PLASMASTALEN
Na het opstellen van een procedure voor waterstalen, moet deze uitgetest en
geoptimaliseerd worden voor plasmastalen. Zeer belangrijk hierbij is de volledige opzuivering
van het staal, zodat geen storende plasmacomponenten aanwezig zijn in de eluaten, zonder dat
er verlies optreedt van de doelanalyten. Ook hier is het de bedoeling een maximaal
extractierendement te bekomen in een minimaal elutievolume.
17
3. MATERIAAL EN METHODEN
3.1. EXTRACTIE
Reagentia en hulpstoffen:
− Blanco plasma verkregen van het bloedtransfusiecentrum in Gent
− Adrenaline van Sigma (Sigma-Aldrich) (Bornem, België)
− Noradrenaline van Fluka (Sigma-Aldrich) (Bornem, België)
− Norphenylephrine (Interne standaard (IS)) van Aldrich (Sigma-Aldrich) (Bornem,
België)
− Zoutzuur-oplossing (HCl, 37%) van Acros Organics (Geel, België)
− Methanol (MeOH) (geschikt voor LC) van Biosolve (Valkenswaard, Nederland)
− HPLC-water
− 2-mercapto-ethanol van Fluka Biochemika (Sigma-Aldrich) (Bornem, België)
− Oplosmiddel voor stockoplossingen (50/50 0,1 M HCl/MeOH + 70 µl/l puur
2-mercapto-ethanol)
− Stockoplossing van adrenaline (1,00 mg/ml)
− Stockoplossing van noradrenaline (1,00 mg/ml)
− Stockoplossing van norphenylephrine (1,00 mg/ml)
− Ammoniumacetaat van Aldrich (Sigma-Aldrich) (Bornem, België)
− Mierenzuur (formic acid, FA) (geschikt voor ULC/MS) van Biosolve (Valkenswaard,
Nederland)
− Natriumhydroxide van Merck (Overijse, België)
− Ammoniak-oplossing (NH3, 25%) van Merck (Overijse, België)
− Ammoniumformiaat van Aldrich (Sigma-Aldrich) (Bornem, België)
− Trimethylchlorosilaan (TMCS) van Fluka (Sigma-Aldrich) (Bornem, België)
− Tolueen van Janssen Chimica (Beerse, België)
− Acetonitrile van Biosolve (Valkenswaard, Nederland)
− Gedenatureerde ethanol van Fiers (Kuurne, België)
18
Toestellen en hulpmiddelen:
− Vac-Elut van Analytichem International (Harbor City, Californië, USA) voor SPE
− 735 Sampler Software van Gilson International (Rijswijk, Nederland)
− Discovery® DSC-18 SPE-kolommetjes 100 mg/1 ml van Supelco (Sigma-Aldrich)
(Bornem, België)
− Oasis® HLB SPE-kolommetjes 60 mg/3 ml van Waters (Manchester, UK)
− Oasis® WCX SPE-kolommetjes 30 mg/1 ml van Waters (Manchester, UK)
− Strata™-X-CW SPE-kolommetjes 30 mg/1 ml van Phenomenex (Utrecht, Nederland)
− Discovery® DSC-MCAX SPE-kolommetjes 100 mg/1 ml van Supelco (Sigma-
Aldrich) (Bornem, België)
− Discovery® DSC-WCX SPE-kolommetjes 100 mg/1 ml van Supelco (Sigma-Aldrich)
(Bornem, België)
− Discovery® DSC-SCX SPE-kolommetjes 500 mg/3 ml van Supelco (Sigma-Aldrich)
(Bornem, België)
− Synergy 185 van Millipore (Brussel, België) voor HPLC-water
− pH-papier van Merck (Overijse, België)
Bij het werken met plasma moeten steeds handschoenen gedragen worden om
contaminatie van de manipulator naar het plasma (en omgekeerd) te vermijden. Het plasma
wordt bewaard bij -20°C en ontdooid net voor gebruik.
Uit de stockoplossingen van adrenaline en noradrenaline worden twee
tussenverdunningen gemaakt in MeOH, zodat de stockoplossing uiteindelijk 1 op 1000
verdund wordt:
− tussenverdunning 1 (10 µg/ml):
100 µl stockoplossing + 9,9 ml MeOH (verdunning 1/100)
− tussenverdunning 2 (1 µg/ml):
1 ml tussenverdunning 1 + 9 ml MeOH (verdunning 1/10)
Uit de stockoplossing van norphenylephrine worden ook twee tussenverdunningen
gemaakt in MeOH, zodat de stockoplossing uiteindelijk 1 op 500 verdund wordt:
19
− tussenverdunning 1 (10 µg/ml):
100 µl stockoplossing + 9,9 ml MeOH (verdunning 1/100)
− tussenverdunning 2 (2 µg/ml):
2 ml tussenverdunning 1 + 8 ml MeOH (verdunning 1/5)
Door toevoeging van 2-mercapto-ethanol aan het oplosmiddel voor de
stockoplossingen (50/50 0,1 M HCl/MeOH + 70 µl/l puur 2-mercapto-ethanol), wordt
oxidatie van de opgeloste componenten (gedeeltelijk) tegengegaan. De tussenverdunningen
kunnen echter niet in dit oplosmiddel aangemaakt worden, omdat de pH van gespiked plasma
dan te zuur is (2 à 3) om de SPE-procedure te kunnen uitvoeren. Daarom worden de
tussenverdunningen in MeOH aangemaakt. Zowel de stockoplossingen als de
tussenverdunningen moeten koel en donker (in flesjes van bruin glas) bewaard worden om
degradatie van de opgeloste componenten zoveel mogelijk te voorkomen.
Er worden verschillende SPE-kolommetjes uitgeprobeerd. De Discovery® DSC-18 en
de Oasis® HLB kolommetjes hebben een omkeerfase pakking. De Discovery® DSC-WCX
kolommetjes bevatten een 'weak' kationuitwisselingspakking; de Discovery® DSC-SCX
daarentegen is een 'strong' kationuitwisselingskolommetje. De Oasis® WCX en de
Strata™-X-CW kolommetjes hebben een pakking met omkeerfase- en met 'weak'
kationuitwisselingseigenschappen. Bij de Discovery® DSC-MCAX kolommetjes treedt
retentie op door een combinatie van een omkeerfase- en 'strong' kationuitwisselingspakking.
Bij elke kolom moet een andere standaardprocedure gevolgd worden (Tabel 3.1, 3.2 en 3.3).
TABEL 3.1: STANDAARDPROCEDURE VOOR DISCOVERY® DSC-18 EN OASIS®
HLB SPE-KOLOMMETJES.
Discovery® DSC-18
Oasis® HLB
ConditionerenEquilibreren
1 ml MeOH1 ml H2O
2 ml MeOH2 ml H2O
Staal opbrengen 1 ml 1 ml, op pH 3 gebracht met 0,1 M
HCl in H2O
Wassen • 1 ml H2O• 1 ml 20/80 MeOH/H2O
2 x 1 ml 5/95 MeOH/H2O
Elueren 2 x 500 µl 60/40 MeOH/H2O + 0,1% FA 2 x 500 µl 100% MeOH
20
TABEL 3.2: STANDAARDPROCEDURE VOOR DISCOVERY® DSC-WCX EN
DISCOVERY® DSC-SCX SPE-KOLOMMETJES.
Discovery® DSC-WCX Discovery® DSC-SCXConditionerenEquilibreren
500 µl 0,5 M HCl in H2O1 ml H2O
2 ml MeOH2 ml H2O
Staal opbrengen 1 ml 1 ml, ½ verdund met
ammoniumformiaat pH 3
Wassen • 1 ml H2O• 1 ml H2O
• 1 ml ammoniumformiaat pH 3• 1 ml 1 M azijnzuur• 1 ml 100% MeOH
Elueren 4 x 250 µl 0,1 M FA 2 x 500 µl 2-5% NH4OH in MeOH
TABEL 3.3: STANDAARDPROCEDURE VOOR OASIS® WCX, STRATATM-X-CW EN
DISCOVERY® DSC-MCAX SPE-KOLOMMETJES.
Oasis® WCX Strata™-X-CW Discovery® DSC-MCAXConditionerenEquilibreren
1 ml MeOH1 ml H2O
1 ml MeOH1 ml H2O
500 µl 0,5 M HCl in H2O1 ml H2O
Staal opbrengen 1 ml 1 ml 1 ml
Wassen
• 1 ml 5% NH4OH• 1 ml 100% MeOH• 1 ml 25/75 MeOH/
H2O + 2% FA
• 1 ml 25 mM ammoniumacetaat (pH 6,5)
• 1 ml 100% MeOH
• 1 ml H2O• 1 ml H2O
Elueren 2 x 500 µl 75/25 MeOH/H2O + 2% FA
2 x 500 µl 2% FA in MeOH 4 x 250 µl 0,1 M FA
Eerst worden de kolommetjes manueel getest met waterstalen, zodat de opbrengstap
en wasstappen afzonderlijk kunnen opgevangen en geïnjecteerd worden. Daarna worden de
kolommetjes getest met plasmastalen. Voor de opbrengstap worden oplossingen bereid van
adrenaline en noradrenaline (10 ng/ml) en van de IS (20 ng/ml):
− vooraf gespiked H 2O:
9,7 ml H2O + 100 µl tussenverdunning 2 (1 µg/ml) van noradrenaline
+ 100 µl tussenverdunning 2 (1 µg/ml) van adrenaline
+ 100 µl tussenverdunning 2 (2 µg/ml) van norphenylephrine
21
− vooraf gespiked plasma :
9,7 ml plasma + 100 µl tussenverdunning 2 (1 µg/ml) van noradrenaline
+ 100 µl tussenverdunning 2 (1 µg/ml) van adrenaline
+ 100 µl tussenverdunning 2 (2 µg/ml) van norphenylephrine
Er wordt telkens 500 µl staal op een SPE-kolommetje gebracht. Bij de waterstalen
wordt hier op voorhand 500 µl H2O aan toegevoegd, bij de plasmastalen is dit 1 ml (anders is
een plasmastaal te viskeus om op een SPE-kolommetje te brengen). Hiermee moet geen
rekening gehouden worden wanneer er afgeëlueerd wordt in een volume van 500 µl.
Om de compatibiliteit van de elutievloeistoffen van de verschillende SPE-kolommetjes
met het chromatografisch en detectiesysteem na te gaan, worden een oplossing (mix)
aangemaakt van adrenaline en noradrenaline (10 ng/ml) en van de IS (20 ng/ml) in de
verschillende SPE-elutievloeistoffen. Na injectie en analyse wordt een chromatogram
bekomen, waarvan de piekoppervlakten gebruikt worden om het rendement te bepalen van de
extractieprocedure bij waterstalen.
Om uiteindelijk het rendement te kunnen bepalen van de extractieprocedure bij
plasmastalen, wordt een blanco plasmastaal aan dezelfde SPE-procedure onderworpen als een
vooraf gespiked plasmastaal (adrenaline en noradrenaline (10 ng/ml) en IS (20 ng/ml)). De
eluaten van het blanco plasmastaal worden dan in dezelfde concentraties gespiked met de
analyten. De piekoppervlakten hiervan worden dan vergeleken met de piekoppervlakten van
de eluaten van het vooraf gespiked plasmastaal, om zo het rendement te bepalen.
Sommige producenten (onder andere Sigma-Aldrich) raden aan gesilyleerde
proefbuizen te gebruiken voor het opvangen van de eluaten van de SPE-procedure, omdat
CA's binden aan onbehandeld borosilicaat-glas (Application Supelco, Note 66). Om te testen
of dit wel noodzakelijk is, wordt vooraf gespiked H2O in behandelde en onbehandelde
proefbuizen gegoten en geanalyseerd. Silyleren gebeurt met een 5% trimethylchlorosilaan-
oplossing in tolueen, die in de proefbuis wordt gegoten. Na één nacht wordt de proefbuis
leeggegoten en gespoeld met gedenatureerde ethanol.
22
3.2. CHROMATOGRAFIE
Reagentia en hulpstoffen:
− Ammoniumformiaat van Aldrich (Sigma-Aldrich) (Bornem, België)
− Mierenzuur (formic acid, FA) (geschikt voor ULC/MS) van Biosolve (Valkenswaard,
Nederland)
− 25 mM ammoniumformiaat op pH 3 gebracht met puur mierenzuur (eluens A)
− Methanol (geschikt voor LC) van Biosolve (Valkenswaard, Nederland)
− HPLC-water
Toestellen en hulpmiddelen:
− Agilent 1100 Series Capillary Pump van Agilent Technologies (Santa Clara,
Californië, USA)
− Chemstation A.10.02 [1757] for LC (software) van Agilent Technologies (Santa Clara,
Californië, USA)
− Discovery® HS F5 HPLC-kolom (50 mm x 2,1 mm, 3 µm) van Supelco (Sigma-
Aldrich) (Bornem, België)
− All-Guard™ Cartridge Alltima™ C18 Guard pre-kolom (7,5 x 2,1 mm, 5 µm) van
Alltech® (Lokeren, België)
− Synergy 185 van Millipore (Brussel, België) voor HPLC-water
− Consort C831 Multi-Parameter Benchtop Meter van Labcor (Turnhout, België)
− Magnetische roerder 851 ECO_MAG_STIR van Labinco (Breda, Nederland)
− Nylon Filter Membrane (47 mm Ø; 0,2 µm poriëngrootte) van Grace (Deerfield,
Illinois, USA) voor het filtreren van eluens A
De componenten worden gescheiden volgens het HILIC-mechanisme. Daarvoor wordt
een HILIC-kolom gebruikt met een silica pentafluorofenylpropyl-pakking (zie Figuur 3.1.).
De kolom kan ook als omkeerfase-kolom gebruikt worden, afhankelijk van de samenstelling
van de mobiele fase. Ze kan gebruikt worden in een pH-gebied van 2 tot 8. Ze is endcapped,
zodat er geen interactie kan optreden met vrije silanolgroepen. Voor de HILIC-kolom zit een
23
C18-pre-kolom, om eventuele onzuiverheden of storende componenten op te vangen. Zo
komen die niet op de HILIC-kolom terecht, waardoor de levensduur van de kolom stijgt.
FIGUUR 3.1.: SILICA PENTAFLUOROFENYLPROPYL-PAKKING VAN DE HILIC-KOLOM.
De mobiele fase is samengesteld uit eluens A (25 mM ammoniumformiaat op pH 3
gebracht met puur mierenzuur), dat gefiltreerd wordt voor gebruik en koel en donker bewaard
moet worden, en eluens B (100% methanol). Er wordt gepompt met een stroomsnelheid van
100 µl/min. Er wordt gewerkt met een gradiënt (zie Tabel 3.4), waarbij 1 minuut gepompt
wordt met een hoger percentage waterige fase. Dit maakt de pakking van de kolom volledig
vrij van ongewenste componenten (afkomstig van plasma) die ongewild weerhouden worden,
zodat er geen storing optreedt in volgende runs.
TABEL 3.4: SAMENSTELLING VAN DE MOBIELE FASE (GRADIËNT).
Tijd % B Stroomsnelheid (µl/min)1 0,0 81,0 1002 4,9 81,0 1003 5,0 60,0 1004 5,9 60,0 1005 6,0 81,0 1006 15,0 81,0 100
Er wordt telkens 20,0 µl staal geïnjecteerd. Acetonitrile dient als wasvloeistof voor de
injectienaald. De scheiding gaat door bij een constante temperatuur van 25°C. Eén run duurt
15 minuten, waarvan 9 minuten equilibratietijd. Noradrenaline elueert eerst af, daarna volgen
adrenaline en de IS.
24
3.3. MASSA-ANALYSE EN DETECTIE
Toestellen en hulpmiddelen:
− Quattro Ultima™ Electrospray Ionization (ESI) MS/MS van Micromass® Waters
(Manchester, UK)
− Masslynx™ 4.0 software van Micromass® Waters (Manchester, UK)
Er wordt gewerkt in de positieve electrospray ionisatie-modus. Het MS-toestel staat
ingesteld in de Multiple Reaction Monitoring-modus (MRM), waarbij slechts enkele
productionen geanalyseerd en gedetecteerd worden. Hun m/z-waarden zijn terug te vinden in
Tabel 3.5, samen met andere parameters voor de MS/MS-detectie. De productionen met
m/z-waarden (153,8 >) 135,7; (169,9 >) 151,7 en (183,9 >) 165,9 worden gebruikt voor
kwantificatie (Figuur 3.2.), de productionen met m/z-waarden (153,8 >) 118,8; (169,9 >)
134,7 en (183,9 >) 150,9 worden gebruikt voor kwalificatie (Figuur 3.3.). De totale
analysetijd bedraagt 10 minuten. Iedere transitie wordt gedurende die volledige tijd
geanalyseerd. Via integratie kan van iedere piek de piekoppervlakte bepaald worden.
Instellingen van de bron en analyser zijn terug te vinden in Tabel 3.6.
FIGUUR 3.2.: CHROMATOGRAM PRODUCTIONEN VOOR KWANTIFICATIE.
25
FIGUUR 3.3.: CHROMATOGRAM PRODUCTIONEN VOOR KWALIFICATIE.
TABEL 3.5: PARAMETERS VOOR DE MASSASPECTROMETER.
Component m/z precursorion
m/z production
Cone-spanning (V)
Collision-energie (eV)
Norphenylephrine153,80 118,80
11,00 10,00153,80 135,70
Noradrenaline169,90 134,70
11,00 8,00169,90 151,70
Adrenaline183,90 150,90
11,00 10,00183,90 165,90
TABEL 3.6: INSTELLINGEN VAN DE BRON (IONISATIE) EN VAN DE ANALYSER.
Bron (ionisatie) AnalyserCapillair (kV) 2,40 LM resolutie 1 12,0
Cone (V) 11 HM resolutie 1 12,0Hex 1 (V) 20,0 Ion energie 1 1,0
Aperture (Opening ((V) 0,0 Entrance (Ingang) -2Hex 2 (V) 1,0 Collision 2
Temperatuur bron (°C) 100 Exit (Uitgang) 1,0Temperatuur desolvatiegas (°C) 250 LM resolutie 2 12,0
Debiet conegas (l/u) 155 HM resolutie 2 12,0Debiet desolvatiegas (l/u) 584 Ion energie 2 2,0
Multiplier (V) 670Collision Cell (Druk botsingsgas) (mbar) 2,58e-3
26
4. RESULTATEN EN DISCUSSIE
4.1. GESILYLEERDE PROEFBUIZEN
Om te testen of het noodzakelijk is om gesilyleerde proefbuizen te gebruiken voor het
opvangen van de eluaten van de SPE-kolommetjes, worden twee oplossingen gemaakt van
adrenaline en noradrenaline (10 ng/ml) en van de IS (20 ng/ml). De ene oplossing wordt
aangemaakt in H2O, de andere in 60/40 MeOH/H2O + 0,1% FA (= elutievloeistof van de
Discovery® DSC-18 SPE-kolom). De beide mengsels worden in een onbehandelde en een
behandelde proefbuis gegoten, zodat uiteindelijk vier verschillende proefbuizen bekomen
worden.
Er wordt onmiddellijk een analyse uitgevoerd met een deel van de oplossing uit de
vier proefbuizen. Daarna worden dezelfde proefbuizen afgedekt en in de koelkast geplaatst
om een volledig weekend te blijven staan. Zo kan ook de invloed van de tijd bepaald worden.
Na het weekend worden deze oplossingen ook geanalyseerd.
Bij de oplossingen die onmiddellijk geanalyseerd worden, is er geen opvallend
verschil tussen de piekoppervlakten van de oplossingen in onbehandelde en behandelde
proefbuizen, zowel bij de oplossing in water als in 60/40 MeOH/H2O + 0,1% FA. Hieruit kan
dus afgeleid worden dat CA's op korte tijd niet reageren met onbehandeld borosilicaat-glas.
Het is dus niet nodig om met gesilyleerde proefbuizen te werken wanneer eluaten van de SPE-
kolommetjes vrij snel na de extractieprocedure geanalyseerd worden.
Ook bij de oplossingen die pas geanalyseerd worden na het weekend is er geen
opvallend verschil te detecteren tussen de piekoppervlakten van de oplossingen in
onbehandelde en behandelde proefbuizen, zowel bij de oplossing in water als in
60/40 MeOH/H2O + 0,1% FA. Na een langere tijd reageren CA's dus ook niet
noemenswaardig met onbehandeld borosilicaat-glas. De volgende experimenten worden
bijgevolg uitgevoerd met onbehandelde proefbuizen.
27
4.2. KEUZE SPE-KOLOM
Er worden verschillende SPE-kolommetjes uitgeprobeerd voor de extractie van CA's
uit een staal. De kolommetjes worden getest met een waterstaal.
4.2.1. Omkeerfase SPE
Zowel de Discovery® DSC-18 als de Oasis® HLB SPE-kolommen worden getest.
Vroegere experimenten werden al uitgevoerd met de Discovery® DSC-18 SPE-kolom, maar
het elutievolume was daarbij te groot (1 ml). Door aanpassingen van de wasstap (10/90
MeOH/H2O) of van de pH van het staal (pH 3 of pH 12) kan het rendement niet verhoogd
worden.
Met de standaardprocedure op de Oasis® HLB SPE-kolom gaat een groot deel van het
analyt al verloren in de opbrengstap: de componenten worden dus onvoldoende weerhouden
op de pakking van de kolom. Bovendien is de elutievloeistof (100% MeOH) niet echt
compatibel met het chromatografisch en detectiesysteem. Wanneer het staal niet meer
aangezuurd wordt en er afgeëlueerd wordt met 80/20 MeOH/H2O + 0,1% FA (mierenzuur
bevordert de ionisatie), worden betere chromatogrammen bekomen, maar het rendement blijft
onvoldoende. Na aanpassen van de pH van het staal (pH 5 à 6 of pH 12), wordt ook
onvoldoende rendement bekomen. Tenslotte wordt er geprobeerd om te elueren met 60/40
MeOH/H2O + 0,1% FA, maar dit geeft geen betere resultaten.
4.2.2. 'Weak' kationuitwisseling en 'strong' kationuitwisseling
Met de standaardprocedure van de Discovery® DSC-WCX SPE-kolom kunnen geen
pieken waargenomen worden in het chromatogram. Na aanpassen van de conditioneringsstap
(0,1 M HCl) en de elutiestap (60/40 MeOH/H2O + 0,1% FA) is er nog steeds niets waar te
nemen. Conditioneren met MeOH helpt ook niet.
28
Volgens het protocol van de Discovery® DSC-SCX SPE-kolommetjes moet er
alkalisch afgeëlueerd worden. Een probleem echter is dat de analyten afbreken in alkalisch
milieu.
4.2.3. Gemengde pakking
Bij de Discovery® DSC-MCAX SPE-kolom geeft de standaardprocedure een redelijk
goed resultaat en het elutievolume bedraagt 500 µl. Het rendement is echter nog te laag en een
groot deel van de analyten gaat al verloren in de opbrengstap en de wasstap. Conditioneren
met MeOH in plaats van met zuur of elueren met 60/40 MeOH/H2O + 0,1% FA geeft geen
betere resultaten.
Via de standaardprocedure van de Strata™-X-CW kolommetjes worden geen goede
resultaten bekomen. Wanneer meer mierenzuur (50/50 MeOH/H2O + 4% FA) toegevoegd
wordt aan de elutievloeistof, wordt bij waterstalen een behoorlijk rendement bekomen. Het
feit dat de componenten beter afgeëlueerd worden door deze elutievloeistof, is te verklaren
doordat er meer kationen (H+) op de pakking gebracht worden, die de gebonden analyten gaan
verdringen. Het elutievolume bedraagt 500 µl.
Ook bij de Oasis® WCX SPE-kolom zijn de resultaten met de standaardprocedure niet
voldoende. Wanneer ook hier meer mierenzuur aan de elutievloeistof wordt toegevoegd,
wordt bij waterstalen een aanvaardbaar rendement bekomen, om dezelfde reden als bij de
Strata™-X-CW kolom. Het elutievolume bedraagt ook hier 500 µl. Het chromatogram,
bekomen na injectie van het eluaat, wordt weergegeven in Figuur 4.1.
29
FIGUUR 4.1.: CHROMATOGRAM ELUAAT OASIS® WCX WATERSTAAL
(50/50 MeOH/H2O + 4% FA ALS ELUTIEVLOEISTOF) .
4.2.4. Besluit
Met de Oasis® WCX SPE-kolommetjes wordt het beste rendement bekomen bij
waterstalen en het elutievolume bedraagt 500 µl. Daarom worden de volgende
extractieprocedures met deze kolommetjes uitgevoerd. De Oasis® WCX kolom heeft een
polymere pakking met omkeerfase-eigenschappen en 'weak' kationuitwisselings-
eigenschappen. De carboxylgroep op de pakking heeft een pKa van ongeveer 5. Het volume
van een kolommetje bedraagt 1 ml en de pakking weegt 30 mg; het zijn dus kleine
kolommetjes om het elutievolume ook zo klein mogelijk te kunnen houden. De structuur van
de functionele groepen op de pakking wordt weergegeven in Figuur 4.2.
FIGUUR 4.2.: FUNCTIONELE GROEPEN OP DE PAKKING VAN OASIS® WCX SPE-KOLOM.
(www.waters.com)
30
4.3. OPTIMALISATIE SPE-PROCEDURE OASIS® WCX VOOR WATERSTALEN
Om een optimale SPE-procedure te bekomen, wordt de standaardprocedure van het
Oasis® WCX kolommetje zo goed mogelijk gevolgd. Eerst worden er testen uitgevoerd op
waterstalen: zo kunnen de laadstap en wasstappen afzonderlijk opgevangen en geïnjecteerd
worden om eventuele verliezen te detecteren. Bij plasmastalen is dit niet mogelijk, omdat
deze stappen nog niet voldoende zuiver zijn om te injecteren. De eluaten worden opgevangen
en geïnjecteerd. Om het rendement van de SPE-procedure te bepalen worden oplossingen
(mix) bereid van adrenaline en noradrenaline (10 ng/ml) en de interne standaard (20 ng/ml) in
de overeenkomstige SPE-elutievloeistof. De piekoppervlakten, bekomen na injectie van deze
oplossingen, worden vergeleken met de piekoppervlakten, bekomen na injectie van de
eluaten, om zo het rendement te bepalen.
4.3.1. Elutiestap
Eerst wordt er geprobeerd om de elutiestap te optimaliseren. Na conditionering (1 ml
MeOH) en equilibratie (1 ml H2O) van de kolom volgt de opbrengstap (500 µl staal + 500 µl
H2O), waarna rechtstreeks overgegaan wordt naar de elutiestap. Er wordt afgeëlueerd in
2 x 500 µl: er zijn dus twee eluaten, die apart geïnjecteerd worden. Hierbij worden
verschillende elutievloeistoffen getest met wisselende hoeveelheden MeOH, H2O en FA:
1) 50/50 MeOH/H2O + 4% FA 4) 50/50 MeOH/H2O + 2% FA
2) 80/20 MeOH/H2O + 4% FA 5) 80/20 MeOH/H2O + 2% FA
3) 20/80 MeOH/H2O + 4% FA 6) 20/80 MeOH/H2O + 2% FA
De opbrengstap wordt telkens opgevangen en geïnjecteerd: er wordt hierin geen
enkele keer een verlies waargenomen, waaruit kan afgeleid worden dat de analyten goed
weerhouden worden op de pakking. De tweede eluaatstap wordt ook geïnjecteerd: bij alle
elutievloeistoffen worden hierin ook pieken voor de analyten waargenomen. De analyten
worden dus niet volledig afgeëlueerd in 500 µl. De piekoppervlakten, bekomen na manuele
integratie bij eluaat 1 & 2 en de mix, alsook de rendementen, worden weergegeven in
Tabel 4.1.
31
TABEL 4.1: PIEKOPPERVLAKTEN EN RENDEMENTEN BIJ VERSCHILLENDE
ELUTIEVLOEISTOFFEN.
EluensPiekoppervlakte Rendement (%)
IS Noradre-naline
Adre-naline IS Noradre-
nalineAdre-naline
1a
Eluaat 1 11173 1768 18901 Eluaat 1 51,76 19,54 27,65Eluaat 2 2359 393 2908
Eluaat 2 10,93 4,35 4,25Mix 21585 9044 68351
2b
Eluaat 1 10584 2592 17467 Eluaat 1 47,15 20,26 19,55Eluaat 2 784 375 1785
Eluaat 2 3,49 2,93 2,00Mix 22449 12794 89365
3c
Eluaat 1 10166 1554 18428 Eluaat 1 27,87 27,38 23,08Eluaat 2 1035 0 911
Eluaat 2 2,84 0 1,14Mix 36470 5676 79840
4d
Eluaat 1 10315 2186 18215 Eluaat 1 49,74 19,76 23,90Eluaat 2 0 0 0
Eluaat 2 0 0 0Mix 20739 11065 76210
5e
Eluaat 1 13322 5398 33468 Eluaat 1 38,34 44,25 42,55Eluaat 2 927 307 2466
Eluaat 2 2,67 2,52 3,14Mix 34749 12198 78655
6f
Eluaat 1 8644 1430 15111 Eluaat 1 58,61 34,42 31,09Eluaat 2 1049 208 811
Eluaat 2 7,11 5,01 1,67Mix 14749 4155 48611a 50/50 MeOH/H2O + 4% FA d 50/50 MeOH/H2O + 2% FAb 80/20 MeOH/H2O + 4% FA e 80/20 MeOH/H2O + 2% FAc 20/80 MeOH/H2O + 4% FA f 20/80 MeOH/H2O + 2% FA
Uit deze tabel kan geconcludeerd worden dat met 80/20 MeOH/H2O + 2% FA het
beste rendement bekomen wordt in eluaat 1. Ook de piekoppervlakten bekomen met de mix
zijn voldoende hoog. Met deze elutievloeistof worden betere resultaten bekomen dan met
50/50 MeOH/H2O + 4% FA (zie p. 29). De volgende testen worden bijgevolg uitgevoerd met
80/20 MeOH/H2O + 2% FA als elutievloeistof. De chromatogrammen van eluaat 1 en van de
mix zijn terug te vinden in Figuur 4.3. en Figuur 4.4.
32
FIGUUR 4.3.: CHROMATOGRAM ELUAAT 1 WATERSTAAL
(80/20 MeOH/H2O + 2% FA ALS ELUTIEVLOEISTOF).
FIGUUR 4.4.: CHROMATOGRAM MIX IN 80/20 MeOH/H2O + 2% FA.
4.3.2. Wasstappen
De volgende stap is het invoeren van wasstappen. Hierbij mag er geen verlies optreden
van de analyten op de pakking. Om dit te controleren worden de wasstappen opgevangen en
geanalyseerd. Als eerste wordt er een wasstap met 1 ml 100% H2O ingevoerd. Deze wasstap
heeft uiteindelijk als bedoeling zoveel mogelijk wateroplosbare componenten, die aanwezig
zijn in plasma en aspecifiek interageren met de pakking, weg te wassen.
33
− conditionering: 1 ml MeOH− equilibratie: 1 ml H2O− staalopbreng: 500 µl staal + 500 µl H2O− wasstap: 1 ml 100% H2O− afelueren: 2 x 500 µl 80/20 MeOH/H2O + 2% FA
Er wordt geen verlies gedetecteerd in de wasstap en het rendement blijft ongeveer
gelijk. Deze wasstap wordt dus behouden. Volgens de standaardprocedure van het Oasis®
WCX SPE-kolommetje moet er een basische wasstap ingevoerd worden met als doel zuren
die aanwezig zijn in plasma weg te wassen. In de standaardprocedure wordt er gewerkt met
5% NH4OH. Dit is echter te sterk alkalisch (pH 10): bij deze pH zal noradrenaline grotendeels
ongeladen zijn en dus niet meer op de pakking weerhouden worden via ionaire interacties. Er
moet dus een oplossing aangemaakt worden die zeer licht alkalisch is, met een pH van 7 à 8.
Hiervoor wordt 0,0025% NH4OH gebruikt. De procedure ziet er nu dus uit als volgt:
− conditionering: 1 ml MeOH− equilibratie: 1 ml H2O− staalopbreng: 500 µl staal + 500 µl H2O− wasstap 1: 1 ml 100% H2O− wasstap 2: 1 ml 0,0025% NH4OH− afelueren: 2 x 500 µl 80/20 MeOH/H2O + 2% FA
Deze procedure levert een slechter rendement op, hoewel er in wasstap 2 geen
merkbaren verliezen te detecteren zijn. Waarschijnlijk is er nog een te grote fractie NH4OH
aanwezig in het eluaat, waardoor de ionisatie van de analyten anders verloopt. Er wordt
bijgevolg geprobeerd een derde wasstap in te voeren met 1 ml 100% MeOH, om neutrale
componenten, die enkel door RP-interacties worden weerhouden op de pakking, weg te
spoelen. Het chromatogram van eluaat 1 wordt weergegeven in Figuur 4.5.
− conditionering: 1 ml MeOH− equilibratie: 1 ml H2O− staalopbreng: 500 µl staal + 500 µl H2O− wasstap 1: 1 ml 100% H2O− wasstap 2: 1 ml 0,0025% NH4OH− wasstap 3: 1 ml 100% MeOH− afelueren: 2 x 500 µl 80/20 MeOH/H2O + 2% FA
34
FIGUUR 4.5.: CHROMATOGRAM ELUAAT 1 WATERSTAAL
(3 WASSTAPPEN EN 80/20 MeOH/H2O + 2% FA ALS ELUTIEVLOEISTOF).
Er wordt geen verlies van analyten gedetecteerd in de derde wasstap: hoewel de RP-
interactie van de analyten met de pakking doorbroken is, worden ze toch weerhouden op de
pakking door middel van ionaire interacties. Met deze procedure wordt een bruikbaar
rendement bekomen (53,27% voor IS; 30,23% voor noradrenaline; 24,78% voor adrenaline)
in eluaat 1, maar een grote fractie van de analyten is terug te vinden in eluaat 2. Om het
elutievolume tot 500 µl te brengen, worden opnieuw verschillende elutievloeistoffen uitgetest,
met behoud van de drie wasstappen. De oplossingen die worden getest zijn:
1) 80/20 MeOH/H2O + 2% FA 5) 50/50 MeOH/H2O + 2% FA
2) 80/20 MeOH/H2O + 4% FA 6) 50/50 MeOH/H2O + 4% FA
3) 80/20 MeOH/H2O + 6% FA 7) 50/50 MeOH/H2O + 6% FA
4) 80/20 MeOH/H2O + 8% FA
Er worden geen testen uitgevoerd met oplossingen met 20/80 MeOH/H2O, omdat
hierin geen goede ionisatie van de analyten optreedt. De piekoppervlakten voor eluaat 1 en de
mix, samen met de rendementen, worden weergegeven in Tabel 4.2.
35
TABEL 4.2: PIEKOPPERVLAKTEN EN RENDEMENTEN BIJ VERSCHILLENDE
ELUTIEVLOEISTOFFEN.
EluensPiekoppervlakte Rendement (%)
IS Noradre-naline
Adre-naline IS Noradre-
nalineAdre-naline
1a
Eluaat 1 13062 2917 15140 Eluaat 1 46,17 23,01 20,59Eluaat 2 4347 1110 5794
Eluaat 2 15,37 8,75 7,88Mix 28290 12679 73517
2b
Eluaat 1 19121 3964 20402 Eluaat 1 93,41 28,88 24,23Eluaat 2 4138 1432 6054
Eluaat 2 20,21 10,43 7,19Mix 20470 13725 84197
3c
Eluaat 1 23323 6502 28295 Eluaat 1 68,85 56,94 34,60Eluaat 2 4391 1568 6985
Eluaat 2 12,96 13,73 8,54Mix 33874 11420 81768
4d
Eluaat 1 8017 1838 11202 Eluaat 1 23,66 59,68 20,39Eluaat 2 5092 166 3757
Eluaat 2 15,03 5,39 6,84Mix 33881 3080 54950
5e
Eluaat 1 10861 4219 21177 Eluaat 1 39,89 38,76 24,97Eluaat 2 2103 978 5039
Eluaat 2 7,72 8,98 5,94Mix 27229 10886 84794
6f
Eluaat 1 10201 3549 19377 Eluaat 1 48,28 51,61 28,44Eluaat 2 1266 505 2283
Eluaat 2 5,99 7,34 3,35Mix 21128 6876 68137
7g
Eluaat 1 10443 2359 16019 Eluaat 1 35,44 51,74 25,46Eluaat 2 4916 44 3675
Eluaat 2 16,68 0,97 5,84Mix 29466 4559 62913A 80/20 MeOH/H2O + 2% FA e 50/50 MeOH/H2O + 2% FAb 80/20 MeOH/H2O + 4% FA f 50/50 MeOH/H2O + 4% FA c 80/20 MeOH/H2O + 6% FA g 50/50 MeOH/H2O + 6% FAd 80/20 MeOH/H2O + 8% FA
36
Met de oplossing met 8% FA worden geen goede chromatogrammen bekomen: het
gehalte aan FA is te hoog. Bij de oplossingen met 2% FA is er nog een grote fractie van
analyten aanwezig in eluaat 2: het elutievolume bedraagt dus meer dan 500 µl. Voor de
elutievloeistoffen die 4% FA bevatten geldt dit ook, hoewel de fractie van analyten in eluaat 2
al kleiner is. Die fractie is nog kleiner in de oplossingen met 6% FA, zodat er kan gesteld
worden dat de analyten beter afelueren wanneer grotere hoeveelheden FA aanwezig zijn in de
elutievloeistof. Dit kan verklaard worden doordat er meer kationen (H+ afkomstig van FA) op
de pakking gebracht worden, die de gebonden analyten gaan verdringen. Hoe meer kationen
aanwezig in de elutievloeistof, hoe vlotter de gebonden analyten verdrongen worden. Deze
theorie is echter in tegenspraak met de bevinding dat betere resultaten bekomen worden met
80/20 MeOH/H2O + 2% FA als elutievloeistof dan met 50/50 MeOH/H2O + 4% FA
(zie p. 31). Dit kan misschien verklaard worden door het invoeren van de wasstappen of door
de verschillende verhouding MeOH/H2O in de elutievloeistoffen. Uiteindelijk wordt er
geopteerd voor 80/20 MeOH/H2O + 6% FA, omdat hiermee betere chromatogrammen
bekomen worden dan met 50/50 MeOH/H2O + 6% FA. De chromatogrammen van eluaat 1 en
van de mix worden weergegeven in Figuur 4.6. en Figuur 4.7.
FIGUUR 4.6.: CHROMATOGRAM ELUAAT 1 WATERSTAAL
(3 WASSTAPPEN EN 80/20 MeOH/H2O + 6% FA ALS ELUTIEVLOEISTOF).
37
FIGUUR 4.7.: CHROMATOGRAM MIX IN 80/20 MeOH/H2O + 6% FA.
De SPE-procedure ziet er tot nu toe als volgt uit:
− conditionering: 1 ml MeOH− equilibratie: 1 ml H2O− staalopbreng: 500 µl staal + 500 µl H2O− wasstap 1: 1 ml 100% H2O− wasstap 2: 1 ml 0,0025% NH4OH− wasstap 3: 1 ml 100% MeOH− afelueren: 2 x 500 µl 80/20 MeOH/H2O + 6% FA
Hiermee wordt een aanvaardbaar rendement bekomen bij waterstalen en het
elutievolume bedraagt 500 µl. De drie wasstappen zouden in principe voldoende moeten zijn
om plasmastalen op te zuiveren. In de standaardprocedure van de Oasis® WCX kolommetjes
wordt nog een zure wasstap voorzien om ionaire verbindingen, die geen RP-interactie
vertonen, van de pakking te wassen. Met een zure wasstap worden dus componenten van
plasma weggewassen die een gelijkaardige structuur hebben als de doelanalyten, maar geen
RP-interactie vertonen. De kans is echter groot dat er door deze wasstap verlies van de
doelanalyten zal optreden. Voorlopig wordt die wasstap dus nog niet ingevoerd en wordt de
bekomen SPE-procedure getest op plasmastalen.
38
4.4. OPTIMALISATIE SPE-PROCEDURE OASIS® WCX VOOR PLASMASTALEN
4.4.1. Testen van de SPE-procedure op plasmastalen
Wanneer de bovenstaande procedure uitgetest wordt op plasmastalen, zijn de analyten
niet detecteerbaar in eluaat 1. De procedure is dus niet geschikt voor plasmastalen.
Een groot verschil tussen een waterstaal en een plasmastaal is de pH. Bij waterstalen
bestaat de opbrengstap uit 500 µl staal en 500 µl H2O: de pH hiervan bedraagt 5 à 6. Bij deze
pH zijn de analyten geladen en kunnen ze interageren met de ladingen van de functionele
groepen op de pakking. Bij plasmastalen bestaat de opbrengstap uit 500 µl staal en 1 ml H2O.
De pH hiervan bedraagt echter 7. Bij deze pH is vooral noradrenaline onvoldoende geladen
om ionaire interactie te vertonen met de pakking. Daarom wordt de pH van het plasmastaal
aangepast: in plaats van 1 ml H2O wordt 1 ml 0,05% FA in H2O toegevoegd aan 500 µl staal,
zodat de pH 5 à 6 bedraagt. Dit levert een chromatogram op waarop wel pieken waar te
nemen zijn voor de analyten, maar op een andere retentietijd (zie Figuur 4.8.).
FIGUUR 4.8.: CHROMATOGRAM ELUAAT 1 PLASMASTAAL
(3 WASSTAPPEN EN 80/20 MeOH/H2O + 6% FA ALS ELUTIEVLOEISTOF).
Het lijkt alsof de componenten veel minder retentie vertonen op de chromatografische
kolom. Dit is te wijten aan een onzuiver extract dat enerzijds zorgt voor een matrixeffect:
doordat het eluaat onvoldoende zuiver is, worden de pieken afkomstig van de analyten
39
onderdrukt. Anderzijds wordt een signaal verkregen dat wellicht afkomstig is van een massale
hoeveelheid onzuiverheden die ergens aselectief ionen opleveren, die in de transities een
respons veroorzaken. De 'piek' die hier gezien wordt op de foute retentietijd is dus
achtergrond (wellicht in het eluensfront). De doelanalyten worden niet meer waargenomen op
de normale retentietijd vermits ze onderdrukt worden. Als hetzelfde eluaat in een hogere
concentratie gespiked wordt met de analyten (dus na de SPE-procedure) en opnieuw
geïnjecteerd wordt, stijgen de piekoppervlakten in het chromatogram niet. Deze observatie
ondersteunt de voorgaande theorie: de piekoppervlakten stijgen niet, zelfs al zijn de analyten
in een hoger concentratie aanwezig in het eluaat. Het eluaat is dus onvoldoende zuiver om te
injecteren.
Om nogmaals te bevestigen dat het eluaat onvoldoende zuiver is, wordt een blanco
plasmastaal aan dezelfde SPE-procedure onderworpen. Het eluaat wordt dan gespiked met
adrenaline en noradrenaline (10 ng/ml) en met de IS (20 ng/ml). Normaal zouden op dit
chromatogram duidelijke pieken zichtbaar moeten zijn op de juiste retentietijd en met een
hoge piekoppervlakte voor ieder analyt. Dit is echter niet het geval (zie Figuur 4.9.): het
eluaat is onvoldoende zuiver, waardoor onderdrukking optreedt.
FIGUUR 4.9.: CHROMATOGRAM ELUAAT 1 (GESPIKED) BLANCO PLASMASTAAL
(3 WASSTAPPEN EN 80/20 MeOH/H2O + 6% FA ALS ELUTIEVLOEISTOF).
40
4.4.2. Verdere opzuivering plasmastaal
Om het plasmastaal beter te kunnen opzuiveren, wordt er geprobeerd om wasstap 3
aan te passen (2 ml 100% MeOH en 3 ml 100% MeOH), maar dit levert gelijkaardige
chromatogrammen op als in Figuur 4.8.
Er wordt een zure wasstap ingevoerd, zoals voorgesteld wordt in de
standaardprocedure. De bedoeling van deze wasstap is het verwijderen van ongewenste
componenten die een gelijkaardige structuur hebben als de doelanalyten, maar geen RP-
interacties vertonen. In deze wasstap worden dus ionaire interacties verbroken, ook die van de
doelanalyten. Die worden weerhouden op de pakking door RP-interacties.
− conditionering: 1 ml MeOH− equilibratie: 1 ml H2O− staalopbreng: 500 µl staal + 1 ml 0,05% FA in H2O− wasstap 1: 1 ml 100% H2O− wasstap 2: 1 ml 0,0025% NH4OH− wasstap 3: 1 ml 100% MeOH− wasstap 4: 1 ml 20/80 MeOH/H2O + 0,1% FA− afelueren: 2 x 500 µl 80/20 MeOH/H2O + 6% FA
Deze procedure wordt eerst getest op een blanco plasmastaal. Eluaat 1 wordt dan
gespiked met adrenaline en noradrenaline (10 ng/ml) en met de IS (20 ng/ml). Het
chromatogram van dit eluaat wordt weergegeven in Figuur 4.10. Hier zijn de componenten
wel detecteerbaar op de gewenste retentietijd. Er treedt dus geen onderdrukking meer op,
waaruit kan afgeleid worden dat het eluaat voldoende zuiver is. Wanneer de bovenstaande
procedure echter getest wordt op een vooraf gespiked plasmastaal, zijn de analyten niet meer
detecteerbaar in eluaat 1 (zie Figuur 4.11.). Er treedt dus verlies op van de componenten in de
vierde wasstap, waardoor geen rendement bekomen wordt.
41
FIGUUR 4.10.: CHROMATOGRAM ELUAAT 1 (GESPIKED) BLANCO PLASMASTAAL
(MET ZURE WASSTAP EN 80/20 MeOH/H2O + 6% FA ALS ELUTIEVLOEISTOF).
FIGUUR 4.11.: CHROMATOGRAM ELUAAT 1 PLASMASTAAL
(MET ZURE WASSTAP EN 80/20 MeOH/H2O + 6% FA ALS ELUTIEVLOEISTOF).
Dit wordt bevestigd wanneer deze procedure (met zure wasstap) wordt uitgevoerd op
een waterstaal. Adrenaline en noradrenaline zijn niet detecteerbaar (Figuur 4.12.), terwijl dit
wel het geval is wanneer de SPE-procedure uitgevoerd wordt zonder zure wasstap (Figuur
4.13.). Door de zure wasstap treedt er dus verlies op van de analyten.
42
FIGUUR 4.12.: CHROMATOGRAM ELUAAT 1 WATERSTAAL
(MET ZURE WASSTAP EN 80/20 MeOH/H2O + 6% FA ALS ELUTIEVLOEISTOF).
FIGUUR 4.13.: CHROMATOGRAM ELUAAT 1 WATERSTAAL
(ZONDER ZURE WASSTAP EN 80/20 MeOH/H2O + 6% FA ALS
ELUTIEVLOEISTOF).
4.4.3. Verdere aanpassing procedure
Er worden verschillende aanpassingen gemaakt van de SPE-procedure om het
plasmastaal voldoende op te zuiveren zonder dat er verlies optreedt van de componenten,
maar die leveren allemaal slechte resultaten op: ofwel is het eluaat niet zuiver genoeg, ofwel
43
treedt er verlies op van de analyten. De aanpassingen die gemaakt worden, zijn
achtereenvolgens:
− 2 ml 100% MeOH in wasstap 3 in plaats van 1 ml 100% MeOH
− 2 ml 0,0025% NH4OH in wasstap 2 in plaats van 1 ml 0,0025% NH4OH
− 2 ml 100% H2O in wasstap 1 in plaats van 1 ml 100% H2O
− weglaten van wasstap 3 (1 ml MeOH)
− 1 ml 50/50 MeOH/H2O in wasstap 3 in plaats van 1 ml 100% MeOH
− 1 ml 10/90 MeOH/H2O + 0,1% FA in wasstap 4 in plaats van 1 ml 20/80 MeOH/H2O
+ 0,1% FA
Hieruit blijkt dus dat elke stap uit de vooropgestelde procedure noodzakelijk is voor de
opzuivering van het plasmastaal. Vooral de vierde, zure wasstap is essentieel om een volledig
zuiver eluaat te bekomen. Deze wasstap zorgt er echter ook voor dat de analyten eigenlijk al
afgeëlueerd worden in de laatste wasstap, waardoor geen rendement bekomen wordt in eluaat
1. Er wordt geprobeerd de volgorde van de wasstappen aan te passen om het rendement van
de procedure te verhogen.
Wasstap 3 (1 ml 100% MeOH) heeft als doel neutrale componenten uit het plasma, die
enkel door RP-interacties weerhouden worden op de pakking, weg te spoelen. Deze wasstap
gaat er uiteraard ook voor zorgen dat de doelanalyten geen RP-interactie meer gaan vertonen
met de pakking. Er treedt echter geen verlies op in deze wasstap, doordat de doelanalyten
weerhouden worden op de pakking door middel van ionaire interacties.
De bedoeling van wasstap 4 (1 ml 20/80 MeOH/H2O + 0,1% FA) is het verwijderen
van componenten die een gelijkaardige structuur hebben als de doelanalyten, maar geen RP-
interacties vertonen. In deze wasstap worden dus de ionaire interacties verbroken, ook die van
de doelanalyten. Er wordt er dus van uitgegaan dat de doelanalyten in deze wasstap
weerhouden worden op de pakking door middel van RP-interacties.
Die RP-interacties worden echter doorbroken door de voorgaande wasstap met
100% MeOH. Het zou kunnen dat de resterende fractie MeOH van wasstap 3 nog te sterk
aanwezig is in de vierde wasstap, waardoor zowel de RP-interacties als de ionaire interacties
44
van de doelanalyten met de pakking doorbroken worden. Hierdoor treedt er dus verlies op in
de vierde wasstap.
Om dit te testen worden wasstap 2 en wasstap 3 omgewisseld. Zo kan de alkalische
wasstap misschien de resterende fractie MeOH wegspoelen, vooraleer de zure wasstap
uitgevoerd wordt. De SPE-procedure ziet er nu als volgt uit:
− conditionering: 1 ml MeOH− equilibratie: 1 ml H2O− staalopbreng: 500 µl staal + 1 ml 0,05% FA in H2O− wasstap 1: 1 ml 100% H2O− wasstap 2: 1 ml 100% MeOH− wasstap 3: 1 ml 0,0025% NH4OH− wasstap 4: 1 ml 20/80 MeOH/H2O + 0,1% FA− afelueren: 2 x 500 µl 80/20 MeOH/H2O + 6% FA
Dit levert echter geen betere resultaten op. Om zeker te zijn dat de resterende fractie
MeOH voldoende weggespoeld is, wordt bovenstaande procedure nog eens herhaald met 2 ml
0,0025% NH4OH in plaats van 1 ml, maar ook hier wordt geen rendement bekomen.
Wasstap 2 (1 ml 0,0025% NH4OH) heeft als doel de zuren die aanwezig zijn in het
plasma weg te spoelen. Deze oplossing is wel niet sterk alkalisch (bij een te hoge pH zouden
de analyten onvoldoende geladen zijn om op de pakking weerhouden te worden), dus in
principe kan deze stap vervangen worden door een wasstap met 100% H2O. Wanneer dit
gecombineerd wordt met bovenstaande procedure, ziet de SPE-procedure er uit zoals
hieronder, maar de resultaten hiervan zijn ook onvoldoende.
− conditionering: 1 ml MeOH− equilibratie: 1 ml H2O− staalopbreng: 500 µl staal + 1 ml 0,05% FA in H2O− wasstap 1: 1 ml 100% H2O− wasstap 2: 1 ml 100% MeOH− wasstap 3: 1 ml 100% H2O− wasstap 4: 1 ml 20/80 MeOH/H2O + 0,1% FA− afelueren: 2 x 500 µl 80/20 MeOH/H2O + 6% FA
45
Wanneer de wasstappen samen met de opbrengstap beschouwd worden, kunnen nog
enkele aanpassingen gemaakt worden. De laadstap gebeurt bij pH 5 à 6, een pH waarbij de
analyten positief geladen zijn en dus ionaire interactie kunnen vertonen met de pakking (naast
RP-interacties). Daarna wordt gewassen met 1 ml H2O, waardoor de pH op de pakking
eigenlijk neutraler wordt. Daardoor zijn de analyten misschien minder geladen en worden ze
voornamelijk op de pakking weerhouden door middel van RP-interacties. Wanneer er dan in
de volgende wasstap gewerkt wordt met 100% MeOH, worden ook deze interacties
verbroken, waardoor er verlies van de analyten optreedt.
Daarom moet de pH op de pakking na de wasstap met H2O terug op 5 à 6 gebracht
worden, zodat de analyten weer voldoende geladen zijn. Zo zullen ze weerhouden worden op
de pakking door ionaire interacties, wanneer erna gewassen wordt met 100% MeOH. Om dit
te bereiken wordt er na wasstap 1 (100% H2O) 1 ml 0,05% FA op de pakking gebracht,
vooraleer met 100% MeOH te wassen. Wasstap 4 hoeft dan niet meer zuur te zijn (zit al
vervat in wasstap 2) en kan gebeuren met 100% H2O om de resterende fractie MeOH van de
pakking weg te spoelen voor elutie (anders is de verhouding 80/20 MeOH/H2O in het eluaat
verstoord). De procedure houdt dan het volgende in:
− conditionering: 1 ml MeOH− equilibratie: 1 ml H2O− staalopbreng: 500 µl staal + 1 ml 0,05% FA in H2O− wasstap 1: 1 ml 100% H2O− wasstap 2: 1 ml 0,05% FA− wasstap 3: 1 ml 100% MeOH− wasstap 4: 1 ml H2O− afelueren: 2 x 500 µl 80/20 MeOH/H2O + 6% FA
Deze procedure blijkt echter ook ongeschikt en levert geen rendement op.
Er moet dus een andere manier gevonden worden om het plasmastaal beter op te
zuiveren. Een oplossing voor dit probleem zou kunnen zijn het plasmastaal al gedeeltelijk op
te zuiveren vooraleer de SPE-procedure uit te voeren. Op die manier wordt de zure wasstap
misschien overbodig, waardoor een hoger rendement kan bekomen worden.
46
4.4.3. Vooropzuivering plasmastaal
Een eerste manier die getest wordt, is denaturatie van proteïnen. Hierbij wordt aan
500 µl plasma 1 ml MeOH toegevoegd. Na vortexen en 10 minuten laten staan, wordt het
geheel 10 minuten gecentrifugeerd bij 4°C en 5000 x g. Het supernatans wordt dan op
pH 5 à 6 gebracht met behulp van 0,05% FA in H2O. Deze procedure wordt eerst uitgetest op
een blanco plasmastaal. Het eluaat wordt dan gespiked met adrenaline en noradrenaline
(10 ng/ml) en met de IS (20 ng/ml). De SPE-procedure die gevolgd wordt, is:
− conditionering: 1 ml MeOH− equilibratie: 1 ml H2O− staalopbreng: supernatans, op pH 5 à 6 gebracht met 0,05% FA in H2O− wasstap 1: 1 ml 100% H2O− wasstap 2: 1 ml 0,0025% NH4OH− wasstap 3: 1 ml 100% MeOH− afelueren: 2 x 500 µl 80/20 MeOH/H2O + 6% FA
Dit levert echter geen goede resultaten op: adrenaline en noradrenaline zijn niet
detecteerbaar in eluaat 1, waaruit kan afgeleid worden dat het eluaat onvoldoende zuiver is.
Zelfs na denaturatie van de proteïnen kan een plasmastaal dus niet voldoende opgezuiverd
worden zonder zure wasstap.
Een tweede manier is LLE. Hierbij wordt een organisch solvent, waarin de analyten
slecht oplosbaar zijn, aan plasma toegevoegd. Het is de bedoeling dat de ongewenste
componenten in het plasma zoveel mogelijk overgaan naar de organische fase, zodat al een
gedeeltelijke opzuivering gebeurt van de waterige fase, waarin de analyten achterblijven. Die
waterige fase kan dan gebruikt worden in de opbrengstap van de SPE-procedure.
Zowel adrenaline als noradrenaline zijn slecht oplosbaar in diëthylether. Dit solvent
(1 ml) wordt toegevoegd aan een plasmastaal (1 ml) dat de analyten bevat. Na vortexen en 10
minuten laten staan, wordt het geheel gecentrifugeerd bij 5000 x g. Het supernatans
(= organische fase) moet zoveel mogelijk verwijderd worden. De waterige fase kan dan op
pH 5 à 6 gebracht worden met 0,05% FA in H2O. De SPE-procedure ziet er als volgt uit:
47
− conditionering: 1 ml MeOH− equilibratie: 1 ml H2O− staalopbreng: waterige fase, op pH 5 à 6 gebracht met 0,05% FA in H2O− wasstap 1: 1 ml 100% H2O− wasstap 2: 1 ml 0,0025% NH4OH− wasstap 3: 1 ml 100% MeOH− afelueren: 2 x 500 µl 80/20 MeOH/H2O + 6% FA
Deze procedure kan echter niet uitgevoerd worden: vanaf wasstap 3 loopt de vloeistof
niet meer doorheen het SPE-kolommetje, zelfs niet wanneer de maximale onderdruk bereikt
wordt met het Vac-Elut SPE-systeem. Dit is misschien te wijten aan emulsievorming met
diëthylether na vortexen.
4.5. SAMENVATTING
Er werd tot nu toe geen adequate SPE-procedure opgesteld voor de opzuivering van
adrenaline en noradrenaline uit plasmastalen met de Oasis® WCX SPE-kolommetjes, ondanks
verschillende pogingen tot optimalisatie. Hoewel de opgestelde extractieprocedure sterk lijkt
op de standaardprocedure van de Oasis® WCX SPE-kolommetjes, levert ze geen resultaten
op. Er werden wel goede resultaten behaald met waterstalen.
Er zijn talloze problemen die optreden bij de opzuivering van deze componenten uit
plasmastalen via SPE. Dit is te wijten aan hun aard: adrenaline en noradrenaline interageren
minder sterk met de pakking van een SPE-kolom dan veel andere componenten aanwezig in
plasma. Ze worden bijgevolg veel gemakkelijker afgeëlueerd, waardoor verlies optreedt van
deze analyten.
Een bijkomend probleem is het verschil in pKa tussen beide componenten: adrenaline
heeft een pKa van 10,32, terwijl de pKa van noradrenaline 8,58 bedraagt. Daardoor is het, in
het geval van een ionenuitwisselings SPE-kolommetje, zeer moeilijk de optimale pH te
bekomen waarbij zowel de functionele groepen op de pakking als beide analyten volledig
geladen zijn. Bovendien kan er met deze componenten niet gewerkt worden in een te sterk
alkalisch milieu. Daardoor kan voor het afelueren geen alkalische oplossing gebruikt worden
om zowel de pakking als de analyten te ontladen. Afelueren berust hier dus volledig op het
48
verdringingsprincipe, waarbij de gebonden analyten verdrongen worden van de pakking door
een overmaat kationen (H+). Tenslotte zijn adrenaline en noradrenaline thermolabiel,
waardoor het noodzakelijk is het elutievolume zo klein mogelijk te houden om
evaporatiestappen en thermodegradatie te omzeilen.
Finaal is er ook nog de HILIC-gebaseerde chromatografische scheiding. In
tegenstelling tot de robuuste RP-chromatografie, is HILIC veel gevoeliger aan verschillen in
samenstelling tussen het chromatografisch eluens en de injectievloeistof (= elutievloeistof van
de SPE-procedure). De variatiemogelijkheden voor wasstappen en elutiestappen worden
hierdoor beperkt, aangezien zich snel een deterioratie in de chromatografie voordoet (zie
Figuur 4.6. en Figuur 4.7.).
49
5. CONCLUSIES
In het kader van de anesthesiestudie wordt een kwantitatieve bepalingsmethode
ontwikkeld voor adrenaline en noradrenaline in plasmastalen van patiënten onder anesthesie.
De concentraties van adrenaline en noradrenaline worden bepaald om de mate van stress te
kunnen bepalen die patiënten tijdens anesthesie ondervinden. Om dit te kunnen doen wordt
een extractieprocedure ontwikkeld, gekoppeld aan een HILIC-MS/MS analyse.
In dit onderzoek werd getracht een SPE-procedure te optimaliseren voor de extractie
van adrenaline en noradrenaline uit plasmastalen. Hiertoe werden verschillende SPE-
kolommetjes uitgetest met waterstalen om te bepalen welk kolommetje het beste
extractierendement gaf. Belangrijk hierbij was dat het elutievolume kleiner moest zijn dan het
elutievolume van de Discovery® DSC-18 SPE-kolommetjes (1 ml). De keuze viel op de
Oasis® WCX SPE-kolommetjes, die het beste extractierendement gaven en waarvan het
elutievolume 500 µl bedroeg.
Voor het opstellen van een optimale extractieprocedure voor de waterstalen werd
methodisch tewerk gegaan. Eerst werd de elutiestap geoptimaliseerd, waarna de wasstappen
één voor één werden ingevoerd. Door het invoeren van de wasstappen, moest de elutiestap
verder aangepast worden. Uiteindelijk werd een SPE-procedure bekomen die goede resultaten
gaf bij waterstalen en waarbij het elutievolume 500 µl bedroeg.
Bij het testen van deze extractieprocedure op plasmastalen, traden echter veel
problemen op. Het bleek zeer moeilijk om de plasmastalen voldoende op te zuiveren zonder
dat er verlies optrad van de analyten. Zelfs door talloze aanpassingen van de procedure
werden geen goede resultaten bekomen.
50
6. LITERATUURLIJST
Application Supelco (Sigma-Aldrich), Note 66 (1997). Simple Solid Phase Extraction and HPLC Analysis of Catecholamines in Plasma.
De Jong, W. H. A.; Graham, K. S.; Van Der Molen, J. C.; Links, T. P.; Morris, M. R.; Ross, H. A.; De Vries, E. G. E.; Kema, I. P. (2007). Plasma Free Metanephrine Measurement Using Automated Online Solid-Phase Extraction HPLC-Tandem Mass Spectrometry. Clin. Chem., 53, 1684-1693
Gu, Q.; Shi, X.; Yin, P.; Gao, P.; Lu, X.; Xu, G. (2008). Analysis of catecholamines and their metabolites in adrenal gland by liquid chromatography tandem mass spetrometry. Anal. Chim. Acta, 609, 192-200
Guo, Y.; Gaiki, S. (2005). Retention behavior of small polar compounds on polar stationary phases in hydrophilic interaction chromatography. J. Chromatogr. A, 1074, 71-80
Hemström, P.; Irgum, K. (2006). Hydrophilic interaction chromatography. J. Sep. Sci., 29, 1784-1821
http://www.aquaculture.ugent.be/coursmat/online%20courses/ATA/analysis/lip_extr.htm (20-02-2009)
http://chem.sis.nlm.nih.gov/chemidplus/chemidheavy.jsp (17-03-2009)
http://www.chm.bris.ac.uk/ms/theory/esi-ionisation.html (18-03-2009)
http://www.drugdiscoveryonline.com/article.mvc/QuanLynx-Software-Advances-ADMEPK-Screening-0001 (20-02-2009)
http://www.pall.com/34696_38542.asp (16-02-2009)
http://www.sigmaaldrich.com/Graphics/Supelco/objects/4600/4538.pdf (16-02-2009)
http://www.spectroscopynow.com/coi/cda/detail.cda?id=14874&type=EducationFeature&chId=4&page=1 (20-02-2009)
http://www.waters.com/waters/nav.htm?cid=513209# (25-03-2009)
http://www.waters.com/waters/nav.htm?locale=en_US&cid=514489 (20-02-2009)
Majors, R. E. (2009). Practical Aspects of Solvent Extraction. LC GC Europe, 22, 143-147
Manisali, I.; Chen, D. D. Y.; Schneider, B. B. (2006). Electrospray ionization source geometry for mass spectrometry: past, present, and future. Trac-Trend. Anal. Chem., 25, 243-256Micromass® Quattro Ultima™ Operator Training Course
51
Müssig, K.; Pfäfflin, A.; Häring, H.; Schleicher, E.D. (2006). Dipyrone (Metamizole) Metabolites Interfere with HPLC Analysis of Plasma Catecholamines but Not with the Determination of Urinary Catecholamines. Clin. Chem., 52, 1829-1831
Myre, K.; Raeder, J.; Rostrup, M.; Buanes, T.; Stokland, O. (2003). Catecholamine release during laparoscopic fundoplication with high and low doses of remifentanil. Acta Anaesthesiol. Scand., 47, 267-273
Peaston, R. T.; Weinkove, C. (2004). Measurement of catecholamines and their metabolites. Ann. Clin. Biochem., 41, 17-38
Raggi, M.A.; Sabbioni, C.; Casamenti, G.; Gerra, G.; Calonghi, N.; Masotti, L. (1999). Determination of catecholamines in human plasma by high-performance liquid chromatography with electrochemical detection. J. Chromatogr. B, 730, 201-211
Roemling, R.; Itoh, S. (2007). HILIC-MS – High Resolution and Sensitivity for the Analysis of Very Polar Compounds. LC GC Europe, supplement S, 49-50
Struys, M. M. R. F.; Vanpeteghem, C.; Huiku, M.; Uutela, K.; Blyaert, N. B. K.; Mortier, E. P (2007). Changes in a surgical stress index in response to standardized pain stimuli during propofol-remifentanil infusion. Brit. J. Anaesth., 99, 359-367
Tsunoda, M. (2006). Recent advances is methods for the analysis of catecholamines and their metabolites. Anal. Bioanal. Chem., 386, 506-514
Unceta, N.; Rodriguez, E.; Gomez de Balugera, Z.; Sampedro, C.; Aranzazu Goicolea, M.; Barrondo, S.; Salles, J.; Barrio, R. J. (2001). Determination of catecholamines and their metabolites in human plasma using liquid chromatography with coulometric multi-electrode cell-design detection. Anal. Chim. Acta, 444, 211-221
Xu, R. N.; Fan, L.; Rieser, M. J.; El-Shourbagy, T. A. (2007). Recent advances in high throughput quantitative bioanalysis bij LC-MS/MS. J. Pharmaceut. Biomed., 44, 342-355