FUNZIONI BIOLOGICHE DELLE PROTEINE - Docenti...
Transcript of FUNZIONI BIOLOGICHE DELLE PROTEINE - Docenti...

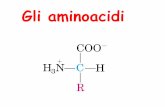
FUNZIONI BIOLOGICHE DELLEPROTEINE
ENZIMIPROTEINE DI TRASPORTO
PROTEINE DI RISERVAPROTEINE CONTRATTILI
PROTEINE DI DIFESAPROTEINE REGOLATRICIPROTEINE STRUTTURALI

ENERGIA LIBERA (G)
ΔG = ΔH - TΔS
Variazioni di energia libera di un sistemache sta subendo una trasformazione apressione e temperatura costanti
ΔH: variazione di entalpiaΔS: variazione di entropia

Il ΔG può essere usato per stabilire se un processo puòavvenire spontaneamente(ΔG negativo)
ΔG=0 equilibrio
Il ΔG dipende dalla differenza di energia libera tra prodottie reagenti. E’ indipendente dalla via seguita dallatrasformazione.
Il ΔG non indica a che velocità avviene la reazione

ΔG° variazioni di Energia Libera Standard(in cui i reagenti sono 1M)
ΔG°’ variazioni di Energia Libera Standard a pH7

Le BIOMOLECOLE sono stabili a pH 7, a37°C, in ambiente acquoso
Difficoltà di una reazione:•Formazione di intermedi instabili•Collisione tra molecole con un precisoorientamento

Un ENZIMA supera questi problemigenerando un ambiente specifico in cui una
data reazione avviene

Le reazioni avvengono in unatasca detta SITO ATTIVO

SITO ATTIVO
• Contiene una regione di specificità chepermette il legame del substrato
• Contiene un sito di reazione in cui ilsubstrato è trasformato

ENZIMI• Sono nella maggior parte proteine• Sono i catalizzatori delle reazioni biologiche• Hanno elevata specificità• Operano in soluzione acquosa in condizioni
blande di temperatura e pH• La loro attività dipende dall’integrità della
conformazione proteica nativa• La loro attività può essere regolata
(fosforilazione, glicosilazione, ecc…)

COFATTORI
Alcuni enzimi per essere attivi necessitanodi cofattoriI cofattori possone essere:• Ioni inorganici (Fe2+; Mg2+; Mn2+; Zn2+)• Molecole organiche o metallo-organichedette coenzimi
Se lo ione inorganico o il coenzima sonolegati covalentemente all’enzima vienedetto “gruppo prostetico”

ENZIMI E SPECIFICITA’
Catalizzano in genere UNA SOLA reazionechimica perché hanno un sito specifico acui si lega il substratoEsempio: ENZIMI PROTEOLITICI

Alcuni ENZIMI PROTEOLITICI catalizzanoreazioni diverse ma correlate
TRIPSINA TROMBINA



Il ΔG°’ tra S e P è negativo. L’equilibrio favorisce laformazione di P. L’enzima non interviene su questoequilibrio. La velocità della reazione non dipende però dalΔG°’ ma dalla barriera energetica che corrispondeall’energia necessaria ad allineare i gruppi reagenti, ariorganizzare legami affinché la reazione possa procedere.Questo punto della reazione è detto STATO DITRANSIZIONE
ΔG‡ = ENERGIA DI ATTIVAZIONE


Un enzima aumenta la velocità di reazione abbassando l’energia diattivazione ΔG‡.
L’enzima non viene consumato durante il processo e il punto diequilibrio rimane inalterato.
La reazione raggiunge l’equilibrio più velocemente
Gli equilibri di reazioni sono collegati al ΔG°’, mentre la velocità al ΔG‡.

L’energia che si libera dalle interazioni
enzima-substrato viene detta ENERGIA DI
LEGAME.
L’energia di legame è la fonte principale di
energia libera usata dall’enzima per
abbassare l’energia di attivazione della
reazione.

L’energia di legame viene utilizzata persuperare le barriere fisiche etermodinamiche di una reazione:
1. RIDUZIONE ENTROPICAL’energia di legame mantiene i substrati nellaposizione corretta
2. DESOLVATAZIONELa formazione di legami tra E e S portano allarimozione di H2O del substrato

3. STIRAMENTO O DISTORSIONE DELSUBSTRATO
La somma delle interazioni deboli tra E e Scompensano le modifiche termodinamicamentesfavorite del substrato che nello stato ditransizione può subire distorsioni sia elettronicheche strutturali
4. ADATTAMENTO DELL’ENZIMAL’enzima può subire cambi conformazionali,adattandosi al substrato. La nuova conformazioneesalta le proprietà catalitiche dell’enzima

IL SITO ATTIVO:
• Promuove la prossimità dei reagenti• Destabilizza lo stato fondamentale
(stabile) con attivazione di alcuni gruppiche diventano più reattivi
• Stabilizza lo stato di transizione evitandola formazione di prodotti secondari

TIPI DI REAZIONI CATALIZZATE:
• Ossido-riduzioni• Addizione/sottrazione di gruppi• Idrolisi• Decarbossilazioni

Per poter catalizzare una reazione un enzima deveessere complementare allo stato di transizione

1. Nel complesso enzima-substrato siformano alcune interazioni deboli cherappresentano la forza trainante dellacatalisi
2. Nel complesso enzima-substrato nellostato di transizione si formano tutte leinterazioni possibile che contribuisconoalla catalisi

Modello ESOCHINASI:variazione conformazionale indotta dal
legame con il substrato (glucosio)

CINETICA ENZIMATICA

y = mx + qVmax
Km
V0
=1
Vmax
1+
[S]
1⋅
V0
1
[S]
1
Vmax
KmPendenza =
Vmax
1
1Km
-


• Valori di Km di alcuni enzimi
• Numero di turnover di alcuni enzimi5,0L-TreoninaTreonina deidradasi
4,0D-Lattosioβ-Galattosidasi
1082,5
GliciltirosinilglicinaN-Benzoiltirosinamide
Chimotripsina
9HCO3-Anidrasi carbonica
0,40,051,5
ATPD-GlucosioD-Fruttosio
Esochinasi (cervello)
25H2O2Catalasi
Km (mM)SubstratoEnzima
0,4ATPProteina RecA (ATPasi)
800FumaratoFumarasi
2’000Benzilpenicillinaβ-Lattamasi
140’000AcetilcolinaAcetilcolinesterasi
400’000HCO3-Anidrasi carbonica
40’000’000H2O2Catalasi
KcatSubstratoEnzima

Inibizione enzimatica

GLI ENZIMI POSSONO ESSERE INIBITI
Gli INIBITORI enzimatici possono essere
• REVERSIBILI
• IRREVERSIBILI
Hanno importanti applicazioni in campofarmaceutico

Gli inibitori reversibili possono esserecompetitivi e non competitivi

INIBIZIONECOMPETITIVA

EFFETTO DELL’INIBIZIONE COMPETITIVASULLA CINETICA ENZIMATICA

INIBIZIONENON COMPETITIVA

EFFETTO DELL’INIBIZIONE NONCOMPETITIVA SULLA CINETICA ENZIMATICA

REGOLAZIONE
DELL’ATTIVITA’ ENZIMATICA

ENZIMI REGOLATORI1. ENZIMI ALLOSTERICI
Questi enzimi esistono in più di una forma. Lamolecola regolatrice può cambiare la conformazionedell’enzima. Questo gruppo di enzimi può essereregolato finemente.
2. ENZIMI REGOLATI DA MODIFICAZIONICOVALENTI REVERSIBILI
Questo gruppi di enzimi o è attivo o inattivo (tutto onulla)
Tutte e due le classi di enzimi regolatori hanno più subunitàe i siti regolatori e siti catalitici sono su subunità diverse

ENZIMI Allosterici
• Sono un gruppo di enzimiche non seguono a cineticadi Michaelis-Menten
• La loro attività è aumentatao diminuita da piccolemolecole o cofattori
• Regolano importanti viemetaboliche
B
A
C
D
E
E1
E3
E2
E4

INTERAZIONI TRA SUBUNITA’ DI UNENZIMA ALLOSTERICO

CURVA DI SATURAZIONE DA SUBSTRATO DIUN ENZIMA ALLOSTERICO

ENZIMI REGOLATI DAMODIFICAZIONI COVALENTI

• REGOLAZIONE ALLOSTERICA
Controlla enzimi che lavorano in maniera
continua.
• REGOLAZIONE COVALENTE
Controlla enzimi che …o funzionano …o sono
spenti. Alcune modificazioni sono reversibili,
altre no. Spesso è sotto il controllo ormonale

fine

REGOLAZIONE DI ACTasi• Lega i substrati in modo cooperativo
(effettori omotropici positivi)• CTP inibisce l’enzima
(effettore eterotropico negativo)
• ATP è un attivatore allostericoL’ATP si lega nello stesso sito del CTPElevato ATP: la cellula ha energia sufficiente perdividersi. Eccesso di purine


ASPARTATOTRANSCARBAMMILASI (ACTasi)
Enzima allosterico che catalizza la primatappa nella biosintesi delle pirimidine

ENZIMI ALLOSTERICIETEROTROPICI E CINETICA
1. Un modulatore puòaumentare o diminuirela K0.5
2. Un modulatore puòaumentare o diminuirela Vmax

ORGANIZZAZIONE DELL’ENZIMA
E’ un eteromultimero del tipo α6β6. Questo enzimapuò essere dissociato dal para-idrossimercurilbenzoato che abolisce le proprietàallosteriche dell’enzima
ACTasi (α6β6)
+ pHMBCatena C Catena R
2 subunità C 3 subunità R
Ogni subunità ècostituita da 3 cateneC; possiede 3 siti peraspartato e 3 siti percarbamilfosfato.Ogni singola catena èinattiva ⇒ ognunacontribuisce ai siti
Ogni subunità R puölegare 2 ATP o 2 CTP
e contiene uno Zn2+ lacui rimozione faperdere l’attivitä
regolatoria.

MODIFICAZIONICOVALENTI

Gli enzimi possono utilizzare diversi tipi dicatalisi per facilitare la rottura o laformazione di legami.
I più caratterizzati sono:
1.CATALISI ACIDO-BASICA
2.CATALISI COVALENTE
3.CATALISI DA IONI METALLICI, legati agruppi prostetici tipo EME o con legami dicoordinazione ad aminoacidi

PROTEASI A SERINA
• TRIPSINA• CHIMOTRIPSINA• ELASTASI
• TROMBINA• PLASMINA
Enzimi digestivisintetizzati nel pancrease secreti come proenziminel tratto digerente
Deriva dal plasminogenoRompe i polimeri difibrina dei coaguli

PROENZIMA O ZIMOGENO (tripsinogenochimotripsinogeno
elastasi)
ENZIMA ATTIVO
ACETILCOLINESTERASINon è una proteasi ma è una serinaesterasi che degrada l’acetilcolina a livellodello spazio sinaptico.Stesso meccanismo d’azione.
taglio

SPECIFICITA’ DI TAGLIO• TRIPSINA ⇒ ARG, LYS• CHIMOTRIPSINA ⇒ PHE, TYR• ELASTASI ⇒ piccoli residui neutri
Sono enzimi strutturalmente simili:• residui idrofobici e aromatici all’interno;• residui carichi sono esposti sulla superficieTre residui polari formano la TRIADE CATALITICAin corrispondenza del sito attivo:
HIS57, ASP102, SER195

CHIMOTRIPSINA
E’ una proteasi specifica per legamipeptidici adiacenti a residui aminoacidiciaromatici o idrofobici
La reazione enzimatica illustra il principiodella stabilizzazione dello stato ditransizione da parte dell’enzima ed è unesempio di catalisi acido-basica e di catalisicovalente

MECCANISMO DI CATALISIDELLA CHIMOTRIPSINA

MECCANISMO DI CATALISIDELLA CHIMOTRIPSINA
1. Posizionamento del substrato
2. Attacco nucleofilo della serina 195. L’istidina 57agisce come base, si ha la formazione di unossianione
3. Rottura del legame peptidico e formazione di un acil-enzima. L’istidina 57 cede il protone (catalisi acida)
4. L’istidina 57 prende un protone dall’H2O (catalisibasica). Intermedio tetraedrico.
5. L’istidina 57 cede un protone alla serina 195. Siottiene enzima libero e prodotto

1. POSIZINAMENTO DEL SUBSTRATONEL SITO ATTIVO
• Legami idrogeno con serina
195 e glicina 193 (sito attivo)
• Inserimento dell’anello
aromatico nell’incavo
idrofobico (adiacente al sito
attivo)

2. FORMAZIONE DI UN INTERMEDIOTETRAEDRICO PER ATTACCO NUCLEOFILODELL’OH DELLA SERINA AL C CARBONILICO
DEL PEPTIDE
• L’-OH della serina 195diventa reattivo (nucleofilo)
• L’isitidina 57 può accettareun protone della serina 195.L’aspartato 102 stabilizzal’istidina carica, che agiscecome base.

L’ossianione èstabilizzato da legamiidrogeno conSerina 195Glicina 193
OSSIANIONE: INTERMEDIOTETRAEDRICO CARICO
ROTTURALEGAME
PEPTIDICO
ACIL-ENZIMA

DEACILAZIONE CON INTERVENTO DI UNAMOLECOLA DI ACQUA
La rete Asp 102 e His 57strappa in protone all’acqua
L’OH- attacca immediatamenteil C carbossilico del gruppoacilico legato alla serina 195.Intermedio tetraedricotemporaneo.

L’istidina 57 dona poi un protonealla serina 195 che rilascia ilsubstrato modificato


CATALISI DA IONI METALLICI
Il metallo dell’enzima può fare legami ionicicon il substrato
I metalli possono anche mediare reazioni diossido-riduzione variando reversibilmente illoro stato di ossidazione

CARBOSSIPEPTIDASI A:un metallo enzima

CINETICA ENZIMATICA• La concentrazione del substrato
modifica la velocità di reazione.Per semplicità si studia la velocitàiniziale V0 in condizioni in cui [S]>>[E]
• Quando si raggiunge Vmax tuttol’enzima è saturato e si trova nellaforma ES. Aggiunte di substrato nonmodificano la Vmax
E + S ES E + PK1
K-1
K2
K-2
• A basse concentrazioni si S, l’enzima si trova nella forma liberaE. Aumentando la [S] aumenta la forma ES e la V0

E + S ES E + PK1
K-1
K2
K-2

La relazione tra concentrazione del substrato evelocità della reazione enzimatica può essereespressa in modo quantitativo dell’equazionedi MICHAELIS-MENTENVmax[S]
Km + [S]V0 =
Km =K2 + K-1
K1

TRASFORMAZIONE DELL’EQUAZIONE DIMICHAELIS-MENTEN
Facendo il reciproco di entrambi i termini dell’equazione
Vmax[S]
Km + [S]
V0
=1
Vmax[S]
Km + [S]V0 =
Vmax[S]
Km
V0
=1
Vmax[S]
[S]+
Vmax
Km
V0
=1
Vmax
1+
[S]
1⋅ y = mx + q

K2 è la costante che limita la velocità.Se K2 << K-1
che rappresenta la costante di dissociazione delcomplesso ES. Solo in queste condizioni Kmrappresenta l’affinità dell’enzima per il substrato.
Km =K2 + K-1
K1
Km =K-1
K1

Kcat
Le reazioni enzimatiche possono avvenire a 2 o più tappe. Kcat
descrive la tappa che limita la velocità di una reazioneenzimatica in condizioni di saturazione.
Kcat = K2 reazione a 2 tappe
Kcat = K3 reazione a 3 tappe
Se le tappe limitanti sono più di una Kcat diventa una funzionecomplessa contenente le costanti di velocità delle varie tappedella reazione
Kcat è una costante espressa in S-1 e viene detta numero diturnover (molecole di substrato convertite in prodotto nell’unitàdi tempo da una singola molecola di enzima)

Il modo migliore per confrontare l’efficienzacatalitica di un enzima per diversi substratio di enzimi diversi è di paragonare ilrapporto
Kcat
Km
detto COSTANTE DI SPECIFICITA’