ΔΙΑΛΥΤΟΤΗΤΑ
-
Upload
libavius-zosimos -
Category
Education
-
view
351 -
download
1
Transcript of ΔΙΑΛΥΤΟΤΗΤΑ

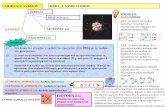
ΔΙΑΛΥΤΟΤΗΤΑΣΤΟΧΟΙΜε αυτή την άσκηση προσπαθούμε να κατανοήσουμε τα φαινόμενα της διάλυσης των ουσιών και να αποδώσουμε τη σημασία τους στις καθημερινές εφαρμογές
ΕΙΣΑΓΩΓΗΑπό τα πρώτα φαινόμενα διάλυσης που παρατηρήσαμε στη ζωή μας ήταν η διάλυση της ζάχαρης και τουκοινού αλατιού στο νερό. Επίσης η διάλυση των ζαχαρωτών γλυκισμάτων (όπως τα γλειφιτζούρια και οι καραμέλες) στο υδάτινο περιβάλλον της στοματικής μας κοιλότητας είναι κάτι που μας ενθουσίαζε ως μικρά παιδιά.Η διαλυτότητα μιας ουσίας σε έναν διαλύτη είναι ένα φαινόμενο πολύ πιο σπουδαίο από όσο νομίζουμε.Για παράδειγμα μια ουσία ανάλογα με τη διαλυτότητάτης σ’ έναν διαλύτη μπορεί να προκαλέσει ή όχι φαινόμενα τοξικής δηλητηρίασης ή ακόμα και περιβαλλοντικής καταστροφής.

Η μείωση της διαλυτότητας του αζώτου στο αίμα με την ελάττωση της πίεσης είναι η αιτία της «νόσου των δυτών» κατά την γρήγορη επάνοδο των δυτών στην επιφάνεια.Η διαλυτότητα του οξυγόνου στο νερό αν και μικρήείναι ουσιώδης για τη διατήρηση της ζωής στον υδάτινοκόσμο , μια μικρή άνοδο της θερμοκρασίας στο νερόενός υδάτινου οικοσυστήματος μπορεί να επιφέρει τονθάνατο στους ζωντανούς οργανισμούς λόγω της μείωσης της διαλυτότητας αυτού του πολύτιμου αερίου(φαινόμενη θερμικής ρύπανσης).Υπάρχουν ουσίες εξαιρετικά ευδιάλυτες και ουσίες εξαιρετικά δυσδιάλυτες , για παράδειγμα στο νερό τονιτρικό αμμώνιο είναι πολύ ευδιάλυτο ενώ ο θειούχος χαλκός είναι πολύ δυσδιάλυτος. Θα πρέπει να ξεκαθαρίσουμε ότι δεν υπάρχει εντελώςαδιάλυτη ουσία , ακόμα και η πιο δυσδιάλυτη ένωση , διαλύεται έστω και απειροελάχιστα σε οποιανδήποτε διαλύτη.

Για να συγκρίνουμε τη διαλυτότητα μεταξύ δύο ουσιών θα πρέπει να αναφερόμαστε στην ίδια θερμοκρασία (αν πρόκειται για στερεές ουσίες) ή και πίεση (αν πρόκειται για αέριες ουσίες) και ο λόγος είναι ότιη θερμοκρασία και η πίεση είναι παράγοντες οι οποίοι επηρεάζουν έντονα τη διαλυτότητα των ουσιών.
Η πειραματική διαδικασία χωρίζεται σε τρία μέρη
1)Διαλυτότητα στερεών σε υγρά2)Διαλυτότητα αερίων σε υγρά3)Υπέρκορα διαλύματα

ΟΡΓΑΝΑ - ΥΛΙΚΑ ΟΡΓΑΝΑ ποτήρια ζέσεως των 100mL X2 σπάτουλα ογκομετρικός κύλινδρος 100 mL ζυγός ράβδος ανάδευσης θερμόμετρο 150 οC τρίποδας πλέγμα αμιάντου φιάλη σφαιρική 250 mL ποτήρι ζέσεως 500 mL γυάλινος σωλήνας μήκους ~30 cm πουάρ σύριγγα 10 mL φελλός μεγάλος με δύο οπές φελλός μικρός με μια οπή λύχνος υγραερίου δοκιμαστικός σωλήνας στατώ με δύο λαβίδες
ΧΗΜΙΚΑ ζάχαρη αλάτι κοινό βενζίνη αμμωνία πυκνή οξικό αμμώνιο απιονισμένο νερό

ΠΕΙΡΑΜΑΤΙΚΟ ΜΕΡΟΣΔΙΑΛΥΤΟΤΗΤΑ ΣΤΕΡΕΩΝ ΣΕ ΥΓΡΑ
Α. Σε ένα ποτήρι ζέσεως των 100 mL προσθέτουμε 2 g ζάχαρης και μετά προσθέτουμε σιγά σιγά απιονισμένο νερό υπό ανάδευση από ογκομετρικό κύλινδρο των 100 mL που έχουμε μετρήσει τον αρχικό τουόγκο μέχρι να διαλυθεί η ζάχαρη και σημειώνουμε τον όγκο του νερού που έμεινε στον κύλινδρο. Επαναλαμβάνουμε το ίδιο αλλά αντί νερού χρησιμοποιούμε βενζίνη (Προσοχή δεν εισπνέουμε τους ατμούς βενζίνης !).
Β. Σε ένα ποτήρι ζέσεως των 100 mL προσθέτουμε 2 g αλάτι και μετά προσθέτουμε νερό υπό ανάδευση από ογκομετρικό κύλινδρο των 100 mLπου έχουμε μετρήσει τον αρχικό του όγκο μέχρι να διαλυθεί το αλάτι. Σημειώνουμε τον όγκο του νερού που απαιτήθηκε για τη διάλυση του αλατιού. Μετράμε τη θερμοκρασία του διαλύματος και τοποθετούμε το ποτήρι πάνω σε τρίποδα με πλέγμα αμιάντου και θερμαίνουμε το διάλυμα μέχρι τους 40 oC. Μετά προσθέτουμε 1 g αλάτι και κρατώντας σταθερή τηθερμοκρασία και υπό ανάδευση προσθέτουμε σιγά σιγά απιονισμένο νερόαπό ογκομετρικό κύλινδρο των 100 mL που έχουμε μετρήσει τον αρχικό του όγκο μέχρι να διαλυθεί το αλάτι. Σημειώνουμε τον όγκο του νερού που απαιτήθηκε για τη διάλυση του αλατιού. Αυξάνουμε τη θερμοκρασία του νέου κορεσμένου διαλύματος στους 60 οC και προσθέτουμε 1 g αλάτι ρίχνουμε απιονισμένο νερό με την ίδια διαδικασία όπως και πριν.

ΠΕΙΡΑΜΑΤΙΚΟ ΜΕΡΟΣΔΙΑΛΥΤΟΤΗΤΑ ΑΕΡΙΩΝ ΣΕ ΥΓΡΑ
Α. Συναρμολογούμε τη διάταξη του σχήματος 1 στον απαγωγόΑνάβουμε τον λύχνο υγραερίου και αφού εμφανιστεί βρασμός στον δοκιμαστικό σωλήνα με το διάλυμα πυκνής αμμωνίας περιμένουμε περίπου 1 λεπτό μέχρι να κορεστεί η σφαιρική φιάλη με ατμούς αμμωνίας (Προσοχή η αέριος αμμωνία είναι ερεθιστική ! ). Αμέσως σβήνουμε τον λύχνο και συναρμολογούμετη διάταξη του σχήματος 2. Με το πουάρ εισάγουμε μερικές σταγόνες νερού στη σφαιρική φιάλη και παρατηρούμε τον έγχρωμο πίδακα που δημιουργείται.
Β. Σε μια σύριγγα των 10 mL εισάγουμε μια ποσότητα νερού προσέχοντας να μην αφήσουμε αέρα. Κλείνουμε το ανοιχτό άκρο της σύριγγας με το δάκτυλό μας τραβάμε το έμβολο προς τα πίσω και παρατηρούμε την εμφάνιση φυσαλίδων μέσα από την μάζα του υγρού. Επαναφέροντας το έμβολο στην αρχική τουθέση παρατηρούμε την επαναδιάλυση των φυσαλίδων.

ΠΕΙΡΑΜΑΤΙΚΟ ΜΕΡΟΣΔΙΑΛΥΤΟΤΗΤΑ ΑΕΡΙΩΝ ΣΕ ΥΓΡΑ
Σχήμα 1 Σχήμα 2

ΠΕΙΡΑΜΑΤΙΚΟ ΜΕΡΟΣΥΠΕΡΚΟΡΑ ΔΙΑΛΥΜΑΤΑ
Ζυγίστε 160 g οξικού αμμωνίου και διαλύστε τα σε 30 mL νερού σε υδρόλουτρο (σχήμα 3 ). Αφήνουμε το διάλυμα να ψυχθεί (για μια μέρα) και την επόμενη φορά έχουμε έτοιμο ένα διάλυμα πολύ ευαίσθητο προς κρυστάλλωση. Αν αποχύσουμε το διάλυμα αυτόπάνω σε λίγους κρυστάλλους οξικού αμμωνίου αμέσως κρυσταλλώνεται όλη η μάζα του διαλύματος μ’ εντυπωσιακό τρόπο. (Εικόνα 1)Κατά τη διάρκεια της κρυστάλλωσης μετράμε τη θερμοκρασία με ένα θερμόμετρο.
Εικόνα 1 : κρυστάλλωση υπέρκορουδιαλύματος οξικού αμμωνίου
Σχήμα 3

ΑΠΟΤΕΛΕΣΜΑΤΑ
ΠΟΣΟΤΗΤΑ ΝΕΡΟΥ ΚΑΤΑ ΤΗ ΔΙΑΛΥΣΗ ΖΑΧΑΡΗΣ ΣΕ ΝΕΡΟ (mL)ΠΟΣΟΤΗΤΑ ΒΕΝΖΙΝΗΣ ΚΑΤΑ ΤΗ ΔΙΑΛΥΣΗ ΖΑΧΑΡΗΣ ΣΕ ΒΕΝΖΙΝΗ (mL)ΔΙΑΛΥΤΟΤΗΤΑ ΖΑΧΑΡΗΣ ΣΤΟ ΝΕΡΟ (g/mL)
ΔΙΑΛΥΤΟΤΗΤΑ ΖΑΧΑΡΗΣ ΣΤΗ ΒΕΝΖΙΝΗ (g/mL)
Α ΠΟΣΟΤΗΤΑ ΖΑΧΑΡΗΣ= 2 g
BΠΟΣΟΤΗΤΑ ΑΛΑΤΙΟΥ (g) 2 3 4ΟΓΚΟΣ ΝΕΡΟΥ ΓΙΑ ΔΙΑΛΥΣΗ (mL)ΘΕΡΜΟΚΡΑΣΙΑ (OC) 40 60ΔΙΑΛΥΤΟΤΗΤΑ (g/mL)
ΔΙΑΛΥΤΟΤΗΤΑ ΣΤΕΡΕΩΝ ΣΕ ΥΓΡΑ

ΑΠΟΤΕΛΕΣΜΑΤΑΔΙΑΛΥΤΟΤΗΤΑ ΑΕΡΙΩΝ ΣΕ ΥΓΡΑ
ΕΡΩΤΗΣΗΠώς εξηγείται ο σχηματισμός πίδακα ;
ΑΠΑΝΤΗΣΗΜόλις το νερό από το πουάρ εισέλθει στη σφαιρική φιάλη διαλύει μια μεγάλη ποσότητα αερίου αμμωνίας , διότι η αμμωνία έχει πολύ μεγάλη διαλυτότητα στο νερό ( 69% v/v)με αποτέλεσμα να δημιουργείται υποπίεση στο εσωτερικότης φιάλης . Η εξωτερική πίεση του αέρα ωθεί το νερόαπό το ποτήρι ζέσεως μέσω του σωλήνα προς τα πάνω και εισέρχεται με ορμή στο εσωτερικό της φιάλης όπου διαλύει και άλλη ποσότητα αμμωνίας κάνοντας το φαινόμενο πιο έντονο.ΕΡΩΤΗΣΗΓιατί αλάζει χρώμα το νερό κατά την εισαγωγή του στη φιάλη;ΑΠΑΝΤΗΣΗΕπειδή η αμμωνία είναι βάση , αλλάζει το χρώμα της φαινολοφθαλεΐνης που είναι δείκτης

ΑΠΟΤΕΛΕΣΜΑΤΑΔΙΑΛΥΤΟΤΗΤΑ ΑΕΡΙΩΝ ΣΕ ΥΓΡΑ
ΕΡΩΤΗΣΗ
ΑΠΑΝΤΗΣΗ
Γιατί κατά το τράβηγμα του εμβόλου εμφανίζονται φυσαλίδες στο νερό μέσα στη σύριγγα ;
Καθώς τραβιέται το έμβολο , η πίεση μέσα στη σύριγγαελαττώνεται με αποτέλεσμα να μειώνεται η διαλυτότητα των αερίων (κυρίως άζωτο και οξυγόνο) που είναι διαλυμένα στο νερό κι εμφανίζονται ως μικρές φυσαλίδες . ΕΡΩΤΗΣΗΓιατί όταν επαναφέρουμε το έμβολο οι φυσαλίδες εξαφανίζονται ; ΑΠΑΝΤΗΣΗΌταν το έμβολο επιστρέψει στην αρχική του θέση η πίεση επανέρχεται στα αρχικά της επίπεδα με αποτέλεσμα τα αέρια να διαλύονται ξανά αφού η διαλυτότητά τους επανέρχεται στα ίδια με πριν επίπεδα .

ΑΠΟΤΕΛΕΣΜΑΤΑΥΠΕΡΚΟΡΑ ΔΙΑΛΥΜΑΤΑ
Κατά την κρυστάλλωση του υπέρκορου διαλύματος ηθερμοκρασία αυξάνεται ή μειώνεται;
ΕΡΩΤΗΣΗ
ΑΠΑΝΤΗΣΗΗ θερμοκρασία αυξάνεται διότι το φαινόμενο είναι εξώθερμο.ΕΡΩΤΗΣΗ
ΑΠΑΝΤΗΣΗΓιατί το υπέρκορο διάλυμα δεν κρυσταλλώνεται από μόνο του;
Η κατάσταση που βρίσκεται το υπέρκορο διάλυμα είναι ασταθής , μόλις εμφανιστεί μέσα στο διάλυμα ένας κρύσταλλοςμε παρόμοια δομή με αυτή που έχει η διαλυμένη ουσία δρα ως «πυρήνας κρυστάλλωσης» κι έτσι ξεκινά η αλυσιδωτή διαδικασία κρυστάλλωσης

ΑΣΦΑΛΕΙΑ-ΠΕΡΙΒΑΛΛΟΝΟ χειρισμός της πυκνής αμμωνίας θα πρέπει να γίνεται με προσοχή διότι η πυκνή αμμωνία είναι καυστική. Η εισπνοή ατμών αμμωνίας μπορεί να προκαλέσει αναπνευστικά προβλήματα γι΄αυτό θα πρέπει οι χειρισμοί να γίνονται σε απαγωγό.Οι εργασίες με οργανικούς διαλύτες πρέπει να γίνονταιμακριά από φλόγες και ο χώρος να εξαερίζεται επαρκώς.Το οξικό αμμώνιο δεν είναι τοξικό και δεν αποτελεί ρύπογια το περιβάλλον. Οι χειρισμοί γυάλινων συσκευών γίνεται με προσοχήλόγω του κινδύνου τραυματισμού από σπασμένο γυαλί.

ΒΙΒΛΙΟΓΡΑΦΙΑ1. μέσα από ΠΕΙΡΑΜΑΤΑ η μαγεία της ΧΗΜΕΙΑΣ , ΓΙΩΡΓΟΥ Ε. ΜΑΝΟΥΣΑΚΗ 2. Διδακτική ΠΕΙΡΑΜΑΤΩΝ ΧΗΜΕΙΑΣ , Κ. ΓΙΟΥΡΗ-ΤΣΟΧΑΤΖΗ , ΕΚΔΟΣΕΙΣ
ΖΗΤΗ 20003. Classic Chemistry Demonstrations , Royal Society of Chemistry 1995