Οξέα
-
Upload
filippos-karagatslis -
Category
Education
-
view
47 -
download
3
Transcript of Οξέα

Οξέα
Εργασία στην Χημεία της:Μίνκολλα Ελισσάβετ – Σοφίας
Υπεύθυνος καθηγητής: Καραγατσλής Φίλιππος

Οξέα Μια ένωση ορίζεται ως «οξύ» για να εξηγηθεί κάποιο φαινόµενο ήκάποια αντίδραση. Ο όρος αυτοςβρίσκει ευρεία χρήση στη Χηµεία καιαντικατοπτρίζει ένα σύνολο ιδιοτήτων βολικά επιλεγµένο για µια συγκεκριµένηπερίπτωση.
Ο εκάστοτε ορισµος οξέων στοχεύει στο να τονίσει την παράλληληµεθοδολογία στην ερµηνεία χηµικώναντιδράσεων.Μερικοί από αυτούς τους ορισµούςείναι:

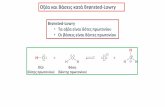
Ορισμός Τον πρώτο ορισμό για τα οξέα έδωσε το
1887 ο S. Arrhenius. Σύμφωνα με αυτόν :
Οξέα ονομάζονται οι ουσίες που όταν διαλυθούν στο νερό, διίστανται (δηλ. "διασπώνται") και αποδίδουν κατιόντα υδρογόνου (Η+ ή σωστότερα Η3Ο
+).
Έναν άλλο ορισμό για τα οξέα έδωσαν το 1923 o Βronsted
Οξέα ονομάζονται οι ουσίες που μπορούν να δώσουν πρωτόνιο (H+).

Οξέα είναι χημικές ενώσεις με σύνολο κοινών χημικών ιδιοτήτων γνωστών με τον όρο "όξινος χαρακτήρας" ή "όξινη αντίδραση".Τα οξέα μπορεί να είναι σε στερεή, υγρή ή αέρια μορφή ανάλογα με τη θερμοκρασία. Μπορούν ακόμα να υπάρξουν σε καθαρή κατάσταση αλλά και σε διάλυμα.
Παραδείγματα :1) HCl → H+ + Cl-, το υδροχλωρικό οξύ (HCl) είναι οξύ.2) HNO3 → H+ + NO3-. Το νιτρικό οξύ (ΗΝΟ3) είναι οξύ.
Θεωρία του Arrhenius (1887)Η θεωρία για τα οξέα του Arrhenius είναι μέρος της ευρύτερης θεωρίας του με τίτλο "θεωρία ηλεκτρολυτικής διάστασης". Σύμφωνα μ' αυτήν : Οξύ είναι
η ομοιοπολική υδρογονούχος ένωση του γενικού τύπου ΗxΑ (όπου Α = αλογόνο ή πολυατομικό ιόν) η οποία όταν διαλύεται στο νερό, ιοντίζεται και
αποδίδει κατιόν υδρογόνου (Η+).

Ταξινόμηση των οξέων
Τα οξέα ταξινομούνται σε πολλές κατηγορίες και με διάφορα κριτήρια :
1. Σε ανόργανα (π.χ. νιτρικό οξύ HNO3) και οργανικά (π.χ. αιθανικό οξύ
CH3COOH) ανάλογα αν μελετώνται από την ανόργανη ή την οργανική
χημεία αντίστοιχα.
2. Σε οξυγονούχα, αν περιέχουν οξυγόνο (π.χ. Θειικό οξύ H2SO4), και μη
οξυγονούχα, αν δεν περιέχουν (π.χ. υδρόθειο Η2S).
3. Σε ισχυρά, αν ιοντίζονται πλήρως και σε ασθενή, αν ιοντίζονται εν μέρει,
δηλαδη υπάρχουν στο διάλυμα και αδιάστατα μόρια και ιόντα. Ισχυρά είναι
μόνο τα : υπερχλωρικό (HClO4), νιτρικό (ΗΝΟ3), υδροχλωρικό (HCl),
υδροβρωμικό (HBr), υδροϊωδικό (ΗΙ), και θειικό (H2SO4, στο α' στάδιο
ιοντισμού) π.χ. HCl + H2O → H3O+ + Cl-. Όλα τα άλλα οξέα είναι ασθενή
π.χ.CH3COOH + H2O ⇆ CH3COO- + H3O+.

Ταξινόμηση των οξέων
Τα οξέα ταξινομούνται σε πολλές κατηγορίες και με διάφορα κριτήρια :
4. Ο Pearson (1963) υποδιαιρεί τα οξέα και τις βάσεις κατά Lewis σε σκληρά
και ήπια ή μαλακά. Τα σκληρά οξέα προέρχονται από άτομα μικρού
ατομικού αριθμού με μικρή επιδεκτικότητα πόλωσης, ενώ τα μαλακά από
άτομα μεγάλου ατομικού αριθμού με μεγάλη επιδεκτικότητα πόλωσης και
συνήθως περιέχουν d ηλεκτρόνια. Σκληρά οξέα είναι τα H+, Na+, K+,
RC+O, R+, BF3 κ.ά. Μαλακά οξέα είναι τα Cu+, Ag+, Hg+ κ.ά.
5. Σε μονοπρωτικά (ή μονοβασικά), αν αποδίδουν πρωτόνιο σε ένα στάδιο
ιοντισμού (π.χ. HCl), και σε πολυπρωτικά (ή πολυβασικά), αν αποδίδουν
πρωτόνια σε πολλά στάδια (π.χ. φωσφορικό H3PO4).

Σε ορθο-οξέα που περιέχουν τόσα άτομα οξυγόνου και υδρογόνου όσος είναι ο
αριθμός οξείδωσης του κεντρικού στοιχείου του χημικού τους τύπου π.χ.
ορθο-βορικό οξύ ή απλά βορικό οξύ (H3BO3), ορθο-πυριτικό οξύ (H4SiO4) κ.ά.
Σε μετα-οξέα τα οποία προέρχονται από τα ορθο-οξέα με αφαίρεση ενός μορίου
νερού π.χ. μετα-πυριτικό οξύ (H2SiO3) κ.ά.
Σε σύμπλοκα οξέα που προκύπτουν θεωρητικά από τα οξυγονούχα οξέα αν
αντικατασταθούν άτομα οξυγόνου από ίσο αριθμό ατόμων άλλου αμετάλλου ή
ιόντος π.χ. εξαφθοριοπυριτικό οξύ (H2SiF6) κ.ά.

Σε υπεροξυ-οξέα αν περιέχουν υπεροξειδική γέφυρα (— Ο — Ο —) π.χ.
υπεροξυνιτρικό οξύ (HNO4) κ.ά.
Σε θειοξέα που προέρχονται από τα οξοοξέα με αντικατάσταση ατόμων
οξυγόνου από θείο π.χ. θειοθειικό οξύ (H2S2O3), διθειοφωσφορικό οξύ
(H3PO2S2) κ.ά.
Σε πολυοξέα που προκύπτουν από τη συνένωση απλών οξέων με ταυτόχρονη
απόσπαση μορίων νερού π.χ. τριπυριτικό οξύ (H8Si3O10) κ.ά.

Μέτρηση του pHΟι βασικοί τρόποι με τους οποίους μπορεί να μετρηθεί το pH ενός
διαλύματος είναι οι εξής:
• Ένα πεχαμετρικό χαρτί, τοποθετημένο πάνω σε χρωματικό πίνακα
• Με τη χρήση δεικτών. Προσθέτοντας ένα δείκτη οξέος-βάσης στο
διάλυμα. Οι δείκτες οξέος-βάσης (ονομάζονται και 'ηλεκτρολυτικοί' ή
'πρωτολυτικοί' δείκτες) είναι ουσίες των οποίων το χρώμα αλλάζει ανάλογα
με το pH του διαλύματος στο οποίο προστίθενται.
Για παράδειγμα, ο δείκτης φαινολοφθαλεΐνη είναι άχρωμος όταν βρίσκεται
μέσα σε διάλυμα με pH μικρότερο του 8,2 και κόκκινος όταν το διάλυμα έχει
pH μεγαλύτερο του 8,2. Αντίθετα το βάμμα του ηλιοτροπίου είναι κόκκινο
παρουσία οξέων και μπλε παρουσία αλκαλίων.

Η χρήση ενός μόνο δείκτη έχει περιορισμένες
δυνατότητες, όσον αφορά την ακρίβεια στη μέτρηση του
pH. Παρόλ' αυτά, η χρήση περισσοτέρων δεικτών (ή ενός
δείκτη σε συνδυασμό με άλλες μεθόδους) μπορεί να
οδηγήσει σε ιδιαίτερα ακριβείς μετρήσεις. Σε ορισμένες
περιπτώσεις χρησιμοποιείται πεχαμετρικό χαρτί, δηλαδή
ειδικό χαρτί διαποτισμένο με μίγμα δεικτών.
Το πεχαμετρικό χαρτί εισάγεται στο υπό μελέτη διάλυμα,
οπότε ανάλογα με το pH αποκτά συγκεκριμένο χρώμα.
Η σύγκριση του χρώματος αυτού με ειδικούς χρωματικούς
πίνακες οδηγεί σε μια καλή προσέγγιση για το pH του
διαλύματος.
Ένα πεχαμετρικό
χαρτί, τοποθετημένο
πάνω σε χρωματικό
πίνακα

Με τη χρήση ενός πεχάμετρου.
Το πεχάμετρο είναι μία ειδική συσκευή που
χρησιμοποιεί την αρχή της ποτενσιομετρικής
μέτρησης του pH (ηλεκτρομετρική μέθοδος).
Το πεχάμετρο βοηθά στην περίπτωση που
απαιτείται ιδιαίτερη ακρίβεια στη μέτρηση του pH.


Τιμές του pH για διαλύματα συνηθισμένων ουσιών
Ουσία/Διάλυμα pH
Οξύ μπαταρίας -0,5
Διάλυμα υδροχλωρίου (HCl) 1 M 0
Γαστρικό υγρό 1,5
Χυμός λεμονιού 2,4
Κόκα-κόλα 2,5
Ξύδι 2.9
Χυμός πορτοκαλιού 3
Μπύρα 4,5
καφές 5,0
Τσάι 5,5

όξινη βροχή < 5,6
Γάλα 6,5
Καθαρό νερό 7,0
Σιέλο υγιούς ατόμου 6,5-7,4
Αίμα 7,35 – 7,45
Θαλασσινό νερό 8,0
Σαπούνι 9,0 – 10,0
αμμωνία εμπορίου 11,5
χλωρίνη 12

Όξινος χαρακτήρας
Τα οξέα όταν βρεθούν σε υδατικό διάλυμα παρουσιάζουν ένα σύνολο
κοινών ιδιοτήτων που λέγεται όξινος χαρακτήρας ή όξινη αντίδραση :
1. Έχουν ξινή γεύση.
2. Αλλάζουν ομοιόμορφα το χρώμα των δεικτών.
3. Αντιδρούν με πολλά μέταλλα σχηματίζοντας άλατα με ταυτόχρονη
έκλυση υδρογόνου Δεν αντιδρούν με τα μέταλλα που βρίσκονται μετά
το υδρογόνο στην ηλεκτροχημική σειρά των μετάλλων (χαλκός,
υδράργυρος, άργυρος, λευκόχρυσος, χρυσός).

Όξινος χαρακτήρας
4.Αντιδρούν με βάσεις σύμφωνα με το γενικό σχήμα :
Οξύ + βάση → άλας + νερό.
Με μοριακή μορφή μπορεί να γραφεί :
NaOH + HCl → NaCl + H2O.
4.Αντιδρούν με ανθρακικά άλατα οπότε εκλύεται διοξείδιο του
άνθρακα
5.Τα υδατικά τους διαλύματα έχουν 0 ≤ pH < 7 στους 25 °C.

Ένα μέσο με πολύ μεγάλη οξύτητα, γενικά μεγαλύτερη απ'
αυτήν του θειικού οξέος περιεκτικότητας 100 % w/w,
ονομάζεται "σουπερ-οξύ".
Η συνηθέστερη μέθοδος παρασκευής σουπερ-οξέων είναι με
διάλυση ενός ισχυρού οξέος κατά Lewis όπως είναι π.χ. το
πενταφθοριούχο αντιμόνιο, SbF5, σε κατάλληλο οξύ κατά
Brønsted-Lowry όπως είναι το υδροφθορικό οξύ (HF).

Τα οξέα έχουν την ιδιότητα να διαλύουν τα άλατα.
Για το λόγο αυτό, τα χρησιμοποιούμε για να καθαρίσουμε τα
άλατα που κλείνουν τους σωλήνες των αποχετεύσεων, του
μπάνιου και των διάφορων ηλεκτρικών συσκευών, όπως
καφετιέρες, ηλεκτρικά σίδερα κλπ .
ΤΑ ΟΞΕΑ ΣΤΗΝ ΚΑΘΗΜΕΡΙΝΗ ΖΩΗ

ΠΡΟΣΟΧΗ στα οξέα.
Μπορεί να είναι χρήσιμα στην καθημερινή μας ζωή,
όμως, αν είμαστε απρόσεκτοι μπορεί να αποδειχτούν
επικίνδυνα.
Πολλά οξέα παράγουν ατμούς που ερεθίζουν μάτια
αλλά και αναπνευστικό σύστημα.

Γι αυτό θα πρέπει:
•να φυλάσσονται σε αποθηκευτικούς χώρους που δεν έχουν πρόσβαση τα
παιδιά
•να φοράμε πάντα γάντια, πριν τα χρησιμοποιήσουμε
•να είναι το καπάκι κατασκευασμένο έτσι που να μη μπορεί να το ανοίξει
παιδί
•να διαβάζονται προσεκτικά οι οδηγίες χρήσης και προφύλαξης
Στις φιάλες που περιέχουν τέτοια υλικά βλέπουμε ετικέτες σαν και αυτές…

Οι χημικές αντιδράσεις είναι στην καθημερινότητά μας!
Δεν αποτελούν περίεργα σύμβολα χωρίς ουσία, που για να
έχουμε έναν καλό βαθμό, πρέπει να ξέρουμε.
Θα σας πω λοιπόν πως ακόμα και η γιαγιά μου έκανε χημικές
αντιδράσεις.
Όταν ήμουν μικρή είχα φάει τόσο πολύ που δεν μπορούσα να
αναπνεύσω. Έριξε λοιπόν η γιαγιά σε ένα ποτήρι νερό, χυμό από λεμόνι
και πρόσθεσε λίγη σόδα φαγητού.
Μου το έδωσε να το πιώ και αμέσως χώνεψα και συνήλθα.

Στην πραγματικότητα μέσα στο ποτήρι έγινε η χημική αντίδραση
ανάμεσα στο κιτρικό οξύ του λεμονιού και στη σόδα (NaHCO3 όξινο
ανθρακικό νάτριο).
Όπως έχουμε μάθει τα οξέα αντιδρούν με ανθρακικά άλατα και δίνουν
μπουρμπουλήθρες διοξείδιο του άνθρακα.
Μπορείτε να το κάνετε και στο σπίτι και να χρησιμοποιήσετε και ξύδι αντί
για χυμό λεμόνι. Το ξύδι περιέχει οξικό οξύ 7% w/v.
Η αντίδραση είναι:
CH3COOH + NaHCO3 -> CH3COONa + CO2 + H2O