Funktionelle Selektivität am Beispiel des β2-Adrenozeptors
Transcript of Funktionelle Selektivität am Beispiel des β2-Adrenozeptors
130 WISSENSCHAFT
MICHAEL T. REINARTZ, ROLAND SEIFERT
INSTITUT FÜR PHARMAKOLOGIE, MEDIZINISCHE HOCHSCHULE HANNOVER
Originally, G protein-coupled receptors were assumed to act as on-offswitches, adopting either an active (R*) or inactive (R) conformation.However, pharmacological and biophysical studies over the past 15–20years have now unequivocally shown that receptors can exist in multipleactive conformations with distinct capabilities to activate effectors. Thisconcept is referred to as functional selectivity and has important implica-tions for future drug design. Here, we discuss this fundamental pharma-cological concept using the β2-adrenoceptor as paradigm.
10.1007/s12268-014-0415-4© Springer-Verlag 2014
Vom Zweizustandsmodell zumultiplen Rezeptorkonformationenó G-Protein-gekoppelte Rezeptoren (GPCRs)stellen die wichtigste Zielstruktur für Arz-neimittel dar. Das traditionelle two-state model(Zweizustandsmodell) der Rezeptoraktivie-rung besagt, dass Rezeptoren entweder ineinem inaktiven (R) oder aktiven (R*) Zustand
vorliegen. Dabei stabilisieren Agonisten R*,wohingegen neutrale Antagonisten dasGleichgewicht zwischen R und R* nicht beein-flussen, aber eine Agonistenbindung verhin-dern. Inverse Agonisten stabilisieren R undvermindern die konstitutive Rezeptoraktivität.GPCRs interagieren in der Zellmembran mitheterotrimeren G-Proteinen. Im Ruhezustand
bindet die Gα-Untereinheit GDP. Eine Akti-vierung des Rezeptors bewirkt die GDP-Dis-soziation, und es entsteht ein ternärer Kom-plex aus Ligand-besetztem Rezeptor undNukleotid-freiem G-Protein. Die Bindung vonGTP an die Gα-Untereinheit führt zur Kom-plexdissoziation und Signalweiterleitung überEffektoren. Das Gα-Protein wird durch Hydro-lyse von GTP zu GDP und anorganischemPhosphat deaktiviert.
Das Zweizustandsmodell kann jedoch nichtalle GPCR-Wirkungen hinreichend erklären.Während der vergangenen 15 bis 20 Jahreentwickelte sich ein Modell mit multiplenaktiven Rezeptorzuständen (multiple-statemodel). Das Modell postuliert für jeden Ligan-den eine spezifische Rezeptorkonformation(R*1, R*2, ..., R*n); jede kann ein stärkeresoder schwächeres Signal über den kanoni-schen (konventionellen) oder nicht-kano -nischen (unkonventionellen) Weg bewirken.Es ergibt sich das Konzept der funktionellenSelektivität, bei der jeder Ligand eine für ihnspezifische Signalmodulierung über den ent-
Schwerpunktthema G-Protein-gekoppelte Rezeptoren
Funktionelle Selektivität am Beispieldes β2-Adrenozeptors
BIOspektrum | 02.14 | 20. Jahrgang
Biophysikalisch Gereinigter β2AR, markiert Eine der ersten Studien, welche durch Fluoreszenzspektroskopie ligandenspezifische mit umgebungssensitiven Konformationen aufzeigt [3]Fluoreszenzsonden
Pharmakologisch β2AR-Gα-Fusionsproteine in β2AR zeigt unterschiedliche pharmakologische Profile je nach Kopplungspartner Insektenzellmembranen (Gsα, Giα, Gqα); die Unterschiede sind dabei abhängig vom Liganden [4]
Pharmakologisch β2AR mit Fluoreszenzsonden, Agonist-induzierte Konformationsänderungen des β2AR werden fluoreszenzbasiert (FRET) exprimiert in HEK293-Zellen für die endogenen Liganden Adrenalin und Noradrenalin nachgewiesen [5]
Biophysikalisch Gereinigter β2AR, rekonstituiert Nachweis ligandenspezifischer Konformationen mittels Einzelmolekül-Kraftspektroskopie in Phospholipidvesikel (single-molecule force spectroscopy) [6]
Pharmakologisch β2AR exprimiert in HEK293- Einige klassische β2AR-Antagonisten inhibieren die cAMP-Akkumulation, können aber Zellen gleichzeitig Signale über β-Arrestin stimulieren [8]
Impedanzmessungen an intakten Zellen detektieren Unterschiede in der kombinierten Signalweiterleitung einzelner Liganden [9]
Pharmakologisch Endogener β2AR in menschlichen β2AR-Agonisten zeigen unterschiedliche pharmakologische Profile bezüglich cAMP-neutrophilen Granulozyten Produktion und Inhibition der Sauerstoffradikal-Produktion im nativen System
(weitere Details in Abb. 2) [10]
Pharmakologisch In vivo im Asthma-Mausmodell Spezifische Wirkungen von β2AR-Liganden auf die Überempfindlichkeit der Atemwege sind im Mausmodell nachweisbar [14]
Tab. 1: Überblick über wichtige Studien zur funktionellen Selektivität des β2-Adrenozeptors (β2AR).
Weitere Beispiele für funktionelle Selektivität von GPCRs in [7].
Art der Studie Untersuchtes System Wichtigste Befunde Referenz
132 WISSENSCHAFT
BIOspektrum | 02.14 | 20. Jahrgang
sprechenden GPCR hervorrufen kann (inAbb. 1 und Tab. 1 beispielhaft dargestellt fürden β2-Adrenozeptor – β2AR, auch β2-adre-nerger Rezeptor genannt). Die Untermaue-rung dieses Konzepts mit funktionellen undstrukturellen Analysen war ein Aspekt derForschung von Robert Lefkowitz (Duke Uni-versity) und Brian Kobilka (Stanford Univer-sity), die 2012 mit dem Chemie-Nobelpreisgewürdigt wurde [1, 2].
β2AR, ein prototypischer GPCRDer β2AR ist der am besten untersuchte GPCRund vermittelt nach Ligandenbindung beikanonischer Kopplung über Gs-Proteine eineStimulation der Adenylylzyklase und einenAnstieg der cAMP-Konzentration. Schon frü-he fluoreszenzspektroskopische Untersu-chungen im Labor von Brian Kobilka deutetenauf die Stabilisierung unterschiedlicherRezeptorkonformationen durch die Partial -agonisten Ephedrin, Dobutamin und Salbu-tamol hin (Tab. 1). In seiner Arbeitsgruppewurden Mitte der 1990er-Jahre außerdemFusionsproteine aus β2AR und Gα-Proteinengeneriert, um Kristalle eines ternären Kom-plexes zu erhalten. Dies gelang zwar erst vie-le Jahre später mit vollkommen anderenMethoden, doch konnten wir die Fusions-proteinkonstrukte dazu nutzen, die Kopplungdes Rezeptors an unterschiedliche G-Protein-
Klassen (Gs, Gi, Gq) pharmakologisch zu unter-suchen. Dabei fanden wir erhebliche ligan-denspezifische Unterschiede als weitere Hin-weise für funktionelle Selektivität [4]. Hoch-sensitive fluoreszenzbasierte Messungendeckten dann ligandenspezifische intramo-lekulare Bewegungen des Rezeptors auf [5].Die Einzelmolekül-Kraftspektroskopie (single-molecule force spectroscopy) erlaubte eine nochgenauere Analyse von Unterschieden in derRezeptorkonformation mit verschiedenenLiganden [6]. Diese und weitere biophysika-lische und pharmakologische Studien amβ2AR festigten das multiple-state-Modell(Tab. 1; Übersicht in [7]).
GPCRs = 7TMRsDie Entdeckung G-Protein-unabhängiger Sig-nalwege führte zur allgemeinen Bezeichnungder GPCRs als „Sieben-Transmembrandomä-nen-Rezeptoren“ (7TMRs). β-Arrestin ist derprominenteste G-Protein-unabhängige Sig-nalpartner des β2AR und aktiviert Mitogen-aktivierte Proteinkinase(MAPK)-vermittelteSignalkaskaden. Beim Vergleich von G-Pro-tein- und β-Arrestin-vermittelten Wirkungenstellte man hochgradige ligandenspezifischeUnterschiede fest: Klassische Antagonisteninhibieren, wie erwartet, G-Protein-induzier-te Effekte, gleichzeitig zeigen einige Antago-nisten aber stimulierende Wirkung auf
β-Arrestin [8]. Damit ist klar: Ein Ligand kannnicht ausschließlich nach Wirkstärke klassi-fiziert werden; der entsprechende Signalwegist immer mit zu benennen.
Funktionelle Selektivität in intaktenZellenDie selektive Inhibition von Signalwegen stellteine wichtige Strategie dar, um ligandenspe-zifische Wirkungen gegeneinander abzu-grenzen. Selektive Toxine und pharmakolo-gische Inhibitoren erlaubten den Nachweisfunktioneller Selektivität am β2AR mittelsImpedanzmessungen, einer holistischenMethode zur Bestimmung der Zellaktivierung[9]. Für den Nachweis funktioneller Selekti-vität auch in nativen humanen Zellen eignensich neutrophile Granulozyten [10]. Diese Zel-len sind leicht aus Blut zu isolieren, besitzeneinen funktionellen β2AR und sind patho-physiologisch relevante Zellen des Immun-systems. Eine β2AR-Aktivierung inhibiert indiesen Zellen die Produktion von Sauerstoff-radikalen (O2
·–) (Abb. 2A).Wir charakterisierten pharmakologisch
β2AR-Liganden hinsichtlich der Stimulationder cAMP-Akkumulation und Inhibition derProduktion von Sauerstoffradikalen [10]. Bis-lang ging man davon aus, dass ein Gs-indu-zierter cAMP-Anstieg die inhibierende Wir-kung auf die NADPH-Oxidase (NOX) ver-mittelt. Die parallele Untersuchung zeigtejedoch ligandenspezifische Dissoziationen:Ephedrin und Dichlorisoproterenol bewirk-ten keine cAMP-Akkumulation in den Zellen;dennoch wurde die Produktion von Sauer-stoffradikalen partiell inhibiert. Folglich spiel-ten cAMP-unabhängige Signalprozesse eineRolle bei der NOX-Hemmung – ein Hinweisauf funktionelle Selektivität.
Quantifizierung funktionellerSelektivitätIm Laufe der Jahre wurden unterschiedlicheMethoden entwickelt, um funktionelle Selek-tivität von Liganden (biased agonism) zu quan-tifizieren. Terry Kenakin und Arthur Chris-topoulos haben dieses Konzept in einemaktuellen Übersichtsartikel diskutiert [11].Hier zeigen wir die pharmakologische Ana-lyse von Konzentrations-Wirkungs-Daten(Abb. 2B, C), die an neutrophilen Granulo-zyten erhoben wurden [10]. Der hyperboli-sche Kurvenverlauf des bias plots stellt denbei gleichen Ligandkonzentrationen generellstärkeren Agonisteffekt auf die O2
·–-Inhibi-tion im Vergleich zur cAMP-Akkumulationdar (Abb. 2D). Der kombinierte Parameter
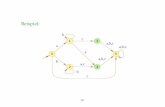
˚ Abb. 1: Liganden stabilisieren spezifische Konformationen des β2-Adrenozeptors (β2AR*1,β2AR*2, ...) und aktivieren verschiedene Signalwege (Gsα, Giα, ...) unterschiedlich effektiv undpotent. Die Kombination der Effektoren entscheidet die Richtung (z. B. AC, MAPK) der Zellantwort.Vergleicht man dies mit dem Klang eines Klaviers, so hängt dieser davon ab, welche Taste mit welcher Intensität gespielt wird: Schlägt der Pianist eine Note hart an, so können andere übertöntwerden, aber auch leise Töne tragen zur Gesamtkomposition bei. AC: Adenylylzyklase, β-Arr:β-Arrestin, MAPK: Mitogen-aktivierte Proteinkinase, PLC: Phospholipase C.
134 WISSENSCHAFT
BIOspektrum | 02.14 | 20. Jahrgang
aus Wirkstärke und Affinität des Agonistenlog(τ/KA) ergibt sich nach Anwendung einespharmakologischen Modells mittels nicht-linearer Regression (Abb. 2E, [11]). Um diefunktionelle Selektivität eines Liganden vonVerzerrungen durch unterschiedliche Ver-suchssysteme zu bereinigen, ist es notwen-dig, die Ligandeneffekte relativ zu einer Refe-renzsubstanz (hier der endogene Ligand Adre-nalin) zu quantifizieren. Am Ende steht derΔΔlog(τ/KA)-Wert und damit eine Gegen-überstellung der zwei untersuchten Signalefür jeden Liganden (Abb. 2F, G). Es ist zubeachten, dass der neutrale Antagonismusvon Dichlorisoproterenol und Ephedrin bezüg-lich der cAMP-Akkumulation aufgrund derflachen Kurve nicht oder mit hohem Fehler
abgebildet wird. Nur Liganden, die in beidenuntersuchten Parametern mindestens einepartielle Aktivierung bewirken, können quan-tifiziert werden: Isoproterenol und Salbuta-mol sind im Vergleich cAMP versus O2
·– funk-tionell kaum selektiv, Dobutamin zeigt einenbias in Richtung O2
·–-Inhibition. Abbildung2B–G zeigt, dass es keine perfekte Methodezur Analyse funktioneller Selektivität gibt,sondern dass sich die Ansätze auf den ver-schiedenen Analyseebenen miteinanderergänzen.
AusblickFunktionelle Selektivität wurde auch an vie-len anderen GPCRs untersucht. So zeigtenBock et al., dass der muskarinische M2-Ace-
tylcholinrezeptor ligandenspezifisch an Gs-oder Gi-Proteine koppelt [12]. Chen et al.beschrieben Dopamin-D2-Rezeptor-Liganden,die selektiv β-Arrestin aktivieren und überdiesen nicht-kanonischen Mechanismus anti-psychotische Wirkung in einem in vivo-Modell entfalten [13]. Funktionelle Selekti-vität kann einen wichtigen Beitrag zur Ent-wicklung effizienterer und sicherer Arznei-stoffe leisten. Ein Schwerpunkt zukünftigerForschung auf dem Gebiet der funktionellenSelektivität wird es sein, in vivo-Systeme zuanalysieren und die therapeutische Relevanzin klinischen Studien zu untersuchen. Dieersten vielversprechenden Schritte in dieseRichtung sind bereits gemacht worden[13, 14].
˚ Abb. 2: Analyse funktioneller Selektivität in neutrophilen Granulozyten. A, Die Formylpeptidrezeptor(FPR)-induzierte Sauerstoffradikal(O2·–)-Produk-
tion wird über den β2-Adrenozeptor (β2AR) inhibiert. B, C, Konzentrations-Wirkungskurven für verschiedene Parameter [10]. D, Auftragung der Ligan-deneffekte bei gleichen Konzentrationen für verschiedene Parameter (bias plot). E, ligandenspezifische Transduktionskoeffizienten log(τ/KA). F, Derbias für einen der beiden Effekte (Δlog(τ/KA)) wird durch Relation zu einem Referenzliganden (hier Adrenalin) Assay-unabhängig dargestellt(ΔΔlog(τ/KA)). G, Datentabelle für die grafischen Darstellungen von Δlog(τ/KA) und ΔΔlog(τ/KA). H, Abkürzungen und Formel des angewendetenModells (siehe auch [11]).
A
D E F
GH
B C
BIOspektrum | 02.14 | 20. Jahrgang
DanksagungDie hier zitierten eigenen Arbeiten wurden von der Deutschen For-schungsgemeinschaft unterstützt. ó
Literatur[1] Reiter E, Ahn S, Shukla AK et al. (2012) Molecular mechanism of β-arrestin-biasedagonism at seven-transmembrane receptors. Annu Rev Pharmacol Toxicol 52:179–197[2] Deupi X, Kobilka BK (2010) Energy landscapes as a tool to integrate GPCR structure,dynamics, and function. Physiology (Bethesda) 25:293–303[3] Gether U, Lin S, Kobilka BK (1995) Fluorescent labeling of purified β2 adrenergicreceptor. Evidence for ligand-specific conformational changes. J Biol Chem 270:28268–28275[4] Wenzel-Seifert K, Seifert R (2000) Molecular analysis of β2-adrenoceptor coupling toGs-, Gi-, and Gq-proteins. Mol Pharmacol 58:954–966[5] Reiner S, Ambrosio M, Hoffmann C et al. (2010) Differential signaling of the endoge-nous agonists at the β2-adrenergic receptor. J Biol Chem 285:36188–36198[6] Zocher M, Fung JJ, Kobilka BK et al. (2012) Ligand-specific interactions modulatekinetic, energetic, and mechanical properties of the human β2 adrenergic receptor.Structure 20:1391–1402[7] Seifert R (2013) Functional selectivity of G-protein-coupled receptors: from recombi-nant systems to native human cells. Biochem Pharmacol 86:853–861[8] Drake MT, Violin JD, Whalen EJ et al. (2008) β-arrestin-biased agonism at the β2-adre-nergic receptor.J Biol Chem 283:5669–5676[9] Stallaert W, Dorn JF, van der Westhuizen E et al. (2012) Impedance responses revealβ2-adrenergic receptor signaling pluridimensionality and allow classification of ligandswith distinct signaling profiles. PLoS One 7:e29420[10] Brunskole-Hummel I, Reinartz MT, Kälble S et al. (2013) Dissociations in the effectsof β2-adrenergic receptor agonists on cAMP formation and superoxide production inhuman neutrophils: support for the concept of functional selectivity. PLoS One 8:e64556[11] Kenakin T, Christopoulos A (2013) Signalling bias in new drug discovery: detection,quantification and therapeutic impact. Nat Rev Drug Discov 12:205–216[12] Bock A, Merten N, Schrage R et al. (2012) The allosteric vestibule of a seven trans-membrane helical receptor controls G-protein coupling. Nat Commun 3:1044[13] Chen X, Sassano MF, Zheng L et al. (2012) Structure-functional selectivity relations-hip studies of β-arrestin-biased dopamine D2 receptor agonists. J Med Chem 55:7141–7153[14] Callaerts-Vegh Z, Evans KLJ, Dudekula N et al. (2004) Effects of acute and chronicadministration of beta-adrenoceptor ligands on airway function in a murine model ofasthma. Proc Natl Acad Sci USA 101:4948–4953
Korrespondenzadresse:Prof. Dr. Roland SeifertInstitut für PharmakologieMedizinische Hochschule HannoverCarl-Neuberg-Straße 1D-30625 HannoverTel.: 0511-532-2805Fax: [email protected]/213.html
AUTORENMichael T. ReinartzJahrgang 1983. 2008 Bachelor in Chemischer Biolo-gie an der TU Dortmund. 2010 Master in Biomedizinan der Medizinischen Hochschule Hannover (MHH).Seit 2010 Doktorand am Institut für Pharmakologieder MHH.
Roland SeifertJahrgang 1960. 1979–1985 Medizinstudium an derFU Berlin. 1986 Promotion. 1992 Habilitation fürPharmakologie und Toxikologie. 1995–1998 For-schungsaufenthalt bei Prof. Dr. Brian Kobilka an derStanford University, CA, USA. 1998–2004 AssociateProfessor für Pharmakologie an der University of Kan-sas, Lawrence, USA. 2004–2008 Lehrstuhl inhaberfür Pharmakologie an der Universität Regensburg.Seit 2008 Direktor des Instituts für Pharmakologieder Medizinischen Hochschule Hannover. 2014 Tagungspräsident für die 80. Jahrestagung der DGPTin Hannover.