Unidad III cinetica enzimatica
-
Upload
reina-hadas -
Category
Documents
-
view
1.939 -
download
6
Transcript of Unidad III cinetica enzimatica
Universidad de Oriente
Núcleo Bolívar
Escuela de Ciencias de la Salud “Francisco Batisttini”
Dpto. de Ciencias Fisiológicas: Bioquímica
Profesora: Zulay Castillo Pérez
Proteínas con actividad catalítica de los seres vivos.
Unidades del Metabolismo
Regulan la velocidad de las reacciones químicas espontáneas
(ΔG-).
No promueven reacciones no-espontáneas (Δ G +).
Incrementan la velocidad de reacción 103 a 1012 veces sin afectar
el sentido de la reacción.
No forman parte del producto de la reacción.
Catalizador de origen biológico y naturaleza proteica, de alto peso
molecular y conformación tridimensional característica, acelera la
reacción al disminuir la energía de activación.
Contiene un centro activo, generalmente situado en un entorno
apolar. La actividad catalítica requiere que dicho centro adopte una
conformación determinada, mantenida por el resto de la molécula
proteica.
No hacen factibles las reacciones imposibles
Son sustancias que, sin consumirse en una reacción, aumentan
notablemente su velocidad.
Ello hace posible que en condiciones fisiológicas tengan lugar
reacciones que sin catalizador requerirían condiciones extremas de
presión, temperatura o pH.
Prácticamente todas las reacciones químicas que tienen lugar en
los seres vivos están catalizadas por enzimas.
* En su mayoría son proteínas, hay ARN con capacidad catalítica (ribozimas)
Aumentan la velocidad de reacción
De 106 a 1012 veces vs sin enzima.
Aún más rápido que los catalizadores químicos.
Condiciones de reacción
Temperatura 25-40 o C (algunas hasta 75 o C)
pH neutro (5-9), la mayoría 6.5 – 7.5
Presión atmosférica normal
Capacidad de regulación
Por concentración de sustrato
Por concentración de enzima
Por inhibidores competitivos (semejantes al sustrato)
Por inhibidores no competitivos (modificación covalente de la enzima)
Por regulación alostérica
Alta especificidad de reacción
Interacción estereoespecífica con el sustrato
No hay productos colaterales.
Las enzimas simples están constituidas por proteína sin
requerir de la unión de otra molécula o grupo químico para
realizar su actividad catalítica.
Las enzimas conjugadas poseen en su estructura una parte
no protéica esencial para su funcionamiento que según su
naturaleza puede llamarse cofactor o coenzima.
Apoenzima: fracción protéica
Cofactor: grupo que se une a la fracción protéica para
permitir el correcto funcionamiento de la enzima.
Holoenzima: fracción protéica + cofactor o coenzima
Átomo, ion o molécula que participa en el proceso catalítico
sin ser enzima ni sustrato.
Los cofactores participan de dos maneras distintas:
A través de una fijación muy fuerte a la proteína y salen sin
ser modificados del sitio catalítico.
Como un segundo substrato; salen modificados del sitio
catalítico y por lo general requieren otra enzima para volver al
estado original.
En función de su naturaleza los cofactores se denominan:
Grupos prostéticos: se trata de iones o moléculas inorgánicas.
Coenzima: es una molécula orgánica. Aquí se puede señalar, que
muchas vitaminas funcionan como coenzimas; y realmente las
deficiencias producidas por la falta de vitaminas responde más bien
a que no se origina la coenzima, para una determinada enzima.
Tiamina B1 Tiamina pirofosfato
RiboflavinaFAD (Flavín adenín dinucleótido), FMN
(Flavín mononucleótido)
Piridoxina PLP (Piridoxal fosfato)
Cobalamina Metilcobalamina, cobamida
Ácido pantoténico Coenzima A (CoA)
NicotinamidaNAD+ (Nicotín adenín dinucleótido) Y NADP+
(Nicotín adenín dinucleótido fosfato)
Ácido lipoico Lipoamida
Ácido fólico THF (Tetrahidrofolato)
Hemo Hemoenzimas , citocromos
Complejos Fe-S Ferredoxinas
Quinonas Transporte electrónico mitocondrial y
fotosintético
Glutatión Redox, transporte de aminoácidos
ATP Transferencia de fosfato y/o energía
UTP Transferencia de grupos glucosídicos
Carnitina Transportador de grupos acilo
Región de la enzima donde se une la molécula de sustrato de
forma específica, suele ser un bolsillo o una hendidura que se
forma entre las cadenas laterales de los aminoácidos.
Estas cadenas:
• Facilitan la unión del sustrato (especificidad de sustrato)
• Intervienen en la catálisis (centro catalítico)
Supone una porción relativamente
pequeña del volumen total de la
enzima
Es una entidad tridimensional
Se unen a los sustratos por fuerzas
relativamente débiles
Son hoyos o hendiduras de las que
suele quedar excluida el agua, salvo
que sea un componente de la
reacción
La especificidad del enlace depende
de la disposición de los átomos
del centro activo
Lugar de la enzima en el que ocurre la catálisis y puede
incluir también:
• Coenzimas
• Cofactores
Puede coincidir o no con el centro activo
En 1958, Koshland propuso el modelo del ajuste inducido
Conformación del estado de transición
Sitio activo
Estereoespecificidad
Centros activos asimétricos: sólo L-aminoácidos
Capacidad de distinguir entre estereoisómeros
Especificidad geométrica
Grupos químicos que interactúan con el sitio activo
Más limitante que la estereoespecificidad
Enzimás digestivas: más “preferencia” que “especificidad”
Antiguamente, las enzimas recibían nombres particulares, asignados
por su descubridor.
Ejemplo:
amilasa (hidroliza el almidón)
Glc + ATP Glc-6P + ADP
Al ir aumentando el número de enzimas conocidos, se hizo necesaria
una nomenclatura sistemática que informara sobre la acción
específica de cada enzima y los sustratos sobre los que actuaba.
Consta actualmente de 3 partes:
el sustrato preferente
el tipo de reacción realizado
terminación "asa"
Ejemplo: la glucoquinasa
ATP-glucosa-fosfo-transferasa
Glc + ATP Glc-6P + ADP
El nombre es identificado por un código numérico:
Encabezado por las letras EC (enzyme commission), seguidas de
cuatro números separados por puntos:
el primer número indica a cual de las seis clases pertenece la
enzima,
el segundo se refiere a distintas subclases dentro de cada
grupo,
el tercero y el cuarto se refieren a los grupos químicos
específicos que intervienen en la reacción.
Ej.: ATP:glucosa fosfotransferasa (glucoquinasa)
Glc + ATP Glc-6P + ADP
EC 2.7.1.2.
2: transferasa
7: fosfotransferasa
1: el aceptor es un grupo OH
2: es un OH de la D-glucosa el que acepta el grupo
fosfato.
Catalizan reacciones de transferencia de hidrógeno (H) o
electrones (e-) de un sustrato a otro
AH2 + B ⇄ A + BH2
Ared + Box ⇄ Aox + Bred
Catalizan la transferencia de un grupo químico (distinto
del hidrógeno) de un sustrato a otro
A-B + C ⇄ A + C-B
Catalizan la unión de dos sustratos con hidrólisis simultánea de un
nucleótido trifosfato (ATP, GTP, etc.)
A + B + XTP A-B + XDP + Pi
Perfil energético de una
reacción espontánea
Perfil energético de una
reacción catalizada
La acción de los catalizadores consiste en disminuir la Energía de
activación.
Las enzimas son catalizadores especialmente eficaces, ya que
disminuyen la energía de activación, aún más que los catalizadores
inorgánicos.
Por ejemplo, la descomposición del agua oxigenada (H2O2) puede ocurrir:
sin catalizador Ea= 18 Kcal/mol
con un catalizador inorgánico (platino) Ea= 12 Kcal/mol
con una enzima específico (catalasa) Ea= 6 Kcal/mol
Así, se puede calcular que el platino acelera la reacción 20.000
veces, mientras que la catalasa la acelera 370.000 veces.
Para que una reacción química tenga lugar, las moléculas de los reactantes
deben chocar con una energía y una orientación adecuadas.
La enzima :
Aumenta la concentración efectiva de los sustratos (aumenta la
probabilidad de choque)
Permite que los reactantes (sustratos) se unan a su centro activo con
una orientación óptima para que la reacción se produzca y
Modifica las propiedades químicas del sustrato unido a su centro
activo, debilitando los enlaces existentes y facilitando la formación de
otros nuevos
Estudio cuantitativo de la catálisis enzimática que proporciona
información sobre las velocidades de reacción, afinidad de las
enzimas por su sustrato, mecanismos de reacción y los
inhibidores
Aplicación:
- Mejor comprensión de las rutas metabólicas
- Diseño de tratamientos más adecuados
Velocidad de una reacción bioquímica: Cambio de la
concentración de un reactante o un producto por unidad de
tiempo
1. Concentración de sustrato
2. Concentración de enzima
3. pH
4. Temperatura
5. Efectores (Activadores e Inhibidores)
La velocidad inicial Vo de la reacción A → P , donde A= Sustrato y P=Producto, es:
Es proporcional a la frecuencia con que las moléculas reactantesforman el producto, la velocidad de reacción es
- Δ[A] Δ[P]Vo=
ΔtΔt=
Donde
[A]= concentración de sustrato
[P]= concentración del producto
T= tiempo
Vo= K [A]x Donde
Vo= velocidad
K= constante de velocidad (temp, pH, fuerza iónica)
X= orden de reacción
Reacción de Primer Orden:
La velocidad es proporcional a la
concentración de sustrato
Reacción de Orden Cero:
Independientemente de la
concentración de sustrato, la
velocidad es constante
Orden de Reacción: Suma de los componentes de los
términos de concentración en la expresión de velocidad
Modelo propuesto por Leonor Michaelis y Maud Menten en
1913
Hipótesis del Estado Estacionario: establece que [ES] se
mantiene casi constante durante gran parte de la reacción
E + S ES E + P
k1
K-1
k2
Donde:
K1= constante de velocidad de la
formación de ES
K-1= constante de velocidad de la
disociación de ES
K2= constante de velocidad de la
formación y liberación del
producto del lugar catalítico
K1 [E][S]=K-1 [ES] + K2 [ES]
Inducen una nueva constante: Km (Constante de Michaelis)
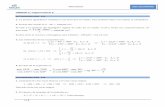
Ecuación de Michaelis-Menten:
vV s
K sm
max
Donde
Vmax= velocidad máxima
Km= constante de Michaelis
[S]= concentración del
sustrato
Km=K-1 + K2
K1
Representa la Ecuación de Michaelis-Menten
Km (Constante de Michaelis): mide laconcentración del sustrato a la que laenzima tiene la mitad de la velocidadmáxima (Vmáx/2)
Vmáx: Se alcanza cuando todos los centroscatalíticos de la enzima se encuentranocupados por sustrato
Km y Vmax se determina midiendo las velocidades iniciales de reacción a varias [S]
No todas las enzimas cumplen las condiciones
(Enzimas alostéricas)
Difícilmente aplicable a reacciones con dos
sustratos
No se puede determinar con exactitud Vmax ni
Km (Hipérbola rectangular, nunca llega a Vmax)
Unidades Internacionales (UI): Cantidad de enzima
necesaria para producir 1 μmol de producto/minuto
Nueva Unidad: Katal
Cantidad de enzima que transforma 1 mol de
sustrato/segundo (6 x 107 UI)
Grado de Pureza: Actividad Específica. Número de UI
en 1 mg de proteína
Consiste en representar la recíproca de la ecuación de
Michaelis-Menten
Resultado: línea recta
Pendiente: Km/Vmax
Corte en ordenada: 1/Vmax
Corte en Abscisa (extrapolado): -1/Km
1
v0
KM
Vmax
1
S
1
Vmax
Donde:
y = 1/Vo
x = 1/[S]
m = Km/Vmáx
b = 1/VmáxY = mx + b
Inhibidores: moléculas que reducen la actividad de una enzima
(fármacos, antibióticos, conservantes alimentarios, venenos)
- Importante para regular las rutas metabólicas
- Tratamiento clínico
Tipos de Inhibición Enzimatica:
Isostérica: Reversible (competitiva, acompetitiva y no
competitiva) e Irreversible
Alostérica
El inhibidor competitivo es muy similar al sustrato normal
de la enzima. Dada esa similitud estructural, este tipo de
inhibidor se une reversiblemente al sitio activo de la
enzima.
Varia el Km, en presencia del inhibidor Vmáx, no es alcanzada. Puede ser superada al aumentar la [S]
El inhibidor se combina sólo con ES, por lo que el inhibidor ejerce su efecto sólo a altas concentraciones de sustrato en las que hay gran cantidad de
complejo enzima-sustrato (ES).
Aumenta el Km, disminuye Vmáx y mantiene Km/Vmáx
El inhibidor se combina con la enzima en un lugar distinto al
sitio activo.
Tanto EI como EIS se forman:
Mantiene el Km disminuye Vmáx y
aumenta Km/Vmáx
Los inhibidores irreversibles reaccionan con un grupo químico de la enzima,
modificándola covalentemente, su acción no se describe por una constante
de equilibrio, sino por una constante de velocidad:
E + I E’
A diferencia de la inhibición reversible, el efecto de los inhibidores
irreversibles depende del tiempo de actuación del inhibidor.
Los inhibidores irreversibles son, por lo general, altamente tóxicos.
Algunos tipos de inhibidores irreversibles
1. Reactivos de grupos -SH
2. Organofosfóricos
3. Ligandos de metales
4. Metales pesados
Sustratos suicidas:
(Inhibidores activados enzimáticamente)
E + I EI EI* E’ + I*1 2 3
1. El inhibidor se unen al centro activo de la enzima, de manera específica, igualque el substrato o un inhibidor competitivo convencional
2. La acción catalítica de la enzima convierte al inhibidor I en una especiealtamente reactiva I*
3. I* modifica covalentemente a la enzima, inactivándola de forma definitiva aligual que un inhibidor irreversible.
Tienen por tanto:
(a) la especificidad del inhibidor competitivo y
(b) la potencia de los inhibidores irreversibles
Ejemplo: Sistema de la b-lactamasa bacteriana
La utilización masiva de antibióticos b-lactámicos(penicilinas, sus derivados semisintéticos ycefalosporinas) ha conducido a la aparición deresistencias a los mismos.
Los microorganismos resistentes a estosantibióticos lo son por producir una enzima, la b-lactamasa, que inactiva a los antibióticos b-lactámicos.
R CO NHS
N
O
CH3
CH3
COO-
R CO NHS
HN
CH3
CH3
COO-
CO
O-
-Lactamasa
Penicilina (activa)
Ác.peniciloico (inactivo)
Características:
También llamadas regulables, la actividad de la enzima seafecta por moléculas efectores que se unen en otros lugares;sitios alostéricos o regulables
Catalizan pasos reguladores claves de las rutas bioquímicas
La regulación puede ser:
Activación alostérica: enzima aumenta afinidad por elsustrato (disminuye su Km), así como su velocidad de catalisis
Inhibición alosterica: efectores negativos.
Características:
Cinéticamente no sigue el
comportamiento catalítico de MM
- Gráfica: curva sigmoidea o
hiperbólica
La presencia de una sigmoide
implica la existencia de
cooperatividad en la fijación del
substrato
Vo
[S]
La cooperatividad (positiva) consiste en que la fijación de unamolécula de substrato favorece la fijación del siguiente, y así hastaocuparse toda la molécula
s s s ss s
s
s
s s
+ + +
1 2 3
En términos de Km veríamos que Km1 > Km2 > Km3
Existe también cooperatividad negativa, cuando la fijación deuna molécula de substrato dificulta la fijación del siguiente.
Enzimas Alostéricas
1. Monad, Wyman y Chanqeux (MWC)
1. Kosland, Nemethy y Filmes (KNF)
2. Eigen (Eig)
s
s s s s s
ss s
s
ii i i i i
i i i
i
Forma R
Forma T
Los inhibidores alostéricos aumentan
el grado de cooperatividad
Los activadores alostéricos
disminuyen el grado de
cooperatividad; a concentraciones
elevadas de activador, la cinética
pasa a ser michaeliana, y deja de ser
sigmoide.
Inhibidores y activadoresalostéricos
s
0 2 4 6 8 10 12
Y
0.0
0.2
0.4
0.6
0.8
1.0
Activador
Inhibidor
Sin
Inhibición
s si
Centro
activoCentro
alostérico
Centro
alostérico
Centro
activo
En ausencia de inhibidor, el sustratose fija normalmente al centro activo
Cuando el inhibidor ocupa el centroalostérico, tiene lugar un cambioconformacional en el centro activo queimpide la fijación del sustrato
La mayoría de las enzimas catalizan reacciones con dos
o más sustratos
Varios mecanismos posibles
- Orden de unión de los sustratos
- Orden de liberación de los productos
Determinación más compleja que en las enzimas
monosustrato
- Para cada sustrato hay Km, Kcat y Vmax
Secuencial Ordenado
Secuencial Aleatorio
Mecanismo secuencial
o de desplazamiento
simple:
adición de todos los
sustratos para poder
obtener los productos
Mecanismo de doble desplazamiento o ping pong:
No se han unidos todos los sustratos cuando ya hay
salida de productos
Catálisis Covalente
- Grupo reactivo que se une transitoriamente mediante enlace
covalente
Catálisis Ácido-Base
- Molécula diferente de H2O acepta o cede protón
Catálisis por Iones Metálicos
- Varias funciones, dependiendo de la reacción
Catálisis por Aproximación
Catálisis por unión del Estado de Transición
Quimotripsina: proteasa que rompe enlaces
peptídicos adyacentes a los aminoácidos aromáticos
Catálisis Covalente
- Unión irreversible con el diisopropilfluorofosfato
(DFP)
- Actividad de residuo clave, Ser 195
Catálisis Ácido-Base
- Otros dos elementos de “triada catalítica”
- Asp 102 e His 57
Aprox. 30% de las enzimas usan iones metálicos:
- Metaloenzimas unidas fuertemente a metales de
transición: Fe2+, Fe3+, Cu2+, Zn2+, Mn2+ o Co3+
- Metaloenzimas unidad débilmente a metales en
solución: Na+, K+, Mg2+ o Ca2+
Mecanismos:
- Enlace con el sustrato para permitir su adecuada
orientación
- Participación del metal en mecanismos de
oxidorreducción
- Estabilizador de la reacción al atraer cargas negativas
del sustrato
Observada en reacciones con varios sustratos
- Reactantes se encuentran en relación espacial
óptima
Proximidad: acercamiento simple de las moléculas
- Aumentos de velocidad de hasta 5x
Orientación: acercamiento de los grupos
Uno de los mecanismos más importantes
- Enzima tiene mayor afinidad por el estado
de transición que por los sustratos o
productos
Conjuntamente con los demás, es
responsable de los grandes aumentos de
velocidad
Las rutas bioquímicas están organizadas en reacciones químicas
catalizadas por enzimas, donde la regulación se hace más compleja
Razones de la regulación:
- Mantenimiento de un estado ordenado
- Conservación de la energía
- Respuestas a las variaciones ambientales
Se realiza:
- Regulación de la concentración enzimática
- Regulación de la actividad intrínseca de la enzima
1. Regulación alostérica
2. Regulación por modificación covalente
Regulación alostérica
Procesos a nivel celular; regulación de ajuste fino de la actividadenzimática, a través de efectos de retroalimentación (negativao positiva)
Regulación por modificación covalente
Procesos a nivel supracelular (orgánico); regulación a gran escalade actividades enzimáticas, a través de modificación covalentede enzimas, provocadas por señales (transducción de señales)
Retroalimentación Negativa en Vías Metabólicas
Thr a-cetobutirato IleTreonina
desaminasa
Síntesis de Isoleucina
El producto final de la ruta, Isoleucina, inhibe a la primeraenzima de la misma, Treonina desaminasa
Regulación alostérica
Suele haber fenómenos de modificación covalente deenzimas en la respuesta celular a señales químicas:
1. Neurotransmisores
2. Hormonas
3. Factores de crecimiento
4. Estímulos morfogenéticos y de diferenciación
5. Muerte celular programada (apoptosis)
6. Estímulos antigénicos
7. Luz y otros agentes físico-químicos
Fosforilación: Protein kinasas
Sobre residuos de Ser, Thr y Tyr
Ser
ATP ADP
Ser
C
N
C
C
N
C
C
N
CH2OH
O
H
R
H
O
R'
H
H
H
H
C
N
C
C
N
C
C
N
CH2O
O
H
R
H
O
R'
H
P O-
O
O-
H
H
H
Defosforilación: Protein fosfatasas
Sobre residuos previamente fosforilados: Ser-P, Thr-P, Tyr-P
Adenilación.Sistema de la Glutamina sintetasa
Tyr
O
OH OH
N
N N
N
H2NC
N
C
C
N
C
C
N
O
H
R
H
O
R'
H
CH2 O P
O
O-
O CH2
H
H
H
ADP-ribosilación. Actúa NAD+ como donador del grupo ADP-ribosa
H
H
H
O
OH OH
N
N N
N
H2N
+
C
N
C
C
N
C
C
N
O
H
R
H
O
R'
H
NHC
NH2
N
O
OH OH
CH2 O P O P O CH2
O O
O-O-H
Son variantes de una misma enzima. Formas
físicamente distintas de una enzima pero que catalizan
una misma reacción
Enzimas multiméricas con varios tipos de subunidades
- LDH: cuatro cadenas, tipos M y H
- 5 isoenzimas diferentes
- Preferencia por reacciones diferentes
Permite ajustes sutiles en función catalítica, una enzima
simple puede tener isoenzimas, ej: anhidrasa carbónica
Niveles enzimáticos como índices de enfermedad
Enzimas Funcionales: Actúan normalmente enlas reacciones del metabolismo
Enzimas No Funcionales: Aumentan sus nivelescuando hay daño tisular o orgánico
Enzima no Funcional Daño ocasionado
a-amilasa Daño pancreático
Fosfatasa AlcalinaObstrucción biliar,
cáncer de huesos
Fosfataa Ácida Cáncer de Próstata
Creatinfosfoquinasa (CKmb), Lactato
Deshidrogenasa (LDH-H4), a-hidroxibutirato
DH
Infarto al miocardio
Trasaminasa Glutámica Oxaloacético
(TGO)Evalúa infarto
Trasaminasa Glutámica Pirúvica (TGP) Evalúa la Hepatitis