Termodinamica quimica
-
Upload
silvestreacevedo -
Category
Internet
-
view
35 -
download
2
Transcript of Termodinamica quimica
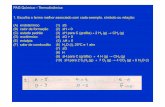
La Conductividad Térmica (λ con unidades W/ (m•K) describe el transporte de energía – en forma de calor – a través de un cuerpo con masa como resultado de un gradiente de temperatura (ver fig. 1). De acuerdo con la segunda ley de la termodinámica, el calor siempre fluye en la dirección de la temperatura más baja.
La relación entre el calor transportado por unidad de tiempo (dQ/dt o flujo de calor Q) y el gradiente de temperatura (ΔT/Δx) a través de un área A (el área a través de la cual el calor fluye perpendicularmente a un ritmo estacionario) está descrita por la ecuación de la conductividad térmica.
La Conductividad Térmica es, por consiguiente, una propiedad específica de cada material usada para caracterizar el transporte de calor en ritmo estacionario. Se puede calcular usando la siguiente ecuación:
Donde a: Difusividad térmica
cp: Capacidad Calorífica Específica
ρ: Densidad
CONDUCTIVIDAD TÉRMICA
Los electrolitos son ácidos, bases o sales, compuestos con los cuales es más fácil, debido a su estructura, romperlos enlaces para producir la disociaciónACIDOS FUERTES : En su interacción con el agua, los ácidos se disocian suministrando iones hidrogeno, los cuales, son simples protones. Si el ácido es fuerte, la disociación se produce al 100%, como es el caso del HCl: HCl---H20----- H+ + Cl-
El grado de disociación no es el mismo para cada etapa, sino que va disminuyendo gradualmente.BASES FUERTES : La disociación de las bases se verifica con suministro de hidroxiliones ( iones hidroxilo: OH-). Al igual que los acidos, cuando una base se disuelve en agua, algunas moleculas o todas, pueden disociarsedependiendo de la naturaleza de la base SALES Las sales se disocian suministrando uno o más iones metálicos positivos y uno o más iones negativos.
GRADO DE DISOLUCIÓN DE ELECTROLITOS FUERTES Y DÉBILES
Los electrólitos débiles son aquellos que se disocian muy poco. Son los acidos debiles y bases debiles. Es decir que en la mayoria de sus moleculas no se separan en iones. Tal es el caso de
acidos debil y bases debil.
Acido debil: Acido acetico.
Base debil: Hidroxido de amonio.
Los electrolitos debiles poseen la llamada constante de ionizacion.El porcentaje o grado de disociación o ionizacion, de un ácido o una base débil se define como la fracción de mol que se encuentra disociado el ácido o la base débil. Los ácidos débiles presentan un porcentaje de disociación o grado de disociación, αa, tanto mayor cuanto menor es su concentración.
Se llevan a cabo entre iones, por consiguiente con carga eléctrica neta. Pueden participar tanto grupos funcionales cargados (carboxilo, amino) como iones inorgánicos, y pueden ser tanto de atracción, si los iones tienen cargas opuestas como de repulsión, si presentan igual carga. Ambos tipos de interacción son importantes en las biomoléculas, y por ello se tratan aquí como interacciones iónicas, y no como enlaces iónicos exclusivamente. La fuerza de una interacción de tipo electrostático viene dada por la ley de Coulomb, pero el parámetro que aquí nos interesa es la energía necesaria para romper un enlace iónico (energía necesaria para separar dos grupos de distinta carga desde la distancia r hasta el infinito), o la energía necesaria para acercar dos grupos con igual carga hasta la distancia r. Esta energía viene dada por la expresión: E= K* q*q’ ----- r*e q y q´ son las cargas de los iones considerados, k una constante de proporcionalidad, r la distancia entre los iones y e la constante dieléctrica
INTERACCIÓN IÓNICA
Es el proceso que separa los elementos de un compuesto por medio de la electricidad. Se aplica una corriente eléctrica continua mediante un par de electrodos conectados a una fuente de alimentación eléctrica y sumergidos en la disolución. El electrodo conectado al polo positivo se conoce como ánodo y el conectado al negativo como cátodo. Cada electrodo atrae a los iones de carga opuesta. Así, los iones negativos, o aniones son atraídos y se desplazan hacia el ánodo (electrodo positivo), mientras que los iones positivos, o cationes, son atraídos y se desplazan hacia el cátodo (electrodo negativo). La energía necesaria para separar a los iones e incrementar su concentración en los electrodos es aportada por la fuente de alimentación eléctrica. En los electrodos se produce una transferencia de electrones entre éstos y los iones, produciéndose nuevas sustancias. Los iones negativos o aniones ceden electrones al cátodo (+) y los iones positivos o cationes toman electrones del ánodo (-). En definitiva lo que ocurre es una reacción de oxidación - reducción, donde la fuente de alimentación eléctrica se encarga de aportar la energía necesaria.
ELECTRÓLISIS
Primera Ley de Faraday: “La masa de un producto obtenido o de reactivo consumido durante la reacción en un electrodo, es proporcional a la cantidad de carga (corriente x tiempo) que ha pasado a través del circuito”.Esta primera ley, permite calcular, la cantidad de electricidad (en coulambios o faraday) para depositar un equivalente gramo de una sustancia. La unidad eléctrica que se emplea en física es el coulomb (C). Un coulomb se define como la cantidad de carga que atraviesa un punto determinado cuando se hace pasar un ampere (A) de corriente durante un segundo. Segunda Ley de Faraday:“Las masas de diferentes sustancias producidas por el paso de la misma cantidad de electricidad, son directamente proporcionales a sus equivalentes gramos”.Esta ley permite calcular la masa de diferentes sustancias depositadas por la misma cantidad de electricidad. La cantidad de elemento depositado por un Faraday (96.500 c) se conoce como equivalente electroquímico.
LEYES DE FARADAY













![PDV: Quimica mencion Guía N°3 [4° Medio] (2012)](https://static.fdocument.org/doc/165x107/5599808e1a28abf0768b458f/pdv-quimica-mencion-guia-n3-4-medio-2012.jpg)
















