Teorema di Bernoulli - scienze.uniroma2.it°-24°-ora-15... · Teorema di Bernoulli ØConsideriamo...
Transcript of Teorema di Bernoulli - scienze.uniroma2.it°-24°-ora-15... · Teorema di Bernoulli ØConsideriamo...
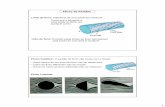
Teorema di Bernoulli Ø Consideriamo un fluido a densità costante che scorre in regime stazionario attraverso il tubo di flusso ( o reale) a sezione variabile mostrato in figura. Ø In un intervallo di tempo Δt una certa quantità di fluido Δm entra attraverso la superficie A1 con velocità v1 ed esce dalla superficie A2 con velocità v2. Ø Vogliamo ricavare la relazione tra velocità, pressione e quota del fluido alle varie sezioni del condotto. Cominciamo determinando il lavoro sul liquido: Ø Nello spostamento l’energia potenziale cambia solo per le parti del fluido che corrispondono ad una variazione globale di quota. Ø Il lavoro della forza peso è pari a:
Ø Le forze di pressione dovute alle pareti compiono un lavoro nullo
Ø le forze di pressione esercitate sulle sezioni A1 ed A2 forniscono il lavoro:
Ø Il lavoro totale è quindi: Per il teorema dell’energia cinetica tale lavoro è pari alla variazione di energia cinetica:
( )12 yygVUL gg −Δ−=Δ−= ρ
Ls= F
1Δx
1−F
2Δx
2= P
1A1Δx
1
ΔV!"#
−P2A2Δx
2
ΔV!"#
x
( ) ( ) VPPyygVLLL sg Δ−+−Δ−=+= 2112 ρ
( ) VPPLs Δ−= 21
LT =Δ
tvxtvx
AxAxV
Vm
Δ=ΔΔ=Δ
Δ=Δ=Δ
Δ=Δ
2211
2211
,
ρ
12ρ ΔV v
22 −v
12( ) = −ρ ΔV g y
2− y
1( )+ P1−P
2( )ΔV
Teorema di Bernoulli
( ) ( ) ( ) VPPyygVvvV Δ−+−Δ−=−Δ 211221
22
21
ρρLT =Δ
Semplificando il volume e raggruppando i termini in modo da avere a sinistra i termini associati al passaggio attraverso la superficie A1 ed a destra quelli associati all’attraversamento della superficie A2 si ha:
22221
211
21
21 gyvPgyvP ρρρρ ++=++
costante 21 2 =++ gyvP ρρ Equazione di Bern0ulli
Teorema di Bernoulli: In un fluido ideale in moto in regime stazionario la somma della pressione, della densità di energia potenziale (energia per unità di volume) e della densità di energia cinetica e’ costante lungo il condotto, ovvero lungo qualunque tubo di flusso.
NB: il teorema di Bernoulli è una riformulazione della conservazione dell’energia meccanica adattata alla meccanica dei fluidi
Equazione di Bernoulli-casi particolari
Ø Fluidi a riposo: In questo caso l’energia cinetica è nulla e l’equazione di Bernoulli si riduce alla legge di Stevino Ø Tubo di flusso ad altezza costante y (y=0 per esempio)
P1+
12ρ v
12 + ρ gy
1= P
2+
12ρ v
22 + ρ gy
2P
1+ ρ gy
1= P
2+ ρ gy
2 P1= P
2+ ρ g y
2− y
1( )h
!"# $#
P1+
12ρ v
12 + ρ gy
1= P
2+
12ρ v
22 + ρ gy
2P
1+
12ρ v
12 = P
2+
12ρ v
22 Se P1>P2 allora v1<v2
Se P1<P2 allora v1>v2 ⎪⎩
⎪⎨⎧
Se lungo una linea di flusso orizzontale aumenta la velocità di un fluido, deve diminuire la pressione e viceversa
Termodinamica
Ø La termodinamica è la branca della fisica che si occupa di calore ( o Energia Termica) e temperatura Ø Spesso nel nostro dialogare quotidiano temperatura e calore vengono confusi, e questi termini vengono utilizzati come sinonimi per indicare sensazioni di caldo o freddo Ø La temperatura ed il calore sono in realtà due grandezze completamente differenti
Temperatura: § è una grandezza scalare fondamentale,nel SI l’unità di misura è il grado Kelvin(K) § La temperatura è una proprietà che determina se un corpo si trova in equilibrio termico con altri corpi § A livello microscopico è una misura dell’energia cinetica media delle particelle (atomi o molecole) che compongono la materia § Lo zero assoluto ( cioè T=0 K) corrisponde ad una situazione in cui l’energia cinetica media delle particelle è nulla => è il limite inferiore dei valori che la temperatura può assumere e non è mai raggiungibile § Contatto termico: Situazione in cui due corpi possono scambiare energia sotto forma di calore o radiazione elettromagnetica ( ciò avviene quando i due corpi hanno temperature diverse) § Equilibrio termico: quando due corpi messi in contatto termico cessano di avere scambi di energia mediante calore o radiazione elettromagnetica. In questo caso i due corpi si trovano alla stessa temperatura
Principio 0 della termodinamica- Legge dell’equilibrio termico Consideriamo due corpi A e B che non sono in contatto termico( cioè che non possono scambiare tra di loro energia sotto forma di radiazione elettromagnetica o “calore” ) ed un terzo corpo C con cui vengono messi separatamente a contatto termico.
PRINCIOPIO 0 DELLA TERMODINAMICA: Se I corpi A e B sono separatamente in equilibrio
termico con il corpo C, allora A e B sono in equilibrio termico se posti a contatto
Due corpi che si trovano in equilibrio termico presentano la stessa temperatura
Se il corpo C è un termometro, nel caso in cui A e B sono all’equilibrio termico il termometro posto a contato con entrambi segnerà la stessa temperatura
A
A
C
C B
B
Senza flusso di calore (A è in equilibrio con C)
Senza flusso di calore (C è in equilibrio con B)
Senza flusso di calore (A è in equilibrio con B)
Misura della temperatura-termometro Ø I termometri sono dispositivi per misurare la temperatura di un corpo o di un sistema con cui termometro è in equilibrio termico. Ø La misurazione della temperatura è una misura indiretta, ciò viene misurata attraverso l’osservazione di una qualche proprietà fisica del corpo che varia al variare della temperatura stessa, es: variazione del volume (o della lunghezza in caso di solido) in conseguenza della dilatazione termica Ø Nei termometri analogici viene utilizzato un liquido (solitamente alcool o mercurio) posto all’interno di un capillare graduato. A cause della dilatazione termica il liquido salirà o scenderà di livello nel capillare a seconda della temperatura di equilibrio termico. Ø Poiché l’innalzamento del liquido ha un andamento lineare con la temperatura, è possibile tarare il termometro ponendo dei livelli di riferimento noti, es: punto di ebollizione(miscela di acqua e vapore in equilibrio termico a pressione atmosferica) o punto di congelamento (temperatura di una miscela di acqua e ghiaccio a pressione atmosferica) dell’acqua Ø Esistono diverse scale di temperatura, che dipendo dal punto di riferimento utilizzato, dal limite superiore adottato e dal numero di livelli intermedi. Ø Scala Celsius (°C): 0°C = punto di congelamento dell’acqua 100°C = punto di ebollizione dell’acqua 100 segmenti di ugual lunghezza => variazione di 1°C La precisione di questi termometri diminuisce allontanandosi dai punti di taratura Ø Scala assoluta => Kelvin La variazione di 1 K è uguale alla variazione 1°C. 0°C=273,15K
Punto triplo dell’acqua
Consideriamo l’acqua, che come tutti gli elementi può esistere in stato gassoso (vapor acqueo) liquido (acqua) e solido (ghiaccio). Lo stato in cui si trova dipende sia dalla temperatura che dalla pressione. Per ogni pressione esiste una valore diverso delle temperatura di fusione (passaggio da solido a liquido), di vaporizzazione (da liquido a gassoso) e di sublimazione (da solido a gassoso) Esiste comunque un solo punto sul grafico P-T in cui i tre stati possono coesistere in equilibrio termico: il PUNTO TRIPLO (cioè un solo valore di temperatura e pressione in cui i tre stati siano presenti in equilibrio termico) . Il punto triplo dell’acqua si trova a: P3 =0,6117kPa T3 =273,15 K (0.01°C)
Tabella punto triplo di alcune sostanze
Materiale T(K) P(kPA)
Acqua 273,16 0,6117
Ammoniaca 195,40 6,076
Anidride carbonica 216,55 517
Argon 83,81 68,9
Azoto 63,18 12,6
Butano 134,6 7 × 10−4
Carbonio (grafite) 4765 10132
Elio-4 2,19 5,1
Idrogeno 13,84 7,04
Mercurio 234,2 1,65 × 10−7
Metano 90,68 11,7
Neon 24,57 43,2
Ossigeno 54,36 0,152
Palladio 1825 3,5 × 10−3
Platino 2045 2,0 × 10−4
Titanio 1941 5,3 × 10−3
Xeno 161,3 81,5
Zinco 692,65 0,065
Il termometro standard rispetto al quale vengono tarati tutti i termometri è basato sulla pressione esercitata da un gas isolato a volume costante Tale termometro è costituito da: Ø Bulbo di vetro contenente gas è collegato mediante un vaso ad un manometro a mercurio . Ø Manometro a mercurio ( serbatoio mobile, scala graduata, ramo in contatto con il gas) Ø Il bulbo è messo a contatto termico con il corpo (o sistema) di cui si vuole conoscere la temperatura Ø Variando l’altezza del manometro si può far in modo di mantenere la superficie di contatto tra mercurio e gas sempre alla stessa altezza (ponendo per esempio a zero tale livello) => volume del gas mantenuto costante La temperatura del gas è data dalla relazione: Dove T è la temperatura, p la pressione del gas e C è una costante. La pressione p del gas (uguale alla pressione del mercurio sulla superficie di contatto viene calcolata applicando la legge di Stevino:
Dove: ρ è la densità del mercurio
p0 la pressione atmosferica
h la differenza di livello di mercurio tra la colonna A ed il serbatoio B del barometro.
Termometri a gas a volume costante(1)
CpT =
ghpp ρ+= 0
p
p0
Termometri a gas a volume costante(2)
CpT = ghpp ρ+= 0
p
p0 Per tarare il termometro si immerge il bulbo di gas in una recipiente contenente ghiaccio ed acqua in equilibrio termico ed il serbatoio viene posto in modo che il livello di contatto mercurio-gas sia posizionato a 0 sulla scala del manometro. Si ha quindi che: Si immerge quindi il bulbo in un recipiente contenente acqua al punto di ebollizione e si risistema il serbatoio di mercurio in modo da avere ancora il livello di contatto mercurio-gas sia posizionato a 0 sulla scala del manometro. Si ha che:
CC CpT °° = 00 CC ghpp °° += 000 ρ
CC CpT °° = 100100 CC ghpp °° += 100100100 ρ
Poiché T varia linearmente con la pressione riportando i due punti trovati su un grafico P-T e tracciando una riga congiungente i due punti si ottiene la taratura del termometro per le temperature incognite. La temperatura di una qualsiasi sostanza può essere determinata quindi misurando la pressione del gas nel bulbo (misurando l’altezza della colonna del manometro) quando questo è in equilibrio termico con la sostanza ed estrapolando tale valore dalla retta di calibrazione trovata
NB: si trova sperimentalmente che se si utilizzano termometri contenenti gas diversi, la misura effettuata è pressoché indipendente dal tipo di gas usato se la pressione del gas è bassa e la temperatura molto al di sopra del punto di liquefazione a tale pressione
Termometri a gas a volume costante(3)
Se consideriamo di utilizzare termometri con lo stesso gas nel bulbo ma a pressioni alla temperatura T=0°C diverse, si ottengono delle curve di calibrazione diverse ma comunque rettilinee ( fin quando la pressione non è troppo alta) che convergono tutte in uno stesso punto:
Indipendentemente dal gas o dal valore di pressione di partenza (comunque bassa) la pressione viene estrapolata a 0 quando la
temperatura è -273,15°C (0K)
Il valore T=-273,15 °C=0K, base della scala Kelvin, è detto zero assoluto Lo zero assoluto è un valore che non può essere mai raggiunto e corrisponde al vuoto assoluto (P=0)
C -273,15T 0P °=⇒→
Termometri a gas a volume costante (4)
p
p0
Nella realtà per tarare il termometro si prendono come punti di riferimento: § il punto triplo dell’acqua: P3 = 0,6117 kPa e T3 =273,16 K [0.01°C] (il bulbo viene messo a contatto termico con un recipiente contenente acqua al punto triplo) § il punto a 0K [-273,15°C]. Abbiamo:
33 CpT =
Si può quindi eliminare la costante C dall’espressione della temperatura:
3
3
pTC =
ppTT3
3= T =T3
pp3
⎛
⎝⎜⎜
⎞
⎠⎟⎟ = 273,15K
pp3
⎛
⎝⎜⎜
⎞
⎠⎟⎟
Dove p deve comunque essere molto bassa
Scala Assoluta - Scala Celsius - Scala Fahrenheit
Ø La scala in kelvin è una scala assoluta, il suo valore zero non è arbitrario in quanto è associato alla caratteristica di vuoto assoluto, valida per tutti i materiali. Ø La scelta dello zero sulla scala Celsius invece è arbitraria, perché dipende da una caratteristica fisica di una materia in particolare, l’acqua Ø Quando nelle equazioni termodinamiche si trova la temperatura essa va sempre espressa in gradi kelvin!! Ø Un rapporto tra temperature è valido solo se entrambe sono espresse in kelvin Ø Poiché l’ampiezza di 1 grado Kelvin e quella di un grado centigrado sono uguali vale la seguente conversione di scala:
Ø Una differenza di temperatura in Kelvin è uguale ad una differenza in Celsius
Ø La scala Celsius è la scala più utilizzata per usi comuni e commercio Ø La scala più utilizzata nei paesi anglosassoni è invece la Scala Fahrenheit Ø La scala Fahrenheit ha un’unità di grado più piccola di quello dei gradi Celsius e lo zero è associato ad un punto di temperatura diverso Ø La conversione di scala è data dalla relazione:
TC= (T
K−273,15)°C
TC= 0°C (T
K= 273,15K )
TC=100°C (T
K= 373,15K )
!"#
$#
°+= 3259
CF TT CF TT Δ=Δ59
ΔTK= ΔT
C
esercizio A quale temperatura i gradi Fahrenheit risultano a) Doppi di quelli Celsius b) La metà di quelli Celsius?
( ) CCTC °=°−= 1609532320
( ) CCTC °−=°−= 6.2495323.12-
FTF °= 320
TF= −12.3°F
( )
( )
⎪⎪⎪
⎩
⎪⎪⎪
⎨
⎧ ⇒=°−
=
⇒°−=⇒°+=
2
9532TT
T )
32T95T 32T
59T
FC
F
FCCF
FTa
( )⇒=
°−=
21
9532TT
T )F
C
F FTb
( )9203
910
9532T2 F
°−=°−= FF TT FTT
FF °=⇒
°=⇒ 320
9320
9
( ) ⇒°
−=°−=18160
185
9532T
21
F FF TT18
1601813 FTF
°−= ⇒T
F= −12.3°F
Ø I materiali solidi o liquidi variano le loro dimensioni lineari al variare della temperatura (è il principio di funzionamento dei termometri a liquido)
Ø La dilatazione di un materiale è una conseguenza della variazione della distanza media di separazione tra atomi o molecole che costituiscono il materiale stesso. Ø Se la dilatazione termica di un oggetto è sufficientemente piccola rispetto alle su e dimensioni originali la relazione tra la dilatazione (di ogni singola dimensione) e la variazione di temperatura è lineare. Ø Se Li è la lunghezza originale di un corpo lungo una certa direzione e ΔL la sua variazione in seguito alla variazione di temperatura ΔT si trova sperimentalmente che, se ΔT rimane comunque piccolo:
Dilatazione termica di solidi e liquidi(1)
TLL iΔ=Δ α TLLL iif Δ=− αTemperatura To
+ΔT
Temperatura To
L + ΔL
Dilatazione lineare
Dilatazione termica di solidi e liquidi(2)
TLL iΔ=Δ α TLLL iif Δ=− αDilatazione lineare
Ø α è il coefficiente di dilatazione lineare, dipende dalle proprietà del materiale ed ha come unità di misura l’inverso dei gradi Celsius
Ø Se α è positivo all’aumentare della temperatura il materiale si dilata, altrimenti si restringe. Questo secondo caso non è molto comune , ma non è impossibile ( es: la calcite CaCO3 all’aumentare della temperatura si dilata lungo una dimensione e si contrae lungo un’altra
Lf= L
i1+αΔT( )
Dilatazione termica (3)
Ø Conviene considerare la dilatazione di un corpo analoga ad un ingrandimento fotografico, cioè riscaldandosi il corpo si dilata in tutte le dimensioni, se l’oggetto è forato anche il foro si ingrandisce Ø Poiché ogni dimensione varia linearmente con la variazione di temperatura, anche il volume e le superfici del corpo varieranno, si trovano le seguenti relazioni:
( )
⎪⎪⎩
⎪⎪⎨
⎧ =−⇒Δ=Δ ifi T-T iif LLLTLL αα
γ = 2α è il coefficiente di dilatazione superficiale
β = 3αè il coefficiente di dilatazione volumica
α è il coefficiente di dilatazione lineare
Dimostrazione : Consideriamo un cubo di lato Li
che, in seguito ad un aumento della temperatura ΔT, subisce in ogni dimensione una dilatazione ΔL Gli ultimi due termini sono potenze di αΔT che è un numero puro molto piccolo, sono quindi trascurabili
dove β = 3α
( ) ( ) ( ) ( )2323333333 T 3T T 3T Δ+Δ+Δ+=Δ+== iiiiiiff LLLLLLLV αααα
Vf= L
i3 +3α L
i3 ΔT =V
i+3α V
i ΔT T Δ=− iif VVV β
( )ifi T-T 2 iif AAATAA αγ =−⇒Δ=Δ
( )ifi T-T 3 iif VVVTVV αβ =−⇒Δ=Δ
Comportamento Anomalo dell’Acqua Ø In generale, i liquidi tendono a dilatarsi all’aumentare della temperatura ed hanno coefficienti di dilatazione cubica circa 10 volte superiori a quelli dei solidi Ø L’acqua, in un ristretto intervallo di temperature è un’eccezione Ø Tra 0°C e 4 °C l’acqua si contrae e quindi la sua densità aumenta (il suo volume diminuisce) Ø dai 4°C (dove raggiunge il picco di densità pari a 1kg/dm3 ) in su il comportamento torna simile a quello degli altri liquidi e si dilata ( e quindi diminuisce in densità) all’aumentare della temperatura
Fin quando la temperatura in superficie è maggiore di 4°C l’acqua in superficie risulta più densa di quella sottostante e quindi scende verso il basso mentre quella più calda sale verso l’alto raffreddandosi. Se la temperatura in superficie è minore dei 4° l’acqua a quella temperatura si dilata e rimane in superficie (perché meno densa di quella più calda sottostante) fin quando non comincia a ghiacciare. Il ghiaccio che si forma rimane in superficie perché meno denso dell’acqua, cosicché il ghiaccio continua a formarsi in superficie, mentre l’acqua sul fondo rimane a 4 °C
Questo comportamento anomalo spiega perché d’inverno i laghi gelano soltanto in superficie, mentre al di sotto l’acqua rimane liquida Capiamo il perché seguendo il grafico del volume all’indietro, da destra a sinistra. • Quando la temperatura esterna si abbassa (esempio da 10 °C a 4°C), l’acqua che si trova in superficie comincia a raffreddarsi. • Il volume dello strato superficiale diminuisce e la sua densità aumenta => l’acqua in superficie diventa
più densa dell’acqua sottostante (vedi grafico della densità). • Per la legge di Archimede lo strato superficiale più denso scende verso il fondo mentre sale dal basso
l’acqua più calda (meno densa). • In questo modo la temperatura dell’acqua diminuisce e il processo continua fino a quando tutta l’acqua
raggiunge la temperatura di 4 °C. A causa dell’aria fredda, la temperatura dello strato in superficie continua a diminuire.
• Quando in superficie la temperatura scende al di sotto dei 4 °C il volume dello strato superficiale aumenta e la sua densità diminuisce => l’acqua in superficie diventa meno densa di quella che si trova sotto.
• Per la legge di Archimede lo strato superficiale meno denso non può scendere e rimane in superficie, dove continua a raffreddarsi, fino a che diventa ghiaccio.
• Poiché da 4 °C a 0 °C l’acqua, invece di contrarsi, si dilata => si crea quindi nei laghi uno strato di ghiaccio che protegge la vita della fauna e della flora acquatica.
Esempio di dilatazione termica
( ) 16cemento C 1012α −− °⋅=
Due blocchi di calcestruzzo in un ponte lungo 250 m sono disposti consecutivamente senza spazio fra di essi. Se T aumenta di 20°C, qual’è l’altezza y a cui si alzano i blocchi per deformazione?
L’aumento di temperatura, produce una dilatazione lineare delle due parti del ponte, che di conseguenza si alzano dalla parte mobile, nel punto di giunzione. Calcoliamo intanto la dilatazione lineare che subiscono i due blocchi:
ΔL = Lf−L
i= αL
iΔT ⇒ L
f= L
i 1+αΔT( ) =125m 1+12 ⋅10−6 °C( )
−1⋅20 °C
⎛
⎝⎜
⎞
⎠⎟ =125.03 m
L’altezza y di cui si alzano i due blocchi si ottiene dal teorema di pitagora:
( ) ( ) mmmm 74.2 5.7 15625501.15632.12503.125LLy 222i
2f ==−=−=−=
!!!!!!!! m 2.74y =
Se nella costruzione dei ponti non venisse tenuta in considerazione la dilatazione termica dei materiali, si rischierebbero grossi problemi dovuti alla deformazione delle strutture
Lf=125.03m
Temperatura e Calore
Tutti sappiamo che se mettiamo a contatto (contatto termico) due corpi a temperatura differente la temperatura del corpo più freddo aumenterà e quella del corpo più caldo diminuirà fino a quando i due corpi non raggiungono la stessa temperatura (equilibrio termico) La stessa cosa succede se tiriamo fuori una mela dal frigo. La temperatura della mela aumenterà fin quando non sarà arrivata alla temperatura che c’è in cucina Generalizziamo:
SISTEMA TS
AMBIENTE TA
Se TS≠ TA TS cambierà fin quando TS = TA
La variazione di temperatura è dovuta ad un TRASFERIMENTO DI UN TIPO DI ENERGIA tra il sistema e l’ambiente circostante
Trasferimento di ENERGIA INTERNA (energia termica)
Energia Interna e Calore
Ø Energia interna: Insieme di energie cinetiche e potenziali dovute ai moti casuali degli atomi, delle molecole e dei corpi microscopici all’interno di un oggetto
Ø Calore: Il trasferimento di energia interna viene chiamato calore Q
Riassumendo possiamo quindi dire che : Il Calore è l’energia interna scambiata tra due corpi a diversa temperatura La Temperatura: è un’osservabile che determina la DIREZIONE DEL FLUSSO di calore (dal corpo che si trova a temperatura maggiore a quello che si trova a temperatura minore). NB: La temperatura non misura la quantità di calore
Il calore va “spontaneamente” dal corpo più caldo a quello più freddo, fino a che la temperatura dei due corpi non diventa la stessa, non è quindi una proprietà intrinseca del sistema , ma descrive solamente un trasferimento di energia che va ad incrementare o diminuire l’energia interna del sistema
Poiché il calore, come il lavoro è un trasferimento di energia, l’unità di misura del calore è il Joule NB: spesso viene usata anche la caloria, definita come la quantità di calore necessaria per di innalzare la temperatura di 1g di acqua da 14,5 a 15,5 °C dove J. cal 18641 =
Temperatura e Calore
Energia esce dal sistema
TS>TA Il sistema cede
calore all’ambiente
Q<0
Non c’è trasferimento di energia
TS=TA Il sistema e
l’ambiente esterno sono in equilibrio
termico
Q=0
Energia entra nel sistema
TS<TA Il sistema assorbe
calore dall’ambiente
Q>0
Capacità termica La quantità di calore fornita o assorbita da un corpo dipende sia dalla differenza di temperatura associata a tale trasferimento, sia dalle caratteristiche chimiche e fisiche del sistema: La quantità di calore necessaria per scaldare una tazza di latte da 20°C a 60°C sarà sicuramente minore di quella necessaria a portare da 20°C a 60°C l’acqua di uno scaldabagno
Definiamo Capacità Termica: la costante di proporzionalità C tra una certa quantità di calore Q, scambiata tra un sistema e l’ambiente, e la variazione di temperatura ΔT ad esso associata:
( )if TTCTCQ −=Δ=
Più grande è la capacità termica del corpo, maggior quantità di calore sarà richiesta per apportare la variazione ΔT di temperatura
TQCΔ
= Unità di misura: KJ
Calore specifico
Ø Due corpi dello stesso materiale ma di dimensioni diverse, avranno capacità termiche diverse( la capacità termica di una tazzina da caffè di acqua è sicuramente minore della capacità termica dell’acqua contenuta in uno scaldabagno) Ø È utile definire quindi una capacità termica per unità di massa, che dipenda solo dalle proprietà del materiale di cui è composto il corpo. Calore Specifico c
( )if TTCTCQ −=Δ=
( )if TTcmTcmQ −=Δ=mCc = Calore specifico
Unità di misura: Il calore specifico si esprime in J/(K·kg) o in J /(K·mole) a seconda che la quantità di materia si misuri in kilogrammi o moli (in quest’ultimo caso si parla di calore specifico molare).
NB: Ø La capacità termica è una quantità caratteristica di un dato sistema.
Ø Il calore specifico c è una quantità caratteristica del materiale che costituisce il corpo
Tabella calore specifico
NB: il calore specifico in generale dipende dalle condizioni sperimentali e dalla temperatura. Per i gas esistono due diversi valori del calore specifico, a seconda che esso sia associato ad una trasformazione a volume costante (cV) o a pressione costante (cP)
Applicazione
Dipendenza del calore specifico dell’acqua dalla temperatura (la scala delle ordinate è molto amplificata!)
Cg Calc OH °
≈ 12
Ø Il calore specifico descrive la capacità di una sostanza di immagazzinare calore. Ø Più alto è il valore del calore specifico, più una sostanza immagazzina calore. Ø Il calore specifico dell’acqua, 1 Cal/g °C a 14.5 °C e 1 atm, è superiore a quello della maggior parte delle altre sostanze. Ø Conseguenza: Il clima vicino al mare o ai grandi laghi è più temperato rispetto al clima continentale, perché durante il giorno il sole riscalda l’aria più velocemente di quanto non riscaldi l’acqua che quindi assorbe energia a causa dell’escursione termica tra aria ed acqua. Questa energia viene poi rilasciata durante la notte quando la temperatura dell’ambiente si riduce rispetto a quella dell’acqua. Ciò fa sì che non ci siano forti escursioni termiche Ø Stesso discorso vale nell’arco dell’anno. Quando la temperatura di una grande estensione di acqua diminuisce durante l’inverno, l’acqua trasferisce energia all’aria, la quale, attraverso il vento la trasporta verso terra
una mole di acqua corrisponde a 18,016 g perché la massa molecolare è uguale appunto a 18,016.quindi: 1g di H2O contiene 1/18.016 moli
C moli Cal016.18
C moli 016.181Cal1
C gCal1c OH2 °
=°
=°
≈
Brezza marina : vento diurno che spira dal mare verso terra. È causato da una depressione dell’aria sopra la terraferma che si forma a causa del diverso calore specifico tra suolo ed acqua. L'acqua, avendo un maggiore calore specifico rispetto al terreno, si raffredda più lentamente rispetto al suolo che tende invece a cedere il calore all'aria con una maggiore velocità di scambio. Il terreno, quindi, di giorno si scalda, e riscalda l'aria che lo sovrasta che tende quindi ad innalzarsi (all’aumentare della temperatura diminuisce la densità). Questo comporta un abbassamento della pressione al livello della superficie terrestre, di conseguenza l'aria che si trova sopra la superficie del mare, più fresca e in una zona a pressione maggiore, si sposta verso la debole depressione sopra la terraferma creando la brezza marina Brezza di terra: Durante le ore notturne la situazione si inverte. Il terreno si raffredda più velocemente del mare. Si creerà quindi una depressione sulla superficie dell'acqua. Questa situazione genera un vento dalla terraferma verso il mare, detta brezza di terra.
Esempio
Se tutta l’energia potenziale dell’acqua che precipita dalle cascate del Niagara da un’altezza di 50 m fosse completamente utilizzata per riscaldare l’acqua, l’aumento di temperatura sarebbe (cacqua=1cal/(g°C)):
• 1)120 °C • 2)12 °C • 3)1,2 °C • ٧4)0,12 °C
L’energia potenziale della cascata all’altezza h è U = mgh ( se prendo come energia alla
base della cascata U=0)
Il calore fornito sarebbe quindi Q = ΔU=mgh
( )C 0.12C
4186490
CgJ4.186KgJ509.8
cghΔTΔTmcghmQacqua
acqua °=°=°⋅
⋅==⇒/=/=
1cal=4.186 J
Conoscendo il calore specifico dell’acqua possiamo determinare la variazione di temperatura, infatti
TΔ m cQΔT mQ
mCc =⇒==Ricordiamo che il calore specifico è:
cacqua=1cal/(g°C)=4.186 J/(g°C)