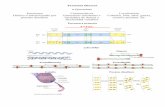
TEMA 3. PROTEÍNAS Composición Aminoácidos:características clasificación propiedades
description
Transcript of TEMA 3. PROTEÍNAS Composición Aminoácidos:características clasificación propiedades

TEMA 3. PROTEÍNAS
Composición
Aminoácidos:características
clasificación
propiedades
Péptidos: definición
constitución: enlace peptídico
tipos: oligopéptidos y polipéptidos
Proteínas: estudio de la estructura: estructuras
propiedades:
clasificación
FUNCIONES
Solubilidad
Punto isoeléctrico
Poder amortiguador
Desnaturalización
Especificidad

Proteínas. Constituidas por C, H, O, N y S. Pueden presentar otros elementos como P, Fe, Mg, Cu, ...
Aminoácidos
Péptidos
Oligopéptidos
Polipéptidos
Proteínas.

Aminoácidos IMoléculas orgánicas que presentan un radical amino y un radical carboxilo. Existen más de cien en la naturaleza.
Sólo 20 forman parte de casi todas las proteínas, se denominan proteínicos. Son todos α-aminoácidos.
C COOHR
NH2
HOtros aminoácidos pueden presentar interés biológico, porque forman parte de proteínas de microorganismos, porque dan lugar a moléculas fundamentales (tiroxina) o porque sufren modificaciones como metilaciones, fosforilaciones, ... ( β-alanina; forma parte de coenzimas, ácido γ- aminobutírico; neurotransmisor de las sinapsis inhibidoras).

Aminoácidos II. Estereoisomería

Aminoácidos III. Clasificación

Aminoácidos IV. Propiedades Sólidos, fácilmente cristalizables; incoloros o blanquecinos; con sabores diversos; los de carácter polar son solubles en agua y algunos de los apolares son muy hidrófobos.Tienen carácter anfótero: su comportamiento ácido o base depende del medio.
pH < 7 ácido pH = 7 neutro pH > 7 básico
BASE NEUTRO ÁCIDO
C COO-R
NH2
HC COOHR
NH2
H
C COOHR
NH3+
H H+ OH-

Enlace peptídico

Oligopéptidos Moléculas formadas por un número de aminoácidos inferior a 100.
Oligopéptidos con actividad biológica:
•Algunas vitaminas del grupo B: ácido pantoténico y ácido fólico.
•Hormonas: adrenocorticotropa (ACTH), melanotropa (MSH), insulina y glucagón, gastrina y secretina y angiotensina.
•Neuropéptidos: encefalinas
•Antibióticos: alcaloides

Proteínas. Estructura

Proteínas. Estructura 1aria

Proteínas. Estructura 2aria. α-hélice

Proteínas. Estructura 2aria. Lámina β

Proteínas. Estructura 3aria

Proteínas. Estructura 4aria
Más de un polipéptido, que pueden ser iguales o diferentes entre sí.
Cada polipéptido se denomina protómero.
La unión entre protómeros se realiza mediante enlaces generalmente no covalentes, pero la estructura completa se estabiliza por los mismos enlaces que la estructura terciaria.Los ejemplos más habituales son la hemoglobina: dos cadenas α y dos β o el colágeno: tres hélices de colágeno.
Algunas proteínas tienen más de una estructura mediante las cuales realizan su actividad.

ARN polimerasa. Premio Nobel de química 2006. Kornberg.

Proteínas. Propiedades I
Solubilidad: solubles en agua donde forman dispersiones coloidales. En la estructura, los aminoácidos hidrófilos se encuentran al exterior y los hidrófobos al interior. Hay excepciones.
Las proteínas fibrosas suelen ser insolubles.
Punto isoeléctrico: el valor del pH para el cual las cargas positivas y negativas de los radicales de los aminoácidos están compensados. En este valor las proteínas son insolubles, por lo que el pH fisiológico debe ser diferente.
Poder amortiguador o tampón: debido a su carácter anfótero regulan el pH del medio

Proteínas. Propiedades II

Proteínas. Propiedades III

Proteínas. Clasificación IHoloproteínas o proteínas simples (sólo contienen aminoácidos) :Globulares: solubles( ) e insolubles ( )
•Globulinas: inmunoglobulinas, seroglobulina, lactoglobulina,...
•Albúminas: ovoalbúmina, lactoalbúmina,...
•Histonas: forman la cromatina
•Protaminas: unidas al ADN en espermatozoides
•Gluteninas: en semillas.Fibrilares o escleroproteínas:
•Colágeno: tejidos conectivos
•Queratinas: estructuras dérmicas(pelo, uñas,...)
•Elastinas: fibras musculares (actina y miosina)
•Fibrinógeno: coagulación sanguínea

Proteínas. Clasificación IIHeteroproteínas o proteínas conjugadas: formadas por una parte proteica (grupo proteico) y otra no proteica (grupo prostético). Se clasifican según la naturaleza del grupo prostético.•Fosfoproteínas: algunos aá. están fosforilados (caseína de la leche)
•Cromoproteínas: llevan unido un pigmento
Porfirínico: con el grupo porfirínico (hemoglobina, citocromos)
no porfirínico: con un ion metálico como Cu (hemocianinas)
•Glucoproteínas: con un oligosacárido como la mucina de la saliva
•Lipoproteínas: con un lípido como el transporte de colesterol
•Nucleoproteínas: con ácidos nucleicos como ribosomas o cromatina

Proteínas. Funciones Energética: lactoalbúmina, caseína,...
Estructural: colágeno, histonas,..
Hormonal: insulina
Transportadora: hemoglobina, proteínas de membrana,...
Antibiótica: actinomicina
Contráctil: actina, miosina,...
Homeostática: regulan las condiciones del medio (pH)
Inmunológica: inmunoglobulinas
Marcadoras: proteínas de membrana
Protectora y lubricante: mucina, proteínas del líquido sinovial
Hemostática: fibrinógeno y fibrina.
CATALIZADORA O ENZIMÁTICA

ENZIMAS:
Definición
Naturaleza y acción
Especificidad
Cinética
Nomenclatura
Clasificación
Coenzimas:
Definición
Tipos
Naturaleza: vitaminas

ENZIMAS o BIOCATALIZADORES

Enzimas. Naturaleza y acciónLa mayoría son proteínas globulares y conjugadas o heteroproteínas.
EnzimaApoenzima (parte proteica)
Cofactor (parte prostética)Cofactor (inorgánico)
Coenzima (orgánico)
Mecanismo de acción: E + S ES E + P
Centro activo: región del enzima donde se une el sustrato. Diferentes aá. realizan distintas funciones: unen el sustrato, orientan el sustrato, mantienen la estructura del centro activo y modifican el sustrato y lo transforman en producto.
Es fundamental mantener la secuencia y estructura.Efectores: lugares donde pueden unirse otras sustancias y modificar la actividad enzimática

Especificidad enzimáticaTeoría de la “llave-cerradura” de Fisher
Teoría del “ajuste inducido”
Especificidad de sustrato:
•Absoluta: sólo reconoce un sustrato. Ej. Glucoxidasa (glucosa)
•Relativa: varios sustratos con estructuras semejantes. Ej. Hexoquinasa (fosforila hexosas)
•Estereoquímica: reconoce a un estereoisómero. Ej. Forma D, pero no a la forma LEnzimas bisustrato: reconocen a dos sustratos
Especificidad de acción: sólo cataliza una de las posibles reacciones que puede sufrir un sustrato y dan lugar a rutas metabólicas diferentes.

Cinética enzimática I

Cinética enzimática II

Cinética enzimática IIIEfectores: modifican la actividad del enzima, pueden ser activadores e inhibidores.
Reversibles:
•Competitivos
•No competitivos.
eino
essi
e
i
s
i
es s esi
ieno
Irreversibles: se altera definitivamente la estructura del enzima. Ej. algunos antibióticos, venenos,...

Cinética enzimática IVOtras formas de regulación de la actividad enzimática:
•Enzimas alostéricos: adquieren nueva conformación al unirse al sustrato de modo que aumenta su actividad.
•Complejos multienzimáticos: conjunto de enzimas que aumentan la eficacia de la reacción.
•Proenzimas o zimógenos: son inactivas hasta que sufren la transformación a enzimas.

Enzimas. Clasificación
denominación función
1. Oxidorreductasas Reacciones de oxidación-reducción
2. Transferasas Transferencia de un grupo funcional.
3. Hidrolasas Ruptura de una molécula mediante adicción de H2O
4. Liasas Ruptura no hidrolítica de enlaces
5. Isomerasas Transformación en su isómero
6. Ligasas Formación de enlaces. Requiere energía (ATP)

Coenzimas INaturaleza nucleotídica:
•AMPc (AMP cíclico). Interviene en la transducción de señales. 2º mensajero.
•ATP (moneda energética). También GTP, UTP, ...
•NAD (nicotín-adenín dinucleótido): vitamina PP y adenosina. Interviene en reacciones de oxido-reducción.
•FAD (flavín-adenín dinucleótido): vitamina B2 y adenosina. Interviene en reacciones de oxido-reducción.
•Coenzima A o CoA (adenosín difosfato y vitamina B5. Interviene en reacciones de descarboxilación y en transferencias de grupos acilo.

Coenzimas IINaturaleza vitamínica: solubles en agua e insolubles en agua
nombre función hipovitaminosisB2 Oxido-reducción Dermatosis y estomatitis.
PP Oxido-reducción Pelagra, diarrea y demencia.
B5 Transferencia de carboxilo Fatiga y náuseas.
B1 Transferencia de aldehído Beriberi: neuritis y cardiopatía.
C Hidroxilación, inmunidad y antioxidante
Escorbuto (hemorragia de encías) e infecciones.
A Síntesis de pigmentos de retina Xeroftalmia, ceguera nocturna.
D Metabolismo de Ca y P Raquitismo.
K Coagulación sanguínea Hemorragias.
E Antioxidante y esterilidad Esterilidad y anemia.