Skript zum Masterpraktikum Modul: Strahlung - hzdr.de · Modul: Biologie . Wechselwirkung von...
Transcript of Skript zum Masterpraktikum Modul: Strahlung - hzdr.de · Modul: Biologie . Wechselwirkung von...

Skript zum Masterpraktikum Modul: Strahlung α−, β−, γ−Spektroskopie Stand: Sommersemester 2009
1

Strahlungsarten
α−Strahlung
Abgabe von 2 Protonen und 2 Neutronen (42He).
HePbPo 42
20682
21084 +⇒
Die Nukleonenzahl verringert sich beim a-Zerfall um 4, die Ordnungszahl um 2. Die Reichweite beträgt in Luft wenige cm (210Po: 4 cm) in Flüssigkeiten und Feststoffen wenige µm (abhängig von der Dichte). β−Strahlung
β−−Strahlung: Abgabe eines Elektrons und eines Antineutrinos β+−Strahlung: Abgabe eines Positrons und eines Neutrinos Elektoneneinfang aus innerem Orbital (EC) unter Abgabe eines Neutrinos
e
eeArK ν++⇒ +4018
4019
eMn ν+5525
eBiPb ν++⇒ −21083
21082
eFe ⇒+ −5526
Die Nukleonenzahl bleibt gleich, die Ordnungszahl erhöht sich um 1 (bei β−) und verringert sich um 1 (bei β+, EC). Die Reichweite beträgt wenige cm bis 1 m (abhängig von der Energie) Abschirmung erfolgt mit Plexiglas (2 Größenordnungen) γ−Strahlung
Durchdringendste elektromagnetische Strahlung, die beim Zerfall der Atomkerne vieler radioaktiver Nuklide entsteht. Die Reichweite beträgt in Feststoffen einige cm bis m (abhängig von Dichte und γ−Energie) Abschirmung erfolgt mit Blei, Schwerbeton (hohe Dichte) Strahlungsmessung – Spektrometrie
Nicht nur die Bestimmung der gesamten Strahlungsmenge ist von Interesse, sondern auch die Art und Herkunft der Strahlung. Dazu ist Spektrometrie notwendig – die Unterscheidung nach der Strahlungsenergie.
2

α−Spektrometrie mit Halbleiterdetektor (PIPS)
PIPS: Passivated Implanted Planar Silicon detector Bei diesen Detektoren handelt es sich um n-leitende Siliziumdetektoren, deren Eintrittsseite p-leitend ist durch wenige nm einer Bor Implantationsschicht. Am pn-Übergang bildet sich eine Ladungsfreie Zone, die durch Anlegen einer Spannung in Sperrichtung vergrößert wird. Die einfallende Strahlung (α−Strahlen) in diese Zone erzeugt Paare von Elektronen und Löchern. In der pn-Übergangsschicht werden Elektronen und Löcher durch das Ladungsfeld getrennt (Löcher wandern ins p- und Elektronen ins n-Gebiet ). Die Anzahl der Elektronen-Loch-Paare hängt von der Energie des einfliegenden Teilchens ab. Der resultierende Stromstoß ist ein Maß für die Energie der Strahlung.
Es wird im Vakuum gemessen, um die Reichweite der α−Partikel zu erhöhen. Der Nulleffekt ist extrem niedrig (1-2 Impulse/h). Die hohe Auflösung von 20 keV erlaubt α−strahlende Nuklide, deren Energien nahe beieinander liegen, zu trennen.
3500 4000 4500 50000
50
100
150
200
250
300
350
400
237Np α−Standard, dünne Schicht
237Np eingetrocknete Probe, dickere Schicht
Impu
lse
Energie in keV
Abb. 1: α−Spektren von 237Np, gemessen mit PIPS Detektor α−, β−Spektrometrie mittels Flüssigszintillation
Es wird ein homogenes Gemisch aus Probe und Szintillations-Cocktail hergestellt. Der Szintillations-Cocktail, bestehend aus Lösungsmittel, primärer Szintillator und sekundärer Szintillator wird durch β− oder α−Teilchen zur Emission von Lichtquanten angeregt:
• Lösungsmittel (z. B. Toluol, Benzol, Xylol, Diisopropylnaphtalin) kinetische Energie des Kernzerfalls regt p-Elektronen an: 200-300 nm
• primärer Szintillator (z.B. Oxazole, Oxadiazole, Benzooxazole, Pyrazoline, 2,5 Diphenyloxazol PPO ca. 10-2 m) Energieübertragung durch Molekülzusammenstöße, Strahlung, Dipol-Dipol-Wechselwirkung: 340-400 nm
3

• sekundärer Szintillator (ähnliche Struktur wie primäre aber längerwelliges Fluoreszenzmaximum, z.B. p-bis-(o-Methylsteryl)-benzol ca. 10-4 m) absorbiert das Licht vom primären Szintillator und gibt es als Fluoreszenzlicht weiter – „Wellenlängenschieber“ 400-470nm
Photoverstärkerröhre: • Lichtumwandlung in elektrische Impulse
• Photoeffekt: Elektronenfreisetzung Hochspannung
Photover- stärkerröhre
Photover- stärkerröhre
Koinzidenz- schaltung
Verstärker
ADC
Impulshöhen- analysator
Probe
Analyse des Spektrums
• Auf Dynoden (pos. Elektrode) gelenkt
• Erzeugung von Sekundärelektronen
• Weitere Dynoden → Kaskade von Elektronen
• Letzte Dynode – Messung des elektrischen Impulses
Koinzidenzschaltung: Nur Messung von Spannungsimpulsen, die von beiden Photoverstärkerröhren kommen Unterdrückung thermischer Impulse
Impulshöhenanalysator: Die im Szintillationsprozess freigesetzte Photonenzahl ist der α−, β−Energie proportional. Lineare Umsetzung in Photoverstärker Impulshöhe proportional der α−, β−Energie
200 400 600 8000
500
1000
1500
α - Spektrum 237Np
β - spectrum 233Pa
233Pa
237 N
p
Impu
lse
Energie [Kanal]
Abb. 2: α−Spektrum von 237Np und β−Spektrum von 233Pa (Tochter) gemessen mit Flüssigszintillationsspektroskopie
4

0 200 400 600 800 10000
200
400
600
800
1000
1200
α-Spektrum 210Po
β-Spektrum 210Pb, 210Bi
Impu
lse
Energie [Kanal] Abb. 3: α−Spektrum von 210Po und β−Spektrum von 210Pb und 210Bi gemessen mit Flüssigszintillationsspektroskopie
0 200 400 600 800 10000
50
100
150
200
250
300
Energie [Kanal]
β LS Spektrum gesamt Fit
210Pb Fit
210Bi Fit
Impu
lse
Abb. 4: Spektrenentfaltung des β−Spektrums γ−Spektrometrie mit Reinst-Germaniumdetektor
Halbleiterdetektor: Ein Halbleiterzähler stellt eine in Sperrrichtung gepolte Diode dar. Die Konversion der einfallenden Strahlung in ein messbares elektrisches Signal geschieht in der Verarmungszone einer Halbleiterdiode, die in der Regel eine p-i-n Struktur aufweist. Die in der intrinsischen Zone erzeugten Ladungsträger werden mittels eines angelegten Spannungsgradienten von 100 bis 200 V/mm gesammelt. Der resultierende Strom führt zu einer Änderung der angelegten Spannung.
5

Der Ladungsimpuls wird über einen ladungsempfindlichen Vorverstärker und einen Spektroskopieverstärker, den Vielkanal-Impulshöhen-Analysator, zugeführt. Der Detektor wird auf ca. 90 K gekühlt. Dadurch wird das thermische Rauschen unterdrückt und die Beweglichkeit der Elektronen und Löcher erhöht. Wechselwirkung γ−Strahlung –Materie
• γ−Strahlen sind keine geladenen Teilchen sondern Photonen • nach der Wechselwirkung mit Materie Messung möglich
Drei Prozesse der Wechselwirkung:
• Photoeffekt o γ−Quanten an stark gebundenen Elektronen (innere Schalen) von Atomen inelastisch
gestreut. Das Elektron wird aus dem Atom geschlagen. o Sekundäreffekt: Augereffekt
• Comptoneffekt o Wechselwirkung der γ−Quanten mit freien Elektronen – Stoßprozess o Elektron gewinnt kinetische Energie, Photon ändert seine Wellenlänge (abhängig
vom Streuwinkel) • Paarbildung
o Energie des Photons > als Energieäquivalent der doppelten Elektronenmasse → Photon vernichtet, Erzeugung eines Elektron - Positron Paares Erläuterung am Beispiel von 137Cs Photopeak
Comptonkante Rückstreulinie
Comptonkontinuum
6

Abb. 5: γ−Spektrum von 237Np mit seiner Tochter 233Pa Spektrometrieversuch
Es soll in einem Versuch 210Pb und die Töchter 210Bi und 210Po bestimmt werden. Stellung in der Nuklidtabelle zeigt das folgende Bild:
Abb. 6: Nuklidtabelle
7

Die Nuklide haben folgende Eigenschaften: 210Pb: T1/2 = 22,2 Jahre β− 16,96 keV (84%), 63,5 keV (16%) α 3720 keV (1,9·10-6%) γ 46,539 keV (4,25%) X-Ray 16 Linien 9.42 bis 15,71 keV (Σ 23,6%)
210Bi: T1/2 = 5.012 Tage β− 1162,1 keV (100%) α 5036,0 keV (1,3·10-4%) γ keine X-Ray keine 210Po: T1/2 = 138,38 Tage α 5307,56 keV (100%) γ 803,10 keV (0,00121%) X-Ray 9,184 bis 87,580 keV (Σ 1,3·10-5%) Folgender Aktivitätsverlauf kann berechnet werden: nach 210Pb Abtrennung erfolgt ein Anwachsen von 210Bi und 210Po 210Pb → β− → 210Bi → β− 210Po → α+ → 206Pb (stabil)
0 1 2 3 40
20
40
60
80
100
Zeit / Jahre
Akt
ivitä
t / %
210Pb Τ1/2 = 22,3 a
210Bi Τ1/2 = 5,013 d
210Po Τ1/2 = 138,38 d
8

Skript zum Masterpraktikum Modul: Biologie Wechselwirkung von Metallen in Biosystemen Stand: Sommersemester 2009
1

Schwermetalle in der Umwelt
Als Schwermetalle werden Metalle mit einer höheren Dichte als 3,8 g/cm3 bezeichnet. Einige von ihnen sind für den Menschen in geringen Mengen lebensnotwendig. Zu diesen essentiellen Schwermetallen zählen die sogenannten Spurenelemente Eisen, Kupfer, Mangan, Molybdän und Zink. Andere Schwermetalle haben bei Stoffwechselprozessen keine erkennbare Funktion und sind bereits in geringen Mengen giftig. Dazu gehören beispielsweise Chrom, Cadmium, Blei, Quecksilber und Arsen. Tabelle 1: Toxische Wirkung und essentieller Funktion ausgewählter Schwermetalle
Schwermetall Toxische Wirkung Essentieller Nutzen
Blei
gelöstes Blei, Bleiverbindungen, Bleistäube, Organobleiverbindungen • kumulative Wirkung (Anreicherung in
Knochen, Zähnen und im Gehirn) • beeinträchtigt das Nervensystem und die
Immunabwehr
Kupfer
• für viele Mikroorganismen bereits in geringen Konzentrationen toxisch
• verschluckte Kupferverbindungen verursachen beim Menschen Schwäche, Erbrechen und Entzündungen im Verdauungstrakt
Bei Säugern in verschiedenen Kupferproteinen z.B. • für Sauerstofftransport • für Entgiftung
Chrom Cr(VI) • stark mutagen und cancerogen
Chromodulin • aktiviert die Tyrosin-
kinase-Aktivität des Insulinrezeptors für Sauerstofftransport
Nickel • Nickelmetall = Überempfindlichkeit • Ni(CO)4 = starkes Inhalationsgift • Nickelstaub = karzinogen
• Für Methanogenese methanogener Bakterien
• Ureasen von Bakterien und Pflanzen
Cadmium • bereits in geringen Konzentrationen giftig • krebserzeugend, erbgut- und fruchtschädigend
• Für die marine Kieselalge Thalassiosira weissflogii Cadmiumenzym
Metalle kommen auf der Erde sowohl im Wasser als auch im Boden und sogar in der Luft vor. Am häufigsten sind sie als Erze, fest im Felsgestein der Erdkruste eingebunden, aufzufinden. Durch natürliche oder anthropogene Freisetzung können diese Schwermetalle auch ins Grundwasser und somit in den Nahrungs- und Nährstoffkreislauf gelangen. Die natürliche Freisetzung von Schwermetallen geschieht unter anderem durch vulkanische Eruptionen, Verwitterung und Erosion. Da viele Metalle wichtige Werkstoffe für den Menschen darstellen und die moderne Welt auf die technische Nutzung von Metallen nicht mehr verzichten kann, müssen mehr und mehr Metallvorkommen abgebaut werden. Durch den Wunsch des Menschen sich die Metalle nutzbar zu machen, werden immer mehr auch giftige Metalle durch Tage- und Bergbau in die Umwelt
2

freigesetzt und mobilisiert. Auch während der Verarbeitung werden durch Abwässer und Abfallstoffe stets Metalle in unsere Umwelt eingebracht. Dadurch können Metallkonzentrationen zum Teil so stark erhöht werden, dass sie für die Pflanzen- und Tierwelt im toxischen Bereich liegen.
Wasserpflanzen & Algen
Bakterien
Bakterien
Wasserpflanzen & Algen
BakterienBakterien
BakterienBakterien
Abb. 1: Eintrag von Schwermetallen in den Nahrungs- und Nährstoffkreislauf. Schwermetalle können leicht über den Nahrungspfad aufgenommen werden (Abb. 1). Viele von ihnen werden im Körper schlecht abgebaut oder reichern sich in den verschiedensten Organen an. Einige Metalle blockieren sogar biochemische Abläufe im Körper aufgrund ihrer Ähnlichkeit zu essentiellen Elementen. Eine klare Abgrenzung zwischen nützlichen und schädlichen Metallen ist nicht immer eindeutig möglich. Der jedem Chemiker bekannte Satz: „Dosis sola facit venenum – die Dosis allein macht das Gift“ (Paracelsus 1493-1541) gilt in besonderem Maße bei der Betrachtung der Schadwirkung von Schwermetallen. Einige Schwermetalle sind durchaus von essentiellem Nutzen, wogegen andere als nichtessentiell gelten (siehe auch Tabelle 1). Essentielle Schwermetalle können bei einer zu geringen (Mangel) oder zu hohen Aufnahme (Vergiftung) negative Auswirkungen auf den Organismus haben, wobei nichtessentielle Schwermetalle schon in sehr geringen Konzentrationen schädigend wirken (Abb. 2).
3

Abb. 2: Schematische Darstellung der physiologischen Wirkung von Schwermetallen. Darüber hinaus ist die Bioverfügbarkeit von Schwermetallen und somit deren Toxizität stark abhängig von der vorliegenden chemischen Form. Bestes Beispiel ist hier das Quecksilber:
metallisch oral aufgenommen = ungiftig einatmen der flüchtigen Dämpfe = chronische Vergiftungen
ionisch Hg (I) z.B. Hg2Cl2 = gesundheitsschädigend, LD50 (oral, Ratte) = 210 mg/kg Hg (II) z.B. HgCl2 = sehr toxisch, LD50 (oral, Ratte) = 1 mg/kg
Organoquecksilber Verbindungen extrem toxisch Uran in der Umwelt
Neben den bisher aufgezeigten Schwermetallen, ist die Freisetzung radioaktiver Schwermetalle besonders problematisch, da sie neben ihrer chemotoxischen Wirkung auch radiotoxisch auf Mensch und Tier wirken. Ein Beispiel für ein radioaktives Schwermetall ist das Uran. Uran kommt in Uranmineralen wie z.B. Uraninit bzw. Pechblende (Uranoxid), Autunit (Uranylphosphat), Boltwoodit (Uransilikat), Coffinit (Uransilikat), Carnotit (Uranvanadat), Brannerit (Urantitanat) vor (Abb. 3).
Pechblende Autunit Boltwoodit
Abb. 3: Beispiele für verschiedene Uranminerale (www.geo.tu-freiberg.de) Der Abbau von Uranmineralen erfolgt hauptsächlich für die Kernenergiegewinnung und zur Herstellung nuklearer Waffen, sowie von urangemantelten Geschossen. Zum Teil findet sich Uran auch in Industrieprodukten, wie Düngemitteln und Zement wieder. Neben dem natürlichen Eintrag von Uran in die Natur, wie z.B. durch Quellwasser (Problem der Mineralwasserbelastung), besteht insbesondere durch Sicker- und Flutungswässer von Uran-
4

Halden und –Gruben, sowie durch die Verwendung urangemangelter Munition ein deutlicher anthrophogener Uraneintrag in die Umwelt. Das Gefährdungspotential für den Menschen beruht hauptsächlich auf den chemischen Eigenschaften des Urans und weniger auf dessen Radioaktivität. Die Aufnahme von Uran erfolgt nahezu ausschließlich über die Nahrung und das Trinkwasser und beträgt täglich 1,5 – 2,6 μg. Davon werden allerdings mehr als 90 % innerhalb der ersten 24 h über den Urin wieder ausgeschieden. In die Nahrungskette gelangt es zunächst durch die Aufnahme und Anreicherung in verschiedenen Pflanzen. Mögliche Folgen einer dauerhaft hohen Uran-Exposition für den Menschen sind vor allem Nierenschäden, Entwicklungsstörungen, Schädigungen des Erbgutes und ein vermindertes Knochenwachstum. Die Uranminerale bergen außerdem neben ihrer eigenen Toxizität die Gefahr der gasförmigen Alphastrahler (z.B. Radon-222), die als ihre Zerfallsprodukte entstehen können. Diese Gase können schwere gesundheitliche Schäden bei der Inhalation verursachen und gelangen häufig unbemerkt in Wohnhäuser, z.B. über Kellerräume beim Bau auf uranmineralhaltigen Böden. Uran tritt in den Wertigkeitsstufen II, III, IV, V und VI auf, wobei in der Natur die vier- und sechswertigen Verbindungen überwiegen. Neben vielfältigen Wechselwirkungen mit anorganischen Komponenten der Geosphäre, spielen ubiquitär verbreitete Mikroorganismen, Algen und Pflanzen eine entscheidende Rolle bei der Mobilisierung bzw. Immobilisierung dieses Radionuklids. Bakterien
Bakterien sind mikroskopisch kleine Organismen ohne echten Zellkern. Zusammen mit den Archaeen werden sie deshalb als Prokaryoten bezeichnet. Bakterien bilden neben Eukaryoten und Archaeen eine der drei Domänen des Lebens, in die alle Organismen eingeteilt werden (Abb. 4).
LUCA* Abb. 4: Phylogenetischer Stammbaum, (*Last Universal Common Ancestor)
5

Wichtige Charakteristika von Bakterien (Abb. 5)
• Einzeller
Zellwand
Zytoplasma-membran
PlasmidDNA
ChromosomaleDNA
Ribosomen
Zytoplasma
Flagellum
Zellwand
Zytoplasma-membran
PlasmidDNA
ChromosomaleDNA
Ribosomen
Zytoplasma
Flagellum
• Durchschnittliche Größe 0,5 bis 2 μm
• Kein Cytoskelett
• Kein Zellkern
• DNA ist ringförmiges Fadenmolekül
• Extrachromosomales Erbmaterial (Plasmide)
• Keine oder nur geringe interne Gliederung (Organellen, Kompartimente)
• Vermehrung durch Teilung, kurze Generationszeiten (E. coli: 20 Minuten)
Abb. 5: Aufbau einer prokaryotischen Zelle
• Unterschiede bei der Transkription und Translation im Vergleich zu den Eukaryonten
• Einfachere Kontrollsysteme zur Regulation der Genaktivität im Vergleich zu den Eukaryonten
Abb. 6: Anordnung von Flagellen auf Bakterien
Bakterien können sich mit Hilfe von Flagellen fortbewegen oder auf Oberflächen anheften. Bakterienarten unterscheiden sich in der Anzahl und Anordnung der Flagellen auf der Zelloberfläche (Abb.6).
peritrich lophotrich monotrichperitrich lophotrich monotrichperitrich lophotrich monotrich
Bakterien lassen sich aufgrund ihrer Gestalt in drei Grundformen unterteilen (Abb.7-links). Dabei werden kugelige Bakterien als Kokken, längliche, zylindrische Bakterien als Stäbchenbakterien und gekrümmte Stäbchen bei kommaförmigen Zellen als Vibrionen und bei schraubenartigen Zellen als Spirillen oder Spirochäten bezeichnet. Neben den Grundformen gibt es noch keulenförmige Zellen bzw. Bakterien, die filamentöse, verzweigte Gebilde ähnlich den Pilzmycelien formen (Streptomyceten). Die Bakterienzellen können nach der Zellteilung noch zusammen bleiben, wobei typische Formen aus mehreren Zellen entstehen (Doppelkokken = Diplokokken, Kettenkokken = Streptokokken, Haufenkokken = Staphylokokken).
Wenn Bakterien auf festen Oberflächen wachsen und sich teilen, bilden sie Kolonien, deren Morphologie charakteristisch für die jeweilige Spezies ist. Eine genaue Beschreibung einer isolierten Kolonie kann eine große Hilfe für die Identifikation von Mikroorganismen sein. Zur Charakterisierung der Kolonieform wurden spezielle Umschreibungen der Koloniemerkmale, wie Form, Rand, Höhe, Größe und Farbe eingeführt (Abb.7-rechts).
6

ganzrandig wellig filamentös gelappt gezackt geringelt
flach erhöht konvex polsterförmig gebuckelt
punktförmig rund filamentös unregelmäßig wurzelartig spindelförmig
Form
Rand
Höhe
ganzrandig wellig filamentös gelappt gezackt geringelt
flach erhöht konvex polsterförmig gebuckelt
punktförmig rund filamentös unregelmäßig wurzelartig spindelförmig
ganzrandig wellig filamentös gelappt gezackt geringelt
flach erhöht konvex polsterförmig gebuckeltflach erhöht konvex polsterförmig gebuckelt
punktförmig rund filamentös unregelmäßig wurzelartig spindelförmig
Form
Rand
Höhe
HHäände:nde:von 100von 100--10001000Bakterien/cmBakterien/cm22
AchselhAchselhööhlehle11--10 Mio.10 Mio.Bakterien/cmBakterien/cm22
StuhlStuhlca. 100 Mio.ca. 100 Mio.Bakterien/gBakterien/g
FusssohleFusssohle100.000100.000--1 Mio.1 Mio.Bakterien/cmBakterien/cm22
StirnStirncon 10.000 bis con 10.000 bis 100.000 Bakterien/cm100.000 Bakterien/cm22
HaarwurzelnHaarwurzelnca. 1 Mio.ca. 1 Mio.Bakterien/cmBakterien/cm22
NasensekretNasensekretca. 10 Mio.ca. 10 Mio.Bakterien/gBakterien/g
SpeichelSpeichelca. 100 Mio.ca. 100 Mio.Bakterien/gBakterien/g
HHäände:nde:von 100von 100--10001000Bakterien/cmBakterien/cm22
AchselhAchselhööhlehle11--10 Mio.10 Mio.Bakterien/cmBakterien/cm22
StuhlStuhlca. 100 Mio.ca. 100 Mio.Bakterien/gBakterien/g
FusssohleFusssohle100.000100.000--1 Mio.1 Mio.Bakterien/cmBakterien/cm22
StirnStirncon 10.000 bis con 10.000 bis 100.000 Bakterien/cm100.000 Bakterien/cm22
HaarwurzelnHaarwurzelnca. 1 Mio.ca. 1 Mio.Bakterien/cmBakterien/cm22
NasensekretNasensekretca. 10 Mio.ca. 10 Mio.Bakterien/gBakterien/g
SpeichelSpeichelca. 100 Mio.ca. 100 Mio.Bakterien/gBakterien/g
HHäände:nde:von 100von 100--10001000Bakterien/cmBakterien/cm22
HHäände:nde:von 100von 100--10001000Bakterien/cmBakterien/cm22
AchselhAchselhööhlehle11--10 Mio.10 Mio.Bakterien/cmBakterien/cm22
AchselhAchselhööhlehle11--10 Mio.10 Mio.Bakterien/cmBakterien/cm22
StuhlStuhlca. 100 Mio.ca. 100 Mio.Bakterien/gBakterien/g
StuhlStuhlca. 100 Mio.ca. 100 Mio.Bakterien/gBakterien/g
FusssohleFusssohle100.000100.000--1 Mio.1 Mio.Bakterien/cmBakterien/cm22
FusssohleFusssohle100.000100.000--1 Mio.1 Mio.Bakterien/cmBakterien/cm22
StirnStirncon 10.000 bis con 10.000 bis 100.000 Bakterien/cm100.000 Bakterien/cm22
StirnStirncon 10.000 bis con 10.000 bis 100.000 Bakterien/cm100.000 Bakterien/cm22
HaarwurzelnHaarwurzelnca. 1 Mio.ca. 1 Mio.Bakterien/cmBakterien/cm22
HaarwurzelnHaarwurzelnca. 1 Mio.ca. 1 Mio.Bakterien/cmBakterien/cm22
NasensekretNasensekretca. 10 Mio.ca. 10 Mio.Bakterien/gBakterien/g
NasensekretNasensekretca. 10 Mio.ca. 10 Mio.Bakterien/gBakterien/g
NasensekretNasensekretca. 10 Mio.ca. 10 Mio.Bakterien/gBakterien/g
SpeichelSpeichelca. 100 Mio.ca. 100 Mio.Bakterien/gBakterien/g
SpeichelSpeichelca. 100 Mio.ca. 100 Mio.Bakterien/gBakterien/g
SpeichelSpeichelca. 100 Mio.ca. 100 Mio.Bakterien/gBakterien/g
Abb. 7: Bakterielle Zellformen (links) und Formen von Bakterienkolonien (rechts). Die Zellwand ist die natürliche Abgrenzung eines jeden Bakteriums zur Umwelt und besitzt eine Vielzahl von Funktionen (Stabilität, Schutz, Stofftransport). Dadurch ist ihre Struktur und Permeabilität von entscheidender Bedeutung für die Toxizität von Schwermetallen. Nach dem Aufbau der Zellwand werden Bakterien in Gram-positive und Gram-negative Bakterien unterteilt. Beide haben eine Cytoplasmamembran, auf die die Zellwand aufgelagert ist. Bei Gram-positiven besteht diese aus vielen Schichten des sogenannten Mureins (Peptidoglycan), in welches (Lipo)teichonsäuren und Proteine eingelagert sind (Abb. 8-links). Bei Gram-negativen liegt der Cytoplasmamembran (innere Membran) nur eine dünne Peptidoglykanschicht auf, auf der eine zweite, äußere Zellmembran, die sich aber in Chemie und Aufbau von der Cytoplasmamembran unterscheidet, aufgelagert ist. Diese äußere Membran durchziehen Proteine, wie Porine, und auf der Außenseite sind Lipopolysaccharide (LPS) aufgelagert, wodurch sie auch als Lipopolysaccharidschicht bezeichnet wird (Abb. 8-rechts).
Abb. 8: Aufbau der Zellwand von Gram-positiven und Gram-negativen Bakterien
Abb. 9: Vorkommen von Bakterien am/im menschlichen Körper
Vorkommen von Bakterien
Bakterien sind ubiquitär verbreitet. Sie besiedeln alle Lebensräume, in denen höhere Lebewesen vorkommen. Zusätzlich sind viele Bakterien in der Lage, auch an Standorten mit extremen Lebensbedingungen zu überleben. Bakterien besiedeln auch den menschlichen Körper (Abb. 9). Zu jedem Menschen gehören etwa 10 Billionen (1014) Bakterien. Das ist etwa 10-mal soviel, wie der Mensch selbst Körperzellen hat. Die meisten Bakterien beherbergt der Dickdarm. Viele Bakterien im und am menschlichen Körper sind weder
7

nützlich noch schädlich. Andere, wie etwa Pneumokokken in den Atemwegen, können gefährlich werden, wenn sie sich übermäßig vermehren (Lungenentzündung). Doch solange sie von anderen Bakterien in Schach gehalten werden, stellen sie keine Gefahr dar. Der Mensch nutzt einige Stoffwechselprodukte der Mikroorganismen: Darmbakterien liefern beispielsweise das lebenswichtige Vitamin K. Zudem produzieren sie Säuren und so genannte Bacteriocine, die neu eingeschleppte Bakterien oder auch potenziell krankheitserregende Pilze abtöten oder deren Wachstum hemmen. Selbstverständlich tragen Darmbakterien auch einen erheblichen Teil zur Nahrungsmittelverwertung des Menschen bei.
e
Wechselwirkungen von Bakterien mit Uran und anderen Schwermetallen
Mikroorganismen sind aufgrund ihres vielseitigen Metabolismus in der Lage, auf verschiedenste Art und Weise mit Uran und anderen Schwermetallen in ihrer Umgebung zu interagieren. Dabei beeinflussen sie die Mobilität und Stabilität der Metalle sowohl durch direkte, enzymatische, als auch indirekte, nicht-enzymatische Reaktionen. Die wichtigsten Wechselwirkung von mikrobiellen und pflanzlichen Zellen mit Uran sowie anderer Schwermetalle sind: die Biosorption, die Biotransformation, die Biomineralisierung, die intrazelluläre Aufnahme und die Chelation (Abb. 10).
e d
Unter Biosorption versteht man die Anlagerung von (Schwer)metallen und Radionukliden an Biomasse oder Biomaterialien. Die Metallbindung erfolgt an reaktiven Gruppen wie Carboxyl-, Amin-, Hydroxyl-, Phosphat- und Sulfhydryl-Resten verschiedener Zellwandkomponenten. Biotransformation ist die durch Mikroorganismen katalysierte Reduktion bzw. Oxidation von Metallen. Die Oxidationsstufe von Uran sowie anderer Schwermetalle und Radionuklide bestimmt deren Löslichkeit, Mobilität und Bioverfügbarkeit. Unter Biomineralisierung versteht man die Bildung von unlöslichen Metallpräzipitaten, wie Phosphate, Carbonate und Hydroxide, mit Hilfe enzymatisch gebildeter Liganden.
ChelationMobilisierung durch z.B.
Siderophore
Biotransformation(nur Mikroorganismen)
Reduktion/Oxidation von Aktiniden→ Beeinflussung der Löslichkeit
UO22+ UO2
BioakkumulationAufnahme in die Zelle
UO22+
UO22+
2L-
UO22+
BiosorptionChemische Sorption durch
Komplexierung mit zellulärenLiganden (L)
BiomineralisierungBildung unlöslicher Präzipitate mit
anorganischen LigandenHPO4
2- + UO22+ UO2HPO4
CO32- + UO2
2+ UO2CO32OH- + UO2
2+ UO2(OH)2
ChelationMobilisierung durch z.B.
Siderophore
Biotransformation(nur Mikroorganismen)
Reduktion/Oxidation von Aktiniden→ Beeinflussung der Löslichkeit
UO22+UO22+ UO2UO2
BioakkumulationAufnahme in die Zelle
UO22+
BioakkumulationAufnahme in die Zelle
UO22+UO22+
UO22+UO22+
2L-
UO22+
BiosorptionChemische Sorption durch
Komplexierung mit zellulärenLiganden (L)
2L-
UO22+
UO22+
BiosorptionChemische Sorption durch
Komplexierung mit zellulärenLiganden (L)
BiomineralisierungBildung unlöslicher Präzipitate mit
anorganischen LigandenHPO4
2- + UO22+ UO2HPO4
CO32- + UO2
2+ UO2CO32OH- + UO2
2+ UO2(OH)2 Abb. 10: Mechanismen der Wechselwirkungen von Schwermetallen am Beispiel von Uran mit mikrobiellen und pflanzlichen Zellen
8

Eine Sonderform der Mobilisierung kann durch chelatierende Agenzien, wie Siderophoren erfolgen. Siderophoren werden bei Eisenmangel gebildet und dienen normalerweise der Bindung und dem Transport von Fe(III). Allerdings interagieren sie ebenfalls über funktionelle Gruppen, wie Catechol-, Hydroxamat- oder Carboxylgruppen sehr effektiv mit verschiedenen Metallen und Radionukliden und erhöhen dadurch deren Mobilität und Bioverfügbarkeit. Stressantwort von Bakterien
Schwermetalle gehören für alle Lebewesen zu den potentiellen Stressoren. Wie bereits erwähnt führen dabei hohe Konzentrationen zur Toxizität. Alle Umweltbedingungen, die nicht dem Wachstumsoptimum der Bakterien entsprechen, führen in der Zelle zu Veränderungen die unter „Bakterieller Stressantwort“ zusammengefasst werden. Da Bakterien als Einzeller direkt allen Umwelteinflüssen ausgesetzt sind, ist Stress nicht ungewöhnlich, aber oft von sehr unterschiedlicher Natur. Weitere Stressfaktoren für die Zellen sind beispielsweise:
• Limitation der C, N, S,…-Quelle(n)
• Hohe Ionenstärke oder Trockenheit
• Zu niedriger oder hoher pH-Wert
• Hohe Temperaturen
Welche Faktoren Stress für ein Bakterium darstellen, ist ganz vom Wachstumsoptimum des jeweiligen Bakterienstammes abhängig. Stressfaktoren wie Hitze oder hohe Schwermetallkonzentrationen führen oft zu Fehlfaltung von Proteinen. Diese Proteine verlieren dabei ihre Funktion und können darüber hinaus in der Zelle agglomerieren, was im Extremfall zum Zelltod führen kann. Eine Agglomeration erfolgt in der Regel dann, wenn hydrophobe Reste, die normalerweise im Inneren des Proteins zu finden sind, durch die Strukturänderung an die Außenseite des Proteins gelangen. Zelluläre Stressantwort
Die Erkennung von Stress erfolgt über spezifische und unspezifische Signalwege. Verallgemeinert lassen sich alle Signalwege in folgende Teile gliedern:
• Erkennung durch einen Rezeptor • Weiterleitung über eine Signalkaskade • Veränderung der Proteinexpression
Die Veränderung der Proteinexpression leitet Maßnahmen zur Stressbewältigung ein, die sehr unterschiedlich sein können. Hier einige Beispiele:
• Chaperone (spezielle Proteine) helfen andere Proteine richtig zu falten • Metallakzeptoren binden Metallionen in der Zelle z.B. Proteine mit Thiolgruppen • Aktiver Transport aus der Zelle, z.B. direkter Ionen Efflux • Oberflächenproteine binden Metallionen und verhindern den Eintritt in die Zelle
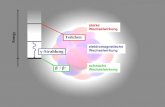
Spezifische Signalwege beinhalten am Anfang der Signalkette einen Rezeptor für den jeweiligen Faktor. Auf einen allgemeinen Signalweg soll hier näher eingegangen werden. Die Abbildung 11 zeigt die allgemeine (RpoE abhängige) Stressantwort, die so in vielen Gram negativen Bakterien vorkommt. Dieser Signalweg beginnt mit der Erkennung von denaturierten Proteinen durch RseB. RseB ist normalerweise mit einem Komplex in der inneren Membran verankert. Durch die
9

Bindung an denaturierte Proteine löst es sich vom Komplex, wodurch die Transmembrankomponente RseA proteolytisch abgebaut wird. Im Cytoplasma ist RpoE, ein Sigmafaktor, am Komplex assoziiert. Durch den Abbau von RseA wird RpoE freigesetzt. RpoE erkennt die Promotorregion spezieller Gene, die für eine allgemeine Stressantwort notwendig sind. RpoE initiiert durch die Anlagerung an die DNA die Bildung des Transkriptionskomplexes. Die RNA-Polymerase lagert sich an den Transkriptionskomplex und beginnt mit der Transkription. Damit beginnt die Expression von Proteinen, die zur Stressbewältigung dienen.
Abb. 11: Schematische Darstellung der zellulären Stressantwort in Gram-negativen Bakterien.
Verwendete Bakterienstämme
Die im Praktikum verwendeten Bakterienstämme gehören den Gattungen Pseudomonas, Escherichia und Sporosarcina an. Dabei handelt es sich zum Einen um Gram-negative Bakterienstämme (Pseudomonas und Escherichia), zum Anderen um Gram-positive sporenformende Bakterien (Sporosarcina). Pseudomonaden sind ubiquitär in der Natur verbreitet. Sie sind typische Bewohner von Böden und Gewässern. Auch Sporosarcinen sind in solchen Habitaten zu finden, allerdings weit seltener und in geringerer Anzahl. Sporosarcinen bilden bei schlechten Wachstumsbedingungen Endosporen aus, welche robuste Überdauerungsformen darstellen. In Sporen ist der Metabolismus auf ein Minimum reduziert, so dass diese weder Wasser noch Nährstoffe noch Sauerstoff benötigen. Deswegen können sie sehr lange unter schlechten Bedingungen überleben. Aus diesen Sporen bilden sich bei verbesserten Wachstumsbedingungen neue Zellen. Der verwendete Stamm der Gattung Eschericha – Escherichia coli – ist dagegen ein typischer Bewohner des Darmes von Mensch und Tier. Daher gilt der Nachweis dieses Bakterium in der Außenwelt, insbesondere in Wasser und in Lebensmitteln, als Indikator für fäkale Verunreinigungen. Alle im Praktikum verwendeten Stämme sind nicht pathogen, neutrophil (Wachstumsoptimum bei pH~7), mesophil (Temperaturoptimum ~30 °C) und besitzen einen aeroben Stoffwechsel, d.h. sie benötigen für ihr Wachstum Sauerstoff (Aerobier) bzw. tolerieren diesen (fakultative Anaerobier).
10

Mikrobiologisches Arbeiten
Allgemeines
Arbeiten in einem mikrobiologischen Labor erfordern die üblichen Sicherheitsvorkehrungen, wie sie von chemischen Laboratorien bekannt sind.
• tragen von Laborkittel, Handschuhe, Schutzbrille und festem Schuhwerk
• im Labor sind Essen, Trinken, Rauchen, Schminken, Aufbewahrung von Nahrungs-mitteln, Tabakwaren, und Kosmetika verboten
• den Anweisungen der Praktikumsassistenten ist Folge zu leisten
• Abfälle werden gesammelt und nach Beenden der Arbeiten autoklaviert
Besonderheiten beim mikrobiologischen Arbeiten
Abb. 13: Sterilwerkbank
Mikrobiologisches Arbeiten setzt die Anwendung steriler Techniken voraus. Verwendete Geräte, Arbeitsmaterialien und Arbeitsoberflächen müssen von lebenden Mikroorganismen oder deren Ruhestadien befreit werden. Die dazu verwendeten Verfahren werden Sterilisation oder Entkeimung genannt. Nur durch die Verwendung von sterilen Arbeitsmaterialien kann eine ungewollte Kontamination der
Nährlösungen und -platten mit fremden Mikroorganismen vermieden werden. Zur Sterilisation werden unter-schiedliche Techniken eingesetzt. Kolben, Flaschen und viele Lösungen lassen sich durch feuchte Hitze im Autoklaven (Abb. 12) bei 121°C und 1 bar Überdruck für 20 min sterilisieren.
Kleine Geräte wie Spatel oder Pinzetten werden in 70 %igen Ethanol getaucht und anschließend in der Brennerflamme abgeflammt, Impfösen werden ausgeglüht. Hitzeempfindliche Lösungen können durch Sterilfiltration von Keimen befreit werden. Es ist ebenfalls darauf zu achten, einen Eintrag von Kontaminationen über die Hände zu vermeiden.
Daher ist es beim mikrobiologischen Arbeiten unerlässlich, vor und nach dem sterilen Arbeiten, die Hände zu waschen und zu desinfizieren. Zusätzlich sollten stets Handschuhe getragen werden.
Abb. 12: Autoklav
11

Weiterhin sollten sämtliche Arbeiten, die sterile Bedingungen erfordern, unter einer sogenannten Sterilwerkbank (Abb. 13) durchgeführt werden. Vor Beginn und nach Beenden der Arbeiten werden die Arbeitsoberflächen (z.B. Oberfläche in der Sterilwerkbank) desinfiziert. Dies kann unter anderem durch das Einsprühen und Abwischen mit 70 %igen Ethanol geschehen. Da unsere Labore auch für gentechnische Arbeiten der Stufe S1 (nicht humanpathogen) zugelassen sind, gelten darüber hinaus spezielle Hygieneanweisungen (siehe Anhang). In mikrobiologischen Laboratorien werden einige Arbeiten wiederholt und routinemäßig durchgeführt. Zu diesen Arbeiten gehören unter anderen: • Das Herstellen von Agarplatten und Nährmedien
• Das Animpfen von Nährmedien
• Das Ernten von Zellen
• Das Ausplattieren von Kulturen auf Agarplatten
Die Wichtigsten dieser Arbeiten, welche auch für den entsprechenden Praktikumsversuch benötigt werden, werden hier kurz erläutert. Handhabung Impföse und Ausstreichen von Kulturen auf Agarplatten
• Sterilisation der Drahtspitze einer Impföse durch ausglühen, d. h. schräg von oben in die Flamme eines Gasbrenners halten, bis der Draht glüht (3 mal wiederholen) siehe Abbildung 14
• nach dem Abkühlen, die sterile Öse in das Kulturmedium tauchen
• durch die Oberflächenspannung bildet sich in der Öse ein Flüssigkeitsfilm, der genügend Zellen enthält, welche dann entsprechend auf einer Agarplatte, ohne zu sehr aufzudrücken, ausgestrichen werden
• anschließend die Impföse durch Ausglühen erneut sterilisieren
Abb. 14: Ausglühen der Impföse
Sterilisation von Lösungen
• Hergestellte Lösungen werden in einem Erlenmeyerkolben gegeben und mit einem Wattestopfen verschlossen.
• Der Stopfen wird noch mit Aluminiumfolie abgedeckt und mit etwas Autoklavier-indikatorband versehen.
• Anschließend werden die Kolben bei 121 °C für 20 min dampfsterilisiert.
12

• Bei Agarlösungen sollten die Kolben bis zum Gießen der Platten nach dem Autoklavieren im 70 °C-Brutschrank aufbewahrt werden, um ein vorzeitiges Erstarren des Agars zu verhindern.
Ansetzen von Agarplatten
• Agar in Erlenmeyerkolben einwiegen und mit destilliertem Wasser vermischen
• Kolben mit Sterilstopfen verschließen, mit Aluminiumfolie abdecken und einem Stück Autoklavierband versehen
• Dampfsterilisation bei 121 °C für 20 min; anschließend Aufbewahrung der Kolben im 70 °C-Brutschrank bis zum Gießen der Platten
• Der warmen Agarlösung unter leichtem Rühren und sterilen Bedingungen entsprechende (je nach Art des herzustellenden Mediums) sterile Nährbestandteile zugeben.
• Noch warme Lösung in sterile Petrischalen ausgießen, so dass etwa eine Agardicke von 0,5 cm entsteht (Abb. 15)
• Platten zum Abkühlen leicht geöffnet in Brennerflammennähe und unter der Sterilbox stehen lassen.
• Wenn die Agarplatten fest geworden sind, werden die Platten abgedeckt und am Boden mit der Bezeichnung des Medium beschriftet.
Abb. 15: Gießen von Agarplatten
Ausplattieren von Kulturen
• Entnehmen von 50 µl oder 100 µl einer Bakterien-kultur und Pipettieren dieses Volumens auf die Mitte einer Agarplatte.
• Abgeflammten Drigalskispatel zunächst zum Erkalten auf einen keimfreien Teil der Agarplatte halten
• gleichmäßiges Verteilen der aufgetragen Flüssigkeitsmenge auf der Agaroberfläche (Abb. 16) Abb. 16: Handhabung des
Drigalskispatels beim Ausplattieren • Erneutes Abflammen des Drigalskispatels und Abstellen im Ständer
13

Bedienung des Lichtmikroskops
Das Ziel der Mikroskopie ist die Beobachtung und Charakterisierung der eingesetzten Bakterienstämme. • Aufbringen von 2 µl verdünnter Bakteriensuspension
auf einen Objektträger and Abdecken der Probe mit einem Deckgläschen (Abb. 17)
• Vergrößerung der Bakterien mit dem Lichtmikroskop Olympus BX61 (Abb. 18) Abb. 17: Mikroskopisches Präparat
• Untersuchung der Probe zunächst mit dem 40x Objektiv bei 400facher Vergrößerung der Zellen
• Dazu die Probe auf dem Objekttisch einspannen, den Objekttisch an das 40x Objektiv heranbewegen und die Probe scharf stellen (Phasenkontrast 2 beachten)
• Die Probenposition merken, den Objekttisch vom 40 x Objektiv entfernen, die Probe entnehmen, einen kleinen Tropfen Immersionsöl auf das Deck-gläschen geben, die Probe wieder einspannen, das 100 x Objektiv einstellen und die Probe diesem an die vorherige Probenposition annähern und scharf stellen Zellen sind nun 1000fach vergrößert zu sehen (Phasenkontrast 3 beachten)
Abb. 18: Lichtmikroskop Olympus BX61
• Beobachtung der Bakterien über die Kamera auf dem Bildschirm und Aufnahme jeder Bakterien-probe
Kultivierung von Bakterien
Unter der Kultivierung von Mikroorganismen versteht man deren gezielte Vermehrung durch die Verwendung definierter Kulturmedien und die Schaffung optimaler Wachstumsbedingungen (Temperatur, pH-Wert, O2-Zufuhr). Dabei unterscheidet man zwischen Flüssigkulturen (Bioreaktor oder Schüttelkolben) und festen Nährmedien (Agarplatten) (Abb. 19). Im Versuch erhalten Sie frisch gewachsene Flüssigkulturen in Nutrient Broth Medium. Dieses Komplexmedium enthält Hefeextrakt und peptisch verdautes Fleischprotein (Pepton) Die Zusammensetzung dieser Extrakte ist nicht genau definiert. Sie liefern aber alle wichtigen Wachstumsfaktoren, wie Aminosäuren, Mineralsalze, sowie Kohlenstoff und Stickstoffquellen.
14

Abb.19: Mit Bakterien bewachsene Schüttelkolben (links); Agarplatten (rechts)
Im Gegensatz dazu wird für die im Versuch verwendeten Agarplatten ein spezielles Medium verwendet, das sehr wenig Phosphat enthält. Phosphat ist ein wichtiger Nährstoff für Bakterien und ein Baustein vieler organischer Verbindungen. Gleichzeitig führt Phosphat aber auch zu einer Komplexierung der gelösten Schwermetalle. Bei einer zu hohen Phosphatkonzentration kann es daher zur Ausfällung anorganischer Phosphatkomplexe kommen, welche nicht mehr bioverfügbar sind. Wachstum von Bakterien (Abb. 20)
Die Vermehrung der Bakterien erfolgt asexuell durch Zellteilung. Das kann durch Querteilung, Knospung oder Sporenbildung geschehen. Bringt man Bakterien aus einer über Nacht gewachsenen Kultur in eine frische Nährlösung, so befinden diese sich zunächst in der lag-Phase. Während dieser Phase adaptieren sich die Bakterien an die Wachstumsbedingungen. Dabei werden Enzyme synthetisiert, die zur Verwertung der verfügbaren Nährstoffe benötigt werden. In der darauffolgenden exponentialen Phase (log Phase) kommt es zur exponentiellen Vermehrung der Bakterien. Bei logarithmischer Darstellung der Zellzahl über der Zeit, entspricht der in dieser Phase lineare Anstieg, der spezifischen Wachstumsrate des Organismus, welche der Anzahl der Teilungen pro Zelle und Zeiteinheit entspricht. Infolge des schnellen Wachstums kommt es zur Reduktion der Nährstoffe und gleichzeitig einer Anreicherung mit (z.T. giftigen) Stoffwechselprodukten im Medium. Dadurch treten die Bakterien in die stationäre Phase ein, in der es zu einem Gleichgewicht zwischen Vermehrung und Tod der Bakterien kommt. Die weitere Verschlechterung der Bedingungen führt zum Absterben der Kultur (Absterbephase).
Abb. 20: Schematische Darstellung einer bakteriellen Wachstumskurve.
15

Metalltoleranztest
Das Wachstum auf Agarplatten dient im Praktikumsversuch der Quantifizierung der koloniebildenden Einheiten (CFU = ‘colony forming units’). Bringt man die einzelnen Bakterien auf einen festen Nährboden und bebrütet diese Platten ein bis zwei Tage bei ca. 30 °C, so vermehren sich die einzelnen Bakterien zu sichtbaren Bakterienkolonien. Die Anzahl der gewachsenen Kolonien entspricht dabei der Anzahl der auf den Nährboden aufgebrachten und vermehrungsfähigen Bakterien. Im Versuch wird immer die gleiche Anzahl Bakterien auf Platten mit unterschiedlichen Schwermetallkonzentrationen aufgetragen. Ein Unterschied in der Anzahl der gewachsenen Kolonien ist daher allein auf die wachstumshemmende Wirkung der Schwermetalle zurückzuführen. In den frisch gewachsenen Übernachtkulturen kann ein Bakterientiter, d.h. die Anzahl der Bakterien pro ml Kulturmedium, von bis zu 1010 erreicht werden. Da eine solche Bakterienanzahl keine Einzelkolonien, sondern einen Bakterienrasen auf der Platte bilden würde, muss die Zellsuspension deutlich verdünnt werden. Für ein gutes Auszählen sollte ein Wert von 30 bis 300 Kolonien pro Platte angestrebt werden. Im Praktikumsversuch werden die gewaschenen Zellen 1:100.000 bzw. 1:1.000.000 verdünnt und von diesen Suspensionen wird je 0,1 ml auf die Agarplatten aufgetragen (Abb. 21).
Abb. 21: Schematische Darstellung zur Verdünnung einer Bakteriensuspension
Geeignete Verdünnungsstufen
Anhand der Anzahl der gewachsenen Kolonien können die minimale Hemmstoffkonzentration (MHK50) und die minimale bakterizide Konzentration (MBK) ermittelt werden. Die MHK50 entspricht dabei der Konzentration des Schwermetalls, die das Wachstum von 50 % der Kolonien hemmt. Die MBK ist die niedrigste Konzentration, bei der das Wachstum der Bakterienstämme auf der Agarplatte vollständig gehemmt wird und makroskopisch nicht mehr nachzuweisen ist.
16

Lochtest
Der Lochtest ist ein weiteres Verfahren zur Resistenz- bestimmung von Mikroorganismen. Zumeist findet er Verwendung bei der Empfindlichkeitsprüfung von Bakteriestämmen gegenüber Antibiotika. Hier im Praktikumsversuch werden jedoch verschiedene Metalllösungen auf ihre wachstumshemmende Wirkung getestet. Dabei wird die Metalllösung in ein Loch in der Mitte der Agarplatte gegeben. Durch die Diffusion der Lösung bildet sich ein Konzentrationsgradient aus. Sind die Testbakterien gegenüber einer gewissen Metallkonzentration empfindlich, werden sie im Wachstum gehemmt und der Impfstrich wird nicht vollkommen ausgebildet. Die Bakterien stellen ihr Wachstum in mehr oder minder großer Entfernung vom Loch ein (Abb. 22). Die Länge des unbewachsenen Impfstrichs zeigt den Umfang der Wirkung des Metalls in entsprechender Konzentration an.
Abb. 22: Metalltolleranztest
17

ANHANG: Kurzbetriebsanweisung für gentechnische Arbeiten gem. § 12 Abs. 2 GenTSV (SICHERHEITSSTUFE 1)
Raum: P430 und P433 im Gebäude 8a (Forschungszentrum Dresden-Rossendorf) BBS (Uniklinikum): B. Schild Tel.: 458 2808 Notruf/Alarmzentrale über Tel.: 112 oder Tel.: 3333 1. Art der gentechnischen Arbeiten
In der Anlage sind nur gentechnische Arbeiten der Sicherheitsstufe 1 zulässig. Gehandhabte biologische Agentien: Archaea-, Bakterien- und Hefekulturen der Risikogruppe1 2. Verhalten im Labor
Grundsatz: Jede zum Arbeiten im Kontrollbereich berechtigte Person ist dafür verantwortlich, dass eine Freisetzung von gentechnisch veränderten Organismen (GVO) verhindert wird.
Allgemeine Verhaltensregeln: Grundlegend gelten die Verhaltensregeln sauberer mikrobio-logischer, radiochemischer und gentechnischer Arbeiten. Insbesondere ist darauf zu achten, dass:
• Türen und Fenster während der Arbeiten geschlossen sind.
• innerhalb der gentechnischen Anlage eigenständige Schutzkleidung zu tragen ist.
• Essen, Trinken und Rauchen untersagt ist.
• das Pipettieren mit dem Mund grundsätzlich untersagt ist.
• Kanülen und sonstige spitze Verbrauchsmaterialien zur Entsorgung getrennt zu sammeln sind.
• bei allen Arbeiten die entsprechenden Bedienungsanleitungen und Schutzvorschriften zu beachten sind.
• der für die gentechnische Anlage erstellte Hygieneplan generell zu befolgen ist.
3. Lagerung/Entsorgung
• Die längerfristige Lagerung aller GVO erfolgt bei -80°C im Raum P433.
• Bakteriell kontaminiertes Material (Kulturen, Kulturgefäße etc.) muss getrennt nach festen und flüssigen Abfällen im Labor in dafür bereitstehenden, geeigneten Behältern gesammelt werden.
• Alle mit GVO kontaminierten Materialien, die den S1-Bereich verlassen, müssen entweder vorher dekontaminiert (Vernichtungssterilisation im Autoklaven, Desinfek-tionsmittel) oder sicher eingeschlossen sein.
• Sind die GVO mit radioaktiven Stoffen in Berührung gekommen, sind die Anforder-ungen bei der Sammlung und Entsorgung von radioaktiven Reststoffen zu beachten. Die Vernichtungssterilisation erfolgt dann nur im Autoklaven SANOclav im KB6, R228 unter dem radiochemischen Abzug.
18

• 4. Verhalten nach Laborunfällen mit biologischen Agenzien
Der oberste Grundsatz ist, Mensch und Umwelt vor Schaden zu bewahren • Erst überlegen, dann handeln!
• Bei Freisetzung (z.B. Verschütten) von GVO Mitarbeiter warnen und Vorgesetzte (Projektleiter und ggf. Strahlenschutzbeauftragten) sofort informieren.
• Kleine Mengen verschüttetes biologisches Material unter entsprechendem Selbstschutz (Kittel, Handschuhe) sofort aufsaugen und die biologisch kontaminierten Oberflächen nach den Methoden des Hygieneplans desinfizieren.
• Bei größeren Unfällen eine weitere Person zu Hilfe rufen, gegebenenfalls frische Schutzkleidung anlegen, zwei Paar Schutzhandschuhe anziehen und biologisch kontaminierten Bereich großflächig mit Zellstofftüchern abdecken, diese dann mit bereitstehendem Desinfektionsmittel tränken, Einwirkungszeit abwarten und dann aufwischen. Siehe Hygieneplan!
Beachte: Erst Dekontamination von Personen und Kleidung, dann von Flächen und Geräten vornehmen.
19

Hygieneplan für die gentechnische Anlage der Sicherheitsstufe S1 in den Räumen P430, P433 im Gebäude 8a des Forschungszentrum Dresden-Rossendorf e.V.
Was Wann Womit Wie Wer
20
Pflege der Hände nach dem Händewaschen Handcreme: Hausmarke Pflegen Jeder, der im Labor arbeitet
Allgemeine Instrumente nach jeder möglichen Kontamination mit GVOs
Autoklav Sterilisation im Autoklaven, Sterilisationszeit 20 min bei 121°C, Reinigung erst nach dem Sterilisieren
der jeweilige Benutzer
Thermolabile Instrumente nach jeder möglichen Kontamination mit GVOs
Präparat:
4 %-ig Korsolex AF
Desinfizieren und Reinigen: unter Verwendung von Handschuhen mit Einwegtüchern einreiben, gegebenenfalls in Lösung einweichen, mind. 15 min einwirken lassen
der jeweilige Benutzer
Werkbänke
Oberflächen von Geräten und Inventar
vor und nach jeglicher gentechnischer und mikrobiologischer Arbeit
Präparat:
70-%-iger Ethanol verg. (Fläche<1qm)
1 %-ig Kohrsolin
Desinfizieren und Reinigen: unter Verwendung von Handschuhen mit Einwegtüchern einreiben, 1h einwirken lassen
der jeweilige Benutzer
Fußböden nach jeder möglichen Kontamination mit GVOs
Präparat: 3 %-ig Kohrsolin,
Desinfizieren und Reinigen: unter Verwendung von Handschuhen mit Einwegtüchern einreiben, 4h einwirken lassen
Jeder Verursacher,
Allg.: Reinigung zentral (zweimal wöchentlich)
alle 1 – 3 Wochen Textilsack Sammeln: Reinigung durch eine Fachfirma
der jeweilige Benutzer Schutzkleidung
nach jeder möglichen/stattgefundenen Kontamination mit GVOs
Präparat: 2 %-ig Kohrsolin
oder Autoklav
12h Einwirkzeit oder Autoklavieren, Reinigung durch eine Fachfirma
der jeweilige Benutzer
Persönliche Schutzausrüstung (Handschuhe)
nach Beendigung der Arbeit oder öfter
nach jeder möglichen Kontamination wechseln
In Autoklaviersäcken sammeln
Entsorgung über allgemeinen Laborabfall
Autoklavieren
der jeweilige Benutzer
Bakteriell kontaminierte Abfälle
sofort in geeigneten Behältern Sammeln, Autoklavieren, der jeweilige Benutzer
…, welche zusätzlich radioaktiv kontaminiert sind
sofort in geeigneten Behältern Autoklavieren: nur im Autoklaven SANOclave im radiochemischen Abzug KB6, P228, Öffnen erst nach vollständigem Erkalten
der jeweilige Benutzer
Waschen; Abtrocknen mit Einmalhandtuch aus Handtuchspender; Desinfektionspräparat entnehmen, verteilen und einreiben, mindestens 30sec einwirken lassen;
Desinfektionspräparat entnehmen, verteilen und einreiben, mindestens 30sec einwirken lassen; erst danach Hände waschen; Abtrocknen mit Einmalhandtuch aus
Jeder, der im Labor arbeitet
Händedesinfektions-präparat: Softaman Präparat aus Direktspender, Dosierung: 2-3 Hübe
Vor Aufnahme jeglicher gentechnischer und mikrobiologischer Arbeit
und nach Beenden jeglicher gentechnischer und mikrobiologischer Arbeit
Händereinigung/ hygienische Händedesinfektion

Skript zum Masterpraktikum Modul: Sorption Sorption von Uran an mineralischen und biologischen Systemen Stand: Sommersemester 2009
1

Sorption
Grundbegriffe der Sorption
Unter Sorption versteht man einen Vorgang, bei dem ein flüssiger oder gasförmiger Bestandteil, genannt Sorptiv, an eine Flüssig- oder Festphase, genannt Sorbens, angelagert (Adsorption) oder in sie eingelagert (Absorption) wird. Den Verbund aus Sorbens und an- oder eingelagertes Sorptivteilchen bezeichnet man als Sorbat. Desorption bezeichnet den Umkehrvorgang der Sorption, bei dem sich das sorbierte Teilchen wieder vom Sorbens löst. Zur Veranschaulichung dieser Grundbegriffe empfiehlt sich eine schematische Darstellung (Abb. 1).
Abb. 1: Grundbegriffe der Sorption [nach Kümmel und Worch (1990)].
Verschiedene Bindungsmechanismen können für die Sorption verantwortlich sein. Grundsätzlich unterscheidet man dabei nach Physi- und Chemisorption. Bei der Physisorption treten relativ schwache Kräfte auf, wie z.B. Dispersions- und Dipol-Dipol-Kräfte, mit Wechselwirkungsenergien, die kleiner als 50 kJ/mol sind. Die Chemisorption beruht auf chemischen Reaktionen zwischen Sorbens und Sorptiv, wodurch die Wechselwirkungsenergien deutlich größer werden (60-400 kJ/mol). Die Bindung erfolgt dabei meist ionisch oder kovalent, wodurch die Chemisorption oft irreversibel ist. Zusammensetzung des Bodens
Unerlässlich für die Abschätzung der Sorption ist ein fundiertes Wissen über die Zusammensetzung des Sorbens. Der Boden setzt sich durchschnittlich aus folgenden Teilen zusammen.
2

Abb. 1: Bodenzusammensetzung.
Mineralische Bestandteile
45 % feste
Wasser 20 … 30 %
Luft 20 … 30 %
Organische Bestandteile
5 %
Bestand- teile
Für die Sorption sind hauptsächlich die festen Bestandteile von Interesse. Der Großteil der festen Teile des Bodens wird durch die mineralischen Bestandteile, die sich in SiO2 (58 %), Al2O3 (16 %), verschiedenen Eisenoxiden (7 %), CaO (5,2 %), MgO (3,8 %), Na2O (3,9 %), K2O (3,1 %) und Spurenelemente aufschlüsseln lassen, repräsentiert. Um das Verhalten von Schwermetallen wie Uran im Boden zu untersuchen, müssen sowohl die Wechselwirkungen mit den mineralischen Bestandteilen als auch mit den organischen Bestandteilen betrachtet werden. Bedeutung von Sorptionsversuchen
Die Abschätzung des Verhaltens von Schwermetallen und anderen Gefahrstoffen im Boden ist von großer Bedeutung um die Risiken für Mensch und Tier nach Havarien oder durch Folgeschäden des Erzbergbaus abschätzen zu können. Durch Sorptionsversuche können Rückschlüsse darauf gezogen werden, wie mobil ein Schadstoff im landseitigen Untergrund ist. Die Mobilität ist dabei von sehr vielen Faktoren abhängig, wie z.B. der Zusammensetzung des Bodens, dem Oxidationszustand des Schadstoffes und dem pH-Wert. Weiterhin sind Sorptionsversuche unerlässlich bei der Suche nach passenden Endlagerstätten für radioaktiven Abfall. Beschreibung der Sorption mittels physikalischer Parameter
Zwischen der Menge an sorbiertem Stoff und der Konzentration des Sorptivs in der Matrix besteht ein (mathematischer) Zusammenhang, welcher bei konstanter Temperatur mit Hilfe von Sorptionsisothermen dargestellt werden kann.
3

0
0.0005
0.001
0.0015
0.002
0.0025
0 0.0005 0.001 0.0015 0.002 0.0025 0.003 0.0035 0.004Konzentration (mmol/L)
Bel
adun
g (m
mol
/kg)
HenryFreundlichLangmuirBET
Abb. 2: Schematische Darstellung gebräuchlicher Sorptionsisothermen.
Die einfachste Isotherme ist die lineare Henry-Isotherme. Sie ist äquivalent zum HENRYschen Gesetz, welches die Verteilung eines Gases zwischen gasförmiger und flüssiger Phase darstellt. Es gilt:
eqHeq cka ⋅=
eqa …. Menge des sorbierten Sorptivs auf der Oberfläche (Beladung)
eqc .… Gleichgewichtskonzentration des Sorptivs in der flüssigen Phase
Hk .… Henrykoeffizient
Bei der Henry-Isotherme sorbieren die Sorptivmoleküle unabhängig voneinander. Die Wechselwirkungsenergie von jedem Teilchen mit der Sorbensoberfläche ist identisch und vom Grad der Bedeckung unabhängig. Weiterhin tritt keine Sättigung ein. Die Henryisotherme ist daher nur für Bereiche niedriger Konzentration bzw. Beladung sinnvoll.
Bei der Freundlich-Isotherme werden im Gegensatz zur Henry-Isotherme Wechselwirkungen zwischen den sorbierten Molekülen berücksichtigt. Je mehr Teilchen sorbiert sind, umso mehr wird die Sorption zusätzlicher Teilchen erschwert. Dadurch flacht die Kurve ab. Es gilt:
neqFeq cka ⋅=
Fk , n .… Freundlichkoeffizienten
Bei der Langmuirisotherme wird berücksichtigt, dass es eine maximale Anzahl an Sorptionsplätzen auf der Oberfläche gibt und somit ein Sättigungsbereich erreicht wird. Jeder Sorptionsplatz wird allerdings als gleichwertig betrachtet und Wechselwirkungen der sorbierten Teilchen untereinander werden vernachlässigt. Dabei gilt:
4

eq
eqmaxeq cb1
cbaa
⋅+⋅⋅
=
maxa , b .… Langmuirparameter
Die BET-Isotherme (BET: Brunauer, Emmet, Teller) ist unter diesen Isothermen die einzige, die Mehrschichtensorption zulässt. Bei niedrigen Konzentrationen ist das Verhalten der BET äquivalent zur Langmuir-Isotherme äquivalent. Besonders für Oberflächenmessungen erweist sich diese Isotherme als sehr sinnvoll. Der Verteilungskoeffizient Kd
Aus Gründen der einfacheren Rechnung wird bei der Sorption oft auf die lineare Henry-Isotherme zurückgegriffen und ein Verteilungskoeffizient Kd wie folgt definiert:
mV
ccc
ca
K 0
eq
eqd ⋅⎟⎟
⎠
⎞⎜⎜⎝
⎛ −==
Da es in der Praxis sehr lange dauern kann bis das Gleichgewicht erreicht ist, wird auch von „steady state“ gesprochen, sobald keine messbaren Veränderungen mehr auftreten. Die Beschreibung mittels dieses Verteilungskoeffizienten ist auf reversible Prozesse beschränkt. Bei Kd handelt es sich zudem um einen unspezifischen Summenparameter, der nur für die gewählten experimentellen Bedingungen Gültigkeit hat. Jedoch ist es oft möglich, Kd so zu normieren, dass sich Aussagen über das Sorptivverhalten unabhängig vom Sorbens treffen lassen. So wird Kd für die Sorption unpolarer, organischer Stoffe auf den Organikgehalt des Sorbens entsprechend folgender Gleichung normiert:
OCdOC fKK ⋅=
OCf .… Anteil organisch gebundenen Kohlenstoffs am Sorbensmaterial Die KOC-Werte bzw. deren dekadische Logarithmen lassen sich in Tabellenwerken unabhängig vom verwendeten Sorbens als stoffspezifische Konstante finden. Oberflächenkomplexierungsmodelle
Wird die Annahme getroffen, dass die Sorption von gelösten Spezies durch chemische Reaktionen an spezifischen Oberflächenbindungsstellen erfolgt, so resultieren verschiedene mögliche Oberflächenspezies. Die betrachteten Reaktionen zwischen den Oberflächen-OH-Gruppen des Sorbens und den Liganden sind dabei äquivalent zu Komplexierungsreaktionen in wässriger Lösung zwischen Zentralatom (meist Metallion) und Liganden. Für die Sorption an Eisenoxiden finden sich bei Cornell und Schwertmann (2003) folgende mögliche Oberflächenspezies:
outersphere Komplex Physisorption
innersphere Komplex Chemisorption
5

mononuklear monodentat mononuklear bidentat binuklear bidentat
Abb. 3: Mögliche Oberflächenspezies an Eisenoxiden [nach Cornell & Schwertmann(2003)].
Oberflächenkomplexierungsmodelle beschreiben modellhaft den Verlauf von Oberflächenladung und Potential bei der Sorption von Ionen aus der Lösung in quantitativer Art und Weise. Dabei greifen sie auf ein vorher zu definierendes System gleichzeitig ablaufender Reaktionen, z.B. Säure-Base-Reaktionen, Oberflächenkomplexierung und Ionenaustausch, zurück, die unter Anwendung numerischer Verfahren computergestützt gelöst werden können. Dabei müssen verschiedene Parameter wie die Anzahl an Oberflächenbindungsstellen, die Stabilitätskonstanten und die Kapazität der Doppelschicht vorgegeben werden. Anwendungsbeispiele für Sorptionsbatchversuche
Zur Optimierung von Sorptionsversuchen ist es erforderlich einen optimalen Bereich für das Fest-Flüssigverhältnis zu bestimmen. Folgende Graphik zeigt dieses beispielhaft für die Sorption von Uran(VI) an Opalinuston.
Abb. 4: Optimierung des Fest-Flüssigverhältnisses bei der Sorption von Uran(VI) an Opalinuston.
Im optimalen Bereich für das Fest-Flüssigverhältnis sollten geringe Änderungen des Fest-Flüssigverhältnisses auch nur geringe Änderungen bei der sorbierten Menge von Uran bewirken.
0 50 100 150 200 250 300
0
20
40
60
80
100[U] = 1⋅10-6 M
S/L = 0,5 – 300 g/l
pH 7,6
I = 0,42 M (Porenwasser)
pCO2 = 10-3,5 atm
Optimales Fest-Flüssig-
Verhältnis: 200 g/l
U(V
I) so
rbie
rt (%
)
Fest-Flüssigverhältnis (g/l)
6

Außerdem ist es sehr wichtig herauszufinden nach welcher Zeit davon ausgegangen werden kann, dass sich ein stationärer Zustand für die Beladung mit Uran ergibt, damit die Versuchszeit nicht unnötig lang oder zu kurz gewählt wird. Folgende Graphik zeigt die Sorptionskinetik am Beispiel der Sorption von Uran(VI) und Huminsäure an Opalinuston:
Abb. 5: Untersuchung der Sorptionskinetik bei der Sorption von Uran(VI) und Huminsäure an Opalinuston.
1 10 30 60 90 1200
10
20
30
40
50
60
70
80
90
100
Zeit (h)
sorb
iert
es U
(VI)
/ sor
bier
te H
umin
säur
e (%
)
Huminsäure U(VI)
[U] = 1·10-6 M Mittelwert: (91,0 ± 0,3)% [HS] = 10 mg/l Mittelwert: (49,8 ± 1,4)% S/L = 60 g/l pH 7,6 I = 0,42 M (Porenwasser) pCO2 = 10-3,5 atm
Nach etwa 10 h Sorptionszeit hat die Beladung mit Uran(VI) in diesem System einen stationären Zustand erreicht. Die Beladung mit Huminsäure ist von der ersten Probennahme an im Gleichgewicht.
Großen Einfluss auf die Sorption hat in allen Fällen der pH-Wert des Systems. Folgendes Diagramm veranschaulicht dies anhand der Sorption von Uran(VI) an Opalinuston:
3 4 5 6 7 8 9 100
20
40
60
80
100
U(V
I) so
rbie
rt (%
)
pH-Wert
[U] = 1⋅10-6 M I = 0,1 M (NaClO4) pCO2 = 10-3,5 atm
Abb. 6: Sorption von Uran(VI) an Opalinuston in Abhängigkeit des pH-Wertes.
Die Abhängigkeit der Sorption vom pH-Wert ist sehr eng verknüpft mit der Speziation des Sorptivs (hier Uran(VI)) und der Ladung der Feststoffoberfläche.
7

Flüssigszintillationsmessung (LSC) an Uran
Die Flüssigszintillationsmessung, im Englischen Liquid Scintillation Counting (LSC) genannt, ist eine Methode zur Aktivitätsbestimmung von Radionukliden durch die Detektion ionisierender Strahlung. Die Methode beruht auf dem 1908 von Rutherford und Geiger beobachteten Effekt, dass bestimmte Substanzen bei Kontakt mit ionisierender Strahlung mit der Emission von Licht reagieren. Dieser Effekt wird als Szintillation und eine dazu befähigte Substanz Szintillator bezeichnet. Bei der LSC wird ein Gemisch aus Probe und Szintillationscocktail (Ultima GoldTM) analysiert. Der Cocktail, bestehend aus einem Lösungsmittel (Diisopropylnaphtalin), einem primären (2,5-Diphenyloxazol) und einem sekundären Szintillator (1,4-Bis(5-phenyl-2-oxazolyl)benzen), wird durch α- und β-Teilchen zur Emission von Lichtquanten angeregt. Folgendes Schema veranschaulicht dies:
CH3
8
Abb. 7: Schematische Darstellung der Energieübertragung bei der LSC.
Während der LSC-Messung können Löscheffekte auftreten, die zur Verringerung des Messsignales führen können. Dies kann durch eine vorher zu bestimmende Zählausbeute wie folgt korrigiert werden:
teZählausbeudpmcpm ⋅= cpm .… vom Gerät gemessene Zählrate (counts per minute) dpm .… Zerfallsrate (disintegrations per minute)
Für das im Praktikumsversuch benutzte U-233 beträgt die Zählausbeute 1.
Quellen:
R. Kümmel, E. Worch: Adsorption aus wäßrigen Lösungen, VEB Deutscher Verlag für Grundstoffindustrie, Leipzig (1990). R.M. Cornell, U. Schwertmann: The Iron Oxides, WILEY-VCH, Weinheim (2003).
CH3
CH3
CH3
Lösungsmittel Diisopropylnaphtalen (DIPN)
Primärszintillator 2,5-Diphenyloxazol (PPO)
O
N PMT
Sekundärszintillator 1,4-Bis-(2-methylstyryl)-
benzen (Bis-MSB)
Farbquenching Farbquenching
h·f
Energieübertragung auf das Lösungs-
mittel
α β
h·f
Chemisches Quenching

1
Skript zum Masterpraktikum Radiochemie Modul: Spektroskopie Spektroskopische Bestimmung der Speziation von Schwermetallen Stand: Sommersemester 2009

Gliederung:
1. Speziation
1.1. Begriffserklärung und Bedeutung der Speziation
1.2. Einflussfaktoren und wichtige Auswirkungen auf die Speziation von Metallionen am Beispiel von Uran(VI) und Europium(III)
1.3. Möglichkeiten zur Speziationsbestimmung
2. Spektroskopische Bestimmungsmethoden
2.1. UV-Vis Absorptionsspektroskopie
2.2. ATR-FT Infrarotspektroskopie
2.3. Laserfluoreszenzspektroskopie
2.4. Vergleich der Methoden 1. Speziation
1.1. Begriffserklärung und Bedeutung der Speziation
Die Speziation oder auch Speziesverteilung bezeichnet das gleichzeitige Auftreten verschiedener miteinander im Reaktionsgleichgewicht befindlicher Ausprägungsformen einer Substanz. Ein typisches Beispiel für solche Spezies sind die in Abhängigkeit vom pH-Wert auftretenden Dissoziationsstufen von Säuren und Basen. Speziation beschreibt beispielsweise auch die in wässrigen Lösungen unter bestimmten Bedingungen existierenden Molekülkomplexe oder Oxidationsstufen des gleichen Elementes. Durch ihre unterschiedlichen chemischen Eigenschaften haben die vorhandenen Spezies einen wesentlichen Einfluss auf die Reaktivität einer Lösung oder deren chemisches Verhalten. Die Speziation bildet beispielsweise eine wichtige Grundlage für das geochemische Verhalten von Metallionen in der Umwelt, z.B. beeinflusst sie Migrations- und Sorptionsprozesse in Böden. Die Bioverfügbarkeit von Pflanzennährstoffen hängt ebenso von der vorliegenden Speziesverteilung ab wie die Aufnahmefähigkeit von Pharmaka oder die Toxizität von Substanzen.
2

1.2. Einflussfaktoren und wichtige Auswirkungen auf die Speziation von Metallionen am Beispiel von Uran(VI) und Europium(III)
Wichtig für die chemische Zusammensetzung von Metallionen in wässrigen Systemen sind zum einen ihre chemischen Eigenschaften wie Löslichkeit, Oxidationszahl und Redoxpotential, zum anderen ihr Komplexbildungsverhalten und ihre Fähigkeit zur Sorption oder Kolloidbildung. Auch die physikochemischen Parameter wie beispielsweise Temperatur, Druck, Konzentration, pH-Wert und Ionenstärke der Lösung haben einen großen Einfluss. Die Auswirkungen dieser Faktoren auf die Speziation der Metallionen sind vielschichtig und komplex. Oft hat die Änderung eines einzelnen Parameters mehrere Effekte, die einander bedingen. So wird zum Beispiel durch die Reduktion des unlöslichen U(IV) zum U(VI) die Löslichkeit erhöht und damit das Metall mobilisiert, was wiederum in einer höheren Bioverfügbarkeit des Urans resultiert. Andererseits ist die Speziation des Uran(VI)-Kations in wässriger Lösung (vereinfacht auch als Uranyl oder UO2
2+ bezeichnet) in Abhängigkeit vom pH-Wert durch die Bildung von teilweise schwerlöslichen Uranylhydroxiden geprägt. Die Hydrolyse kann nach folgendem Reaktionsschema beschrieben werden:
x UO22+ + y H2O (UO2)x(OH)y(2x-y)+ + y H+ (1) ↔
Um sich einen Überblick über die vorliegende Speziesverteilung in einer wässrigen Lösung zu verschaffen, ist es möglich, mithilfe von Speziationsmodellen theoretische Aussagen über Zusammensetzung eines Komponentensystems X in wässrigen Lösungen zu treffen. Sind aufgrund vorher bestimmter thermodynamischer Gesetzmäßigkeiten die möglichen chemischen Umsätze einer Substanz bekannt, so lassen sich anhand von Komplexbildungskonstanten, Redoxpotentialen, Aktivitäten usw. Konzentrationsprofile bei verschiedenen pH-Werten erfassen. Dies erfolgt unter Einsatz numerischer Verfahren, die ein System von nichtlinearen Gleichungssystemen unter Verwendung zweistufiger Iterationen nach ihren Variablen auflöst. Abbildung 1 zeigt das Speziationsdiagramm einer wässrigen 1 x 10-5 M U(VI) Lösung über den pH-Bereich 2 – 10.
3
2 3 4 5 6 7 8 9 100
20
40
60
80
100
Abb. 1: 10-5 M U(VI) (links) und 10-3 M U(VI) (rechts) in CO2-freier wässriger Lösung bei I = 0.1 M und T = 25 °C.
Es wird ersichtlich, dass das freie Uranylkation UO22+ nur bis pH-Werte < 5 dominiert. Die
Hydrolyse des U(VI) beginnt bereits bei pH > 3.5, zwischen pH 5 – 6,5 werden hauptsächlich die polymeren Hydroxokomplexe, v.a. die (3,5)- und ein geringerer Teil der (4,7)-Spezies erwartet.
Spez
iesv
erte
ilung
/ %
pH-Wert
UO22+
UO2OH+
(UO2)2OH3+
(UO2)2(OH)22+
(UO2)3(OH)42+
(UO2)3(OH)5+
(UO2)4(OH)7+
UO2(OH)2(aq)
(UO2)3(OH)7-
UO2(OH)3-
UO2(OH)42-
2 3 4 5 6 7 8 9 100
20
40
60
80
100
UO22+
UO2OH+
(UO2)2OH3+
(UO2)2(OH)22+
(UO2)3(OH)42+
(UO2)3(OH)5+
pH-Wert
(UO2)4(OH)7+
UO2(OH)2(aq)
(UO2)3(OH)7-
UO2(OH)3-
UO2(OH)42-

In CO2-freier Lösung können bis zu zehn verschiedene Hydroxyspezies gefunden werden. Die Änderung der U(VI)-Konzentration bewirkt eine deutliche Verschiebung der auftretenden Uranylhydroxidspezies. Actinide zeigen ebenfalls ein ausgeprägtes Komplexierungsverhalten gegenüber anorganischen und organischen Liganden. Als Beispiel wird hier die Komplexbildung von Uran(VI) mit Carbonationen betrachtet. Zur Modellierung der Speziesverteilung wird eine 1 x 10-5 M U(VI)-Lösung angenommen, welche mit dem Kohlendioxid der Luft im Gleichgewicht steht. Das CO2 löst sich in Wasser und reagiert zu Kohlensäure. Diese dissoziiert zu Carbonat- und Hydrogencarbonationen und komplexiert mit den freien UO2
2+-Ionen. Die entstehenden Carbonatkomplexe sind thermodynamisch so stabil, dass sie mit steigendem pH-Wert die Hydrolysespezies des Urans verdrängen (Abb. 2).
4
2 3 4 5 6 7 8 9 100
20
40
60
80
100
Abb. 2: 10-5 M U(VI)-Lösung unter Inertgas (links) und unter normaler Atmosphäre (rechts), I = 0.1 M und T = 25 °C.
Ganz anders stellt sich die Speziesverteilung einer 1 x 10-5 M Eu(III)-Lösung dar (siehe Abb. 3). Das Eu3+-Ion dominiert die Verteilung bis pH 7, die Hydrolyse des dreiwertigen Lanthanids beginnt erst ab pH-Werten > 7. Bei der Europium-Speziation handelt es sich um ein einfaches System, bei dem sich laut Speziationsmodell in CO2-freier Lösung nur vier Hydroxyspezies bilden. Bei Europium(III) handelt es sich im Gegensatz zum Uran(VI) um ein einfaches Speziationssystem. Das zeigt sich auch darin, dass eine Erhöhung der Eu(III)-Konzentration auf 1 x 10-3 M keine signifikanten Änderungen des Speziationsdiagramms ergibt. Im Gegensatz zum Uran(VI) bilden sich unter normaler Atmosphäre ebenfalls weniger Carbonatspezies.
Abb. 3: 10-5 M Eu(III)-Lösung unter Inertgas (links) und unter normaler Atmosphäre (rechts), I = 0.1 M und T = 25 °C.
Spez
iesv
erte
ilung
/ %
pH-Wert
Eu3+
EuOH2+
Eu(OH)2+
Eu(OH)3(aq)
Eu(OH)4-
2 3 4 5 6 7 8 9 100
20
40
60
80
100
pH-Wert
Eu3+
EuOH2+
EuCO3+
EuOHCO3(aq)
Eu(OH)2+
EuOH(CO3)22-
Eu(CO3)33-
2 3 4 5 6 7 8 9 10
20
40
60
80
100
0
Spe
zies
verte
ilung
/ %
pH-Wert
UO22+
UO2OH+
(UO2)2OH3+
(UO2)2(OH)22+
(UO2)3(OH)42+
(UO2)3(OH)5+
(UO2)4(OH)7+
UO2(OH)2(aq)
(UO2)3(OH)7-
UO2(OH)3-
UO2(OH)42-
102 3 4 5 6 7 8 90
20
40
60
80
100
pH - Wert
UO22+
UO2OH+
(UO2)2(OH)22+
(UO2)2OH3+
UO2CO
3(aq)
UO2(OH)
2(aq)
(UO2)3(OH)5+
(UO2)3(OH)42+
(UO2)2CO3(OH)3-
(UO2)4(OH)7+
UO2(OH)
3-
UO2(CO3)22-
UO2(CO3)34-

5
1.3. Möglichkeiten der Speziationsbestimmung
Tabelle 1 gibt einen Überblick über die verschiedenen Möglichkeiten, die Speziation zu bestimmen. Dabei ist ersichtlich, dass der Großteil der Methoden lediglich Aussagen zu einem Speziationsparameter (wie z.B. der Struktur) liefert. Mit Hilfe der in diesem Praktikum verwendeten spektroskopischen Methoden (UV/vis und Fluoreszenz) ist es möglich, zusätzlich zu den Strukturinformationen auch Komplexbildungskonstanten zu bestimmen, die wichtige Informationen zur Stöchiometrie und Stärke der gebildeten Komplexe enthalten.
Tab. 1: Überblick über die Möglichkeiten der Speziationsbestimmung
Methode Untersuchung … Parameter, der bestimmt
wird UV/vis- / Fluoreszenz-Spektroskopie
von Übergängen zwischen elektronischen Zuständen
Komplexbildungskonstante
Schwingungs-Spektroskopie von Übergängen zwischen Schwingungszuständen einzelner Atomgruppen
Struktur einzelner Atomgruppen, Komplexbildung
Potentiometrie von Änderungen der elektromotorischen Kraft
Komplexbildungskonstante, Speziation
NMR der Umgebung einzelner Atome (C, H, P, F, N, O)
Strukturformel
EXAFS der Absorption von Röntgenstrahlung
Art, Anzahl und Entfernung von Nachbaratomen
Massenspektrometrie des Verhältnisses von Masse zu Ladung
Summenformel, teilweise Struktur
Polarographie/ Voltammetrie
der Veränderung des Elektrolysestroms
Komplexbildungskonstante
Chromatographie/ Extraktion
des Verteilungskoeffizienten zwischen 2 Phasen / Auftrennung von Komponenten
Speziation, wenn hoher Trennfaktor
Diffusion der gleichmäßigen Verteilung von Teilchen
Struktur
Sorption der Anreicherung eines Stoffes innerhalb einer Phase oder auf einer Grenzfläche
Struktur
2. Spektroskopische Bestimmungsmethoden
2.1. UV-Vis Absorptionsspektroskopie
Die UV/VIS-Spektroskopie ist die älteste spektroskopische Methode. Sie beruht auf der Anregung von Elektronenübergängen durch Absorption von ultravioletten (190-400 nm) und sichtbaren (400-700 nm) Licht. Dabei werden vor allem Valenzelektronen aus σ- und π–Bindungen (bei Metallionen d- oder f-Elektronen) sowie nichtbindende Elektronenpaare angeregt. Mit Hilfe der Molekülorbitale lassen sich die verschiedenen Übergänge genauer einordnen. Elektronen aus bindenden σ - und π -Orbitalen oder nichtbindenden n-Orbitalen können in antibindende σ*- und π*–Orbitale (σ → σ*, π → π*, n → σ*) angehoben werden. Dabei sind jedoch nur bestimmte Übergänge erlaubt. Die dabei zu beachtenden Übergangsverbote sind das Spin-Verbot und das Symmetrie-Verbot. Das Spin-Verbot besagt, dass sich während eines Übergangs der Gesamtspin nicht ändern darf. Bei einem Übergang von einem Singulett-Zustand S0 (Grundzustand) in einen energetisch höheren Singulett-

Zustand S1 ändert sich der Spin nicht. Nach dem Symmetrie-Verbot sind nur solche Übergänge erlaubt, die zwischen Orbitalen ungleicher Parität stattfinden. Abb. 4: Prinzip der UV-Vis Spektroskopie
Wenn Licht durch ein optisch dichteres Medium fällt, so verringert sich dessen Geschwindigkeit und ein Teil der Strahlungsenergie wird absorbiert. Dabei übertragen einige Photonen ihre Energie auf die äußeren Elektronen des Analyten und das Molekül wird vom Elektronengrundzustand S0 in einen elektronisch angeregten Zustand angehoben (Abb. 4). Die dabei absorbierte Energie kann mit dem Planckschen Gesetz beschrieben werden.
λ⋅=ν⋅= chhE (2)
mit E: Energie h: Plancksches Wirkungsquantum (6,626*10-34 J s) ν: Frequenz des Lichtes (s-1) c: Ausbreitungsgeschwindigkeit des Lichtes im Vakuum (3*108 m/s) λ: Wellenlänge des Lichts (m)
Die relative Intensitätsabnahme I/I0 (Absorption) ist proportional zur durchstrahlten Schichtdicke und der Konzentration (Teilchenanzahl) der Probe. Dieser Zusammenhang wird durch das Lambert-Beersche Gesetz beschrieben:
dcIIA ⋅⋅=−= ε0
lg (3)
mit A: Absorbanz I: Intensität nach dem Durchgang durch die Küvette I0: Intensität des einfallenden Lichtes c: Konzentration der absorbierenden Substanz in der Lösung (mol/l) ε: Molarer dekadischer Absorptionskoeffizient (l·cm/mol) bei der Wellenlänge λ d: Schichtdicke (cm)
Messprinzip Das für die Untersuchungen verwendete Spektrometer ist ein Zweistrahlspektrometer. Der Strahlengang ist in Abbildung 5 dargestellt.
6

Abb. 5: Schema des Strahlenganges im Zweistrahlspektrometer.
Das aus der Lichtquelle (Xenonlampe) tretende Licht wird im Monochromator nach Wellenlängen zerlegt und danach in zwei gleiche Lichtstrahlen zerlegt. Diese durchlaufen jeweils die Mess- bzw. Vergleichsküvette. Der Absorptionsunterschied wird im Detektor registriert und danach als wellenabhängiges Spektrum aufgezeichnet. Dieses wird automatisch auf dem PC gespeichert. UV/Vis-Spektroskopie von Uran Actinidelemente absorbieren im ultravioletten und sichtbaren Bereich. Sie besitzen schmale, gut definierte, charakteristische Absorptionsbanden. Die für die Absorption verantwortlichen Übergänge werden durch die verschiedenen Energieniveaus der 5 f-Elektronen verursacht. Abbildung 6 zeigt die typischen Absorptionsspektren der ungebundenen Uran(IV, V, VI)-Ionen. Durch die charakteristischen Absorptionsbanden ist es möglich, alle drei Oxidationsstufen quantitativ und qualitativ zu analysieren. Die Bandenmaxima mit den höchsten Extinktionskoeffizienten befinden sich bei 255 nm für Uran(V), bei 414 nm für Uran(VI) und bei 647,5 nm für Uran(IV) und liegen damit jeweils deutlich auseinander. Die Extinktionskoeffizienten für die einzelnen Oxidationsstufen sind mit 48,1 L·mol-1·cm-1 (U4+), 660 L·mol-1·cm-1 (UO2
+) und 7,1 L·mol-1·cm-1 (UO2
2+) eher gering im Vergleich zu organischen Substanzen, bei denen die Extinktionskoeffizienten zwischen 1000 L·mol-1·cm-1 und 50000 L·mol-1·cm-1 betragen können. Somit liegen die Nachweisgrenzen für die Oxidationszustände des Urans im Bereich von 50 bis 100 µmol (Ableitung aus dem Lambert-Beerschen-Gesetz).
7

Abb. 6: Uran(IV, V, VI) Absorptionsspektren
Mit Hilfe der UV/VIS Spektroskopie können zudem Komplexbildungskonstanten und Dissoziationskonstanten bestimmt werden. Dabei wird die Konzentration von Uran und Ligand konstant gehalten und die Spektren in Abhängigkeit vom pH-Wert aufgenommen. Durch die Komplexbildung verschiebt sich die Bandenlage mit Änderung des pH-Wertes, wie es in Abbildung 7 dargestellt ist. Sowohl die Verschiebung als auch die Erhöhung der Absorptionsbanden resultieren aus der unterschiedlichen Spezieszusammensetzung bei dem jeweiligen pH-Wert.
Abb. 7: UV/VIS Spektren von 0,05 M Uran und 1 M Essigsäure in Abhängigkeit vom pH-Wert. 2.2. ATR-FT Infrarotspektroskopie
Raman- und infrarotspektroskopische Untersuchungen können über die Erfassung von charakteristischen Schwingungsfrequenzen von funktionellen Gruppen (z.B. UO2
2+) Informationen zur Struktur von Molekülen bzw. von Molekülkomplexen liefern. Die Infrarotspektroskopie beruht auf der Absorption elektromagnetischer Strahlung von Molekülen. Da die Infrarotstrahlung energetisch im Bereich der Schwingungsniveaus von Molekülbindungen liegt (800 - 500000 nm), führt die Absorption zur Anregung von periodischen Bewegungen von Atomen oder Atomgruppen eines Moleküls, die als Form von Ausschlägen im gemessenen Spektrum sichtbar werden (Schwingungsspektren). IR-aktiv sind Schwingungen, die ihr Dipolmoment ändern.
8

Eine besondere Variante der IR-Spektroskopie ist die Fourier-Transform-IR-Spektroskopie (FTIR). Dabei werden über Fouriertransformation aus den mit Hilfe eines Michelsen-Interferometers gemessenen Interferogrammen IR-Spektren berechnet (Abb.8). Die FTIR-Spektroskopie zeichnet sich besonders durch ein höheres Signal-Rausch-Verhältnis im Vergleich zur dispersiven IR-Spektroskopie und eine hohe Frequenzgenauigkeit aus.
Abb. 8: Fourier-Transformation der IR-Spektren
Messprinzip Den wichtigsten Teil der Optik eines FTIR-Spektrometers stellt das Interferometer dar. Üblicherweise verwendet man ein Michelson-Interferometer (Abb.9). Die infrarote Strahlung der Strahlungsquelle wird am Strahlteiler in zwei Teilstrahlen geteilt, die auf einen feststehenden beziehungsweise auf einen beweglichen Spiegel treffen. Der Detektor nimmt die Intensität der rekombinierten Teilstrahlen, das sogenannte Interferogramm, in Abhängigkeit von der Spiegelauslenkung auf. Über die Fourier-Transformation wird daraus direkt das Spektrum berechnet.
Strahlteiler mitaktiver Schicht
Fester Spiegel(Referenz)
BeweglicherSpiegel (Probe)
x
Strahlteiler mitaktiver Schicht
Fester Spiegel(Referenz)
BeweglicherSpiegel (Probe)
x
Abb. 9: Messprinzip der FT-IR Spektroskopie
Die abgeschwächte Totalreflektion Fourier-transform-Infrarot Spektroskopie (ATR FT-IR) ermöglicht die Untersuchung von stark IR-absorbierenden oder optisch dichten Medien. Hierbei tritt der IR-Strahl nicht direkt durch die Probe, wie bei üblichen Transmissionsverfahren, sondern wird durch einen Kristall mit einem hohen Brechungsindex unter Totalreflektion gelenkt. Bei der Reflektion an der Grenzfläche zwischen den Medien unterschiedlicher optischer Dichte wird der IR-Strahl in der Größenordnung seiner Wellenlänge seitlich zu seiner Ausbreitungsrichtung verschoben und dringt über diese Länge als sogenanntes evaneszentes Feld aus dem Kristall
9

(optisch dichteres Medium) in die Probe (optisch dünneres Medium) ein. Die Eindringtiefe ist wellenlängenabhängig und bewegt sich für den mittleren IR-Bereich zwischen rund 0.5 und 1.5 µm. Wie die konventionelle Transmissions-IR-Spektroskopie beruht die ATR-Technik auf der Abschwächung des IR-Strahls über Aufnahme und Umsetzung von Strahlungsenergie in Molekülschwingungen innerhalb der Probe, so dass beide Methoden hinsichtlich ihrer Bandenlagen direkt miteinander vergleichbar sind. Durch mehrfache Reflektion des IR-Strahls im ATR-Kristall kann die Empfindlichkeit der Methode noch entscheidend gesteigert werden. Abbildung 10 veranschaulicht das Prinzip einer Durchflussmessung am Institut für Radiochemie..
Abb. 10: Messprinzip der ATR-FT IR-Spektroskopie.
IR-Spektroskopie von Uran Das UO2
2+-Kation zeigt eine symmetrische (υ1, Raman-aktiv) und eine antisymmetrische (υ3, IR-aktiv) Streckschwingung bei 870 cm−1 bzw. 961 cm−1. Durch die Komplexierung mit Liganden wie OH− oder CO3
2− kommt es zu einer Schwächung der U–O Bindungskraftkonstante, die in eine Verschiebung der charakteristischen Schwingungsfrequenz zu niedrigeren Wellenzahlen resultiert. Tabelle 2 gibt eine Zusammenfassung der U(VI)-Hydroxid-Komplexe mit ihren entsprechenden Schwingungsbanden. Durch Untersuchungen bei verschiedenen experimentellen Bedingungen, z.B. Variation der Konzentrationen an U(VI) und CO3
2−, oder des pH-Wertes können strukturelle Aussagen über die jeweilig vorliegende Spezies getroffen werden.
Tab. 2: Antisymmetrische Streckschwingung von Uran(VI)-Komplexen. Spezies υ3 (cm-1) UO2
2+ 961 (UO2)2(OH)2
2+ 943 (UO2)3(OH)5
+ 923 UO2(OH)2
0 922 UO2(OH)4
2- 870 UO2(CO3)3
4- 894 2.3. Laserfluoreszenzspektroskopie
Die Fluoreszenzspektroskopie ist eine emissionsspektroskopische Methode, die auf der Abgabe von Lumineszenz (Fluoreszenz oder Phosphoreszenz) durch angeregte Atome oder Moleküle beruht. Dabei werden Elektronen von Atomen oder Molekülen durch Absorption von Strahlung angeregt,
10

was zum Übergang des Elektrons vom Grundzustand S0 in ein energetisch höher gelegenes Orbital führt. Durch verschiedene Elektronen-, Schwingungs- und Rotationszustände kann das Elektron eine große Anzahl verschiedener Energiezustände einnehmen. Die Übergänge zwischen den Energiezuständen werden als photophysikalische Primärprozesse bezeichnet und mit Hilfe so genannter Jablonski-Termschemata dargestellt(Abbildung 11).
Abb. 11: Jablonski-Termschema für die Fluoreszenz- und Phosphoreszenzstrahlung. [http://www.olympusmicro.com/primer/java/jablonski/jabintro/index.html]
Werden Moleküle durch Strahlungsabsorption angeregt, erreichen sie einen höheren Schwingungszustand als den Grundzustand des ersten angeregten Singulettzustandes. Zur Rückkehr des Moleküls vom angeregten Zustand in den Grundzustand gibt es mehrere Möglichkeiten. Prinzipiell unterscheidet man dabei in strahlungslose Übergänge und Desaktivierung durch Strahlung. Die strahlungslose Energieabgabe kann ohne oder mit Änderung des Elektronenzustandes erfolgen. Eine Desaktivierung ohne Änderung des Elektronenzustandes ist durch Schwingungsrelaxation oder thermische Equilibrierung durch Kollision mit anderen Atomen und Molekülen möglich. Dabei wird der Grundzustand des ersten angeregten Singulettzustandes S1 erreicht und nachfolgende Emissionsvorgänge vom niedrigsten Schwingungszustand aus betrachtet. Strahlungslose Übergänge mit Änderung des Elektronenzustandes können in Form von interner und externer Konversion auftreten. Eine Desaktivierung durch Emission von Strahlung erfolgt durch Fluoreszenz und Phosphoreszenz. Bei der Emission von Fluoreszenzstrahlung wird die Energie in Form eines Photons emittiert und so das Atom vom S1 in den S0-Zustand relaxiert. Die Lebensdauer dieser Übergänge liegt bei 10-9 bis 10-7 s, die Fluoreszenz tritt nur während der Anregung eines Moleküls auf. Aufgrund der strahlungslosen Energieverluste im angeregten Zustand ist das emittierte Fluoreszenzspektrum im Vergleich zum Absorptionsspektrum in den höheren Wellenlängenbereich verschoben (Stokessche Verschiebung) (Abbildung 12). Die Zeitdifferenz zwischen Absorption und Emission beträgt 10-10
bis 10-6 s. Die Fluoreszenz tritt solange auf wie die
11

Probe angeregt wird. Die Abklingdauer bezeichnet man als Fluoreszenzlebensdauer. Diese ist stoffspezifisch und liefert somit eine qualitative Aussage über die untersuchte Probe.
Abb. 12: Absorption- und Fluoreszenzspektrum von Uranylperchlorat (UO
2(ClO
4)
2)
Eine spezielle Methode der Fluoreszenzspektroskopie ist die zeitaufgelöste laserinduzierte Fluoreszenzspektroskopie, welche gegenüber der konventionellen Technik einige Vorteile aufzeigt:
• geringe Nachweisgrenzen (c < 10-7 mol/l)
• Analyse von Mehrkomponentensystemen
• Unterscheidung von statischer und dynamischer Fluoreszenzlöschung
• Identifizierung von ultraschnellen Reaktionen im angeregten Zustand
Bezüglich des fluoreszierenden Stoffes wird in Metall- und Ligandfluoreszenz (organische Stoffe) unterschieden. Der Unterschied liegt in den zu erwartenden Fluoreszenzlebensdauern des fluoreszierenden Stoffes. Somit bestimmt die Fluoreszenzlebensdauer die Pulsdauer des Lasers, welche eine Größenordnung unterhalb der Fluoreszenzlebensdauern liegen sollte (Tab. 3).
Tab. 3: Grundarten der zeitaufgelösten laserinduzierten Fluoreszenzspektroskopie Fluoreszenzemitter Lumineszenzlebensdauer Pulsdauer des Lasers Metalle (z.B.: UO2
2+, Cm3+) Nano- bis Mikrosekunden Nanosekunden
organische Verbindungen Piko- bis Nanosekunden Femto- bis Pikosekunden Messprinzip Die Fluoreszenz wird im einfachsten Falle bei einer feststehenden Wellenlänge angeregt und über einen Monochromator rechtwinklig zur Probe detektiert. Abbildung 13 zeigt den schematischen Aufbau der Laserfluoreszenzmessungen. Über Einzelmessungen können die Peaklagen und Intensitätsverhältnisse, über zeitaufgelöste Messungen zusätzlich die Lebensdauer (über Abnahme der Lumineszenz mit der Zeit) bestimmt werden.
12

Laser
Messsystem Kontroller + PC
ProbeAnregungspuls
Fluoreszenz
Spektrograph
Lichtempfindlicher Detektor CCD-Kamera mit Bildverstärker
Laser
Messsystem Kontroller + PC
ProbeAnregungspuls
Fluoreszenz
Spektrograph
Lichtempfindlicher Detektor CCD-Kamera mit Bildverstärker
Abb. 13: Schematischer Aufbau des Laserfluoreszenzmesssystems
Laserfluoreszenzspektroskopie von Europium Dreiwertige Lanthanide (und Actinide) können durch Laser angeregt werden und emittieren Licht im sichtbaren Bereich. Die resultierenden Lumineszenzspektren sind gekennzeichnet durch relativ schmale, gut definierte, charakteristische Banden. Verantwortlich dafür sind Übergänge zwischen den verschiedenen 4f- (bei Actiniden: 5f-) Übergängen, die teilweise sehr sensitiv auf die chemische Umgebung des Metallions reagieren. So kann es durch Bindungen und Komplexierungen einerseits zur Verschiebung der Lumineszenzmaxima kommen, andererseits zu einer Aufspaltung der einzelnen Peaks auf Grund des äußeren Ligandenfeldes. Dreiwertiges Europium weist bei Anregung mit 395 nm im Wellenlängenbereich 570 – 640 nm maximal drei Lumineszenzmaxima auf (578 nm, 592 nm und 616 nm). Im freien Aqua-Ion wird der erste Peak nicht beobachtet, da es sich um einen verbotenen Übergang handelt. Der zweite Lumineszenzpeak ist relativ unabhängig vom äußeren Ligandenfeld (magnetischer Dipol), während der dritte Peak sich bei Komplexierung sehr stark ändert (elektrischer Dipol). Dieser Übergang wird daher auch als hypersensitiv bezeichnet. Typisch für Eu(III)-Komplexierungsrekationen ist eine Aufspaltung der Lumineszenzmaxima in mehrere Einzelpeaks, eine Bandenverschiebung tritt kaum auf. Abb. 14 veranschaulicht dies und zeigt das Lumineszenzspektrum von Eu(III) bei steigender Ligandenkonzentration in wässrigen Systemen mit Harnstoff (a) und Citronensäure (b).
Abb. 14: Lumineszenzspektren von 3E-5 M Eu(III) in Abhängigkeit von der Ligandenkonzentration in wässrigen Systemen mit a) Harnstoff und b) Citronensäure bei I = 0,1 M (NaClO4) und Raumtemperatur
13

14
2.4. Vergleich der Methoden
In Tabelle 4 ist ein Vergleich der in den vorangegangen Kapiteln beschriebenen spektroskopischen Methoden aufgezeigt. Die Methoden werden dabei hinsichtlich der Anforderung an die Proben-vorbereitung, der Messdauer, der Auswertung einer Probe und der Nachweisgrenzen für Uran(IV), Uran(VI) und Europium(III) miteinander verglichen. Die Präparation einer wässrigen Messprobe erfolgt für alle verwendeten spektroskopischen Methoden identisch. Es wird eine Lösung mit definierter chemischer Zusammensetzung hergestellt und auf einen bestimmten pH-Wert eingestellt. Im Unterschied zu den anderen Methoden wird bei der ATR FT-IR Spektroskopie eine zweite Probe für eine Messung benötigt. Diese zweite Referenzprobe unterscheidet sich in genau einem Parameter zur Messprobe und wird für die Auswertung anhand von Differenzspektren gebraucht.
Tab. 4: Vergleich der verwendeten Methoden für flüssige Proben.
UV/VIS
Spektroskopie TRLFS
Spektroskopie ATR FT-IR
Spektroskopie Probenvorbereitung einfach einfach einfach
Messdauer 1 – 10 min. 5 – 30 min. 1 – 2 h Auswertung einfach mittel schwer
U(VI) 10-4 - 10-5 M 10-7 M 10-6 M
U(IV) 10-5 M 10-6 M nicht IR-aktiv Nachweisgrenze
Eu(III) 10-2 M 10-6 M nicht IR-aktiv
In der Länge der Messdauer unterscheiden sich die Methoden deutlich voneinander. Werden für die Spektrenaufnahme im UV/VIS nur 1 bis 10 min benötigt, so dauert das Aufnehmen des Fluoreszenzspektrums bei einer zeitaufgelösten laserinduzierten Messung bereits bis zu einer halben Stunde (51 bis 101 Spektren in der Regel). Bei der IR-Spektroskopie wird eine lange Messdauer zur Gewinnung vieler Spektren der zwei Proben benötigt. Diese werden nach der Messung gemittelt. Durch anschließende Differenzrechnung können die Unterschiede zwischen Mess- und Referenzprobe im mikromolaren Bereich detektiert werden. Die Nachweisgrenzen sind bei der UV/VIS-Spektroskopie mit 10-4 M und 10-5 M für die beiden Uranoxidationsstufen und mit 10-2 M für Europium am höchsten. Bei Messungen mit der TRLFS sind umweltrelevante Uran- und Europiumkonzentrationen von 10-6 M detektierbar.

Skript zum Masterpraktikum Studiengang: Radiochemie Radioaktivität und Strahlenschutz Stand: Sommersemester 2009
1

Gliederung
1. Einführung
1.1. Grundlagen zur Radioaktivität
1.2. Messgrößen der Radioaktivität und im Strahlenschutz
1.3. Schutzmaßnahmen beim Umgang mit radioaktiven Stoffe
1.4. Überwachung der strahlenexponierten Personen im KB RCL
1.5. Überwachung der Oberflächenkontamination im KB RCL
1.6. Überwachung der Ortsdosis im KB RCL
2. Praktische Durchführung
2.1. Messung der Dosis eines α-, β-, und γ-Strahlers Abstandsmessung und Abschirmung der Strahler
2.2. Verhalten bei Oberflächen- und Personenkontaminationen
1. Einführung
1.1. Grundlagen zur Radioaktivität
Radioaktivität • spontane Umwandlung/Zerfall instabiler Kerne unter Energieabgabe in Form
ionisierender Strahlung (exothermerVorgang)
Energieabgabe
direkt vom Atom indirekt durch Prozesse in der Elektronenhülle
Entdeckung des Phänomens „Radioaktivität“ 1896 durch H. Bequerel
Bequerel • Bq = 1s-1 → kBq, MBq, GBq, TBq…,
Maß für die Aktivitätsmenge bezogen auf die Masse → spezifische Aktivität: Bq/g
Radioaktivität ist mit unseren Sinnesorganen nicht wahrnehmbar.
Radioaktivität kann in der Wilsonschen Nebelkammer sichtbar dargestellt werden.
2

Das Grundprinzip besteht darin, dass in einem aus gesättigtem Alkohol bestehenden Dampfraum geladene Teilchen längs ihrer Flugbahn eine Ionisation erzeugen. An diese ionisierenden Teilchen setzen sich Alkoholtröpfchen und ergeben eine sichtbare Nebelspur. Die Länge und Beschaffenheit der Spur geben Auskunft über das ionisierende Teilchen 1
2
3
4
1
2
3
4
Bild 1 α-Teilchen Bild 3 Protonen Bild 2 β-Teilchen Bild 4 Myon
(schnell zerfallendes, elektrisch geladenes Elementarteilchen, welches in 10-6 s in ein Elektron, Neutrino und Antineutrino zerfällt)
→ keine γ-Strahlung sichtbar darstellbar – da keine Teilchenstrahlung (elektromagnetische Welle)
1.2. Messgrößen der Radioaktivität und im Strahlenschutz
Freigrenze (FG): • Aktivitätsmenge/spezifische Aktivität (nach StrlSchV Anlage III Tabelle 1 Spalte 1 und 2),
bei deren Unterschreitung beim Umgang mit radioaktiven Stoffen keine Überwachung oder Genehmigung nötig ist kein Strahlenschutz!
Beispiele für FG: U-238sec (Pechblende) 1E+03 Bq Tc-99m (Radiologie) 1E+07 Bq H-3 (Luft) 1E+09 Bq
Halbwertszeit (T 1/2): • Zeit in der die Hälfte der Kerne zerfällt: T1/2 = ln2/λ λ…Zerfallskonstante
Beispiele für T1/2 : U-238sec (Pechblende) 4,4E+09 a Tc-99m (Radiologie) 6 h H-3 (Luft) 12,3 a
3

Energiedosis: • Gesamte absorbierte Strahlungsenergie pro Masseeinheit
1 Gy = 1 J/kg 1 J = 1 Nm = 1 Ws
Strahlenwirkung ist abhängig von Strahlenart, Strahlenenergie, Gewebeart
Äquivalentdosis (H): • Energiedosis x Qualitätsfaktor = Äquivalentdosis (in Sv)
dimensionslos, Röntgen-, Gamma- Betastrahlung 1 Neutronen, Protonen 5…20 Alphastrahlung 20
zum Beispiel: natürliche Strahlenbelastung 2…3 mSv/a strahlenexponierte Person B Grenzwert 6 mSv/a
1.3. Schutzmaßnahmen beim Umgang mit radioaktiven Stoffe
Grundsätzlich gilt beim Umgang mit radioaktiven Stoffen lt. §1 …..Schutz des Menschen und der Umwelt vor der schädlichen
Wirkung ionisierender Strahlung …….. durch:
• Aktivitätsmenge optimieren
• Abstand halten
• Abschirmung aufbauen
• Aufenthaltszeit optimieren Arbeitsschritte vor Versuchsbeginn inaktiv testen
zu Abstand halten: Abstandsgesetz: Strahlung nimmt mit dem Quadrat des Abstandes ab, bei doppelter Entfernung → Verringerung auf ¼ zu Abschirmung aufbauen: Papier Glas, Al, Plast
Blei, Beton Evtl. Kombination mehrerer Abschirmmaterialen z.B. bei Abschirmung von Nukliden mit Bremsstrahlung nötig
4

1.4. Überwachung der strahlenexponierten Personen im KB RCL
Personenüberwachung lt. §40 StrlSchV Ermittlung der Körperdosis (Personendosis) nach §41 StrlSchV Inkorporationsmessung Dosimeter Messung der im Körper gespeicherten oder ausgeschiedenen Radioaktivität
Messung der externen Dosis
Amtliches Dosimeter Dosimeterart Nichtamtliches Dosimeter Gleitschattendosimeter Typ EPT Mk10 Schwärzung fotogr. Film Messprinzip Proportionalzählrohr Bestimmung der Tiefen-Persondosis Hp(10)
direkte Anzeige der Tiefen-Personendosis Hp(10) und Hp(0,07)
Auswertung an LPS Berlin
1.5. Überwachung der Oberflächenkontamination im KB RCL
Überwachung der Oberflächenkontamination nach §44 StrlSchV mit LB 122
Überwachung von Arbeitsplätzen, Überwachung von Personen Gegenständen - LB 122 - α-/β- Ganzkörpermonitor Proportionalzählrohr
mit P-10 Zählgas gespült
Außerdem: Wischteste bei unebenen Oberflächen und bei C-14, H-3-Kontaminationen
5

1.6. Überwachung der Ortsdosisleistung im KB RCL
Messung der β- und γ- Strahlung, α-Strahlung nur über Zerfallsprodukte möglich Überwachung der Ortsdosis mit
LB 133-1 UMO LB 123 30 nSv /h….30 mSv/h Messbereich 10 nSv/h ....10 mSv/a
Sonde wechselbar für Kontamination, Dosis und Aktivität
2. Praktische Durchführung
2.1. Messung der Dosis eines α-, β-, und γ-Strahlers
An drei verschiedenen Präparaten (fest/flüssig) soll die Dosis mit dem UMO LB 123 ermittelt werden. Anschließende werden zwischen Präparat und Detektor (UMO LB 122) unterschiedliche Abschirmmaterialien geschoben um an hand der Abschirmwirkung auf die Strahlungsart zu schließen. Messungen der Dosis in Abhängigkeit des Abstandes Strahlungsquelle – Detektorsollen die Gültigkeit des Abstandgesetzes verdeutlichen.
2.2. Verhalten bei Oberflächen- und Personenkontaminationen
Am Modell (Kittel, Handschuhe) wird das Verhalten bei Kontaminationen erläutert. Mit geeigneten Dekontaminationsmittel werden die Kontaminationen beseitigt. Entsprechende Messungen mit dem LB 122 demonstrieren den Dekontaminationsvorgang.
6