Rol de α SNAP en la homeostasis de la glucosa
Transcript of Rol de α SNAP en la homeostasis de la glucosa

UNIVERSIDAD AUSTRAL DE CHILE
FACULTAD DE CIENCIAS
Rol de α-SNAP en la homeostasis de la glucosa: consecuencias de la mutación M105I de α-SNAP en la
secreción de insulina
TESIS DOCTORAL
María Paz Miró Pino
VALDIVIA – CHILE
2018

2
Rol de α-SNAP en la homeostasis de la glucosa: consecuencias de la mutación M105I de α-SNAP en la
secreción de insulina
Tesis presentada a la Facultad de Ciencias de la Universidad Austral de Chile en cumplimiento parcial de los requisitos para optar al grado de
Doctor en Ciencias
por
María Paz Miró Pino
Valdivia - Chile
2018

3
UNIVERSIDAD AUSTRAL DE CHILE FACULTAD DE CIENCIAS
INFORME DE APROBACIÓN DE TESIS DE DOCTORADO
La Comisión Evaluadora de Tesis comunica a la Dra. Leila Cárdenas, Directora de la Escuela de
Graduados de la Facultad de Ciencias que la tesis de doctorado presentada por el candidato
MARIA PAZ MIRÓ PINO
Ha sido aprobada en el examen de defensa de Tesis rendido el día……, como requisito para
optar al grado de Doctor en Ciencias. Y, para que así conste para todos los efectos firman:
Profesor Patrocinante de Tesis:
Dr. Luis Federico Bátiz ----------------------------------
Comisión Evaluadora de Tesis:
Dr. Rody San Martín -----------------------------------
Dr. Carlos Figueroa V. -----------------------------------
Dra. Marcela Michaut -----------------------------------

4
“sólo con el corazón se puede ver bien,
lo esencial es invisible para los ojos”

5
AGRADECIMIENTOS
Esta tesis ha sido desarrollada gracias al continuo apoyo y amor de las personas que me
rodean, quienes han sido pilares fundamentales en la construcción de esta etapa. Mi familia, es
el eje central de todo cuanto hago en mi vida y estoy inmensamente agradecida de mi gran
compañero de vida, por toda su paciencia, por toda su contención y por todo su amor, gracias
Luis Alberto!. Mis proyectos más hermosos de la vida, son mis hijos! Gracias Luquitas y Rosario
por todos los abrazos, por todas las sonrisas y por toooodos esos besos, que han hecho que no
me rinda jamás y que sea mejor cada día. Gracias a mis padres Sara y Ernesto y a mi hermano
Juan Ignacio, porque son ellos los que día a día me recuerdan que se puede volar más alto, que
no hay ningún objetivo que no se cumpla sin adversidades, pero que todo tiene más sentido si
colocas un trozo de tu corazón en lo que haces.
Gracias al Instituto de Anatomía, Histología y Patología por acogerme todos estos años
y brindarme un espacio para desarrollarme. Al Dr. Carlos Figueroa por toda su orientación y
cariño, a Gladys por su preocupación y apoyo, a Don Hernán y a Don Jaime, por su gran
voluntad, a los Académicos porque siempre tuvieron la mejor voluntad para orientarme,
escucharme y aconsejarme y sobre todo a mi Patrocinante de tesis, Dr. Federico Bátiz, porque
la vida entrecruzó nuestros caminos para aprender y para unir nuestros afectos a la ciencia y al
trabajo bien hecho. Gracias por todas las lecciones de vida y gracias por tu gran calidad humana,
que fue fundamental en esta etapa. A mis compañeros de laboratorio, muchas gracias por todo,
porque cada uno ha dejado en mí distintas vivencias, que han enriquecido este trayecto.
Estaré muy agradecida de las palabras de apoyo de mis amigos cuando las cosas no
parecían fáciles, cuando hubo cambio de planes o cuando la ciencia parecía no jugarme una
buena pasada. Son ustedes quienes han dado sentido al trabajo diario, al crecimiento innato de
esta etapa y quienes me han reforzado que la vida es mucho mejor en compañía de ustedes.
Gracias a la vida, que me ha dado tanto y que me ha brindado la oportunidad de crecer
y de compartir con ustedes mi crecimiento. ¡Gracias totales!

6
Índice de contenidos
1. Introducción ...................................................................................................... 166
1.1 Homeostasis de la glucosa. ......................................................................................... 166
1.1.2 Producción hepática de glucosa. ..................................................................................................... 177
1.1.3 Regulación pancreática de la glicemia .............................................................................................. 177
1.1.4 Eje hipotalámico - hipofisario ......................................................................................................... 188
1.1.5 Efecto incretinas ............................................................................................................................. 199
1.1.6 Patologías asociadas. ......................................................................................................................... 20
2. Páncreas ......................................................................................................................... 23
1.2.1 Embriología del páncreas ................................................................................................................ 233
1.2.2 Plasticidad Pancreática .................................................................................................................... 244
Capítulo 3. Células beta pancreáticas ............................................................................... 277
1.3.1 Síntesis de insulina .......................................................................................................................... 277
1.3.2 Secreción de insulina....................................................................................................................... 277
1.3.3 Factores que influyen secreción pancreática de insulina. .................................................................... 30
1.3.2 Acción del tejido periférico en la homeostasis de la glucosa. ............................................................ 333
Capítulo 4. a-SNAP: ¿un factor clave en la homeostasis de la glucosa? ............................. 377
Materiales y métodos ................................................................................................ 455
Materiales ........................................................................................................................ 455
2.1.1 Insumos y reactivos ........................................................................................................................ 455
2.1.2 Equipos e insumos ......................................................................................................................... 466
2.1.3 Animales de experimentación ......................................................................................................... 477
2.2 MÉTODOS ................................................................................................................ 477
2.2.1 Genotipificación de ratones hyh ..................................................................................................... 477
2.2.2 Cultivo Primario de Islotes de Langehans ....................................................................................... 488
2.2.4 Secreción de insulina estimulada por glucosa (GSIS) ....................................................................... 499
2.2.5 Métodos bioquímicos para análisis de proteínas .............................................................................. 499
2.2.6 Morfometría y estereología pancreática ........................................................................................... 522
2.2.7 Métodos bioquímicos de análisis de mRNA .................................................................................... 533
2.2.8 Evaluación estado metabólico del modelo murino ............................................................................ 54
2.2.9 Obtención de muestras de tejido pancreático .................................................................................. 555
2.2.10 Fijación de tejido pancreático ........................................................................................................ 566
2.2.11 Inclusión, corte y montaje de las muestras ..................................................................................... 566
2.2.12 Tinción general hematoxilina-eosina ............................................................................................. 566
2.2.13 Inmunocitoquímica ....................................................................................................................... 577
2.2.13.2 Bloqueo de la actividad peroxidasa endógena ............................................................................. 577
2.2.14 Inmunofluorescencia/microscopía confocal ................................................................................. 588
2.2.15 Marcaje con BrdU en ratones postnatales ...................................................................................... 588
3. Resultados .............................................................................................................. 60
3.1 α-SNAP ......................................................................................................................... 60

7
3.2 Homeostasis de la glucosa .......................................................................................... 677
3.3 Páncreas ..................................................................................................................... 788
4. Discusión ................................................................................................................ 92
5. Conclusión ............................................................................................................ 107
6. Bibliografía ........................................................................................................... 109

8
Índice de Tablas
Tabla 1. Anticuerpos Primarios ______________________________________________ 51
Tabla 2. Registro de alimentación controlada| __________________________________ 70

9
Índice de Figuras
Figura 1. Caracterización de la expresión de α-SNAP y NSF en tejido pancreático. ................................. 61
Figura 2. Caracterización histológica de la expresión de α-SNAP tejido pancreático. .............................. 62
Figura 3. Procedimiento quirúrgico en el desarrollo del cultivo primario de Islotes de Langerhans. ...... 64
Figura 4. Esquema representativo del ensayo de secreción de insulina estimulada por glucosa (GSIS). 65
Figura 5. Secreción de insulina desde cultivo primario de islotes de Langerhans. .................................... 66
Figura 7. Glicemias Basales. .......................................................................................................................... 70
Figura 8. Protocolo de Test tolerancia a la glucosa. ..................................................................................... 71
Figura 9. Test de tolerancia a la glucosa. ...................................................................................................... 73
Figura 10. Protocolo de registro de insulinemias. ......................................................................................... 74
Figura 11. Insulinemia Basal. ......................................................................................................................... 75
Figura 12. Protocolo de Test de Tolerancia a la Insulina (TTI). ................................................................. 76
Figura 13. Test de tolerancia a la insulina (TTI). ......................................................................................... 77
Figura 15. Relación entre el peso corporal y edad en ratones WT y hyh. .................................................... 79 Figura 17. Relaciones entre el volumen endocrino y el número de células endocrinas por área
pancreática ...................................................................................................................................................... 81 Figura 18. Relaciones entre la cantidad de islotes y tamaño de los islotes de Langerhans en ratones WT y
hyh. .................................................................................................................................................................. 82
Figura 19. Caracterización de la expresión de células α y β en islotes pancreático de ratones WT y
mutantes hyh. .................................................................................................................................................. 84
Figura N°20. Análisis cuantitativo de células α y β del tejido pancreático endocrino ............................... 86 Figura 21. Esquema representativo del protocolo de ensayo BrdU. Administración de una dosis de 100
mg/Kg de ratón, tres veces al día por tres días a grupos de ratones WT y mutantes hyh. A partir de la última dosis
de BrdU, se extrae el páncreas para posteriores análisis histológicos. .................................................................. 88
Figura 22. Ensayos de proliferación celular a través de la incorporación de BrdU. ................................... 89 Figura 23. Estudio de compensación en seriados pancreáticos en estadíos embrionarios (E16.5 y E18.5) y
Post-natales (PN1, PN2 y PN4) en los grupos WT y hyh. Imágenes representativas de los estudios de
inmunohistoquímica para insulina en páncreas de animales WT y hyh. Se puede observar la conformación de los
islotes pancreáticos en el transcurso del desarrollo. Tamaño de las imágenes 20X. Barra de escala 20 µm. .......... 90
Figura 24. Relación de volumen endocrino con las distintas edades del desarrollo. ................................. 91

10
Índice de abreviaciones
ADA: Asociación de diabetes de américa
ACC: AcetilcoA carboxilasa
AICAR: AICA-Riboside
AMP: Adenosinmonofosfato
AMPK: Proteína kinasa activada por AMP
ARC: Núcleo arqueado
AgRP: Proteína r-agouti
BrdU: 5-bromo-2-desoxiuridina
DM: Diabates mellitus
DMH: Hipotálamo dorso medial
DPP4: Dipeptidil peptidasa 4
DTT: 1,4 - dithiothreitol
GABA: Ácido γ-aminobutírico
GAP: Rab-GTPasa
GIP: Péptido inhibidor gástrico
GLP-1: Péptido-1 similar a glucagón
GLUT2: Transportador de glucosa 2
GSIS: Secreción de insulina estimulada por glucosa
GSV: Vesícula de almacenaje de GLUT4
GLUT4: Transportador de glucosa 4

11
HGP: Producción hepática de glucosa
hyh: Hop gait hydrocephalus
LHA: Área hipotalámica lateral
LDCV: Vesículas grandes de núcleo denso
LKB1: Kinasa hepática B1
NPY: Neuropéptido Y
NSF: Factor sensible a N-metilmaleimida
POMC: Proopiomelacortina
PVN: Núcleo paraventricular
PACAP: Péptido hipotalámico similar a VIP
RI: Resistencia a la insulina
RP: Gránulos secretorios de reserva
RRP: Gránulos secretorios de rápida liberación
SLMV: Microvesículas tipo sinápticas
SNAP: Proteína solubre de anclaje a NSF
SNARE: Receptores de SNAP
TGN: Red trans-golgi
TIRF: Microscopía de fluorescencia de reflexión total interna
VIP: Péptido intestinal vasoactivo
WT: Wild type (silvestre)
ZNT8: Transportador de zinc 8

12
RESUMEN
La homeostasis de la glucosa es un mecanismo fisiológicamente balanceado que depende
fundamentalmente de la secreción de insulina por parte de las células β pancreáticas y de la
translocación de GLUT4 a la membrana plasmática. Ambos eventos de fusión de membranas
son mediados por la familia de proteínas SNAREs y la ausencia de proteínas de este complejo
conlleva a la desregulación de la glicemia.
α-SNAP es una proteína soluble involucrada en los eventos de fusión de membrana.
Junto con NSF tienen como función principal la liberación de las proteínas SNAREs (función
canónica de α-SNAP) para una nueva ronda de fusión, sin embargo, en los últimos años, se han
descrito otras funciones independientes de su interacción con NSF (funciones no canónicas) que
han cobrado importancia en diversos procesos celulares dentro de los cuales, destaca su
participación como ATPasa de AMPK.
Los antecedentes que vinculan a α-SNAP y a las proteínas SNARE con la secreción de
insulina han sido obtenidos en modelos celulares o en ensayos in vitro, por lo que resulta
interesante evaluar el rol de α-SNAP en la homeostasis de la glucosa in vivo. Desarrollamos esta
investigación en el modelo de ratón hyh (hydrocephalus whit hop gait), que presenta una
mutación puntual espontánea en el gen Napa que codifica para α-SNAP. Esta mutación genera
hipomorfismo α-SNAP en cerebro y otros órganos.
Con estos antecedentes, el presente trabajo de investigación propone que “la mutación
M105I de α-SNAP provoca una reducción en la liberación de insulina en células β pancreáticas”.
Para desarrollar esta hipótesis evaluamos el rol que tiene α-SNAP en la secreción de insulina in
vitro, registramos parámetros fisiológicos del metabolismo de glucosa del modelo animal y
establecimos las consecuencias de la mutación de α-SNAP en la arquitectura del tejido
pancreático.
Los resultados obtenidos a partir de esta tesis, señalan la existencia de hipomorfismo de
α-SNAP a nivel pancreático, donde la mutación de esta proteína altera la función de las células
β que se traduce en una menor liberación de insulina. A pesar de esta condición evaluada in vitro,
nuestros datos señalan que los ratones hyh presentan un balance metabólico normal, a pesar de

13
mantener algunas diferencias en la dinámica del control de este equilibrio (TTGIP) y de presentar
menores valores de insulinemias. Este efecto es una consecuencia de los resultados observados
en morfometría pancreática, donde señalamos que la mutación M105I de α-SNAP genera una
tendencia al aumento del volumen endocrino que está dado por un mayor número de islotes de
Langerhans que a su vez, presentan una mayor cantidad de células endocrinas producido
eventualmente por un mayor índice proliferativo de células endocrinas, que comienza
marcadamente en estadíos perinatales
El conjunto de resultados presentados en este trabajo de investigación, apoyan la
hipótesis que la mutación M105I de α-SNAP disminuye la secreción de insulina desde las células
β pancreáticas, sin embargo, no altera la homeostasis de la glucosa en animales mutantes hyh.
Indudablemente esta investigación representan un aporte para conocer mejor los mecanismos
celulares y moleculares que mantienen la homeostasis de la glucosa in vivo; situando a α-SNAP
como una proteína multifuncional relevante en la fisiología de las células β pancreáticas, lo cual
abre nuevas interrogantes que garantizan la proyección biomédica de este trabajo.

14
ABSTRACT
Glucose homeostasis is a physiologically balanced mechanism that depends mainly on the
secretion of insulin by pancreatic β cells and the translocation of GLUT4 to the plasma
membrane. Both membrane fusion events are mediated by the SNAREs family of proteins and
the absence of proteins from this complex leads to the deregulation of glycemia.
α-SNAP is a soluble protein involved in membrane fusion events. Together with NSF, the main
function is the release of SNAREs (canonical function of α-SNAP) for a new round of fusion,
however, in recent years, other functions have been described that are independent of their
interaction with NSF (functions not canonicals) that have gained importance in various cellular
processes, among which, their participation as AMPK ATPase stands out.
The antecedents that link α-SNAP and SNARE proteins with insulin secretion have been
obtained in cell models or in vitro tests, so it is interesting to evaluate the role of α-SNAP in
glucose homeostasis in vivo. We developed this research in the hyh (hydrocephalus whit hop
gait) mouse model, which has a spontaneous point mutation in the Napa gene that codes for α-
SNAP. This mutation generates α-SNAP hypomorphism in the brain and other organs.
In this context, this research paper proposes that "the M105I mutation of α-SNAP causes a
reduction in the release of insulin in pancreatic β cells". To develop this hypothesis, we evaluated
the role of α-SNAP in insulin secretion in vitro, recorded physiological parameters of glucose
metabolism of the animal model and established the consequences of α-SNAP mutation in
pancreatic tissue architecture.
The results obtained from this thesis, show the existence of α-SNAP hypomorphism at
pancreatic level, where the mutation of this protein alters the function of the β cells that results
in a lower release of insulin. Despite this condition evaluated in vitro, our data indicate that hyh
mice have a normal metabolic balance, despite maintaining some differences in the dynamics of
control of this balance (TTGIP) and presenting lower values of insulinemias. This effect is a
consequence of the results observed in pancreatic morphometry, where we point out that the
mutation M105I of α-SNAP generates a tendency to increase the endocrine volume that is given
by a greater number of islets of Langerhans which, in turn, present a greater amount of endocrine

15
cells produced eventually by a higher proliferative index of endocrine cells, which begins
markedly in perinatal stages
The results presented in this research work support the hypothesis that the M105I mutation of
α-SNAP decreases insulin secretion from pancreatic β cells, however, it does not alter glucose
homeostasis in hyh mutant animals. Undoubtedly, this research represents a contribution to
better understand the cellular and molecular mechanisms that maintain glucose homeostasis in
vivo; situating α-SNAP as a relevant multifunctional protein in the physiology of pancreatic β
cells, which opens new questions that guarantee the biomedical projection of this work.

16
1. INTRODUCCIÓN
La existencia de un organismo depende de la provisión continua de energía para sus
procesos metabólicos, siendo las fuentes de energía más importantes en mamíferos la glucosa y
los ácidos grasos (Jouvet and Estall, 2017). El mantenimiento de la concentración de glucosa en
sangre, denominado homeostasis de la glucosa, es clave para proporcionar energía a diferentes
tipos celulares; tanto así, que algunos tejidos son casi totalmente dependientes de este
carbohidrato como fuente de energía (Moore et al., 2012).
1.1 HOMEOSTASIS DE LA GLUCOSA
La homeostasis de la glucosa es un mecanismo fisiológicamente balanceado que depende
fundamentalmente de tres procesos simultáneos y coordinados que involucran i) la producción
hepática de glucosa, ii) la liberación de insulina por las células β pancreáticas y iii) la
La importancia de una homeostasis eficiente radica en la dependencia que tienen algunos
tejidos por la glucosa. Ha sido descrito que luego de la ingesta de carbohidratos,
aproximadamente el 33% de la glucosa es absorbida por el hígado, otro 33% es captada por los
tejidos musculares y adiposos, y la glucosa restante es demandada desde el cerebro, el riñón y
las células rojas de la sangre (Moore et al., 2012).
Para llevar a cabo la regulación de los niveles de glucosa en sangre, es preciso disponer
de un sistema de control que permita actuar de manera óptima y precisa, frente a variaciones en
la glicemia.

17
1.1.2 Producción hepática de glucosa
El hígado es el órgano por excelencia encargado de almacenar glucosa en forma de
glucógeno y es quien tiene la capacidad endógena de producirla, participando entonces de
manera activa en la regulación de la glicemia.
Cuando los nutrientes están disponibles, se absorbe la glucosa del torrente sanguíneo
para ser almacenada como glucógeno, esto conlleva la secreción pancreática de insulina que
suprime la producción hepática de glucosa (HGP) y promueve la lipogénesis. En cambio, cuando
los nutrientes se vuelven escasos, se promueve la HGP para satisfacer las demandas energéticas,
la cual se logra a través de la síntesis de novo desde precursores disponibles, proceso conocido
como gluconeogénesis y por la degradación del glucógeno denominado, glucogenólisis.
La producción de glucosa por el hígado también es controlado por catecolaminas
secretadas por la médula suprarrenal, las cuales aumentan la producción de glucosa a través de
la activación de la glucógeno fosforilasa (Rizza, 1980). Se ha observado que tanto la hormona de
crecimiento como el cortisol, favorecen la expresión de enzimas de la vía gluconeogénica y
disminuyen el transporte de glucosa (Rizza, 1982).
1.1.3 Regulación pancreática de la glicemia
Un aspecto importante en la regulación de la glicemia es la secreción hormonal del
páncreas. Para esto, el páncreas cuenta con diferentes tipos de células endocrinas, las cuales se
encuentran agrupadas en islotes, denominados islotes de Langerhans, los cuales están rodeados
de tejido pancreático exocrino que a su vez, está compuesto de células acinares, células de los
conductos, y células centro-acinares. Todos estos tipos celulares derivan de células progenitoras
multipotentes ubicadas en el epitelio del páncreas mamífero en desarrollo (Stanger and Hebrok,
2013). Las células endocrinas pancreáticas se clasifican en células α: secretoras de glucagón; β:
secretoras de insulina; δ: secretoras de somatostatina; épsilon: productoras de ghrelina; células
P: productoras de polipéptido pancreático y células G: sintetizan gastrina (Unger et al., 1978).
Las células α, sensan una disminución de los niveles plasmáticos de glucosa y liberan de manera

18
inmediata glucagón, hormona que tiene como tejido blanco el hígado, en donde se comienza
con la degradación del glicógeno almacenado en los hepatocitos y con ello aumenta la
disponibilidad de glucosa en sangre, favoreciendo entonces el aumento de la glicemia.
Por otro lado, la insulina, hormona sintetizada por células β, regula la glicemia en sentido
contrario a glucagón. Los elevados niveles de glicemia en sangre son pesquisados por las células
β-pancreáticas, gatillando la secreción de insulina que favorece la captación de glucosa en tejido
muscular y adiposo y la gluconeogénesis en el hígado y en tejido periférico, disminuyendo de
esta manera la glicemia.
1.1.4 Eje hipotalámico - hipofisario
Tal como hemos mencionado, la glicemia es un proceso altamente regulado que no sólo
involucra la secreción hormonal pancreática, sino que además es un proceso concertado entre el
eje hipotálamo-hipófisis-páncreas. El hipotálamo es un área del cerebro que actúa como un
regulador clave del metabolismo y media numerosos procesos como la ingesta de alimentos, la
temperatura corporal, el comportamiento sexual y la reproducción, los ritmos circadianos y las
respuestas emocionales (Bisschop et al., 2014). El hipotálamo, está compuesto de muchos
núcleos neuronales distintos, dentro de los cuales destaca el núcleo arqueado (ARC) por su
relevancia en la regulación del balance energético. Su posición anatómica es adyacente a la
eminencia media, permitiendo así que el ARC pueda detectar señales tales como leptina, grelina
e insulina en circulación (Roh et al., 2016). ARC contiene dos grandes poblaciones neuronales
con efectos opuestos sobre la ingesta de alimentos: las neuronas AgRP/NPY de axión
orexigénica y las neuronas POMC de acción anorexigénicas. Las neuronas AgRP/NPY envían
proyecciones a otros núcleos hipotalámicos tales como el núcleo paraventricular (PVN),
hipotálamo dorsomedial (DMH), y el área hipotalámica lateral (LHA), todos involucrados en el
control de la alimentación (Cornejo et al., 2016).
Para lograr la regulación del balance energético, los circuitos del sistema nervioso central
deben ser capaces de interactuar con el sistema endocrino que proporciona señales periféricas
que indican el estado energético del cuerpo. Entre ellos, la grelina es la única hormona péptido

19
de mamífero conocida por aumentar la ingesta de alimentos. Además esta hormona participa en
otros procesos que incluyen la motilidad del tracto gastrointestinal, los comportamientos
relacionados con la ansiedad y el estrés, el metabolismo de la glucosa, entre otros (Kojima et al.,
2005).
La fase cefálica de liberación de insulina es representada por el reflejo condicionado de
un aumento de la secreción de la hormona incluso en ausencia de nutrientes como la glucosa,
preparando al organismo anticipadamente para la ingesta de alimentos y de esta manera
responder adecuadamente a los nutrientes. Por otra parte, esta fase cefálica es fundamental para
asegurar el normal manejo de la glucosa postprandial (Gonnissen et al., 2013). Por el contrario,
la insulina liberada en respuesta a una comida, ingresa en el cerebro a través de la barrera hemato-
encefálica con el fin de disminuir la ingesta de alimentos a través de la señalización de neuronas
hipotalámicas. Se ha propuesto en base a lo anterior que tanto la señalización central de insulina
como la señalización periférica está deteriorada en pacientes con patologías asociadas a
desórdenes metabólicos (Gonnissen et al., 2013).
1.1.5 Efecto incretinas
Las incretinas son sustancias que se producen en el intestino y se liberan en respuesta a
la ingesta oral de nutrientes, sobre todo carbohidratos, siendo poderosas secretagogas que
aumentan la liberación de insulina. Las dos hormonas incretinas más importantes son el
polipéptido inhibidor gástrico o GIP y el péptido-1 similar al glucagón o GLP-1 (glucagon-like
peptide-1). GIP y GLP-1 son en conjunto responsables del llamado “efecto incretina”, es decir,
que la administración oral de una cantidad de glucosa causa un estímulo mayor de la secreción
de insulina que la misma cantidad de glucosa administrada por vía intravenosa (Neumiller, 2009).
El GIP es un péptido de 42 aminoácidos producido por las células K de las vellosidades
intestinales, las cuales son un tipo de células enteroendocrinas que están principalmente
distribuidas a lo largo del duodeno y yeyuno y son muy raras en el íleon terminal. Por otro lado,
GLP-1 es también un péptido constituído por 37 aminoácidos sintetizado a partir de
proglucagón en las células L, localizadas principalmente en el íleon. Ambas incretinas son

20
secretadas en respuesta a estímulos procedentes del contenido alimenticio en el bolo intestinal
(proteínas, grasas y carbohidratos), siendo el carbohidrato el mejor estímulo para la secreción de
GLP-1. La secreción de incretinas empieza a los 15 minutos después de la ingesta de alimentos
y alcanza su máximo a los 30 a 45 minutos, retornando a valores basales 2 a 3 horas después de
la ingesta. Una vez en la sangre, la vida media de las incretinas es muy corta, variando entre 3 a
5 minutos y siendo rápidamente degradadas por la enzima dipeptidil peptidasa 4 (DPP4) y otras
endopeptidasas (Cornejo et al., 2016).
Otro factor que influencia la secreción de incretinas es la velocidad con la que los
alimentos entran al intestino delgado. Es decir, que el vaciamiento gástrico también es capaz de
modular la secreción de GIP y GLP-1, produciéndose un vaciamiento gástrico rápido con un
marcado incremento en las concentraciones plasmáticas de GIP y GLP-1 que conlleva a una
disminución subsecuente en la glucosa en la sangre (Merkel, 2000; Bisschop and Kalsbeek, 2014).
En el páncreas, las incretinas actúan principalmente sobre las células beta, estimulando
su función a través de un aumento en la síntesis y secreción de insulina y su masa (Neumiller et
al., 2009). Aunque los mecanismos intracelulares que finalmente llevan a la secreción de insulina
no son bien conocidos, se sabe que éstos incluyen la participación de adenilatociclasa/AMP
cíclico y cambios en la actividad de los canales de Ca+2 y K+, que eventualmente causan la
exocitosis de gránulos de insulina. Como bien es sabido, en la DM tipo 2, existe una disminución
de la masa de células beta pancreáticas y se ha reportado que el “efecto incretinas” en personas
con esta patología está disminuido, a su vez ha sido descrito que las incretinas tendrían un rol
importante en la mantenimiento de la masa de las células beta. De allí el gran interés por las
incretinas y los agonistas de receptores de incretinas para el tratamiento de la DM2 (Neumiller
et al., 2009)
1.1.6 Patologías asociadas
La vorágine diaria, el sedentarismo y la mala alimentación, entre otros factores, se han
convertido en los “peores enemigos” de la sociedad actual; tanto así que los problemas asociados
a los estilos de vida representan una gran crisis a nivel mundial que afecta a todas las edades y

21
etnias. Los malos hábitos alimenticios y la falta de actividad física son las principales causales de
trastornos en la homeostasis de la glicemia. De hecho, las diferentes alteraciones en estos
procesos son consideradas actualmente como los mecanismos patogénicos responsables de
trastornos en la homeostasis de la glucosa, tales como resistencia a la insulina (RI), síndrome
metabólico y diabetes mellitus (DM) (Christian Weyer, 1999; Baynes and Dominiczak, 2004). La
RI hace referencia a un cuadro fisiopatológico donde niveles normales o aumentados de insulina
producen un efecto biológico atenuado (Cefalu, 2001); en otros términos, existe un defecto en
la sensibilidad a la acción de la insulina en tejidos periféricos como músculo y tejido adiposo,
reduciendo la incorporación de glucosa a estos tejidos (Reaven, 2004; Wilcox, 2005). La
asociación de RI, obesidad, hipertensión y alteraciones del perfil lipídico aumentan
significativamente el riesgo de enfermedad cardiovascular y el conjunto de estas alteraciones ha
sido denominado Síndrome Metabólico. En la actualidad, este síndrome afecta
aproximadamente al 25% de la población de Estados Unidos (Reaven, 2004).
Por otro lado, la DM se clasifica en DM tipo 1 y tipo 2. La DM tipo 1 (10-15% del total
de casos de DM a nivel global) afecta principalmente a jóvenes y se caracteriza por un defecto
inicial en la capacidad de las células β de secretar suficientes cantidades de insulina para mantener
los niveles de glicemia en el rango normal (American Diabetes Association – ADA, 2015). Este
cuadro es el resultado de una respuesta autoinmune, y el principal autoantígeno descubierto hasta
el momento es el transportador de zinc (ZNT8) presente en las células β pancreáticas. ZNT8
actúa como diana de linfocitos T, lo que genera la destrucción de las células β, produciendo un
déficit en la concentración de insulina en el torrente sanguíneo, traduciéndose en un constante
estado hiperglicémico en niños y jóvenes (Lefebvre et al., 2012; Skarstrand et al., 2013). A
diferencia de la DM tipo 1, la DM tipo 2 (90% del total de casos de DM a nivel global) se origina
a partir de un cuadro de RI y una progresiva incapacidad de las células β de compensar, mediante
una hiperinsulinemia, la resistencia periférica a la acción de esta hormona (ADA, 2015). El origen
de la DM tipo 2 parece ser poligénico con factores ambientales que se superponen a esta
predisposición básica. La RI típicamente precede el desarrollo de DM tipo 2 y muchos autores
consideran a la RI como un cuadro de pre-diabetes (Akbaraly, 2013). De hecho, la morbilidad
de la DM tipo 2 se relaciona tanto con la severidad de la hiperglicemia como con las
consecuencias metabólicas de la resistencia a la insulina por sí misma (Wilcox, 2005).

22
Según estadísticas del Organización Mundial de la Salud (OMS) 442 millones de adultos
tienen diabetes alcanzando cifras de proporciones epidémicas que se mantienen en la actualidad.
De hecho, datos del año 2015, obtenidos por la Asociación Americana de Diabetes (ADA),
indican que cerca de 2 millones de personas de 20 años o más son diagnosticados anualmente
con DM y 1,5 millones de personas en el mundo mueres a causa de esta patología. Por otro lado,
las altas concentraciones de glucosa en sangre o hiperglicemia pueden provocar complicaciones
macrovasculares y microvasculares; así, DM es una de las principales causas de infarto al
miocardio y accidentes cerebrovasculares, y es la séptima causa de muerte en Chile (OMS, 2016).
Basándose en datos del 2013, ADA estima que el impacto económico de la DM en Estados
Unidos es considerable, alcanzando 500 mil millones de dólares en gastos asociados directa e
indirectamente a esta enfermedad (Economic Costs of Diabetes in the U.S. in 2012).
A nivel celular, la etiopatogenia de la DM tipo 2 ha sido asociada a un defecto primario
en la acción de la insulina a nivel de las células musculares y adipocitos, lo cual resulta en un
deficiente transporte de glucosa mediado por insulina en estas células (Hunter and Garvey, 1998;
Choi and Kim, 2010). Esta resistencia a la acción insulínica provoca, tal como se comentó
anteriormente, una hiperinsulinemia compensatoria; sin embargo, diversos autores han señalado
que la dinámica de secreción de insulina se encuentra alterada desde los estadíos iniciales de la
enfermedad (Seino et al., 2011). Así, la adición de factores ambientales o fisiológicos que
“estresen” aún más el sistema como el embarazo, la obesidad, y el sedentarismo, pueden
aumentar la resistencia a la insulina y complicar el cuadro. En este contexto, cuando las células
β son incapaces de compensar la RI, se desarrolla progresivamente intolerancia a la glucosa y
DM tipo 2. Más aún, a medida que los niveles de glicemia aumentan, la función de las células β
se deteriora aún más, reduciéndose la capacidad secretoria de insulina y por lo tanto empeorando
la hiperglicemia (Wilcox, 2005).
En este contexto, la investigación sobre mecanismos celulares y moleculares claves en
los procesos que regulan la homeostasis de la glucosa tanto a nivel pancreático, principalmente
en la secreción de insulina como a nivel periférico en la captación de glucosa, permitirá seguir
avanzando en la comprensión de estas devastadoras enfermedades y probablemente, contribuir
al hallazgo de nuevos blancos terapéuticos para el tratamiento de éstas.

23
1.2 PÁNCREAS
Tal como describimos en el capítulo anterior, la bifuncionalidda pancreática permite
participar activamente del proceso digestivo. El páncreas exocrino, es una glándula tubuloacinar
cmpuesta, que a diario produce alrededor de 1200ml de un líquido rico en bicarbonato y
proenzimas para la digestión de proteínas, hidratos de carbono, lípidos y ácidos nucleicos el cual
se vacía en el duodeno a través de los conductos pancreáticos principal de Wirsung y accesorio
de Santorini. Aproximadamente 40 a 50 células acinares forman un acino seroso cuya luz
contiene 8 células centroacinares que dan inicio al sistema de conductos pancreáticos, y de esta
manera conforman el páncreas exocrino. Cada célula acinar tiene forma de pirámide truncada
cuya base descansa sobre la lámina basal que separa las células del tejido conectivo denso que
rodea al páncreas. A su vez, la secreción endocrina encargada principalmente de la regulación de
los niveles de glucosa en el torrente sanguíneo, se compone fundamentalmente de las hormonas
insulina y glucagón, que se secretan por parte de las células de los islotes de Langerhans. Los
primeros rudimentos de los islotes de Langerhans son brotes macizos que surgen de la pared de
los conductos más delgados desde donde se desprenden y se tornan en grupos celulares
independientes, diseminados entre las estructuras excretoras y secretoras del páncreas exocrino.
Las células α, β, γ características de los islotes de Langerhans se diferencian tempranamente.
1.2.1 Embriología del páncreas
El desarrollo de tracto digestivo parte con la formación del intestino primitivo que por
razones didácticas se ha dividido en cinco partes: Faringe, Intestino Anterior, Intestino Medio,
Intestino Posterior y Cloaca. El páncreas se desarrolla a partir de un proceso inductivo entre el
revestimiento endodérmico del duodeno y el mesodermo esplácnico con la consecuente
diferenciación de dos esbozos. El esbozo pancreático ventral que guarda íntima relación con el
colédoco, y el esbozo pancreático dorsal que está situado en el mesenterio dorsal.
A consecuencias del crecimiento diferencial, el duodeno rota hacia la derecha y con él, el
brote pancreático ventral se desplaza dorsalmente, para situarse inmediatamente por debajo y

24
detrás del esbozo dorsal; posteriormente, se fusionan el parénquima y el sistema de conductos
de ambos esbozos para conformar el páncreas. El esbozo ventral forma una parte de la cabeza
del páncreas y el resto de la glándula deriva del esbozo dorsal. El parénquima pancreático deriva
del endodermo de los esbozos que forman una red de túbulos; a comienzos del período fetal, se
desarrollan los acinos a partir de agrupaciones celulares que rodean los extremos de dichos
túbulos. Los islotes pancreáticos se desarrollan a partir de grupos de células que se separan de
los túbulos y se sitúan entre los acinos. La secreción de insulina, glucagón y somatostatina se
inician durante el período fetal temprano.
En modelos murinos, específicamente en ratón, el primer indicio visual de morfogénesis
pancreática es alrededor del día embrionario 9 (E 9,5) cuando los rudimentos se hacen visibles
en la zona del endodermo del intestino primitivo. Hacia el día E 10,5 se inicia el crecimiento y
ramificación del epitelio de los dos primordios pancreáticos, los cuales se fusionan y reorientan
entre el día E 13,5 – E 14,5. La diferenciación endocrina comienza mientras todos estos procesos
morfológicos ocurren. Se ha observado que entre E 9,5 y E 12,5 la mayoría de las células
formadas son glucagón positivas, y a partir de esta edad embrionaria comienza la diferenciación
exponencial de células beta a partir de precursores. Hacia el día E 16,5 las células endocrinas
comienzas a agruparse, sin embargo en el término de la vida gestacional (E 18,5) se presentan
islotes plenamente conformados y la maduración final se da durante las primeras semanas de
vida. El páncreas exocrino empieza a diferenciarse en E 14,5 y es a partir del día E 15,5 cuando
son claramente distinguibles.
1.2.2 Plasticidad Pancreática
El control transcripcional, la expansión y diferenciación de los precursores
endodérmicos hacia los distintos linajes pancreáticos son el resultado de una secuencia de señales
extracelulares altamente regulada y de cambios en programas de expresión génica. Dichos
cambios son dirigidos por una cascada de factores de transcripción cuyas activaciones e
inactivaciones permiten la progresión del precursor pluripotente a la célula pancreática

25
diferenciada. La identificación de estos factores y de las relaciones existentes entre ellos es
indispensable para llegar a comprender los procesos que culminan en la formación de las células
del islote y la proporción de cada una de ellas (Ben-Othman et al., 2013). Los factores reguladores
de la expresión del gen de insulina, Pdx1 o NeuroD/BETA2 son claves para el desarrollo
endocrino y/o pancreático. Estos factores se expresan en el endodermo prepancreático antes de
la formación de los primordios pancreáticos ya que cada uno de ellos determina la formación de
ambos primordios o bien del desarrollo de éstos (Zhu et al., 2017)
Las células endocrinas y exocrinas en el páncreas de un adulto no son estáticas, sino que
pueden cambiar su estado de diferenciación en respuesta al daño o a condiciones de estrés; tal
es así, que se han descubierto factores importantes en la mantención de la identidad celular, en
donde el factor de transcripción Pdx1 es necesario para el desarrollo pancreático y la maduración
de células β y la metilación del DNA en el gen Arx (genes homeobox) (Ahlgren et al., 1998;
Dhawan et al., 2011).
La expresión de Pdx1 y Hb9 decae después de E 10,5 pero vuelve a aparecer en células
β diferenciadas, reportándose que todas aquellas células que son Pdx1 positivas dan origen a
células pancreáticas. Por otro lado, Neurogenina3 (Ngn3) es el factor pro-endocrino clave en el
páncreas. El modelo animal knockdown para el gen que codifica Ngn3 no tiene células
endocrinas en el páncreas y mueren poco después de nacer, lo que demuestra que Ngn3 ejerce
una función no redundante en la diferenciación endocrina. Este factor actúa como interruptor
de la cascada transcripcional que culmina en la formación de células endocrinas. Sin embargo,
su expresión es transitoria, siendo en E 15,5 donde se expresa mayoritariamente y luego decae
su expresión en páncreas neonatos. Ngn3 actúa regulando la expresión de otros factores que se
han descrito indispensables para la formación de células beta pancreática, estos factores son:
Pax4, Nkx2.2 e IA-1. En el caso de Pax4 y Arx son factores determinantes para la especificación
de los linajes α y β, así como también los factores Nkx2.2 y Nkx6.1 que determinan el linaje de
células β (Wilson et al., 2003; Xiao et al., 2013).
La plasticidad endocrina se puede definir como la capacidad que tiene el páncreas para
regular la masa de células beta según las necesidades de insulina y poder así garantizar un óptimo
control de la glicemia. Esta plasticidad celular implica tanto una capacidad de expansión como

26
de disminución de la masa de células beta. El páncreas endocrino está en continua remodelación
mediante un proceso dinámico, en el cual participan tanto la regeneración como la muerte
celular. El número absoluto de células beta puede aumentar mediante dos mecanismos:
replicación y neogénesis (Bouwens and Rooman, 2005).
La replicación consiste en la división de una célula beta funcional para obtener dos
nuevas células beta, lo que lo convierte en el principal mecanismo de aumento de masa de células
beta, aunque la neogénesis continua produciéndose. De hecho, se han identificado células
ductales alrededor de los islotes neonatales con una alta tasa de replicación que darían lugar a
células β funcionales después de su diferenciación.
La neogénesis se refiere a la formación de nuevas células beta a partir de precursores no
endocrinos; el proceso requiere la proliferación de estos precursores y una posterior
diferenciación de estos hacia células β funcionales. Sin embargo, la naturaleza de estos
precursores no ha sido determinada con claridad, aunque diferentes estudios sugieren que se
encontrarían en el ducto pancreático y serían de origen epitelial. La importancia de la neogénesis
en la determinación de masa de células beta en el adulto no está clara siendo ésta un tema muy
controversial. El aumento en la masa de células beta producido por replicación o neogénesis
puede ser contrarrestado por la apoptosis.
El aumento de masa de células beta mediante replicación y neogénesis dura hasta el
destete de los animales y se ha observado recientemente que alteraciones en la dieta durante el
embarazo y periodo de lactancia, modifican el proceso de maduración de las células endocrinas,
lo cual podría desencadenar complicaciones, a largo plazo, de la capacidad homeostática del
páncreas endocrino.
Existe evidencia que señala que tras un daño en el tejido pancreático como sucede en la
DM tipo 1, la regeneración de las células β observada inicialmente deriva de células β pre-
existentes, dando a entender que el mecanismo replicativo sería clave para la mantención de la
masa endocrina (Dor et al., 2004). Sin embargo, se ha descrito que bajo circunstancias extremas
en donde existe una ablación prácticamente completa de las células β (algunos casos de DM tipo
1), se desencadena un efecto de plasticidad pancreática, originando células β a partir de células α

27
(Thorel et al., 2010) o a partir de células acinares, así como también de células madres alojadas
en los conductos pancreáticos (Ben-Othman et al., 2013). Esta plasticidad de las células β
pancreáticas es evidentemente insuficiente en pacientes con DM tipo 1; sin embargo, se propone
que da cuenta del aumento compensatorio de la masa o número de células β observado en
pacientes con RI, intolerancia a la glucosa y estadios iniciales de DM tipo 2 (Del Prato, 2002)
1.3 CÉLULAS β-PANCREÁTICAS
Las células β en su función constituyen parte importante de la homeostasis de la glicemia.
Corresponden a parte del tejido endocrino representado sólo como el 1% de la masa pancreática.
Su función principal es la síntesis y secreción de insulina al torrente sanguíneo.
1.3.1 Síntesis de insulina
El gen responsable de la síntesis de la insulina humana se ha identificado en el brazo
corto del cromosoma 11. La traducción del mRNA genera la pre-proinsulina, un polipéptido de
100 aminoácidos constituido secuencialmente la cadena B (péptido señal), el péptido conector
(C), y la cadena A. En el retículo endoplásmico se elimina la cadena B obteniéndose la
proinsulina, la cual se pliega espacialmente y sufre una sulfo-oxidación que genera 2 puentes
disúlfuros entre las cadenas A y B de la molécula. En TGN se forman los gránulos inmaduros
de insulina, en los cuales se escinde la proinsulina, produciendo en cantidades equimolares:
insulina (cadena A+B; 51 aa) y péptido C (30 aa) (Dodson and Steiner, 1998). Luego de este
proceso, existe una captación de zinc que genera un gránulo maduro de insulina–zinc, listo para
ser secretado. La cantidad de insulina contenida en células β pancréaticas es muy constante así
como el balance entre la secreción de insulina, biosíntesis de proinsulina y la degradación de los
gránulos de insulina (Thurmond, 2000).
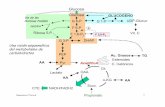
1.3.2 Secreción de insulina

28
La secreción de insulina depende de mecanismos intrínsecos de las células β y señales
exógenas metabólicas, hormonales y neurales (Seino et al., 2011).
La glucosa extracelular proveniente del torrente sanguíneo entra en el citosol a través de
transportadores específicos de glucosa, GLUT2. Este aumento agudo de la concentración de
glucosa intracelular produce un incremento de los niveles intracelulares de ATP producto del
aumento del flujo glicolítico. El incremento en la razón ATP/ADP da lugar al cierre de los
canales de K+ dependientes de ATP (KATP), lo cual lleva a una depolarización de la membrana
plasmática. Esta depolarización activa canales de Ca+2 dependientes de voltaje, permitiendo así
la entrada de calcio desde el exterior. El incremento de calcio citosólico desencadena la secreción
de insulina (Curry et al., 1968; Hedeskov et al., 1980; Rorsman et al., 2000). Ante un estímulo de
glucosa por encima de 8 mM, se produce una señal de Ca+2 oscilatoria que da lugar a una
liberación pulsátil de insulina lo que refleja la sumatoria de eventos secretorios coordinados de
millones de células β localizadas en diferentes islotes (Prentki et al., 1992; Gilon and Henquin,
1993). Se ha reportado que la secreción de insulina presenta, además de las variaciones
postprandiales, un patrón de secreción oscilatoria ultradiano (Pørksen et al., 2002).
Experimentos de clamp hiperglicémico y ensayos con islotes pancreáticos aislados demostraron
que la secreción de insulina estimulada por glucosa presenta un patrón bifásico, en el cual se
distingue una “primera fase” que comienza entre 20 a 30 segundos luego del estímulo (glucosa)
y se mantiene aproximadamente entre 5-10 minutos (Bratanova-Tochkova et al., 2002); Barg et
al., 2002), y una “segunda fase” o segundo componente que sostiene una secreción de insulina
por un periodo de tiempo mayor y se relaciona principalmente con otro tipo de estímulos
(hormonales y neuronales) acompañándose además de la síntesis de insulina (Curry et al., 1968;
Gembal et al., 1992; Heinemann et al., 1993).
Por otro lado, experimentos bioquímicos y registros de capacitancia han sugerido que
existen vesículas secretorias agrupadas en distintos pooles funcionales y que la liberación
secuencial de estos pooles genera los componentes separables de la exocitosis de insulina
(Rorsman et al., 2003). Estos grupos de vesículas secretorias son identificados como: grupo
reserva (RP) en el cual se concentra la mayoría de las vesículas secretorias y otro grupo de rápida
liberación (RRP) en el cual se encuentran los gránulos maduros y dispuestos a ser liberados.
Ohara-Imaizumi y col. (2007) proponen que la liberación de los gránulos RRP corresponde al

29
primer componente de la liberación de insulina estimulada por glucosa, lo cual permite responder
de manera aguda a una alteración de la homeostasis de la glicemia y consecuentemente, el
segundo componente comprende la movilización de los gránulos secretorios RP, lo cual puede
verse afectado en problemas crónicos de hiperglicemia. Sin embargo, años más tarde, Seino y
col. (2011) describieron que existen 3 tipos de gránulos secretorios: old face, que son gránulos
semifusionados a la membrana plasmática (en docking) que tras un estímulo liberan su contenido
rápidamente; restless newcomer, los cuales tras el estímulo son reclutados a la membrana plasmática
y fusionados inmediatamente y resting newcomer, son reclutados a la membrana plasmática luego
del estímulo, se adhieren a la membrana plasmática (docking) y luego son fusionados. Este grupo
de investigadores propone que ambos componentes de la secreción de insulina corresponden
principalmente a los gránulos restless newcomer, dentro de los cuales se subagruparían unos más
próximos a la membrana que otros y participarían proteínas diferentes en su fusión, acompañado
de un remodelamiento del citoesqueleto también diferencial (Seino et al., 2011).
En ratón, esta coordinación se debe a la existencia de un alto grado de acoplamiento
celular mediado por uniones tipo gap (gap-junctions) que permiten el funcionamiento en forma
de sincitio de toda la población de células β (Jain and Lammert, 2009). Este acoplamiento en
islotes de ratón se cree que es indispensable para una adecuada liberación de insulina, dando
lugar a una secreción más vigorosa. Cabe destacar que el modelo murino, a diferencia del ser
humano posee la población de células β agrupadas en el centro del islote, mientras que las células
α y δ se disponen en las capas más superficiales o periféricas.
Por otro lado, el ácido γ-aminobutírico (GABA) se secreta de manera conjunta con
insulina regulando negativamente el efecto de insulina y de manera autocrina al unirse a
receptores GABAB que se expresan en la célula β. Además, se ha descrito que ATP tendría un
rol autocrino y paracrino, siendo capaz de reducir la secreción inducida por glucosa actuando a
varios niveles pero sobretodo por una interferencia directa con el proceso de exocitosis.
Otros mediadores de la liberación de insulina incluyen la activación de fosfolipasas y
proteína quinasa C (por ejemplo, por acetilcolina) y estimulación de la actividad adenilato ciclasa
y activación de la proteína quinasa A, la cual potencia la secreción de insulina. Este último

30
mecanismo puede ser activado por hormonas gastrointestinales como VIP (vasoactive intestinal
peptide), PACAP, GIP y GLP-1. (Bratanova-Tochkova et al., 2002).
1.3.3 Factores que modulan la secreción pancreática de insulina
La secreción de insulina puede ser influenciada tanto por factores que afecten la síntesis
de este péptido a nivel de la transcripción génica, de traducción y de modificaciones post-
traduccionales a nivel del Golgi, como así también por factores que afecten el tráfico/secreción
de insulina a partir de los gránulos secretorios. Incluso, alteraciones a largo plazo pueden afectar
la secreción de insulina por modificaciones en la masa o diferenciación de las células β (Nielsen
et al., 2001b)
Dado el rol clave que desempeña la insulina en la utilización y metabolismo de la glucosa,
no resulta sorprendente que la glucosa sea el factor más relevante en la regulación de la síntesis
y secreción de insulina por las células β. Sin embargo, otros factores como aminoácidos, ácidos
grasos, acetilcolina (sistema nervioso autónomo, inervación vagal), PACAP (pituitary adenylate
cyclase-activating polypeptide), GIP (glucose-dependent insulinotropic polypeptide), GLP-1 (glucagon-like
peptide-1), y muchos otros, también afectan el proceso de síntesis y secreción de insulina
(Bratanova-Tochkova et al., 2002).
1.3.3.1 Rol de la maquinaria SNARE en la secreción de insulina
Independientemente de los mecanismos moduladores y la identidad de los gránulos
secretorios responsables de la secreción bifásica de insulina, diferentes estudios coinciden en el
rol clave que desempeña la maquinaria de fusión de membranas dependiente de SNAREs en el
último paso de la exocitosis de los gránulos de insulina (Kiraly-Borri et a., 1996; Nagamatsu et
al., 1996; Nagamatsu et al., 1999a)
Las proteínas SNAREs (Soluble N-ethylmaleimide Sensitive Factor [NSF] Attachment
Protein [SNAP] Receptors) son una familia de proteínas involucradas en la fusión de
membranas, tanto en eventos de exocitosis como de transporte vesicular intracelular. En el caso
de la exocitosis de los gránulos de insulina, la fusión de los gránulos con la membrana plasmática

31
requiere la formación un complejo heterotrimérico de SNAREs compuesto por sintaxina 1/4,
SNAP-25 (t-SNAREs presentes en la membrana plasmática de las células β) y VAMP2 (v-
SNARE presente en los gránulos secretorios) en una razón 1:1:1 (Söllner et al., 1993; Nagamatsu
et al., 1996; 1999; Thurmond, 2000). En este contexto, Nagamatsu y col. (1999) describieron que
las células β presentan una gran densidad de microvesículas tipo sinápticas (SLMVs) y secretoras
de insulina (LDCVs; large dense-core vesicles) siendo la fusión de LDCVs con la membrana
plasmática dependiente de SNAREs y regulada por la concentración de calcio intracelular.
Interesantemente, en ratas diabéticas GK y fa/fa Zucker, los niveles de mRNA y proteínas
SNAREs implicadas en la secreción de insulina se encuentran reducidos, lo que se correlaciona
con una falla en la secreción de insulina (Nagamatsu et al., 1999b) y deja en evidencia la
importancia de la estequiometría proteica para el correcto funcionamiento de la maquinaria de
fusión de membranas dependiente de SNAREs en las células β. Sin embargo, no existen a la
fecha estudios que evalúen la homeostasis de la glicemia en modelos animales donde se
encuentre afectado primariamente el mecanismo de fusión de membranas mediado por
SNAREs.
Desde el punto de vista fisiopatológico, algunos autores han descrito que bajo
condiciones de RI existen cambios en la expresión y localización de proteínas del complejo
SNARE como son: SNAP-23, VAMP2, sintaxina 4 y Munc18c (Thurmond, 2000; Bryant et al.,
2002; Torrejon-Escribano et al., 2011). Más aún, recientemente se ha descrito que las ratas
diabéticas GK presentan una disminución de los niveles de proteínas del complejo SNAREs y
una hiperplasia/hipertrofia de células β pancreáticas (Fox et al., 2013).
1.3.3.2 Rol de AMPK en la secreción de insulina.
El balance metabólico celular y fisiológico comprende varias vías de regulación, en donde
participan un sin número de móleculas. Una de ellas, AMPK (kinasa dependiente de AMP), ha
sido blanco terapéutico para el tratamiento de desórdenes metabólicos, incluyendo RI y DM tipo
2 (Shih et al., 2014). AMPK es una proteína heterotrimérica, compuesta de una subunidad
catalítica (α) y dos subunidades regulatorias (β y γ). La actividad de AMPK depende de su estado
de fosforilación en treonina 172 (T172). Así, su activación es consecuencia del incremento de la

32
razón (AMP+ADP)/ATP intracelular, los cuales pueden unirse directamente a la subunidad γ
de AMPK, generando un cambio conformacional en la proteína y promoviendo su fosforilación
por proteínas quinasas, dentro de las cuales, la principal y más estudiada es LKB1 (Hardie, 2011).
Por otro lado, la inactivación de AMPK depende de la actividad de enzimas fosfatasas como
proteína fosfatasa 2. Sin embargo, son muy poco conocidas las fosfatasas a cargo de su
regulación (Wang and Brautigan, 2013).
AMPK fue originalmente descrita como una quinasa río arriba de enzimas metabólicas
críticas como acetilcoA carboxilasa (ACC) y HMG-CoA reductasa, centrándola como un
regulador importante en la velocidad de síntesis de ácidos grasos y esterol, principalmente en
tejido muscular y adiposo. Sin embargo, a medida que el mundo científico fijó sus ojos en esta
proteína, fueron aún más los descubrimientos en torno a ella, llegándola a relacionar
directamente con la regulación transcripcional de proteínas del ciclo circadiano, apoptosis,
autofagia, polaridad celular, síntesis de proteínas, y biogénesis mitocondrial, entre otras
(Mihaylova and Shaw, 2011). Interesantemente, en los últimos años se ha señalado que AMPK
desempeña un rol clave en la homeostasis de la glucosa, modulando tanto la síntesis y liberación
de insulina, como la disponibilidad de GLUT4 en la membrana plasmática de tejidos periféricos
(Hardie, 2011; Wang and Brautigan, 2013).
En este contexto, en las células β pancreáticas, la función de AMPK está regulada
directamente por la kinasa LKB1 y la activación de APMK (pAMPK) participando como un
regulador negativo de la síntesis y liberación de insulina. Más aún, se ha observado
experimentalmente que la administración de AICAR (activador de AMPK) a células MIN6 (tipo
islotes) y a cultivo primario de islotes pancreáticos resulta en una disminución en la liberación
de insulina al medio de cultivo; así mismo, resultados inversos se han descrito al administrar a
los cultivos un inhibidor de AMPK (Compuesto C) en donde se observa un aumento de la
liberación de insulina tras su inactivación (Fu et al., 2013). Además del efecto que tiene AMPK
sobre la secreción de insulina otros autores han reportado que tiene efectos directos sobre la
síntesis de insulina mediante la vía CRT2/CREB (Fu et al. 2013). De acuerdo a estos
antecedentes, la mayoría de los cuales se ha obtenido en los últimos dos años, los procesos
celulares y mecanismos moleculares que modulan la actividad de AMPK podrían ser relevantes

33
en la fisiología de las células β y/o en la fisiopatología de los trastornos en la regulación de la
glicemia.
1.3.4 Acción del tejido periférico en la homeostasis de la glucosa
Tal como se describió anteriormente, uno de los mecanismos claves en la regulación de
la homeostasis de glucosa es la captación de glucosa en los tejidos periféricos. El músculo
esquelético y el tejido adiposo constituyen los principales sitios de reserva de glucosa, y la insulina
es la principal señal para la incorporación de glucosa en estos tejidos.
El tejido muscular, representa casi la mitad del peso corporal. A pesar de usar una gran
parte de la glucosa que consumimos diariamente, el músculo no realiza gluconeogénesis, no
puede desfosforilar a la glucosa-6-fosfato y por lo tanto no puede generar glucosa libre y
contribuir al mantenimiento de la glicemia. Las grandes reservas de glucógeno muscular no
pueden ser movilizadas para mantener la glicemia, pero son importantes para el metabolismo
energético local, a través de la activación del sistema adrenérgico. El tejido muscular expresa
transportadores de glucosa (GLUT4) y receptores para insulina, los cuales se movilizan desde
compartimento de almacenaje hacia la superficie celular tras un aumento en los niveles de
insulina circulante en el torrente sanguíneo. De esta manera la glucosa es incorporada por el
tejido muscular y favorece la normalización de la glicemia.
La función principal del tejido adiposo es almacenar combustibles lipídicos en forma de
triglicéridos. El transporte de glucosa a los adipocitos es un mecanismo que depende de insulina,
por ende un aumento en la insulinemia genera la incorporación de glucosa a través de GLUT4,
que entra al ciclo de la glicólisis generando glicerol-3-fosfato proviene de la reducción de un
intermediario de la glicólisis, el cual es necesario para la síntesis de triglicéridos. Por ende la
síntesis de triglicéridos depende de los niveles de glucosa, cuando sus niveles son adecuados, se
produce glicerol-3-fosfato que favorece la vía de síntesis y cuando los niveles son bajos, los
ácidos grasos sintetizados se liberan de los adipocitos y son utilizados por otros tejidos.

34
Para generar este balance en la concentración de glucosa el tejido periférico expresa el
transportador de glucosa 4 (GLUT4), una proteína de 12 dominios transmembrana expresada
en células musculares y adipocitos que facilita el transporte de glucosa a través de la membrana
plasmática mediante un mecanismo de difusión facilitada (Hruz y Mueckler, 2001). En
condiciones de reposo, GLUT4 presenta una distribución predominantemente intracelular; sin
embargo, en respuesta a insulina y otros estímulos, es reclutado hacia la membrana plasmática
(Bryant et al., 2002). GLUT4 recicla continuamente entre la membrana plasmática y las reservas
intracelulares. Estas reservas corresponden a elementos túbulo-vesiculares y pequeñas vesículas
poco caracterizadas, denominadas vesículas de almacenamiento de GLUT4 o GSV (GLUT4
storage vesicles) (Foley et al., 2011). GLUT4 es una proteína estable con una vida media de
aproximadamente 48 horas (Sargeant and Paquet, 1993) por lo tanto, una molécula de GLUT4
es sometida a varios ciclos de reciclamiento entre la membrana plasmática y las GSV antes de
ser destinada a degradación. Bajo estimulación de insulina las GSV sufren una serie de
modificaciones que les permiten movilizarse desde los compartimientos de reserva y fusionarse
con la membrana plasmática, lo cual desencadena un aumento (2 a 10 veces) de la disponibilidad
de transportadores de glucosa funcionales en la membrana plasmática y una mayor captación de
glucosa desde el compartimento extracelular (Thurmond, 2000).
Existe consenso en relación a la participación de las señales generadas por insulina en los
diferentes procesos que permiten aumentar la disponibilidad de GLUT4 en la membrana
plasmática, incluyendo: (i) movilización de vesículas desde los compartimientos GSV, (ii)
asociación/estabilización (tethering/docking) de las vesículas con la membrana plasmática y (iii)
la fusión de las vesículas con la membrana plasmática; sin embargo, según Fujita y col. (2010) las
diferentes señales derivadas de la acción de insulina parecen modular distintos pasos de este
proceso. El proceso completo desde la movilización a partir de los compartimientos de reserva
hasta la fusión con la membrana plasmática es conocido como “translocación de GLUT4” (Foley
et al., 2011).
La unión de la insulina a su receptor desencadena la activación de la subunidad β del
receptor produciéndose la autofosforilación y la fosforilación en residuos de tirosina de diversas
proteínas, siendo el sustrato principal la familia de proteínas IRS (White et al., 1998). La
fosforilación de IRS resulta en la activación de PI3K (Chen et al., 1993), lo cual genera PIP3,

35
necesario para la estimulación de PKB/Akt y PKC. Uno de los sustratos de Akt es
AS160/TBC1D4, una proteína activadora de Rab-GTPasa (GAP) que, al igual que TBC1D1,
cuando se encuentra en estado no fosforilado se une a las vesículas GLUT4 y actúa como un
“freno” de la movilización de estas vesículas hacia la membrana plasmática; sin embargo, tras
ser fosforilada en respuesta a insulina permite la movilización de GLUT4 desde las GSV hacia
la membrana plasmática (Larance et al., 2005). En este contexto, la mutación del sitio de
fosforilación de AS160 produce alteraciones en la incorporación de glucosa bajo el estímulo de
insulina (Chen et al., 2011). Incluso se ha sugerido que la fosforilación de estas proteínas GAP
funcionaría como un punto de convergencia para diferentes vías de señalización que favorecen
la translocación de GLUT4 y el aumento de la captación de glucosa en células musculares
(Kramer et al., 2006). Por otro parte, existe evidencia que señala que la modificación de los
niveles de PIP3 no es suficiente para estimular la incorporación de glucosa y, por consiguiente,
deber a existir más de una vía de señalización a partir de la unión de insulina a su receptor (Chang
et al., 2004). De acuerdo a este último punto, algunos estudios muestran que existe una vía
independiente de PIP3 y que proviene de microdominios ricos en colesterol, esfingolípidos,
glicosilfosfatidilinositol, proteínas ancladas a GPI y glicolípidos, denominadas balsas lipídicas
(Smart et al., 1999). Se ha descrito que el receptor de insulina reside en estos microdominios y
su activación estimula la fosforilación de residuos de tirosina de protooncogenes como c-Cbl y
Cbl-b, lo cual hace necesaria la presencia de proteínas adaptadoras como APS, CAP, TC10 α/β
y CIP4 para la interacción con la subunidad β del receptor de insulina y con Exo70, una proteína
que participa de un complejo exocítico en la interacción de membranas de los gránulos
secretorios con la membrana plasmática. Se cree que estas vías de señalización del receptor de
insulina tienen en común una PKC atípica que representa un punto de convergencia tanto para
PI3K como para TC10, pudiendo ser activadas ambas vías de señalización (Chang et al., 2004;
Leney and Tavare, 2009). En resumen, la unión de insulina a su receptor activa diferentes vías
de señalización, con varios puntos de convergencia, que pueden afectar diferentes etapas o pasos
implicados en la translocación de GLUT4.
1.3.4.1 Rol de la maquinaria SNARE en la translocación de GLUT4

36
Evidencia obtenida mediante diferentes técnicas indica que la estimulación de células
musculares y adiposas con insulina (a) aumenta la tasa de redistribución de vesículas conteniendo
GLUT4 hacia la proximidad de la membrana plasmática, (b) causa una reducción en la movilidad
de las vesículas ricas GLUT4 dentro de la zona TIRF, (c) reduce la duración de los tiempos de
anclaje (tethering/docking) previos a la fusión de membranas, y (d) aumenta significativamente
la tasa de fusión con la membrana plasmática (Bai et al., 2007; Huang et al., 2007; Stenkula et al.
2010; Jiang et al. 2008).
Por otro lado, existen numerosos estudios que indican que la fusión de las vesículas
conteniendo GLUT4 con la membrana plasmática de adipocitos y células musculares es mediada
por proteínas SNARE incluyendo VAMP2, sintaxina4, SNAP23, y proteínas reguladoras como
Munc18c (Volchuk et al., 1994; Volchuk et al., 1996; Martin et al., 1998; St-Denis et al., 1999;
Kawanishi et al., 2000; Leney and Tavaré, 2009; Torrejón-Escribano et al., 2011). A pesar de que
VAMP2 es la proteína v-SNARE mejor validada en cuanto a su rol en este proceso, estudios
recientes en adipocitos sugieren que VAMP3 y VAMP8 también podrían cumplir un rol similar
en la fusión de vesículas conteniendo GLUT4 con la membrana plasmática mediada por insulina
(Zhao et al., 2009). Por otra parte, la proteína Munc18c es conocida por su capacidad de
interactuar con sintaxina 4 monomérica, evitando la asociación de este SNARE con VAMP2 y
SNAP-23 (Araki et al., 1997). Interesantemente, la señalización de insulina genera la disociación
de Munc18c lo cual permite la interacción de los SNAREs (Spirulin et al., 2003; Oh et al., 2005).
Todos estos datos han sido obtenidos in vitro y sugieren fuertemente que la maquinaria SNARE
desempeña un rol clave en el paso final de la translocación de GLUT4 hacia la membrana
plasmática; sin embargo, tal como se señaló anteriormente, no existen estudios que reflejen las
consecuencias in vivo al comprometerse primariamente la funcionalidad de la maquinaria
SNARE.
1.3.4.2 Rol de AMPK en la translocación de GLUT4
La captación de glucosa en el músculo esquelético ocurre tanto por una vía insulino-
dependiente como por vías independientes de insulina (Krook et al. 2004). El ejercicio, por
ejemplo, aumenta la captación de glucosa mediante un mecanismo independiente de insulina

37
(Hayashi et al., 1997). La contracción muscular provoca un aumento en las razones
creatinina/fosfo-creatinina y AMP/ATP (Winder, 2001), lo cual activa AMPK, favoreciendo la
translocación de GLUT4 a la membrana plasmática y el aumento en la captación de glucosa.
Interesantemente, este proceso puede ser recapitulado mediante la activación farmacológica de
AMPK utilizando AICAR (Merrill et al., 1997; Bergeron et al., 1999; Hayashi et al., 1998; Musi
et al., 2001).
Tal como se describió anteriormente, las proteínas GAP AS160/TBC1D4 y TBC1D1
actuarían como punto de convergencia de diferentes vías. En este contexto, se ha descrito que
la activación de AMPK participa en la fosforilación de AS160 y TBC1D1, favoreciendo la
movilización y translocación de GLUT4 a la membrana plasmática (Treebak et al., 2006);(Funai
and Cartee, 2009). Asimismo, un ratón knockout de AMPKα2 tras ser estimulado con AICAR
(activador de AMPK) pierde la capacidad de incorporar glucosa a nivel periférico; lo mismo fue
observado para un ratón knockdown de AMPKα1 (Jorgensen et al., 2004). Además, la activación
de AMPK, ya sea a través del ejercicio o por la administración de AICAR, (i) favorece la síntesis
de GLUT4 (Holmes and Dohm, 2004; Holmes et al., 2005) y (ii) aumenta la sensibilidad a
insulina, resultando en una mayor translocación de GLUT4 y transporte de glucosa mediado por
insulina (Jessen et al., 2003; Fisher et al., 2002). En conjunto, estos datos apoyan la hipótesis de
que AMPK juega un rol clave en la translocación de GLUT4, tanto dependiente de insulina
como independiente de insulina, en tejido muscular y adiposo.
1.4 α-SNAP: ¿UN FACTOR CLAVE EN LA HOMEOSTASIS DE LA GLUCOSA?
La homeostasis de la glucosa es, sin duda, el resultado de la compleja interconexión de
diferentes mecanismos que actúan tanto a nivel molecular, celular y de organismo. Como se ha
descrito previamente, la maquinaria de fusión de membranas dependiente de SNAREs y la
actividad AMPK juegan un rol clave tanto en la secreción de insulina por las células β, como en
la translocación de GLUT4 en células musculares y adipocitos. En este contexto, procesos y/o
moléculas capaces de modular tanto la función de la maquinaria SNARE como la actividad de
AMPK, aparecen como blancos atractivos para estudiar su rol en la regulación de la homeostasis

38
de la glucosa tanto en condiciones normales como patológicas. Una de estas moléculas en la
proteína α-SNAP.
Las proteínas SNAPs (soluble N-ethylmaleimide-sensitve factor [NSF] attachment proteins) fueron
descubiertas en 1990 por el grupo del Dr. James Rothman (Clary et al., 1990). En mamíferos, la
familia de proteínas SNAPs está compuesta por tres miembros, llamados α-, β- y γ-SNAP,
codificados por tres genes diferentes (Whiteheart et al., 1993). La expresión de α- y γ-SNAP es
ubicua, mientras que la expresión de β-SNAP se ha reportado sólo en cerebro y durante estadios
postnatales (Whiteheart et al., 1993). A pesar de que α- y β-SNAP comparten un 83% de su
secuencia aminoacídica y poseen algunas funciones similares (Sudlow et al., 1996; Burgalossi et
al., 2010), se ha sugerido que sus funciones no son redundantes (Clary et al., 1990; Xu et al.,
2002; Nishiki et al., 2001). α-SNAP es la proteína mejor caracterizada de las tres isoformas. Ha
considerada como un componente clave para el funcionamiento de la maquinaria de fusión de
membranas mediada por SNAREs; de hecho, SNAREs significa receptores de SNAP (SNAP
REceptors) (Sollner et al. 1993; Woodman et al., 1997; Stenbeck, 1998). Básicamente, α-SNAP
reconoce e interactúa con los complejos cis-SNARE (inactivos) y, seguidamente, media el
reclutamiento y activación de la ATPasa NSF que, a través de hidrólisis de ATP, desensambla
los complejos cis-SNARE. Así, la acción concertada de α-SNAP y NSF permite el desensamblaje
de los complejos cis-SNARE, dejando SNAREs libres (activos) que pueden ser re-utilizados en
otro evento de fusión de membrana (Woodman, 1997; Stenbeck, 1998; Risselada and
Grubmuller, 2012; Jahn and Fasshauer, 2012).
Esta función (NSF-dependiente) de α-SNAP, que en nuestro laboratorio hemos
denominado “función canónica”, ha sido asociada a una gran variedad de eventos de tráfico
intracelular incluyendo el tráfico intra-Golgi, fusión endosoma-endosoma, y exocitosis
(Stenbeck, 1998). Más aún, α-SNAP ha sido específicamente implicada en diversos mecanismos
fisiológicos como (i) el ciclo de las vesículas sinápticas (Burgalossi et al., 2012; Brunger, 2001;
Wang and Tang, 2006), (ii) la exocitosis del surfactante pulmonar (Dietl and Haller, 2005), (iii)
la reacción acrosomal de espermatozoides (Tomes et al., 2005; De Blas et al., 2005; Bátiz., 2009),
(iv) la exocitosis de gránulos corticales en ovocitos (de Paola et al., 2015) y (v) la secreción de
insulina por las células β pancreáticas (Nagamatsu et al., 1999 a,b).

39
En relación a este último punto, inicialmente Oho y col. (1995) reportaron la expresión
de α-SNAP en células endocrinas, siendo uno de los primeros en sugerir que α-SNAP junto a
sinaptobrevina (VAMP-2) y SNAP-25 participaban directamente de la exocitosis de insulina.
Años más tarde, Nagamatsu y col. (1999b) describieron que tras infectar cultivos primarios de
islotes o células MIN6 (pseudoislotes) con un dominante negativo de α-SNAP (C-terminal
delecionado), existe una reducción de al menos 50% en la liberación de insulina, respecto a la
condición control (α-SNAP nativa). Esto sugiere, que la ausencia de α-SNAP o la
disfuncionalidad de esta proteína, genera una disminución de la capacidad secretoria de las
células β y por ende una menor liberación de insulina.
Si bien se puede asumir que estos defectos en la secreción de insulina son consecuencia
de un defecto en el proceso de fusión de membranas mediado por SNAREs; diferentes estudios,
publicados en los últimos 3 años, sugieren que además de la función canónica, NSF-dependiente,
α-SNAP presenta un repertorio de funciones biológicas más amplio.
La primera “nueva” función no canónica descrita para α-SNAP fue la regulación de la
apoptosis en células tumorales (Wu et al., 2011) y en células epiteliales de intestino (Naydenov
et al., 2012). Wu y col. (2011) reportaron que la pérdida de α-SNAP (usando shRNAs) sensibiliza
células tumorales a cisplatino, induciendo una acumulación de p53 mientras que Naydenov y
col. (2012a) concluyen que α-SNAP presenta un efecto anti-apoptótico mediado por la
regulación de la expresión de Bcl-2. Otra función no-canónica descrita recientemente para α-
SNAP es la modulación de la macroautofagia. La macroautofagia (de aquí en adelante
mencionada como autofagia) es uno de los mecanismos celulares básicos para degradar proteínas
y organelos innecesarios o disfuncionales (Rubinsztein et al., 2011), y se caracteriza por la
formación de autofagosomas que engloban los componentes celulares a degradar y luego se
fusionan con lisosomas para su degradación (Wirawan et al., 2012), por lo tanto el flujo
autofágico depende de eventos de tráfico/fusión de membranas. De hecho, distintos estudios
indican que componentes de la maquinaria SNARE participan en el flujo autofágico como
factores reguladores positivos, ya que su depleción inhibe el flujo autofágico (Moreau et al., 2011;
Renna et al., 2011). Con estos antecedentes se podría especular que α-SNAP (rol canónico)
también es un regulador positivo; sin embargo, un estudio reciente del grupo del Dr. Ivanov
reveló que α-SNAP es un regulador negativo de la autofagia (Naydenov et al. 2012b). De hecho,

40
la pérdida de α-SNAP en células epiteliales provoca un aumento del flujo autofágico por una vía
independiente de Beclin-1 y asociada a una reducción en la señalización mediada por mTOR
(Naydenov et al., 2012). Es interesante destacar que tanto la función moduladora de apoptosis
como la función moduladora de autofagia son independientes de NSF.
Finalmente, Wang y Brautigan (2013) revelaron a α-SNAP como un factor regulador
negativo de AMPK, limitando la activación de esta quinasa frente a diferentes estímulos y, por
lo tanto, restringiendo/modulando la señalización mediada por AMPK. De hecho, el knockdown
de α-SNAP mediante ensayos de siRNA resultó en un aumento significativo de la fosforilación
de AMPK en T172 y de los sustratos de pAMPK, como ACC y Raptor. Además, los autores
demostraron que α-SNAP es capaz de unirse directamente a AMPK y, mediante ensayos in vitro,
observaron que α-SNAP desfosforila AMPK, sugiriendo que α-SNAP actuaría como una
fosfatasa para AMPK. Un hecho interesante, y bien conocido, es que AMPK regula
negativamente la actividad de mTOR (Kim et al., 2011) por lo que la inducción de autofagia
asociada a una menor señalización de mTOR en células depletadas de α-SNAP descrita por
Naydenov et al. (2012), podría estar reflejando una hiperactividad de AMPK; sin embargo, la
relación α-SNAP/AMPK/autofagia no ha sido explorada. Otro hecho remarcable es que, al igual
que las otras funciones no canónicas de α-SNAP mencionadas anteriormente, la modulación de
la actividad AMPK es independiente de NSF.
Si bien todos los antecedentes expuestos reflejan la ubicuidad e importancia funcional de
α-SNAP, incluso más allá de la maquinaria SNARE, la gran mayoría de los resultados han sido
obtenidos en experimentos con modelos celulares y ensayos in vitro, por lo que surge la siguiente
pregunta: ¿Cuál es rol de α-SNAP in vivo?, y más específicamente ¿pueden defectos en
las funciones canónicas y no canónicas de α-SNAP alterar la homeostasis de la glucosa
en un organismo vivo (modelo animal)?
En el año 1990, Bronson y Lane describen el ratón mutante espontáneo hyh (hydrocephalus
with hop gait) como un modelo animal que poseía una mutación en el cromosoma 7 y que era
potencialmente útil para el estudio de la hidrocefalia y otros trastornos del desarrollo del sistema
nervioso (Bronson and Lane, 1990). Catorce años después, dos grupos independientes
identificaron simultáneamente que la mutación hyh correspondía a una transición G>A en el

41
exón 4 del gen Napa, la cual resultaba en una sustitución de una metionina altamente conservada
en la posición 105 por una isoleucina (M105I) en la proteína α-SNAP (Chae et al., 2004; Hong
et al., 2004). Interesantemente, la mutación hyh no es una mutación nula, y la proteína se expresa;
sin embargo, estudios en diferentes tejidos han demostrado que los niveles de α-SNAP en los
ratones mutantes son menores (hipomorfismo) que los niveles observados en los ratones
silvestres o wild type (WT) (Chae et al., 2004 ; Hong et al., 2004; Bátiz et al., 2009). Estudios in
vitro realizados por Chae et al. (2004) sugerían que la proteína mutada (α-SNAP M105I) era
igualmente funcional que la WT en relación a su función canónica; es decir, la proteína M105I
se une a los complejos cis-SNARE y los disocia en presencia de NSF de una manera similar a la
que lo hace la proteína WT. Sin embargo, estudios realizados por Bátiz y col. (2009) en
espermatozoides, sugieren fuertemente que en contexto celular, la proteína α-SNAP M105I
presenta alteraciones funcionales intrínsecas. De hecho, resultados no publicados de nuestro
laboratorio indican que la proteína α-SNAP M105I presenta una menor asociación a membranas
que la proteína α-SNAP WT.
En este contexto, y considerando que el ratón knockout para α-SNAP es inviable en
estadíos tempranos del desarrollo embrionario (Chae et al. 2004), el ratón hyh se presenta como
un modelo único para estudiar la función de α -SNAP in vivo y las consecuencias de la mutación
M105I en diferentes sistemas, incluyendo la homeostasis de la glucosa. Dada las características
del ratón hyh, consideramos que nos permitirá estudiar el rol funcional de α-SNAP tanto en la
secreción de insulina como en la translocación de GLUT4, evaluando aspectos vinculados a su
rol canónico (NSF dependiente) y a su rol no canónico (actividad AMPK, NSF independiente).
De hecho, Wang y Brautigan (2013) describieron que, a iguales cantidades, la proteína α-SNAP
(M105I) presenta una mayor unión a AMPK y una mayor actividad fosfatasa que la proteína wild
type. Sin embargo, ¿qué ocurre cuando existen menores niveles de la proteína α-SNAP
M105I respecto a la wild type?
En consideración de todos los antecedentes expuestos donde se destaca que: (i) la
liberación de insulina desde las vesículas secretorias de las células β del páncreas involucra
eventos de exocitosis mediados por proteínas del complejo SNARE/NSF/SNAP y es regulada
por la actividad AMPK, (ii) la disponibilidad en la superficie celular de GLUT4 depende de un
correcto evento de exocitosis y de la actividad de AMPK, (iii) una disminución de los niveles de

42
α-SNAP en células en cultivo tiene un efecto negativo directo en la liberación de insulina, (iv) la
mutación M105I de α-SNAP provoca una reducción de los niveles de α-SNAP y una alteración
funcional en la proteína, y (v) la mutación M105I produce una sobreregulación negativa de la
actividad de AMPK; surgen las siguientes preguntas de investigación: ¿Los ratones mutantes
hyh presentan alteraciones en la homeostasis de la glucosa? ¿Los ratones mutantes de α-SNAP
tienen alteraciones en la secreción de insulina y/o en la translocación de GLUT4 en tejido
periférico?

43
1.5 HIPÓTESIS DEL TRABAJO
La homeostasis de la glucosa es clave para los procesos metabólicos en mamíferos. Una
falla en la liberación de insulina o en la disponibilidad de GLUT4 en la membrana plasmática
celular del tejido periférico, modifican las señales necesarias para mantener el equilibrio de
glucosa circulante. A su vez, se ha descrito en la literatura que tanto la liberación de insulina
como la localización de GLUT4 en la superficie celular dependen de eventos de fusión de
membrana mediados por la maquinaria SNARE y de la actividad quinasa de AMPK.
Interesantemente, α-SNAP es una proteína que presenta una actividad dual, favoreciendo la
fusión de membranas mediada por SNAREs (rol canónico) y modulando la actividad de AMPK
(rol no canónico)
En este contexto, la hipótesis general es que “α-SNAP mantiene la homeostasis de la
glucosa in vivo, favoreciendo la liberación de insulina en células β pancreáticas”. Así, la
mutación hyh (M105I) de α-SNAP, que provoca una reducción en los niveles de α-SNAP y
alteraciones funcionales intrínsecas en la proteína, altera tanto las funciones canónicas (mediadas por
SNAREs y NSF dependientes) como las funciones no canónicas (modular la actividad de AMPK, NSF
independiente), provocaría una reducción en la liberación de insulina por las células β pancreáticas.

44
1.6 OBJETIVOS
1.6.1 Objetivo General
Establecer el rol fisiológico de α-SNAP en la homeostasis de glucosa in vivo, evaluando su
participación en la secreción de insulina pancreática.
1.6.2 Objetivos específicos
1. Determinar la expresión de α-SNAP en tejido pancreático de ratones WT y mutantes de α-
SNAP (hyh).
2. Establecer el rol canónico de α-SNAP en la liberación de insulina bajo señales de hiperglicemia
en cultivo primario de islotes de Langerhans.
3. Evaluar parámetros fisiológicos de la homeostasis de la glucosa en ratones WT y mutantes
hyh.
4. Evaluar parámetros morfométricos de la homeostasis de la glucosa en ratones WT y mutantes
hyh.

45
2. MATERIALES Y MÉTODOS
2.1 MATERIALES
2.1.1 Insumos y reactivos
En Sigma Chemical Co. se adquirió los siguientes reactivos: Tritón X-100 (X-100), ácido etilén-
diamino acético (EDTA, E-51347), fluoruro de fenil metil sulfonilo (PMSF, P-7626), glicerol, 2-
mercaptoetanol (M-3148), L-glutamina (G-3202), Hepes (H-9136), bicarbonato de sodio (S-
5761), Tween-20 (P-7949), solución balanceada de Hank (H-2387), medio de Eagle modificado
de Dulbecco (DMEM, D-5648) y Cocktail de inhibidores de proteasas (P2714).
En Merck Química Chilena se adquirió los siguientes reactivos: cloruro de sodio, cloroformo,
isopropanol, etanol, metanol, azul brillante de Coomassie R-250, azul de bromofenol, peróxido
de hidrógeno, fosfato de sodio, fosfato de potasio, Kit Immobilon HRP quimiolumniscente para
western blot (WBKLS0500); AICAR (US1123040), Compuesto C (1171260), D(+)-glucosa
monohidratada (8342), Las membranas de PVDF para las electrotransferencias se adquirieron
de MILLIPORE (Immobilon-P, IPVH00010).
En INVITROGEN: se adquirió enzima Taq DNA polimerasa (11615-010), DAPI tinción ácida
nuclear (D1306)
Exalpha: obtuvo anticuerpos anti-NSF (x1014); anti-β actina (X2672M); anti α-SNAP (X1026).
De BIORAD se utilizaron los siguientes reactivos: Pierce 660 Protein Assay Reagent (#22660)
GeneOn: Se adquirió dNTP mix (110-001)
Dako: Medio de montaje para fluorescencia (S3023)
Genaxxon: Se adquirió Proteinasa K (M3037.0001)
Santa Cruz: Se adquirió Albúmina de suero bovino (BSA, sc-2323) y anticuerpo anti-insulina H-
86 (sc-9168)

46
Life Technologies Chile SpA: Se adquirió los anticuerpos secundarios Alexa Fluor 594 Goat
(A11005); Alexa Fluor (R) 488 goat (A11008), Taq DNA polymerase (11615010); SYBR SAFE
DNA Gel stain (S33102), así como también Trizol (1559601) para la extracción de RNA. A su
vez, obtuvimos insumos de cultivo celular, RPMI, suero bovino fetal (FBS) Gibco (),
aminoácidos no esenciales Gibco (11140-050), antibióticos/antimicóticos Gibco (...),
WINCKLER: suministró BIS-ACRIL 29:1 30% (701011) y albúmina de suero bovino (BSA)
(BM-0150). Por otro lado, a través de CRYSTALCHEM, se importó el Kit ultrasensible de
ELISA para insulina en ratón (CR.90080).
PROMEGA, distribuye material de biología molecular, desde el cual se adquirió M-MLV
transcriptasa reversa (M1701); y Colagenasa, Whorthington (LS004188) para el cultivo de islotes
de Langerhans.
Arquimed, proporciona material químico que se utilizó para técnicas histológicas, como: parafina
(PARAPLAST™) en Monoject Scientific y alcholes. El suero anti-IgG de conejo y el complejo
peroxidasa-antiperoxidasa (PAP) se produjeron en nuestro Instituto.
2.1.2 Equipos e insumos
Las electroforesis de proteínas y ácidos nucleicos, así como también las
electrotransferencias de proteínas a membranas de PVDF se realizaron utilizando cámaras de
BIORAD (MiniProtean-3). Para los cultivos se utilizó material plástico desechable adquirido en
NUNCLON y Beckton Dickinson. Este material incluye placas Petri plásticas y placas de 24 y
96 pocillos, botellas de cultivo de 50 y 250ml, pipetas desechables de 1 y 10ml. Se utilizó un
Termociclador Perlkin Elmer GeneAmp 2400 System (PerkinElmer Inc., MA, USA). Los tubos
Eppendorf, microtubos de pared delgada de 0,2 ml y puntas de micropipeta estériles con filtro,
certificadas como libres de nucleasas, proteasas y pirógenos fueron adquiridos en AXYGEN. Se
utilizaron además, centrífuga a 4°C (Hettich, Zentrifugen MIKRO 200R), Vortex, Balanza analítica
y Termoblock. Material quirúrgico estéril (Pinzas, hojas de bisturí, tijeras).

47
2.1.3 Animales de experimentación
Se utilizaron ratones de la cepa mutante hyh (Bronson y Lane, 1990). La mutación hyh
surgió espontáneamente en ratones de la cepa C57BL/10J. Posteriormente, mediante cruces
fuera de su línea (outcross), la mutación fue transferida a la cepa híbrida B6C3Fe-a/a (Jackson
Laboratory, Bar Harbor, ME, USA). El Instituto de Anatomía, Histología y Patología de la
Universidad Austral de Chile adquirió 6 parejas de ratones heterocigotas de esta cepa (llamada
B6C3Fe a/a-Napahyh/J), a partir de los cuales se ha desarrollado la colonia que actualmente se
encuentra en reproducción en el bioterio del Instituto ubicado en el Campus Isla Teja de la
Universidad Austral, en la ciudad de Valdivia, Chile. En la presente tesis se utilizaron ratones de
diferentes edades embrionarias (E16.5-E18.5) y postnatales (PN1-PN120-PN740) de diferentes
sublíneas y generaciones. Los animales recibieron alimentación ad libitum con alimento especial
para roedores (elaborado por Champion S.A., Santiago, Chile) y fueron mantenidos bajo un
fotoperiodo constante de luz-oscuridad de 12:12 hs. y a una temperatura ambiental constante de
22ºC. El manejo, cuidado y procesamiento de los animales se llevó a cabo bajo condiciones
homologadas por el Consejo de la Sociedad Americana de Fisiología y supervisado por el Comité
de Ética de la Universidad Austral de Chile.
2.2 MÉTODOS
2.2.1 Genotipificación de ratones hyh
2.2.1.1 Extracción de DNA genómico
El DNA genómico se obtuvo a partir de biopsias de cola, desde donde se realiza la
digestión de DNA con proteinasa K (10 mg/ml) en buffer de lisis (Tris-HCl 50 mM, pH8;
EDTA 50 mM; NaCl 100mM; SDS 0,5%). Se dejaron digiriendo toda la noche con agitación
constante (80 rpm) a 55°C y luego se procedió a la precipitación alcohólica del DNA. Después
de la lisis completa, las muestras se centrifugaron a 10000 rpm durante 10 min. Se agregó
isopropanol y se sometieron a otro proceso de centrifugación a 13000 rpm por 30 min. Se realizó
un lavado con etanol 70% y se dejaron secar para evaporar restos de alcohol. Se resuspendieron

48
en buffer TE (Tris-HCl 10 mM pH8; EDTA 1 mM) por al menos 2 hrs en agitación constante
a 80 rpm y a 50°C. Las muestras fueron almacenadas a -20°C. Después de la extracción, el DNA
fue cuantificado mediante el método espectrofotométrico convencional, midiendo la
absorbancia a 260 nm (A260), y la presencia de contaminantes proteicos fue calculada mediante
la relación A260/A280.
2.2.1.2 PCR convencional
La reacción en cadena de la polimerasa (PCR) se desarrolló bajo el protocolo descrito
comercialmente para la enzima y los partidores ocupados para dicha reacción fueron diseñados
específicamente para reconocer la mutación, que en este caso permite la identificación del SNP
presente en el DNA de hyh , no así de WT. La secuencia del partidor-hyh en sentido forward es:
5’-GAGGCCATTAACTGTCTCAT-3’, y la secuencia reverse del partidor es: 5’-
CTAAAGCACAGCATAAACAGG-3’. El protocolo de PCR es: 94 °C por 2 min, 35 ciclos [94
°C por 30 seg; 60 °C por 30 seg; 70 °C por 2 min], 70 °C por 10 min, 4 °C.
2.2.1.3 Digestión enzimática del producto PCR
El producto de PCR fue digerido con la enzima BSPHI a 20 rpm, 37 °C durante toda la
noche en agitación constante. Esta digestión facilita la identificación de los diferentes genotipos,
dado que sólo en WT se observará una digestión satisfactoria.
Los productos ya digeridos, fueron sometidos a una electroforesis en poliacrilamida, donde se
puede evidenciar la separación diferencial de los tamaños del producto digerido.
2.2.2 Cultivo Primario de Islotes de Langerhans
Los ratones fueron anestesiados con una mezcla de Ketamina/Xilasina para realizar la
incisión abdominal. El abdomen es expuesto y se localiza el intestino delgado, desde donde se
expuso el esfínter de Oddi para bloquear el conducto biliar. Una vez que el conducto

49
pancreático está extendido, se procedió a inyectar a través de él 3 ml de colagenasa (0,21 mg/ml).
El páncreas inyectado, se extrajo desde el intestino delgado hacia el estómago y luego el bazo.
Se desprendió del tejido mesentérico y es colocado en un tubo cónico de 50 ml. Se digiere a 37
°C por 11 minutos con agitación parcial. Posterior al periodo de digestión, se inactivó la
colagenasa agregando 20 ml de medio RPMI con suero bovino fetal. Se agitó vigorosamente y
fue centrifugado a 1800 rpm por 90 segundos. Se repitió 3 veces los lavados de igual forma con
medio RPMI. Paso siguiente, consistió en preparar la gradiente de Histopaque® (1,077) con el
cual se logran separa los islotes pancreáticos del resto de células exocrinas a través de un proceso
de centrifugación a 2500 rpm por 20 min con desaceleración suave. Los islotes fueron colectados
y lavados para sacar el exceso de Histopaque® y luego fueron limpiados por sedimentación. Una
vez limpios de otras células, se realizó “hand pick” que permite contabilizar y colectar islotes de
tamaño similar para los distintos procedimientos.
2.2.3 Secreción de insulina estimulada por glucosa (GSIS)
Para evaluar la liberación de insulina al medio extracelular, se colocaron 5 islotes de
Langerhans en una placa multipocillos. Cada uno de los pocillos, cuenta con su triplicado. Los
islotes fueron lavados con 500 µl de buffer con baja concentración de glucosa (2,8 mM) por 1
hr. Luego de esta ambientación del cultivo, se retiró el medio de ambientación y los islotes
pancreáticos fueron incubados por 1hr con 500 µl de glucosa 2,8 mM. Pasado este periodo
fueron colectados 400 µl del sobrenadante y se incubó con 400 ul de glucosa 16,2 mM durante
1 hr. Paso siguiente, fue colectar 400 ul de sobrenadante, los cuales fueron almacenados -20°C
para su posterior cuantificación. Los islotes de Langerhans fueron sometidos a un protocolo de
extracción ácida, para cuantificar el remanente de insulina no secretada bajo estímulo, con el cual
se normalizan las cantidades de insulina secretada.
2.2.4 Métodos bioquímicos para análisis de proteínas
2.2.4.1 Proteínas totales

50
En el caso de extracción de proteínas totales, una vez obtenidas las muestras, se lavaron con
PBS frío fueron suspendidas en buffer de extracción RIPA modificado frío (Tris-HCl (pH 7.4)
50 mM, NaCl 150 mM, Triton-X-100 1%, desoxicolato de sodio 1%, SDS 0,1%) con inhibidores
de proteasas (Cocktail Sigma P2714 (AEBSF 2 mM, EDTA 1mM, bestatin 130 μM, E-64 14
μM, leupeptin 1 μM, aprotinin 0,3 μM, PMSF 1 mM). Inmediatamente, el tejido fue
homogenizado mediante sonicación (3 x 10-15seg) en hielo. Los homogenizados fueron
centrifugados a 14000 x g durante 10 min a 4ºC para sedimentar los restos celulares y núcleos.
El pellet fue descartado y del sobrenadante (fracción post-nuclear = extracto de proteínas
totales) se extrajeron 2 alícuotas: i) para cuantificación de proteínas y ii) fue transferido a un
nuevo tubo y guardado a -20ºC hasta su utilización.
2.2.4.2 Cuantificación de proteínas
La concentración de proteínas de las muestras se determinó mediante el método de
Bradford (Bradford, 1976), el cual se basa en la afinidad de las proteínas por el colorante azul de
Coomassie. Se preparó una solución de albúmina de suero bovino (BSA) 2 μg/μl y a partir de
ésta se prepararon una serie de diluciones de 1; 0,5; 0,25 y 0,125 μg/μl. Las diferentes
concentraciones de BSA se utilizaron para construir una curva de calibración. Tanto para la curva
de BSA, como para los extractos, se utilizó un reactivo Bradford modificado, que tiene la
característica de no interferir con algunos detergentes en la cuantificación de proteínas. Para
desarrollar la cuantificación de proteínas, se debmantuvo la relación 1:15 en donde fueron
ocupados 5 ul de muestra en 30 ul de agua (factor de dilución 7) a los cuales se les agregó 525 ul
de reactivo. Se incubó por 5 min (la reacción es estable por aproximadamente 25 min) y se leyó
la absorbancia a 660 nm en un espectrofotómetro Shimadzu UV 240. Para calcular la
concentración de proteínas en los extractos se utilizó la siguiente ecuación: Y=B.X+A, donde
Y=Abs660, B y A son constantes obtenidas de la regresión lineal de los valores para la curva de
calibración con BSA, y X corresponde a la concentración de proteínas del extracto en μg/μl.
2.2.4.3 Electroforesis en geles de poliacrilamida-SDS (SDS-PAGE)

51
La separación electroforética de proteínas se realizó en condiciones denaturantes, en el
sistema de electroforesis Mini-Protean3 (Bio-Rad), siguiendo el procedimiento descrito por
Laemmli (1970). Los geles separador y espaciador de 1,5 mm de espesor, se prepararon a partir
de una solución de acrilamida:bisacrilamida al 30 %. El gel separador se preparó a una
concentración final de poliacrilamida del 10% conteniendo Tris-HCl 375 mM (pH 8,8), SDS
0,1%, persulfato de amonio 0,05 % y TEMED 0,198 %. El gel espaciador se preparó a una
concentración final de poliacrilamida del 4 %, conteniendo Tris-HCl 125 mM (pH 6,8), SDS
0,1%, persulfato de amonio 0,05 % y TEMED 0,198 %. Las muestras de proteínas (15 μg o 30
μg según el experimento) se mezclaron (3:1) con buffer de carga 4X (Tris-HCl 0,25 M pH 6,8,
β-mercaptoetanol 4 %, glicerol 20 %, azul de bromofenol 0,2 %, SDS 4 %) y calentadas a 90 °C
por 2 min. Posteriormente las muestras (15-30 μg de proteína por carril) fueron cargadas en el
gel, realizándose la electroforesis en buffer de corrida 1X (Tris-HCl 0,025 M pH 8,3; glicina
0,192 M y SDS 0,1 %) a un voltaje constante de 100V por un tiempo aproximado de 1,5 hs.
Como marcadores de peso molecular se utilizó una mezcla de proteínas preteñidas y cuyos
rangos de peso estaban entre 10 y 180 kDa (Invitrogen).
2.2.4.4 Electrotransferencia y detección inmunoquímica (Western blot o inmunoblot)
Una vez concluida la separación electroforética, las proteínas fueron electrotransferidas
a una membrana de PVDF (Immobilon-P, Millipore), previamente activada en metanol absoluto
de alto grado por 10 seg y equilibrada en tampón de transferencia 1X (Tris-HCl 25 mM pH 8,9;
glicina 192 mM, metanol 20 %, SDS 0,1 %) por 15-20 min. La electrotransferencia se realizó en
el sistema húmedo Mini Trans Blot (Bio-Rad) a una corriente constante de 350 mA durante 2 h;
transcurrido este tiempo, la membrana volvió a pasar por metanol, se dejó secar a 37ºC y luego
se guardó a temperatura ambiente para el análisis inmunoquímico posterior. Para el análisis
inmunoquímico, la membrana se incubó con anticuerpo primario diluido en buffer Ab (PBS (pH
7,4), 0.1 % Tween y 1 % BSA) por 1,5 hrs a 37 °C. Finalizado este tiempo, se lavó durante 15
min (3 x 5 min) con PBS 1X (pH 7,4), se incubó con anticuerpo secundario (1:50.000 en buffer
Ab) durante 30 min, y se volvió a lavar durante 15 min con PBS 1X. Finalmente, se incubó en
el kit comercial de quimioluminiscencia Kit Immobilón de HRP para transferencia: sustrato
quimioluminiscente (Immobilon), mezclando partes iguales de los dos reactivos (1:1,

52
Luminol:Enhancer) a temperatura ambiente. Luego de este tiempo, se realizó la
fotodocumentación de la membrana a través de equipo de fotoluminiscencia G-box SynGene.
Finalmente, los blots fueron cuantificados densitométricamente utilizando el software
UNSCANIT (Silk Scientific, Orem, UT, USA).
Anticuerpo Especie Peso molecular
α-SNAP mouse 36 kDa
NSF mouse 82 kDa
Insulina rabbit 34 kDa
β-actina mouse 42 kDa
2.2.5 Morfometría y estereología pancreática
Para realizar morfometría de tejido pancreático se analizaron 3 seriados de animales WT y 3
seriados de animales hyh (PN 120 y PN750), considerando el Principio de Dellese y Cavalieri en
el que se hace referencia a que el área analizada a lo largo de todo el seriado de tejido, corresponde
al volumen del tejido. Se realizó tinción inmunohistoquímica tal como ha sido descrita
anteriormente contrastada con hematoxilina/eosina; insulina (1:50) y glucagón (1:50) para
determinar la distribución de células beta y alfa, respectivamente. Además, los resultados
morfométricos de área endocrina, área pancreática y cuantificación de células INS+ y GLU+,
fueron normalizados respecto al peso pancreático (húmedo) y peso del animal. Las imágenes
fueron obtenidas a través de un microscopio óptico Zeiss Axioskop acoplado a una cámara
digital AxioCam MR (Zeiss) y cuantificado con el software NIH Image J. Cada seriado fue
fotodocumentado en 20x de magnitud y 2 personas independientes estuvieron a cargo de la
cuantificación de los parámetros establecidos en el análisis morfométrico.
Tabla 1. Anticuerpos Primarios. Listado de anticuerpos primarios utilizados
para evaluar la expresión de proteínas de interés a través de Western blot e
inmunohistoquímica en tejido pancreático.

53
2.2.6 Métodos bioquímicos de análisis de mRNA
2.2.6.1 Extracción de RNA total
La extracción de RNA total se realizó utilizando la solución de extracción Trizol
(Ambion #15596018), según las indicaciones del fabricante. Cada una de las muestras de
páncreas se obtuvo según el procedimiento descrito anteriormente y se colocó en un tubo de
policarbonato estéril de 1,5 ml conteniendo 1 ml de Trizol, y se homogenizó mecánicamente en
hielo. El homogenizado fue dejado 5 min a temperatura ambiente (inactivación de RNasas y
destrucción de las membranas celulares). Por cada ml de solución de extracción se agregaron
200 μl de cloroformo y la muestra fue mezclada por 15 seg en vortex a máxima potencia. Luego
se incubó a temperatura ambiente por 5 min, se traspasó a un tubo Eppendorf de 1,5 ml y se
centrifugó a 12.500 x g durante 15 min a 4°C. La fase superior (orgánica) que contiene el RNA
total se traspasó a un Eppendorf nuevo y las fases inferiores (proteínas y DNA) se eliminaron.
Se agregaron 500 μl de alcohol isopropílico por cada ml de trizol agregado, mezclando varias
veces por inversión y posteriormente se incubó 10 min a temperatura ambiente (precipitación
del RNA). Se centrifugó a 12.500 x g, durante 10 min a 4 °C; se eliminó el sobrenadante, y el
pellet se lavó con agitaciones breves en vortex utilizando 500 μL de etanol pro-análisis al 75 %,
seguido de centrifugación a 7.500 x g durante 5 min a 4°C (este proceso de lavado se realizó dos
veces). Posteriormente, se eliminó el sobrenadante y se dejó secar el pellet de RNA a 37°C por
10 min en Termoblock con la tapa del tubo abierta. El pellet fue resuspendido cuidadosamente en
H2O libre de nucleasas (30-50 μl, según el tamaño del pellet) previamente calentada, mediante
pipeteo repetido. El RNA fue cuantificado mediante el método espectrofotométrico
convencional, midiendo la absorbancia a 260 nm (Abs260), y la presencia de contaminantes
proteicos fue calculada mediante la relación Abs260/Abs280. Todas las muestras de RNA total
exhibieron una razón a Abs260/Abs280 entre 1,55 y 2,0, que corresponde a valores dentro del
rango óptimo para una extracción eficiente de RNA-libre de proteínas. Se determinó la
concentración de RNA en cada muestra y se hicieron diluciones para llevar todas las muestras a
una concentración de trabajo de 1 μg/μl. Finalmente, se determinó la integridad del RNA por
medio de un mix preparado con Formaladehído/cloroformo en un gel de agarosa no

54
denaturante al 1 % con Syber safe, en corrida electroforética de 90 Volts. Los parámetros evaluados
fueron: probable contaminación con DNA genómico, eventual degradación de la muestra y
cantidad de RNA total relativa entre las muestras.
2.2.6.2 Transcripción Reversa
Se sintetizó primera hebra de cDNA por transcripción reversa de muestras de RNA
previamente seleccionadas para los diferentes estadíos y condiciones. La transcripción reversa se
realizó a partir de 2 μg de RNA, utilizando 100 ng de partidores al azar (ramdom primers;
Promega), buffer de síntesis de primera hebra 5X (4 μl; 1X), DDT 0,1 M (10 nM),
desoxinucleótidos trifosfato (0,5 mM) y SuperScript II RNase H (10 U), en un volumen final de
20 μl. Las muestras de RNA total fueron llevadas a 10 μl en agua libre de nucleasas y denaturadas
a 70 ºC durante 10 min. Posteriormente, la reacción de transcripción reversa fue montada en
hielo e incubada en el termociclador con el siguiente programa: 25 ºC durante 10 min, 42 ºC
durante 60 min, 4°C
2.2.6 Evaluación estado metabólico del modelo murino
2.2.6.1 Registro de glicemias basales
Para tomar registro de las glicemias basales de los ratones, se consideraron 2 condiciones:
Registro de glicemia en condiciones de alimentación ad libitum y registro de glicemias en ayuno.
Para esto, se realizó una pequeña incisión en la cola de los animales y se les extrajo una gota de
sangre la cual es inmediatamente colocada en el dispositivo de registro glicémico Accu-Check
Active. Se repitió el mismo protocolo para la segunda condición, pero esta vez se consideró
someter a los animales a un ayuno de 6 hrs. Cabe destacar que todas las glicemias fueron
registradas en el mismo horario del día (14:00 hrs).

55
2.2.6.2 Test de Tolerancia a la glucosa intraperitoneal
El desarrollo de este protocolo, involucró someter a los animales a un ayuno de 6 hrs y
posterior a este periodo se realizó una climatización de los animales a la manipulación en donde
se registró la glicemia. El tiempo 0, fue considerado el instante de la carga de glucosa. Luego de
esta administración intraperitoneal de 0,5; 1; 2 y 3 mg/ml de glucosa (dependiendo el protocolo),
se realizó el seguimiento de la glicemia cada 15, 30, 60 y 120 min. postcarga. Los datos de cada
animal, fueron normalizados respecto a la glicemia basal en tiempo 0 antes de la carga de glucosa.
2.2.6.3 Insulinemia basal
A los ratones sometidos a un ayuno de 6 hrs. se les extrajo sangre de su cola mediante
una pequeña incisión desde donde se obtienen aproximadamente 100ul de sangre de se dejan
incubar por 15 min a temperatura ambiente, posterior a este periodo la sangre fue centrifugada
a 1000 rpm por 10 min. para separar el suero. El suero fue almacenado a -20°C para su posterior
medición a través de ELISA (Crystal Chem), según las indicaciones del fabricante. La
cuantificación de la concentración de insulina en fluido o medio de cultivo, se realizó a partir de
la calibración del kit de acuerdo a la sensibilidad de éste.
2.2.7 Obtención de muestras de tejido pancreático
Los animales fueron anestesiados y sacrificados por decapitación. Inmediatamente se
obtuvieron muestras de tejido correspondiente a páncreas. El procedimiento fue realizado con
material quirúrgico estéril. La disección fue estandarizada para la obtención de una cantidad de
tejido con un peso húmedo aproximado de 100 mg en caso de animales adultos y 25 mg en caso
de animales embriones o animales recién nacidos. Los páncreas fueron destinados a diferentes
protocolos: homogenización de tejido para extracción de proteínas, homogenización de tejido
para extracción de RNA y fijación de tejido para inmunohistoquímica.

56
2.2.8 Fijación de tejido pancreático
Una vez extraídos los páncreas, fueron fijados por inmersión en PFA 4% o en bouin. La
duración de la etapa de fijación en ambos casos, no pasó a ser más de 24 hrs.
2.2.9 Inclusión, corte y montaje de las muestras
Concluido el período de fijación, las muestras se deshidrataron en concentración
crecientes de etanol (50º, 70º, 80º, 96º, 100º), se equilibraron en butanol y se incluyeron en
Paraplast® (soluble en butanol) de acuerdo a protocolos convencionales. Los pasos que
contenían Paraplast® se realizaron en estufa a 60ºC. En el caso de los aislados de islotes
pancreáticos, luego de la fijación, se pasaron por la batería de alcoholes en un tubo cónico de 1,5
ml y se incluyeron en el mismo tubo con Paraplast. Luego, con ayuda de un bisturí se extrae el
bloque y se realizan cortes de 5 μm de grosor, los que fueron montados en portaobjetos tratados
con silano (3-amino-propil-trietoxi-silano) (Polysciences Inc.,EE.UU.). Se realizaron montajes
seriados (series paralelas) que permitieron estudiar zonas muy próximas entre sí con diferentes
técnicas. Los cortes montados en portaobjetos se dejaron secar en estufa a 60ºC (mínimo de 2-
3 horas). Las muestas obtenidas desde los ratones fueron procesadas simultáneamente; esto
permitió un análisis comparativo de animales mutantes y controles de la misma edad.
2.2.10 Tinción general hematoxilina-eosina
Una vez que los cortes montados se secaron, fueron desparafinados en xilol por 15 min y
luego re-hidratados en una batería decreciente de alcoholes (100º, 96º, 80º, 70º, 50º), terminando
finalmente la hidratación con agua. Una vez hidratados, se realizó la tinción con Hematoxilina
de Mayer por 3-5 min y a continuación se lavó con abundante agua. Finalmente se tiñó con
Eosina 1% por 1-2 min. Los cortes fueron lavados con agua, deshidratados y montados para su
análisis al microscopio óptico.

57
2.2.11 Inmunocitoquímica
Los cortes de las muestras seleccionadas se inmunotiñeron con diferentes anticuerpos
primarios y la reacción antígeno-anticuerpo se reveló mediante tres métodos: (i) el método
peroxidasa-antiperoxidasa (PAP) de Sternberger et al. (1970), (ii) el método ABC peroxidasa, y
(iii) inmunofluorescencia indirecta (IFI) utilizando segundos anticuerpos o estreptavidina
marcados con fluorocromos. En algunos casos, fue necesario exponer antígenos y/o bloquear
la actividad peroxidasa endógena previo a la inmunotinción.
2.2.11.1 Exposición de antígenos
En algunos casos se procedió a exponer los antígenos de los cortes de tejido
desparafinados. Para tal efecto los cortes se incubaron en tampón citrato (20mM pH 6.0) y se
trataron en microondas a máxima potencia a 90° C, durante 15 min. Luego de enfriar a T°
ambiente, se lavaron en agua destilada y fueron procesados para inmunocitoquímica.
2.2.11.2 Bloqueo de la actividad peroxidasa endógena
La eliminación de la actividad peroxidasa endógena sólo fue necesaria cuando se empleó
peroxidasa (HRP) como marcador de la reacción antígeno-anticuerpo (método PAP y método
ABC-peroxidasa). En estos casos, antes de realizar la incubación con el anticuerpo primario, se
incubaron los cortes en una solución de peróxido de hidrógeno al 3% en metanol durante 10
min.
2.2.11.3 Visualización de la inmunorreacción: Revelado de la actividad peroxidasa
La visualización de la actividad enzimática (peroxidasa) asociada a la reacción antígeno-
anticuerpo es el objetivo final de los métodos PAP o ABC-peroxidasa. Ésta se realizó incubando
los cortes con H2O2 al 0,007 % y 3,3´-diaminobenzidina (DAB 0,2% en Tris-PBS) en oscuridad
durante 10 min. La DAB es un cromógeno que al reaccionar con la peroxidasa produce un

58
precipitado café oscuro claramente visible al microscopio óptico. Después de la incubación en
DAB/H2O2, los cortes se lavaron en agua destilada, se deshidrataron y montaron para su
visualización. El control de la inmunotinción se realizó omitiendo la incubación con el primer
anticuerpo. Las muestras se visualizaron, examinaron y fotografiaron en un microscopio óptico
Zeiss Axioskop acoplado a una cámara digital AxioCam MR (Zeiss) o a una cámara digital Nikon
Coolpix 5000.
2.2.12 Inmunofluorescencia/microscopía confocal
Las incubaciones con los anticuerpos primarios y secundarios se realizaron de manera
similar al método PAP. Sin embargo, en estos casos, (i) los anticuerpos secundarios estaban
marcados con fluorocromos (Alexa Fluor 488 o Alexa Fluor 594) utilizados a dilución de 1:500
y tinción de núcleos con DAPI 1/10000 durante 10 min. Posteriormente, las muestras fueron
montadas en un medio para fluorescencia (S3023, Dako) y visualizadas en un microscopio
confocal Olympus Fluoview FV1000 (Olympus, Japón).
El escaneo de las muestras se realizó utilizando los láseres correspondientes para excitar
cada fluoróforo. Así, en los casos que se realizaron estudios de co-localización, un canal detector
filtraba el espectro de emisión de un fluoróforo (Alexa Fluor 488 excitado con el láser Argon a
488 nm), mientras otro canal detector filtraba la fluorescencia emitida por otro fluoróforo (Alexa
Fluor 633 excitado por el láser Helio-Neón-633 a 633 nm). La combinación digital de ambas
imágenes permitió determinar co-localización de las dos señales fluorescentes en la misma célula,
la cual fue confirmada realizando secciones ópticas a lo largo del eje Z. Se examinaron al menos
cinco campos por muestra y para cada condición experimental. Las muestras correspondientes
a los controles negativos fueron analizadas bajo las mismas condiciones que las muestras
experimentales. En algunos casos se midió el perfil de intensidad de la inmunofluorescencia
utilizando el software FV10-ASW 1.4 Viewer (Olympus, Japón).
2.2.13 Marcaje con BrdU en ratones postnatales

59
Para marcar células en proliferación en el páncreas de ratones adultos se utilizó 5-bromo-2’-
desoxiuridina (BrdU) (Sigma Chemical, St. Louis, MO, USA), un análogo de la timidina que se
incorpora al DNA de las células en división durante la fase S del ciclo celular. La BrdU se
administró mediante inyección intraperitoneal (i.p.) a una dosis de 100 mg/kg. Se utilizó un
protocolo de marcaje acumulativo con 3 pulsos diarios durante 3 días donde se inyectaron 3
animales WT y 3 animales mutantes hyh; 30 min después de la última inyección de BrdU se
eutanasiaron los animales y fueron inmediatamente procesados histológicamente según se
describe el protocolo para inmunocitoquímica utilizando un anticuerpo primario anti-BrdU y
revelados con DAB. Para cuantificar las diferencias entre los ratones mutantes hyh y sus
correspondientes controles, se examinaron cortes de páncreas seriados y se obtuvieron imágenes
comparables con un microscopio Zeiss Axioscop. Posteriormente, fueron contadas las células
BrdU positivas en los islotes de Langehans en imágenes digitales (obtenidas con objetivo 20X)
que incluían toda la zona de interés, utilizando el software NIH Image J. La suma de todas las
células BrdU+ contadas en cada corte fue tomado como el valor de las células BrdU+ por sección
(seriado por animal). Los valores se presentaron como el promedio de los valores obtenidos en
3 animales por genotipo.
2.2.14. Análisis estadístico
El análisis estadístico de las cuantificaciones realizadas en esta tesis, se llevó a cabo en el
software STATgraphic Prism 5, en el cual dependiendo de los datos se comparó a través del test
t-Student dos parámetros. Para aquellos resultados que involucraban comparación entre más de
2 factores se ocupó Anova de 1 vía. La significancia fue considerada de acuerdo al p-valor en
rangos de (*) p valor>0,1; (**) p valor>0,01; (***) p valor>0,001

60
3. RESULTADOS
3.1 α-SNAP
α-SNAP es una proteína de expresión ubicua relacionada a la maquinaria de fusión de
membranas. Tras su acoplamiento a los complejos SNARE, permite la interacción con la ATPasa
NSF, y la disocación (pre-activación) de los complejos inactivos. Así, la función canónica de α-
SNAP favorece, entre otros procesos, la exocitosis.
En el páncreas, esta proteína ha sido asociada a la liberación de insulina; sin embargo,
poco se sabe de su expresión y localización a nivel celular. Bajo este contexto se torna importante
evaluar su expresión en tejido pancreático, para lo cual se determinó la expresión del ARN
mensajero a través de PCR convencional, los niveles expresión de la proteína de α-SNAP a partir
de western blot (Figura 1) y su localización tisular a través de inmunohistoquímica e
inmunofluorescencia (Figura 2).
Adicionalmente se evaluó la expresión de otra proteína que interactúa funcionalmente
con α-SNAP en los procesos de exocitosis. NSF es una ATPasa, requerida para la disociación
de los complejos cis-SNARE y particularmente se utilizó como control de localización de α-
SNAP. Tal como se observa en la Figura 1, el ARN mensajero de ambas proteínas (α-SNAP y
NSF) se expresa en el homogenizado total del páncreas, sin mostrar alteraciones evidentes en la
expresión génica entre animales WT y mutantes hyh. Para este experimento, ambas membranas
fueron expuestas bajo las mismas condiciones, con el fin de obtener resultados comparables. Al
analizar los niveles a través de western blot, los niveles de expresión de las proteínas en cuestión,
se observa que existen los mismos niveles de expresión de NSF en ambos grupos de animales,
no así para α-SNAP, donde es evidente que existe una menor expresión de la proteína en
animales mutantes hyh. Cómo ya ha sido descrito en otros tejidos de este modelo murino (Bátiz
et al., 2009), α-SNAP presenta un hipomorfismo, esto quiere decir que existe expresión del ARN
mensajero en cantidades similares a los animales WT, sin embargo, es sólo un 40% de este ARN
mensajero es traducido en proteína.

61
Al estudiar la expresión de α-SNAP a nivel tisular (Figura 2) a través de
inmunohistoquímica e inmunofluorescencia, podemos observar que existe una segregación de la
expresión de α-SNAP a los islotes de Langerhans, lo cual llama aún más la atención se localiza
muy particularmente en el centro del islote de Langerhans con distribución similar a la
localización de las células beta pancreáticas. Queda en evidencia, sobre todo es las imágenes de
inmunofluorescencia, la diferencia en la expresión de α-SNAP, siendo menor en animales
mutantes hyh.
En consideración de los resultados de expresión y localización de α-SNAP y de las
principales proteínas involucradas en su rol canónico, podemos describir que es la primera vez
que se evidencia el hipomorfismo en la expresión de α-SNAP en páncreas, lo cual no tiene
relación con los niveles de expresión de su ARN mensajero y además hemos observado que
existe una inmunoreacción de α-SNAP preferencialmente en el páncreas endocrino en relación
al páncreas exocrino y con una distribución muy similar entre animales WT y animales mutantes
Figura 1. Caracterización de la expresión de α-SNAP y NSF en tejido pancreático. A) Western blot para NSF (82kDa), α- SNAP (37kDa), y β-actina (42kDa) en páncreas en animales WT y hyh. (n= 3(WT)/ n=4 (hyh)) (B) Las barras representan el promedio± SEM de los niveles de expresión de α-SNAP en animales WT y hyh. (n= 3(WT)/ n=4 (hyh)) (*) (p >0,1)Análisis estadístico: Student´s test. (C) Las barras representan el promedio de los niveles de expresión de NSF en animales adultos WT y hyh. (n= 3(WT)/ n=4 (hyh)
A
B
C

62
hyh, sin embargo con intensidades diferentes, que se relaciona con la diferencia de expresión de
α-SNAP.
Como ya lo hemos mencionado anteriormente el páncreas es un órgano bifuncional, a
cargo de la secreción de enzimas digestivas que son vertidas en el duodeno. En su rol endocrino,
hemos descrito anteriormente que secreta tres hormonas principales encargadas de la
homeostasis de glucosa: i) insulina, ii) glucagón y iii) somatostatina. De ellas, nos centraremos
en insulina, hormona hipoglicemiante, que se secreta mediante un proceso muy regulado que se
Figura 2. Caracterización histológica de la expresión de α-SNAP tejido pancreático. A) Panel muestra la expresión de α-SNAP en cortes histológicos de páncreas con inmunoreacción positiva para α-SNAP. Panel inferior, muestra los controles negativos (izquierda) y positivo (derecha) para la inmunoreacción del anticuerpo contra α-SNAP. B) Inmunofluorescencia revela la expresión de α-SNAP (rojo) en cortes histológicos de páncreas, localizado mayoritariamente en islote de Langerhans, donde los núcleos de las células han sido teñidos con DAPI (azul). Se puede apreciar claramente la menor expresión de α-SNAP en el islote de ratón hyh en comparación con el WT.
A B

63
desencadena en 2 etapas. La primera de ellas, responde a una hiperglicemia aguda y conlleva la
liberación del contenido intracelular de vesículas de almacenajes próximas a la membrana celular
de células beta (Seino et al., 2011) y la segunda fase de secreción de insulina involucra un proceso
más complejo, donde se responde a un estado de hiperglicemia crónico, que asocia una síntesis
de insulina de novo y la continua liberación de vesículas secretoras desde las células beta (Zawalich
et al., 2008).
α-SNAP es una proteína que se ha relacionado directamente con la secreción de insulina
en ensayos in vitro. Estos ensayos describieron que el knockdown de α-SNAP disminuye la
secreción de insulina en células MIN6 (línea celular derivada de insulinoma) y que además esta
disminución es exclusivamente en la liberación de insulina y no del neurotransmisor GABA
(secretado también por células beta pancreáticas) (Nagamatsu et al., 1999). Estos resultados son
atractivos como contexto para evaluar las consecuencias de la mutación M105I en la secreción
de insulina.
Se realizaron experimentos de secreción de insulina en cultivos primarios de islotes de
Langerhans de ratones WT y mutantes hyh. El paso crítico para lograr estos cultivos es una
buena técnica de perfusión de la colagenasa P, con el objetivo de mantener la integridad de los
islotes pancreáticos. Para esto, se realizaron diferentes tipos de cirugía, técnicas que fueron
aprendidas e implementadas a partir de una pasantía en Joslin Institute of Harvard, en Boston,
USA. El protocolo consiste en un bloqueo del conducto biliar, en el esfínter de Oddi, para luego
inyectar a través del conducto pancreático principal la solución de colagenasa P, lo cual aumenta
el volumen pancreático facilitando su extracción y a su vez, permite la difusión de la colagenasa
P en mayor porción del tejido pancreático. Una vez que se aisla el tejido, se digiere a 37ºC y se
separan los islotes de Langerhans por gradiente de Histopaque®, desde donde son cultivados a
37ºC con 0,5% de CO2. Bajo estas condiciones, el cultivo primario de islotes de Langerhans
estará óptimo para ser trabajado 24 hrs después de la extracción (Figura 3).

64
Una vez transcurrido el periodo de cultivo (24 hrs.), se realizó un ensayo de liberación
de insulina estimulado por glucosa, GSIS (Figura 4). El propósito de este ensayo, es evaluar
inicialmente la funcionalidad de los islotes de Langerhans aislados y particularmente evaluar la
respuesta de los islotes de Langerhans provenientes de animales mutantes hyh frente a un estado
de hiperglicemia. Tal como se muestra en el esquema representativo del protocolo, se trabajan
sólo 5 islotes de Langerhans por cada pocillo a estimular, considerando parámetros
microscópicos como el tamaño, coloración y rugosidad de los bordes. Una vez elegidos los
islotes pancreáticos a estimular, se dejan en ambientación en solución HANK’s con 2,8 mM de
glucosa por 1 hr, luego de este periodo, se retira el medio y son estimulados con la misma
Figura 3. Procedimiento quirúrgico en el desarrollo del cultivo primario de Islotes de Langerhans. A)
Esquema del protocolo de extracción de los islotes de Langerhans para el desarrollo de cultivo primario y
posterior ensayo de estimulación de la secreción de insulina estimulada por glucosa (GSIS). Recuadro de
aumento, destaca el bloqueo del conducto biliar para direccionar la solución de colagenasa hacia el tejido
pancreático.

65
solución por 1 hr, desde donde se extrae el sobrenadante para ser considerado como condición
basal. Estos mismos islotes, son estimulados nuevamente con una solución 16,2 mM por 1 hr,
desde donde se extrae el sobrenadante considerado como condición de alta glucosa. Para
normalizar la liberación de insulina en este ensayo, es conveniente realizar la cuantificación del
remanente intracelular de insulina, para lo cual, los islotes de Langerhans son colocados en una
solución ácida, desde donde se cuantifica la cantidad de insulina intracelular.
La cuantificación de la insulina liberada al medio, se obtiene a partir de un ensayo ELISA
colorimétrico, donde la absorbancia se relaciona a través de una curva hiperbólica con la
concentración de insulina (Figura 5). Esta interpolación de las concentraciones, arroja que los
islotes de Langerhans son funcionales, por ende el desarrollo del cultivo primario para la
extracción de estas estructuras es exitoso y además se observa que los islotes de Langerhans
Figura 4. Esquema del ensayo de secreción de insulina estimulada por glucosa (GSIS). Representación del
protocolo utilizado para el GSIS donde 5 islotes de Langerhans son acondicionados al medio de estimulación por 1
hr., posterior a este periodo comienza la estimulación de 1hr con 2,8 mM de glucosa (basal) desde donde se extraen
400 ul de medio para registrar la Insulinemia basal. Luego se agrega medio con alta concentración de glucosa, el cual
se mantiene por 1 hr y desde donde se extraen 400ul para medir la insulina liberada al medio bajo estas condiciones.
El remanente de insulina es ocupado para la normalización de las concentraciones de insulina liberadas bajo
estimulación, para cuantificar este remanente se lisan en medio ácido los islotes pancreáticos y a partir de este lisado
se cuantifica la cantidad intracelular de insulina.

66
proveniente de animales mutantes hyh secretan menores niveles de insulina, 0,042 ng/islotes/hr
en condiciones basales respecto a los animales WT, que generan 0,107 ng/islotes/hr. La
diferencia en la capacidad de secreción de los islotes pancreáticos se acentúa cuando son
estimulados con alta concentración de glucosa, donde la cantidad de insulina secretada por los
animales WT es de 0,28 ng/islote/hr y por los animales mutantes hyh es de 0,1 ng/islote/hr, lo
cual corresponde a un 64% menos secreción de insulina. Estos datos sugieren que la mutación
de α-SNAP M105I produce una alteración en la función celular que se traduce en una menor
liberación de insulina al medio de cultivo.
Figura 5. Secreción de insulina desde cultivo primario de islotes de Langerhans. A partir del cultivo primario de islotes pancreáticos, se realizó un ensayo GSIS con una estimulación de glucosa de 16.2 mM por un periodo de 1 hr en animales WT y animales mutantes hyh. Se consideraron 5 islotes por pocillo, donde la normalización de las cantidades de insulina liberada, es respecto a la cantidad de islotes estimulados. (n= 2(WT)/ n=2 (hyh))N.S: diferencias no significativas. Análisis estadístico t-Student

67
3.2 Homeostasis de la glucosa
Con los resultados obtenidos en cultivo primario de islotes decidimos evaluar las
consecuencias de estos defectos en la secreción de insulina en la homeostasis de la glucosa in
vivo en ratones mutantes hyh. La homeostasis de la glucosa es un proceso estrictamente regulado
que involucra la participación del hígado, secreción hormonal pancreática, el efecto de las
incretinas y además la función del eje hipotalámico-hipofisiario. Una alteración de cualquiera de
estos ejes de control, genera patologías que cursan con anomalías metabólicas. Sin embargo,
muchas de estas patologías tienen signos subclínicos o incluso los parámetros de control de estas
enfermedades se mantienen inalterados y el organismo es capaz de adaptarse a cambios
metabólicos de manera sutil.
En este contexto, la evaluación del eje: secreción de insulina-homeostasis de la glucosa
permite determinar el funcionamiento de los diferentes órganos involucrados en este proceso y
de posibles alteraciones de los mismos.
Basados en esto, se realizaron determinaciones de glicemia e insulinemia en distintas
condiciones para evaluar el estado metabólico de los ratones mutantes hyh en comparación con
los ratones WT.
3.2.1 Glicemia basal y Test de Tolerancia a la glucosa
Para estudiar el estado metabólico basal de nuestro modelo de estudio, desarrollamos
registros de glicemia en animales WT y animales mutantes hyh en dos condiciones esenciales: i)
alimentación y ii) ayuno, Para esto, se han estandarizado las condiciones de trabajo y
manipulación de los grupos de animales, evaluando género, progresión de la enfermedad, el
estrés causado por la manipulación, uso de anestésicos, la hora de registro de las glicemias
(considerando el ritmo circadiano), horas de ayuno y vías de administración de glucosa, Dado
que han sido muchas las variables a evaluar, hemos determinado cuales son los mejores
parámetros para el registro de antecedentes metabólicos:

68
Género: a pesar de no encontrar diferencias significativas en los registros de
glicemia realizados a machos y hembras, preferimos trabajar con machos, evitando así
fluctuaciones de los niveles de glucosa debido al periodo estral.
Progresión de la enfermedad: Dado que nuestro modelo animal desarrolla
hidrocefalia, fue importante clasificar de acuerdo a sus signos clínicos dos grupos de animales en
los cuales la progresión de la enfermedad es diferente: rp (rapid progress): es el grupo de animales
donde la progresión es mucho más rápida y más severa, y por ende presentan una sobrevida
inferior; y los sp (slow progress): en los cuales los signos clínicos de hidrocefalia no o tan severos y
presentan mayor sobrevida (ver Batiz et al. 2006). De acuerdo a los objetivos planteados para
esta tesis, consideramos que el grupo ideal de trabajo, son animales sp, ya que presentan signos
clínicos más similares entre ellos y proporcionan una mayor ventana de tiempo para estudiarlos.
Manipulación y administración de anestésicos: Debido a que los animales mutantes hyh
(sp) presentan hiperactividad y son hiperrreactivos a la manipulación, evaluamos la posibilidad
de administrar anestésicos de distintas familias y formas, para contrarrestar el estrés que significa
la manipulación en los grupos de animales. Sin embargo, los anestésicos evaluados: i)
pentobarbital/nembutal, ii) mezcla Xilacina/Ketamina, y iii) Isofluorano, alteraron los
parámetros metabólicos de nuestro interés, generando hiperglicemias y/o modificando la
secreción de insulina pancreática. Por lo tanto, determinamos que la mejor modalidad de trabajo,
es el adiestramiento de los animales a la manipulación evitando así el estrés y por tanto la
alteración de los parámetros de estudios.
Horas de ayuno y horario de registro de glicemia: Una de las condiciones agudas a la
cuales se someten los individuos para evaluar control metabólico, es la sobrecarga de glucosa;
sin embargo, este examen se realiza bajo condiciones de ayuno y en estado de reposo, por lo
tanto, era imprescindible evaluar qué condiciones se asemejan más a estos requisitos. Para esto,
algunos autores plantean que en animales de la misma cepa, es conveniente un ayuno de 6 hrs y
el registro de glicemias idealmente debe coincidir con periodos de reposo de los animales (es
decir durante el día: a las 14-15 horas). En consideración de lo anterior, los registros de glicemias
que fueron medidos tanto en alimentación como en ayuno cumplen con estos requisitos.
Vía de administración de sobrecarga de glucosa: Otro aspecto importante a considerar
es la vía por la cual se administra la glucosa cuando se requiere una sobrecarga de este

69
carbohidrato. Al igual que con los periodos de ayuno, se ha descrito que la mejor forma de
administración de la glucosa es a través de la inyección intraperitoneal, evitando agregar de esta
manera otros factores (ej. Incretinas) que puedan alterar los registros glicémicos.
Estandarizadas las condiciones de trabajo para estudiar los parámetros metabólicos a
evaluar, procedimos a registrar glicemias basales en condiciones de alimentación y ayuno, en
animales WT y animales mutantes hyh (Figura 6), en donde los periodos de alimentación fueron
controlados en tiempo y en cantidad de alimento, registrando a su vez el volumen de alimento
consumido por periodo de tiempo (4 horas). Cabe destacar que ambos grupos de animales,
consumen la misma cantidad de alimento seco, por lo que la diferencia de glicemias observable
bajo este protocolo no se debe a una diferencia en el ingesta (Tabla 2).
Figura 6. Protocolo de registro de
glicemias. Animales WT y animales
mutantes hyh son dejados en ayuno por
un periodo de 6 hrs, posteriormente, se
separan en 2 grupos: i) se registra la
glicemia inmediatamente (bajo ayuno) y
ii) se mantiene una alimentación
controlada por 2 hrs para registrar la
glicemia basal en condición de
alimentación.

70
Bajo el protocolo detallado anteriormente, se realizaron los registros de glicemias basales
en animales Wt y animales mutantes hyh con el objetivo de evaluar los niveles de glucosa
sanguínea sin estímulo previo (ayuno) y bajo alimentación controlada (Figura 7).
Genotipo Alimento
consumido (gr)
Alimento
consumido en 2 hrs
(gr)
WT 5,8 1
hyh 5,84 0,98
Figura 7. Glicemias Basales. Glicemia basal de animales WT y animales mutantes hyh obtenidos en condiciones de ayuno prolongado por 6 horas y de alimentación controlada (ayuno (n= 24(WT)/ n=30 (hyh)); alimentación (n= 12(WT)/ n=10 (hyh)). Análisis estadístico Anova one way (*) p<0,1; (**) p<0,01.
Tabla 2. Registro de alimentación controlada. Promedio de alimento seco consumido por
día en grupos de animales WT y hyh y promedio de alimento consumido en un periodo de 2
hrs posteriores a una condición de ayuno de 6 hrs. Los datos corresponden al promedio ± SEM.
WT n=12; hyh n= 10

71
Sorprendentemente, los registros obtenidos muestran que las glicemias basales en ayuno
son similares en ambos grupos de animales, sin embargo tras un periodo de alimentación
controlada, los animales WT aumentan aproximadamente 21% su glicemia, mientras que los
animales mutantes hyh presentan un aumento muy leve de su glicemia (6%) lo que ocasiona que
mantengan niveles muy similares a los observados en ayuno.
Una vez establecidas las glicemias basales en las cuales se desenvuelven los grupos de
animales, se determinó la capacidad de regulación del eje glucosa – insulina tras un estímulo
agudo de glucosa, condición conocida como TEST de TOLERANCIA a la GLUCOSA
administrada intraperitonealmente (TTGIP).
Figura 8. Protocolo de Test tolerancia a la glucosa. Esquema representativo del desarrollo experimental para el Test de Tolerancia a la glucosa intraperitoneal (TTGIP). Inicialmente los animales WT y animales mutantes hyh se someten a un periodo de ayuno de 6 hrs, posterior a este tiempo se les realiza un tiempo de ambientación a la manipulación (40 minutos previos a la carga de glucosa) donde se realizan los primeros registros de glicemias. Se administraron diferentes concentraciones de glucosa (0,5 – 3 mg/g de ratón) considerando este tiempo como T0. Luego de la administración de glucosa intraperitoneal se tomó registro de la glicemia durante 2 hrs.

72
Tal como se muestra en la Figura 8, consideramos cuatro concentraciones de glucosa
para ser administradas intraperitonealmente en un rango de 0,5 mg/ml – 3mg/ml (5%, 10%,
20% y 30%) que fueron administradas a animales WT y mutantes hyh. Igualmente, se consideró
incorporar en el análisis el periodo previo de manipulación de los animales (40 minutos previos
a la carga de glucosa), con el fin de evidenciar que efectivamente la manipulación produce un
pico de glicemia, que se interpreta como un pulso de glucosa generado por el estrés inicial del
test, que al cabo de este periodo logra normalizarse. De esta forma se realizaron registros de
glicemia (i) en cuatro puntos antes de la sobrecarga de glucosa, siendo el último registro en el
instante previo a la administración (tiempo 0), y (ii) en cuatro puntos después de la sobrecarga
de glucosa (15, 30, 60, 120 min).
Los resultados obtenidos que describen el comportamiento metabólico entre ambos
grupos de animales y en los diferentes tratamientos se muestran en la Figura 9.
Si bien no se observaron diferencias estadísticamente significativas en ninguno de los
tratamientos, los resultados muestran que con sobrecargas del 20% los ratones hyh alcanzan a
los 15 min post-sobrecarga glicemias promedio de 1,82 respecto del control (tiempo 0), mientras
que los WT alcanzan glicemias de 1,65 respecto del control (tiempo 0). Interesantemente, cuando
se utilizó una sobrecarga de 30% glucosa, esta tendencia se observó a los 15, 30 y 60 minutos,
evidenciado por la separación de la curva de glicemia en esta primera hora de registro, sin
embargo, ambos grupos logran normalizar sus glicemias finalizado el registro (120 minutos).

73
Figura 9. Test de tolerancia a la glucosa. Administración intraperitoneal de distintas dosis de glucosa (A-D) y su respectivo análisis del área bajo la curva. Los datos graficados corresponden al promedio ± SEM de las glicemias normalizadas respecto al tiempo 0 (T0) de cada individuo. No se observaron diferencias significativas entre los animales WT y hyh en ninguno de las dosis evaluadas 5% (n= 7(WT)/ n=8 (hyh)); 10% (n= 4(WT)/ n=4 (hyh)); 20% (n= 15(WT)/ n=14 (hyh)); 30% (n= 6(WT)/ n=8 (hyh)). Análisis estadístico ANOVA de una vía. p<0,1.
A
B
C
D

74
3.2.2 Insulinemia y Test de Tolerancia a la insulina
Si bien las variaciones observadas en las curvas de tolerancia a la glucosa podrían estar
reflejando los defectos en la secreción de insulina detectada en los cultivos primarios de islotes,
también podrían estar demostrando una relativa resistencia periférica a la acción de la insulina
en los animales mutantes hyh. Es por esta razón, que nuestro siguiente paso fue evaluar la
insulinemia basal de los grupos de animales en condiciones de ayuno ocupando los mismos
criterios utilizados para el registro de glicemia basal (Figura 10).
Los datos obtenidos (Figura 11) no mostraron diferencias estadísticamente significativas
entre los animales WT y hyh; sin embargo, se observó que los ratones mutantes hyh presentan
una insulinemia promedio que es un 28% más baja que los ratones WT (3,241 ± 0,363 ng/ml en
los WT vs. 2,344 ± 0,377 ng/ml en los hyh). Estos resultados sugieren, por un lado, que los
ratones mutantes hyh no presentan resistencia periférica a la insulina, ya que de existir sería
esperabl encontrar insulinemias aumentadas. Por otro lado, si bien no se encontraron diferencias
significativas, la tendencia a la reducción de las insulinemias basales en los ratones mutantes hyh
Figura 10. Protocolo de registro de
insulinemias. Animales WT y animales
mutantes hyh son dejados en ayuno por un
periodo de 6 hrs, posteriormente, se
extraen aproximadamente 100 ul de sangre
desde una incisión en la cola. Se centrifuga
para separar la sangre en sus componentes
y tomar registro de la cantidad de insulina
plasmática.

75
es coherente con los resultados encontrados en los cultivos primarios de islotes y podría
significar una diferencia fisiológicamente relevante, por ejemplo, en la respuesta inicial ante una
sobrecarga aguda de glucosa (TTGIP).
A pesar de que los resultados de insulinemia basal no sugieren una resistencia periférica
a la acción de insulina, se realizó un test de tolerancia a la insulina (TTI) para confirmarlo. Para
llevar a cabo este protocolo, se consideró el ayuno y la alimentación bajo las mismas condiciones
en que se han trabajado los animales anteriormente y luego de la dosis de insulina intraperitoneal
(0,25 UI/ml), se registró la glicemia en 4 puntos, completando un tiempo total de 60 minutos
(Figura 12).
Figura 11. Insulinemia Basal. Las barras representan el promedio ± SEM del registro de insulinemias posterior a un ayuno de 6 horas. NS: no se observaron diferencias estadísticamente significativas entre ambos grupos (n= 10(WT)/ n=20 (hyh)). Análisis estadístico: Student’s t-test p<0,1

76
Los resultados del TTI muestran que ambos grupos de animales, tanto en condiciones
de ayuno y alimentación son sensibles a la carga de insulina y presentan dinámicas de reducción
de las glicemias muy parecidas. Estos datos complementan los resultados de insulinemia basal y
sugieren fuertemente que los animales mutantes hyh no presentan resistencia periférica a la
insulina, y que el tejido periférico (muscular y adiposo) de ambos grupos experimentales es capaz
de responder al exceso de insulina, incorporando la glucosa en los tejidos y de esta manera
disminuyendo la glicemia. En este contexto, las diferencias (no significativas estadísticamente)
observadas en las curvas del TTGIP apoyan la hipótesis que los ratones mutantes hyh presentan
una deficiencia en la liberación de insulina producto de la mutación M105I de α-SNAP.
Figura 12. Protocolo de Test de
Tolerancia a la Insulina (TTI).
Animales WT y animales mutantes hyh
son separados en 2 grupos i) son dejados
en ayuno por un periodo de 6 hrs, ii) son
dejados en condiciones de alimentación
ad libitum. Posteriormente, se
administra intraperitonealmente 0,25 de
insulina y se registra en un periodo de 1
hr la glicemia.

77
A partir de los resultados obtenidos hasta este capítulo, es interesante destacar que la
mutación M105I de α-SNAP genera una disminución de la secreción de insulina en cultivo
primario de islotes de Langerhans. Por otro lado, si bien los resultados de los ensayos fisiológicos
no muestran diferencias significativas entre animales WT y mutantes hyh, si muestran variaciones
(no significativas) en el manejo de la sobrecarga de glucosa no debidos a la resistecia periférica a
la insulina, y sugerntes de una probable disfunción pancreática (secreción de insulina). En este
contexto, y considerando que (i) α-SNAP se expresa fuertemente en los islotes de Lnagerhans,
y (ii) que los ratones mutantes hyh no son ratones nulos para α-SNAP sino que son hipomórficos
(presentan menores niveles de proteína), se dicidió analizar en profundidad las características del
tejido pancreático endocrino con la finalidad de cuantificar si existen diferencias en la
conformación del tejido que puedan explicar un estado homeostático normal en los ratones
mutantes hyh, a pesar de la disfunción de α-SNAP.
Figura 13. Test de tolerancia a la insulina (TTI). (A, B) El gráfico representan el promedio ± SEM del registro de glicemias a los minutos 0, 15, 30 y 60 tras la administración intraperitoneal de insulina 0,25 UI/ kg de animal en condiciones de ayuno de 6 hrs (A) y tras alimentación controlada de 2 horas (B). Los valores se expresan en términos relativos respecto del tiempo 0 (valor 1,0) para cada animal analizado. (A) (n= 6 (WT)/ n=11 (hyh)), (B) (n= 4(WT)/ n=4 (hyh)). Análisis estadístico: Student´s t-test.
A B

78
3.3 Páncreas
Para evaluar la estructura y conformación del tejido endocrino pancreático de animales
WT y mutantes hyh se decidió realizar un estudio histológico, morfométrico y estereológico.
Para esto, realizamos un análisis de cortes seriados de páncreas completos de animales WT y
animales mutantes hyh y nos basamos en el principio de Delesse (morfometría) y de Cavalieri
(estereología) donde se señala que existe una relación entre estructuras tridimensionales y
parámetros de medición que pueden ser obtenidos de imágenes (Figura 14).
El análisis morfométrico partió considerando una de las características más evidentes a
nivel macro que posee el grupo de animales mutantes hyh, su tamaño corporal. Ha sido descrito
previamente por nuestro laboratorio (Bátiz et al., 2006) algunas de las características
Figura 14. Principio de Cavalieri para la determinación de volumen. A partir de la morfometría, la estereología
busca determinar el volumen de un objeto a partir del producto de la distancia entre planos y la suma de áreas en
secciones sistemáticamente aleatorias a través del objeto. Permitiendo la cuantificación de ciertos parámetros
generales de estructuras tridimensionales a partir de imágenes bidimensionales.

79
morfológicas y clínicas que poseen los animales mutantes hyh, destacando que son notablemente
más pequeños y que esta diferencia se acentúa a medida que aumentan en edad (Figura 15).
Considerando las diferencias en el tamaño corporal de los animales mutantes hyh
decidimos analizar morfométricamente el tejido pancreático y su relación con el tamaño
corporal. Para esto, fue necesario extraer el tejido, registrar su peso húmedo y posteriormente
incluirlo en parafina para análisis inmunohistoquímicos que comprendían un seriado completo
Figura 15. Relación entre el peso corporal y edad en ratones WT y hyh. (A) Fotografía representativa de las diferenias morfológicas del modelo murino en estudio respecto a un animal WT. (B) Gráfico de barras que representa el promedio ± SEM del peso corporal (g.) en ratones WT y hyh. Diferencias significativas (**) (P<0.01) (n=19 (WT) / n=20 (hyh). Análisis estadístico: Student’s t-test. (C) Gráfico de barras que representa el promedio ± SEM del peso corporal (g.) en diferentes grupos etarios (30-60/ 60-90/ >120 días) en ratones WT y hyh. Diferencias significativas: (*) 30-60 días / (**) > 120 días. N.S. no hay diferencias significativas 60-90 días. n=7(WT)/ n=9(hyh) 30-60 días; n=4(WT)/ n=2(hyh) 60-90 días; n=8(WT)/ n=9(hyh) > 120 días. Análisis estadístico: Anova, one-way.
A B
A
B C
wt hyh

80
del páncreas de animales WT y animales mutantes hyh y montar en portaobjetos 1 de cada 20
corte a los cuales se les realizó tinción con hematoxilina/eosina para posteriormente fotografiar
cada uno de los islotes de Langerhans del seriado teñido.
En la Figura 16, podemos observar que no existen diferencias significativas en el peso
del páncreas respecto al peso corporal, por ende el tamaño pancreático es proporcional al tamaño
corporal; sin embargo, se observa una cierta tendencia al aumento en los ratones mutantes hyh
respecto a los WT. Al analizar el promedio del área pancreática (obtenida a partir de secciones
seriadas de páncreas completo) respecto al tamaño corporal tampoco se observan diferencias
significativas. Finalmente, al cuantificar el volumen endocino en relación al tamaño corporal, no
se observó diferencias significativas entre los animales mutantes hyh los animales WT, sin
embargo, es evidente una tendencia al aumento.
Considerando la tendencia al aumento del volumen endocrino observado en los
animales mutantes hyh, quisimos profundizar aún más en el análisis morfométrico del páncreas,
donde se comparó la razón entre el volumen endocrino y el volumen pancreático ( densidad
volumétrica del tejido endocrino) en ambos grupos de animales, así como también el número de
células endocrinas presentes en cada islote de Langerhans fotografiado (Figura 17). Los
Figura 16. Relación del peso y volumen pancreático en ratones WT y hyh. (A) Gráfico de barras que representa el promedio ± SEM del peso pancreático (g.) por gramos de peso corporal en ratones adultos (>120 días) WT y hyh. N.S. no se observan diferencias significativas. n=8 (WT)/ n=10 (hyh). Análisis estadístico: Student’s t-test. (B). Gráfico de barras que representa el promedio ± SEM de la relación entre el volumen pancreático (mm3) y el peso corporal (g) en ratones adultos (>120 días) WT y hyh. N.S. no se observan diferencias significativas. n=8 (WT)/ n=10 (hyh). Análisis estadístico: Student’s t-test.
A B

81
resultados muestran que los ratones mutantes hyh presentan una valor promerio ± SEM de
densidad volumétrica de 0.076 ± 0,013 (n=3), mientras que los ratones WT presentan un valor
de 0,058 ± 0,010 (n=3). Estos datos, aunque no estadísticamente significativos, reflejan un
aumento del 31% en la densidad volumétrica del tejido endocrino en los ratones hyh respecto
de los WT (Figura 17A).
Esta tendencia al aumento de la densidad volumétrica del tejido endocrino podría
deberse a dos mecanismo compensatorios: hipertrofia (aumneto del tamaño celular) o
hiperplasia (aumento del número de células). Para definir esto, se cuantificó el número de células
por área endocrina y se observó que los ratones mutantes hyh presentan un mayor número de
células (Figura 17B). Estos resultados, en conjunto, sugiere que las células endocrinas de los
ratones mutantes hyh son más pequeñas que las de los ratones WT, y, por lo tanto la tendencia
al aumento de la densidad volumétrica del tejido endocrino no se debe a una hipertrofia de las
células endocrinas, sino, por el contrario, a un mecanismo de hiperplasia.
Figura 17. Relaciones entre el volumen endocrino y el número de células endocrinas por área pancreática (A) Las barras representan el promedio ± SEM de la relación entre el volumen endocrino (mm3) y el volumen pancreático (mm3) en animales WT y hyh. N.S: diferencias no significativas n=3 (WT)/ n=3 (hyh). Análisis estadístico: Student´s test. (B) Las barras representan el promedio ± SEM de la relación entre el número de células endocrinas contabilizadas por unidad de área endocrina (mm2) en animales WT y hyh. * p >0,01 n=3
(WT)/ n=3 (hyh). Análisis estadístico: Student´s t test.
A B

82
Estos resultados sugieren que los animales mutantes hyh podrían presentar diferencias
en la composición y/o desarrollo del tejido endocrino pancreático respecto de los WT. En este
contexto, se analizaron dos variables en relación al tejido endocrino: (i) el número de islotes de
Langerhans y (ii) la distribución de tamaño (área) de los islotes.
En relación a la primera variable se cuantificó el número de islotes por volumen de tejido
pancreático (Figura 18ª) y se observó que los animales WT presentan un promedio de 4,00 ±0,56
Figura 18. Relaciones entre la cantidad de islotes y tamaño de los islotes de Langerhans en ratones WT y hyh. (A) Gráfico de barras que representa el promedio ± SEM de islotes de Langerhans contabilizados por volumen pancreático (mm3) en los grupos WT y hyh. N.S: diferencias no significativas (n=3 (WT)/ n=3 (hyh). Análisis estadístico: Student´s test. (B) Gráfico de barras que representa el promedio ± SEM del tamaño (área) de los islotes de Langerhans en animales WT y hyh. N.S: diferencias no significativas (n=3 (WT)/ n=3 (hyh). Análisis estadístico: Student´s test. (C) Gráfico de distribución porcentual del tamaño (cada 10000 μm2) de los islotes de Langerhans contabilizados.
A B
C

83
islotes/mm3 (n=3). Por otro lado, se cuantificó el área promedio de los islotes (Figura 18B),
observándose que ambos grupos presentan islotes con un tamaño promedio muy similar. De
hecho, el área promedio de los islotes en los animales WT es de 1,19 ± 0,04 x 105 µm2 (n=3) y
en los hyh de 1,10 ± 0,03 x 105 µm2 (n=3). Incluso, al analizar la distribución relativa de los
tamaños de islotes en los animales WT y mutantes hyh se observó que ambos grupos presentan
una distribución casi idéntica (Figura 18C).
Considerando que los ratones hyh presentan una tendencia hacia una mayor densidad
volumétrica del tejido endocrino y que los islotes hyh presentan un tamaño similar a los de los
ratones WT, esta tendecia está determinada fundamentalmente por una hiperplasia de las células
endocrinas y un relativo aumento del número de islotes en comparación a los ratones WT.
Para determinar, si el aumento de células endocrinas observado en los islotes de
Langerhans corresponde a un tipo celular en particular, desarrollamos una inmunohistoquímica
para los 2 grupos de células endocrinas más abundantes en el páncreas: células α, secretoras de
glucagón y células β, secretoras de insulina (Figura 19).

84
A partir de las inmunohistoquímicas desarrolladas en el seriado completo de páncreas,
se cuantificó el número de células inmunoreactivas para glucagón e insulina, y se relacionó con
diferentes denominadores relacionados a la morfometría pancreática realizada anteriormente
(Figura 20).
Figura 19. Caracterización de la expresión de células α y β en islotes pancreático de ratones WT y mutantes hyh. (A)Islote de Langerhans WT con inmunoreacción positiva para glucagón. (B) Islote de Langerhans hyh marcado por inmuhistoquímica para glucagón. (C) Islote de Langerhans WT marcado por inmuhistoquímica para insulina. (D) Islote de Langerhans hyh marcado por inmuhistoquímica para insulina. Tamaño de imágenes 10X. Barra
de escala 100 μm.
A B
C D

85
C
A B
D
E F
G H

86
Figura 20. Análisis cuantitativo de células α y β del tejido pancreático endocrino (A) Gráfico que representa el promedio ± SEM del tamaño (μm²) de células alfa en los grupos WT y hyh. *** P<0,001 Student´s t test. (B) Gráfico que representa el promedio ± SEM del tamaño (μm²) de célula beta en los grupos WT y hyh. *** P<0,001 Student´s t test. (C) Gráfico que representa el promedio ± SEM de la proporción de células alfa respecto al total de células endocrinas en los grupos WT y hyh. N.S: diferencias no significativas. (D) Gráfico que representa el promedio ± SEM de la proporción de células beta respecto al total de células endocrinas en los grupos WT y hyh. N.S: diferencias no significativas. (E) Gráfico que representa el promedio ± SEM del número de células alfa pancreática por área (mm²) pancreática de los grupos WT y hyh. ** P<0,01. Student´s t test. (F) Gráfico que representa el promedio ± SEM del número de células beta pancreática por área (mm²) pancreática de los grupos WT y hyh. ** P<0,01. Student´s t test. (G) Gráfico que representa el promedio ± SEM del número de células beta pancreática por gramos de peso corporal de los grupos WT y hyh. . N.S: diferencias no significativas (H) Gráfico que representa el promedio ± SEM del número de células beta pancreática por gramos de peso corporal de los grupos WT y hyh. Diferencias significativas *** P<0,001 Student´s t test. Para todos los grupos WT, n=3; hyh, n=3.

87
La morfometría realizada a partir de las inmunohistoquímicas de glucagón e insulina
mostraron que, en coherencia con los resultados obtenidos anteriormente, tanto las células
secretoras de insulina (beta) como aquellas secretoras de glucagón (α) no son hipertróficas, sino
por el contrario presentan tamaños menores a los de las células WT (Figura 20A y B). Por otro
lado, no existen diferencias significativas en la proporción de células α y β, respecto al total de
células endocrinas de un islote pancreático, siendo en proporción 1,6 % células secretoras de
glucagón y 98% células secretoras de insulina, lo cual es coherente con los datos descritos en la
literatura (Figura 20C y D). Si se relaciona el número de células (α y β respectivamente) con el
área pancreática, se puede observar que los animales mutantes hyh presentan un aumento en el
número de células α y una marcada tendencia al aumento en el número de células β (Figura 20
E y F). Esta tendencia al aumento de las células β se hace muy evidente al relacionarlo con el
peso corporal de los animales, observándose un claro aumento del número de células β en
relación al peso corporal en los ratones mutantes hyh en comparación a los WT (Figura 20G y
H). Esto sugiere, que las células endocrinas, y particularmente las células β, se encontrarían en
mayor proporción en los islotes pancreáticos de los animales mutantes hyh.
En resumen, los resultados obtenidos demuestran que (i) α-SNAP (y NSF) se expresan
preferencialmente en el tejido pancreático endocrino y, que los ratones mutantes hyh presentan
un hipomorfismo (menores niveles) para esta proteína, (ii) que la mutación M105I provoca una
reducción en la secreción de insulina estimulada por glucosa en cultivos de islotes, (iii) que los
ratones hyh presentan una tendencia hacia una mayor densidad volumétrica del tejido endocrino,
debida fundamentalmente a un mayor número de islotes y un mayor número de células
endocrinas. En conjunto, estos resultados sugieren que existe un mecanismo compensatorio a
nivel tisular (aumneto del tejido endocrino por aumento del número de células y número de
islotes) en los ratones mutantes hyh para α-SNAP lo que se traduce en una homeostasis de la
glucosa normal.
Uno de los mecanismos más estudiados de plasticidad pancreática, y que podría (Butler
et al., 2010) explicar esta compensación a nivel tisular es el aumento de la proliferación de células
beta a nivel de los islotes de Langerhans. Para evaluar esto realizamos un ensayo de proliferación
celular in vivo, el cual consiste en realizar inyecciones intraperitoneales de Bromodesoxiuridina
(BrdU), un análogo de la timidina que se intercala al DNA sólo en aquellas células que hayan

88
pasado por la etapa S del ciclo celular. Se realizó un protocolo de 3x3 (tres veces al día, por tres
días consecutivos) en ratones adultos (120-200 días), luego del tercer día, estos animales fueron
eutanasiados y procesados. Se realizó la inclusión y el seriado del tejido, para posteriormente
realizar un inmunomarcaje para BrdU (Figura 21).
Al igual que con los tejidos trabajados anteriormente, se realiza la
cuantificación de las células BrdU positivas que estén circunscritas al área de los islotes
pancreáticos en todo el seriado del tejido (Figura 22).
Figura 21. Esquema representativo
del protocolo de ensayo BrdU.
Administración de una dosis de 100
mg/Kg de ratón, tres veces al día por
tres días a grupos de ratones WT y
mutantes hyh. A partir de la última dosis
de BrdU, se extrae el páncreas para
posteriores análisis histológicos.

89
El ensayo de proliferación evidencia que los animales mutantes hyh poseen una mayor
tasa proliferativa, y a juzgar por la ubicación de las células dentro del islote de Langerhans
Figura 22. Ensayos de proliferación celular a través de la incorporación de BrdU. (A) Imagen representativa de inmunohistoquímica para BrdU de un islote de Langerhans WT, con una baja incorporación de BrdU. (B) Imagen representativa de inmunohistoquímica para BrdU un islote de Langerhans hyh. Flechas blancas indican células proliferativas dentro del islote de Langerhans y flecha roja, indica células proliferativa en tejido exocrino. Aumento 40X. (C) Las barras representan el promedio ± SEM de la relación entre células proliferativas y el número total de células cuantificadas por islote pancreático en animales WT y hyh. N.S: diferencias no significativas n=2 (WT)/ n=2 (hyh). (D) Las barras representan el promedio ± SEM de la relación entre células proliferativas y el área endocrina (µm2) por islote pancreático en animales WT y hyh. n=2 (WT)/ n=2 (hyh). Diferencias significativas (**) (p<0,01). Análisis estadístico: Student´s test. Tamaño de imagen 40X.
A
B
C
D

90
podrían ser principalmente células β, sin embargo es necesario realizar la confirmación de este
supuesto.
Interesantemente, una mayor tasa de proliferación, puede sugerir que el proceso de
plasticidad pancreática comience a desarrollarse en estadíos tempranos y que determine la masa
endocrina expresada en la adultez. Así, para complementar estos resultados, realizamos un
análisis morfométrico del páncreas de animales WT y animales mutantes hyh en estadíos
embrionarios (E 16,5 y E 18,5) y perinatales (PN0, PN1, PN2). Como mencionamos en el marco
teórico de este trabajo, existe evidencia científica que señala que la masa de células endocrinas se
define a temprana edad y este balance se mantiene hacia la adultez. Dado que existe un marcado
aumento en la tasa proliferativa de células endocrinas en los animales mutantes hyh y que
sugerimos que son principalmente células β, realizamos una inmunohistoquímica contra insulina
para observar la modificación en el área endocrina durante el desarrollo (Figura 23)
En el panel de inmunohistoquímica se puede observar que no existen diferencias
importantes en la cantidad de inmunoreacción detectada, sin embargo, al medir el área endocrina
Figura 23. Estudio de compensación en seriados pancreáticos en estadíos embrionarios
(E16.5 y E18.5) y Post-natales (PN1, PN2 y PN4) en los grupos WT y hyh. Imágenes
representativas de los estudios de inmunohistoquímica para insulina en páncreas de animales WT
y hyh. Se puede observar la conformación de los islotes pancreáticos en el transcurso del
desarrollo. Tamaño de las imágenes 20X. Barra de escala 20 µm.

91
total (considerada principalmente por la señal de insulina) se observa que en el caso de los
animales mutantes hyh tiene una tendencia al aumento a medida que avanzamos en edad, lo que
se relaciona con los datos de morfometría adulta (Figura 24).
El conjunto de resultados presentados en este trabajo de investigación, apoyan la
hipótesis que la mutación M105I de α-SNAP disminuye la secreción de insulina desde las células
β pancreáticas, sin embargo, no altera la homeostasis de la glucosa en animales mutantes hyh, ya
que ésta se mantiene a expensas de un efecto compensatorio tisular que se traduce en un mayor
volumen endocrino, producido eventualmente por un mayor índice proliferativo de células
endocrinas, que comienza marcadamente en estadíos perinatales.
Figura 24. Relación de volumen endocrino con las distintas edades del desarrollo. Gráfico de barras que muestra el área (μm²) endocrina promedio de celulas beta en los diferentes estadios (E16.5; E18.5; PN1; PN2; PN4) normalizados respecto al WT (valor 1). Edad embrionara n=3 (WT)/ n=2 (hyh); Edad perinatal n = 3(WT) / n= 4 (hyh)

92
4. DISCUSIÓN
Este trabajo de investigación tiene sus cimientos en los antecedentes preliminares que
señalan que α-SNAP es esencial para la secreción de insulina, in vitro (Nagamatsu et al., 1999);
sin embargo, hasta el momento, se desconoce tanto la función de esta proteína en la secreción
de insulina y la homeostasis de la glicemia in vivo, como el efecto que posee la mutación M105I
en este proceso.
Nagamatsu et al., describieron en 1999 la expresión de α-SNAP en cultivo primario de
islotes pancreáticos y en la línea celular MIN6 (línea celular tipo células beta). A pesar que la
literatura ha demostrado que β-SNAP no se expresa en islotes de Langerhans y sólo se expresa
en tejido nervioso postnatal (Nagamatsu S et al., 1999; Hanley JG, 2002), en este reporte
científico si señalan la expresión de β-SNAP pero en líneas celulares inmortalizadas. ϒ-SNAP
por otro lado, presenta una expresión y distribución ubicua, al igual que α-SNAP, pero no se ha
asociado a una función fisiológica en células beta pancreáticas y tampoco se le ha asociado una
interacción directa con los complejos SNARE (Tani et al., 2003). En esta tesis hemos
caracterizado, por primera vez, la expresión de α-SNAP en páncreas de ratones mutantes hyh,
donde destaca el hipomorfismo en la expresión de α-SNAP y su expresión circunscrita al tejido
endocrino. El hipomorfismo de α-SNAP M105I ya había sido descrito en otros tejidos de ratones
mutantes hyh como cerebro, testículo, y, recientemente, ovario (Bátiz et al., 2009; Arcos et al.,
2017). Sin embargo, no se conocían sus niveles de expresión en páncreas. Por otro lado, es
importante destacar que la mutación M105I provoca alteraciones funcionales intrínsecas en la
poteína en contexto celular (Batiz et al., 2009). Así, ensayos realizados por Chae et al., 2004,
demostraron que la mutación M105I no afecta la función canónica de α-SNAP en ensayos
solubles e in vitro; sin embargo, ensayos en contexto celular realizados por Batiz et al., 2009,

93
demostraron que la mutación M105I afecta la funcionalidad de la proteína en ensayos de reacción
acrosomal. Datos no publicados de nuestro laboratorio sugieren que la mutación M105I afecta
la interacción proteína-proteína y proteína-lípidos de α-SNAP, pudiendo así afectar su eficiencia
funcional en contexto celular.
Tal como se mencionó anteriormente, existen reportes científicos que vinculan a α-
SNAP con la secreción de insulina; sin embargo, en la mayoría de estos reportes se han ocupado
cultivos de líneas celulares como modelo de estudio, por lo cual no se tiene certeza del rol que
cumple α-SNAP en la secreción de insulina in vivo.
En este contexto, las primeras evidencias sobre el rol de la maquinaria de fusión de
membranas dependiente de SNAREs en la exocitosis de gránulos de insulina en células beta
pancreáticas fueron descritas por el grupo de Nagamatsu (1999), donde describen que las células
beta de ratas diabéticas GK presentan una disminución de las proteínas SNAREs: sintaxina 1 y
SNAP-25. Interesantemente, la recuperación de los niveles de ambos SNARES es suficiente para
que las células beta aumenten la secreción de insulina. Por otro lado, se ha observado que
Munc18b y DOC2B, proteínas reguladoras de la maquinaria SNARE, favorecen la fusión de los
gránulos de insulina. Más aún, una depleción de Munc18b y DOC2B se ha asociado a una
reducción en la secreción de insulina estimulada por glucosa (GSIS) y al desarrollo de diabetes
en roedores y humanos (Qin et al., 2017; Aslamy and Thurmond, 2017). Dados estos
antecedentes, se vuelve relevante el rol canónico de α-SNAP (dependiente de NSF) en la
regulación de la maquinaria SNARE y la exocitosis de insulina. Así, por ejemplo, la mutación
M105I podría generar una disminución de la secreción hormonal a causa de su baja expresión
(hipomorfismo) en el tejido pancreático; sin embargo, es importante destacar que no se ha
definido con exactitud si la mutación M105I genera una disminución o ganancia de función en

94
α-SNAP. En algunos casos, como por ejemplo lo descrito por Bátiz et al., 2009, la mutación
M105I de α-SNAP produce una disminución de la reacción acrosomal (función canónica). Por
otro lado, se ha señalado que la mutación M105I genera una ganancia de función en su actividad
fosfatasa (función no canónica), particularmente sobre AMPK (Naydenov et al., 2014). Para
comenzar a caracterizar el rol de α-SNAP y su mutación M105I en la secreción de insulina,
realizamos ensayos de cultivo primarios de islotes de Langerhans donde observamos que la
mutación M105I de α-SNAP, genera una disminución de la secreción de insulina cercana a un
60%, tanto en condiciones basales (2,8 mM de glucosa), como bajo estímulo (16,2 mM de
glucosa). Este efecto, es similar al observado por Nagamatsu (1999), donde el bloqueo de la
expresión de α-SNAP con un oligo antisentido a la secuencia del cDNA de la proteína, genera
la disminución en la secreción de insulina en células MIN6 de aproximadamente un 50%.
Entonces, la mutación M105I de α-SNAP genera, en cultivo primario de islotes de Langerhans
de ratones mutantes hyh, una disminución en la secreción de insulina. Sin embargo, no podemos
definir si esta reducción se debe al hipormofismo y/o a la pérdida de funcionalidad canónica de
la proteína provocada por la mutación M105I.
Considerando estos resultados que evidenciaban que la mutación M105I provoca un
efecto deletéreo en el rol de α-SNAP en la secreción de insulina, se esperaba encontrar que los
animales mutantes hyh presentaran defectos en la homeostasis de la glicemia, con altos niveles
de glucosa en sangre. Sin embargo, al realizar los registros de glicemias basales, pudimos observar
que los ratones hyh son normoglicémicos e incluso presentan una tendencia a la baja de los
valores de glicemias; incluso, si los registros de las glicemias se realizan en condiciones de
alimentación controlada, los valores se mantienen muy cercanos a las condiciones basales, dando
la impresión que a pesar de la ingesta de alimentos, no generan un cuadro hiperglicémico post-
alimentación. La administración oral de alimentos, tiene una incidencia diferente en la

95
homeostasis de la glucosa, dado que se genera la liberación de incretinas, sustancias de origen
peptídico que se producen en el intestino y se liberan en respuesta a la ingestión oral de
nutrientes, sobre todo hidratos de carbono, siendo poderosas secretagogas que aumentan la
liberación de insulina. Dentro de las más descritas están GIP y GLP-1, a quienes se les ha
relacionado con un aumento en la secreción de insulina y además un aumento en la masa de
células beta pancreáticas (Perfetti et al., 2000, (TJ, 2004). En condiciones normales, el efecto
incretinas, produce un aumento de la secreción de insulina para contrarrestar la hiperglicemia
generada por la alimentación. En este contexto, en los animales mutantes hyh podríamos estar
en presencia de un alto “efecto incretinas”, generando una hiperestimulación de la secreción de
insulina tras la alimentación que “compensaría” la menor capacidad secretora de las células beta
pancreáticas hyh, y así mantendría valores de glicemia normales.
Para evitar el efecto incretinas discutido anteriormente, realizamos un Test de
Tolerancia a la glucosa intraperitoneal (TTGIP), donde administramos diferentes
concentraciones de glucosa que van desde 0,5 mg/ml hasta 3 mg/ml. En este test se observó
que en las concentraciones bajas de estímulo, 5 y 10 mg/ml, las curvas de tolerancia a la glucosa
no muestran diferencias significativas en ambos grupos de animales, sin embargo, al aumentar
la dosis de administración a 2 mg/ml, observamos que las curvas de tolerancia comienzan a
separarse en los primeros 30 minutos del ensayo, alcanzando un mayor pico hiperglicémico los
animales mutantes hyh, y que al cabo de 2 horas normalizan sus valores. De igual manera ocurre
con la curva de 3 mg/ml, pero en este caso el efecto de separación de las curvas, es más evidente
y se prolonga en el tiempo. Cabe destacar, que para ninguna de las dosis administradas, existieron
diferencias estadísticamente significativas. Sin duda, estas tendencias estadísticamente no
significativas, podrían ser fisiológicamente significativas. En este contexto, es relevante

96
considerar el mecanismo involucrado en la secreción de insulina y algunas limitaciones de las
técnicas empleadas.
La secreción de insulina es un proceso bifásico que necesariamente involucra la
exocitosis de vesículas de almacenaje (predocking) en la primera fase y en su segunda etapa
requiere de la síntesis de novo de insulina (Daniel et al., 1999; Kwan and Gaisano, 2007); Kasai
et al., 2012). Hace unos años, Park y col., (2014) reportaron que α-SNAP juega un rol importante
en el docking de las membranas, no sólo en el proceso de reclutamiento de NSF para poder
desensamblar los complejos SNARE, sino que es necesaria su participación en la mantención de
las vesículas en docking, disponibles para ser secretadas. El ensayo de secreción de insulina
estimulada por glucosa (GSIS) que se desarrolló en los cultivos primarios de islotes de
Langerhans es un ensayo a tiempo fijo; es decir, sólo se evalúa la liberación de insulina al final
del ensayo, por lo que no es posible evaluar la dinámica de la secreción y, por ende, los menores
niveles de insulina secretados por islotes pancreáticos provenientes de animales mutantes hyh
podrían deberse a un defecto en el docking y fusión de las vesículas secretoras con la membrana
plasmática de células β pancreáticas, o a una alteración de la síntesis de insulina, o bien a ambos
procesos. Para poder determinar el/los proceso/s involucrados en una menor secreción de
insulina en animales mutantes hyh, es necesario disponer de otros ensayos GSIS con perfusión,
donde se mide a tiempo real la liberación de insulina y/o ensayos de amperometría, que
permitirían centrarse en el efecto que tiene la mutación M105I en el docking de vesículas
(Barbosa et al., 1998; Zhang et al., 2005). Si la mutación de α-SNAP redujera los procesos de
docking de las vesículas, los animales hyh responderían más lento frente a una hiperglicemia
aguda, debido a que requieren realizar pasos previos en la dinámica de exocitosis con menor
disponibilidad de proteína. Esta suposición hace sentido en los ensayos de tolerancia a la glucosa
intraperitoneal, donde en concentraciones de 2 y 3 mg/ml observamos que los animales

97
mutantes hyh presentan una separación de la curva respecto al comportamiento de los animales
WT. Si bien, al finalizar ambas curvas, los animales mutantes hyh normalizan sus glicemias, es
interesante centrarse en los minutos iniciales, para entender cómo responden los animales
mutantes hyh frente a un estímulo hiperglicémico agudo. Pues bien, en torno a estos datos,
sugerimos que la mutación M105I de α-SNAP genera un retraso en la respuesta frente a
estímulos agudos de hiperglicemia, que va de la mano con el retraso en el reclutamiento de la
maquinaria SNARE que incluye la participación de α-SNAP o bien la ausencia de una secreción
bifásica de insulina, donde desde el comienzo se requiere de la síntesis de novo de insulina, para
lo cual α-SNAP también debe estar disponible. Cualquiera de las opciones que se mantenga
sostenida en el tiempo (2 hrs.) logra la normalización de los niveles de glucosa.
Por otro lado, y para evaluar de manera indirecta que esta separación de las curvas
observada no se deba a un efecto de resistencia a la insulina en los tejidos periféricos, se
realizaron ensayos de insulinemia basales y tests de tolerancia a la insulina. Si los ratones hyh
presentaran resistencia periférica a la insulina sería esperable que las glicemias normales se
mantengan a expensas de una insulinemia mayor. Sin embargo, y en coincidencia a lo esperado
según los resultados observados en el cultivo primario de islotes de Langerhans, los animales
mutantes hyh tienen una insulinemia 30% menor a la observada en los animales WT. Por otro
lado, en los ensayos de tolerancia a la insulina se observó que los animales hyh responden de
manera similar a los WT, demostrando que no presentan resistencia periférica a la insulina.
Entonces, ¿Por qué los ratones hyh mantienen la homeostasis de la glucosa a pesar de
su deficiente secreción de insulina? ¿Cómo compensan fisiológicamente los mutantes hyh el
efecto de la mutación M105I?

98
Para evaluar los mecanismos compensatorios involucrados decidimos analizar aspectos
generales y particulares del tejido pancreático a través de observaciones histológicas, análisis de
morfometría y estereología. Del modelo hyh, se destaca que es un animal que presenta menor
tamaño y menor peso corporal, destacando que presenta una reducción en el desarrollo del tejido
muscular esquelético y del tejido adiposo blanco, lo que sin duda llama aún más la atención,
considerando que ambos son tejidos importantes para la homeostasis de la glucosa. A pesar de
esto, los animales mutantes hyh no presentan resistencia periférica a la insulina.
En primer lugar, al comparar el tamaño del páncreas en relación al tamaño corporal se
observó que los animales mutantes hyh presentan un tamaño (peso) pancreático mayor respecto
a los animales WT cuando se normaliza por el peso corporal. En este mismo contexto, el análisis
histológico mediante morfometría y estereología permitió observar que los animales mutantes
hyh presentan un aumento de la densidad volumétrica del tejido endocrino que se ve reflejado
fundamentalmente por un mayor número de islotes. Interesantemente, los islotes hyh no se
diferencian en su distribución de tamaño respecto de los WT pero, sin embargo, presentan un
mayor número de células. La caracterización de la distribución de las células endocrinas en los
islotes de Langerhans, permitió observar que la distribución celular dentro de los islotes es
normal, pero en los animales mutantes hyh existe un mayor número de células β. Estos resultados
sugieren fuertemente que en los animales mutantes hyh existe una compensación tisular (mayor
número de islotes, mayor tejido endocrino (células β) que permite mantener la regulación de la
glicemia en valores normales a pesar de la deficiencia en la secreción de insulina. En este
contexto, una de las preguntas que surge es ¿cuáles son los mecanismos que permiten esta
compensación tisular?

99
El páncreas tiene la capacidad de adaptarse a cambios fisiológicos o patológicos,
aumentando o disminuyendo el número de células endocrinas pancreáticas, lo que es
denominado plasticidad pancreática. Estudios de pancreatectomía parcial y ligadura ductal
pancreática en ratones, han demostrado que estos animales logran recuperar un porcentaje de la
masa de células β mediante un aumento del tamaño celular (hipertrofia) y la replicación
(hiperplasia) de estas células; lo cual es acompañado de la expresión de factores de transcripción
involucrados en el desarrollo pancreático embrionario, como la expresión transitoria de PDX1
y Neurogenina 3 (Wang et al.,1995; Puri and Hebrok, 2010; Bonner-Weir et al., 2012). Por otro
lado, se ha demostrado que algunos nutrientes como glucosa, piruvato, leucina, etc. y factores
de crecimiento estimulan la proliferación de las células β (Lingohr et al., 2002), sin dejar de
mencionar el efecto incretinas que se ha visto relacionado directamente con el aumento de
células β (Perfetti et al., 2000; Wideman and Kieffer, 2004). Existen varias hipótesis sobre la
capacidad que tienen las células β de proliferar, ya que por mucho tiempo se creyó que su tasa
de recambio era muy baja y esto explicaba por qué en enfermedades como Diabetes tipo II no
existe una regeneración del tejido. Sin embargo, se ha determinado que la regeneración
pancreática post-natal de células β es un fenómeno que explica en cierta medida la plasticidad
pancreática, y que procedería de la diferenciación de progenitores existentes en la periferia de los
vasos sanguíneos, así como también a apartir de la proliferación de células β maduras (Hill, 2011).
De acuerdo a estas referencias, los estudios de proliferación celular mediante
incorporación de 5-bromo-2-desoxiuridina (BrdU) en páncreas de ratones adultos demostraron
que los animales mutantes hyh presentan una tasa de proliferación celular en los islotes de
Langerhans 5 veces mayor a la que presentan los animales WT. A juzgar por la localización de
las células positivas para BrdU, corresponderían principalmente a células β-pancreáticas. Esta
mayor tasa de proliferación en islotes de Langerhans de animales mutantes hyh, sugiere que éste

100
es uno de los mecanismos compensatorios desarrollados por los animales mutante hyh para
compensar la disfunción de α-SNAP en la secreción de insulina. Es interesante, que aunque la
tasa de proliferación en animales mutantes hyh es elevada, no se desarrollan neoplasias, por lo
que también indica que es un proceso altamente regulado. Ha sido descrito que citoquinas como
IL-1, IFN-γ, TNF-α y leptinas actuarían como inhibidores del crecimiento de las células β
(Nielsen et al, 2001a). Sin duda, el balance generado por el tejido para mantener la proliferación
celular es un mecanismo complejo, donde muy probablemente este tenga su origen durante el
desarrollo embrionario o perinatal y que se mantiene hasta la adultez.
Interesantemente, al evaluar el desarrollo de la masa endocrina en estadíos
embrionarios y perinatales, observamos que existe un aumento del volumen endocrino
progresivo durante el desarrollo, que se hace notoriamente diferente en estadíos postanatales
tempranos. En este contexto, es relevante destacar que el desarrollo del tejido pancreático
endocrino comienza en estadios embrionarios tempranos (E9) donde las células α ya han sido
desarrolladas tras una primera transición regulada por NEUROG3. En una segunda transición
(E13), comienza la generación de células PP y células β alcanzando su máximo en E14,5 (Gittes
et al., 2009; Larsen and Grapin-Botton, 2017). Sin embargo, es importante hacer una distinción
entre conceptos de proliferación y diferenciación celular. La proliferación implica un aumento
en el número de células, que no necesariamente están maduras, en cambio la diferenciación es el
proceso por el cual a partir de progenitores las células tienen la capacidad de diferenciarse en un
tipo celular. Este proceso de diferenciación celular, implica la expresión y el apagado de ciertos
genes, en el caso de las células β pancreáticas, los principales genes intermitentes de este proceso
serían Arx y Pax4, que determinan la masa de células β entre E13- E15 (Afelik and Rovira, 2017).
En la maduración y diferenciación celular que ocurren en las últimas semanas de desarrollo
embrionario (E14-E18) destacan Pdx1, NeuroD1, Pax4, Pax6 y MafA. Pdx1 es importante para

101
el crecimiento de los compartimientos endocrino y exocrino y la maduración de las células β,
teniendo su pico máximo de expresión desde E14; mientras que NeuroD1, Pax4 y Pax6 actuarían
en el desarrollo celular del islote (Artner et al., 2005). MafA participa en la maduración de las
células comenzando su expresión a partir de E13, aumentado sus niveles de expresión en edades
post-natales hasta adulto (Zhu et al., 2017).
Por otro lado, el islote pancreático está dentro de un microentorno conformado por la
matriz extracelular, células mesenquimales, nervios y vasos sanguíneos que interactúan con el
tejido vecino a través de señales solubles e interacciones céula-célula, y con otras rutas neuronales
o circulatorias que afectan la función de la célula β (Roscioni et al., 2016). Por lo tanto,
alteraciones de este nicho (interacciones célula-célula y/o célula-matriz) puede influir en el
comportamiento/diferenciación de las células β y del tejido endocrino en general. En este
contexto, si bien el aumento del tejido endocrino en los animales mutantes hyh puede ser
analizado como una compensación al defecto de las células β en la secreción de insulina, también
podría ser el resultado de una respuesta a una alteración del nicho de los islotes de Langerhans
que consecuentemente compense los defectos en la secreción de insulina. En este contexto,
existen numerosos antecedentes que demuestran que las cadherinas y otras moléculas de
adhesión celular regulan la agregación y funcionalidad de las células β pancreáticas (Cirulli et al.,
1994; Dahl et al., 1996; Hauge-Evans et al., 1999; Rogers et al., 2007). Interesantemente, estudios
previos han demostrado que α-SNAP juega un rol importante en el establecimiento y/o
mantenimiento de las uniones adherentes dependientes de E-cadherina en células epiteliales de
intestino (Naydenov et al., 2012). Por otro lado, en nuestro laboratorio existen antecedentes que
demuestran que la mutación M105I afecta las uniones adherentes dependientes de N-cadherina
en cerebro y en células de la granulosa (Arcos et al., 2017), pudiendo provocar alteraciones en
los procesos de diferenciación y sobrevida celular. En el caso del cerebro, la mutación M105I de

102
α-SNAP altera la distribución subcelular de N-cadherina y debilita las uniones célula-célula entre
las células madre neurales durante el desarrollo embrionario. Este fenómeno provoca una
alteración en la polaridad celular y consecuentemente defectos en el proceso de
proliferación/diferenciación neurogénica que puede llevar a una sobrediferenciación a neuronas.
Así mismo, se ha descrito que la mutación M105I de α-SNAP altera la diferenciación de las
células de Paneth en el intestino (Lechuga et al., 2017). En síntesis, estos antecedentes indican
que defectos en la función de α-SNAP podrían alterar la relación célula-célula durante el
desarrollo del tejido endocrino y afectar su diferenciación, lo cual podría estimular un aumento
de la proliferación/diferenciación de células beta durante el desarrollo del tejido endocrino.
Existen varios factores de transcripción que han sido asociados al proceso de desarrollo
y diferenciación del tejido endocrino. Por ejemplo, existen modelos murinos para diabetes tipo
2 que presentan una disminución en la expresión de factores de transcripción como MafA,
Nkx6.1 y Pdx1, factores que participan en la maduración de las células β. La supresión de Pdx1
en estadios postnatales resultaría en la pérdida del fenotipo de las células β pancreáticas (Remedi
and Emfinger, 2016). Pax4 y Pax6 participan en la diferenciación de de células β/δ (Ueda et al.,
2000) mientras que Arx, de manera antagonista a Pax4, favorece la diferenciación α celular
(Collombat et al., 2003). MafA y MafB tendrían un rol similar en la maduración de estas células
(Hardie et al., 2011; Larsen et al., 2017) NeuroD1 con Pdx1 son factores de transcripción que se
expresan a la semana post-concepción en el humano y de los cuales se sabe que son los
principales factores de transcripción de genes de insulina con un importante rol en el desarrollo
pancreático y diferenciación celular endocrina (Nishimura et al., 2006 ; Jacobson and Tzanakakis,
2017). Sería interesante evaluar a futuro la expresión de estos marcadores en los estadios
perinatales y/o juveniles, ya que posiblemente la sobreexpresión o inhibición de éstos permitiría

103
identificar el momento en el que se pone en marcha y/o el periodo en el que se mantiene el
proceso que da cuenta del aumento de la masa endocrina en los animales mutantes hyh.
Dos aspectos importantes que no han sido estudiados directamente en este trabajo de
investigación pero que influyen directamente en la regulación de la glicemia son: (i) el rol del eje
hipotálamo-hipofisiario, y (ii) la función no canónica de α-SNAP.
El eje hipótalamo-hipofisiario controla diferentes funciones orgánicas y es el centro de
control neuroendocrino por excelencia. El ratón mutante hyh presenta en su fenotipo
alteraciones manifiestas del desarrollo del sistema nervioso central (SNC) que incluyen defectos
del desarrollo cortical, hipoplasia cerebelosa, agenesia del cuerpo calloso e hidroceflia. Esta
última condición se caracteriza por una expansión de los ventrículos laterales, tercer ventrículo
y acueducto de Silvio, los cuales además, se acompañan de desplazamientos en el piso del tercer
ventrículo y deformaciones hipofisiarias (Bátiz et al., 2006). Estos cambios anatómicos a nivel
del SNC podrían generar cambios en las funciones del eje hipotálamo-hipófisis, modificando
con ello el balance neuroendocrino en general. La secreción de insulina postprandial se divide
en tres destinos, por un lado permite la captación de glucosa en el hígado, otro tercio se distribuye
en los tejidos periféricos para el almacenaje de la glucosa y por último, se distribuye a otros
órganos independientes de insulina para la incorporación de glucosa, como por ejemplo, el
cerebro. Muchos estudios han demostrado que el SNC puede modular indirecta y directamente
los principales reguladores de la homeostasis de glucosa: el páncreas, el hígado y los músculos
esqueléticos, tanto así que lesiones en el hipotálamo ventromedial en ratas generan rápidamente
hiperfagia (mayor ingesta de alimentos) y ganancia de peso y niveles anormalmente altos de
insulina basal. Entonces, el SNC controla aspectos claves de la homeostasis de glucosa periférica
mediante el control de diversas señales periféricas que son reconocidas por mecanismos

104
neuronales y endocrinos. Las neuronas del SNC responsables del control anabólico y catabólico
se encuentran en una subregión del hipotálamo ventromedial llamado núcleo arcuato (ARC).
Estas neuronas expresan los péptidos anabólicos neuropéptido Y y el péptido relacionado a
Agouti (AGRP), así como el péptido catabólico proopiomelanocortina, que es un precursor de
numerosos péptidos biológicamente activos, incluyendo la hormona estimulante de melanocitos
alfa (MSH-α) (Schwartz, 2000). Estos péptidos permiten la comunicación con neuronas de
segundo orden en los núcleos paraventricular, dorsomedial, ventromedial y en el hipotálamo
lateral. Estos núcleos proyectan neuronas hacia el cerebro posterior y la periferia,
proporcionando así una ruta de comunicación. Estos circuitos generan un control autónomo,
neurohumoral y somatomotor que participan en respuesta a la saciedad, a la falta de alimentación
y por ende al control energético corporal (Sandoval et al., 2009). La insulina circulante cruza la
barrera hematoencefálica (Schwartz et al., 2000) y contribuye a la regulación de los niveles de
glucosa actuando sobre los receptores de insulina en el hipotálamo basal-medio lo que conlleva
a que disminuya la producción hepática de glucosa y se incremente la captación de glucosa en
tejidos periféricos (Obici et al., 2002). Para el modelo animal hyh, la patología del SNC podría,
ocasionar una disminución del control del SNC, generando un cuadro de hiperglicemia, obesidad
e hiperinsulinemia. Sin embargo, ninguna de estas condiciones son observadas en el ratón
mutante hyh.
En relación al rol no canónico de α-SNAP, se ha determinado que α-SNAP actúa como
fosfatasa de AMPK, modulando su actividad. AMPK es un sensor metabólico, que controla el
estado energético a nivel celular. Su activación es consecuencia del incremento de la razón
(AMP+ADP)/ATP intracelular que favorece su fosforilación por proteínas quinasas, dentro de
las cuales la principal y más estudiada es LKB1 (Hardie, 2011). Por otro lado, la inactivación de
AMPK depende de la actividad de enzimas fosfatasas como proteína fosfatasa 2, sin embargo

105
son muy poco conocidas las fosfatasas a cargo de su regulación (Wang and Brautigan, 2012).
AMPK desempeña un rol clave en la homeostasis de la glucosa, modulando tanto la síntesis y
liberación de insulina, como la disponibilidad de GLUT4 en la membrana plasmática de tejidos
periféricos (Hardie et al., 2012; Wang y Brautigan, 2013). En las células β pancreáticas, la función
de AMPK está regulada directamente por la kinasa LKB1, y la activación de APMK (pAMPK)
participa como un regulador negativo de la síntesis y liberación de insulina. Más aún, se ha
observado experimentalmente que la administración de AICAR (activador de AMPK) a células
MIN6 y a cultivo primario de islotes pancreáticos resulta en una disminución en la liberación de
insulina al medio de cultivo; así mismo, se han descrito resultados inversos al administrar a los
cultivos un inhibidor de AMPK (Compuesto C) en donde se observa un aumento de la liberación
de insulina tras su inactivación (Fu et al., 2013). Además del efecto que tiene AMPK sobre la
secreción de insulina, otros autores han reportado que tiene efectos directos sobre la síntesis de
insulina mediante la vía CRT2/CREB (Fu et al., 2013). Por ende, si contextualizamos esta
referencia con lo observado en nuestro modelo animal, al efecto de una alteración en la dinámica
de secreción (más lento o unifásico) producto del hipomorfismo generado por la mutación
M105I de α-SNAP, le sumamos una disminución de la actividad fosfatasa de α-SNAP, generaría
una hiperactivación de AMPK, que conlleva a una menor síntesis y secreción de insulina.
Interesantemente, resultados preliminares de nuestro laboratorio indican que cultivos de células
madre neurales derivadas de ratones hyh presentan una hiperactivación de AMPK.
No cabe duda que la fisiología pancreática y la regulación de la glicemia es compleja y
que inevitablemente tiene muchas aristas a considerar frente a un conjunto de resultados. Este
trabajo es un aporte al rol de α-SNAP en la secreción de insulina y las consecuencias de la
mutación M105I en este proceso. Más aún, pone en evidencia cómo una célula, un tejido y un
organismo son capaces de poner en marcha mecanismos compensadores que permiten aminorar

106
y hasta revertir los efectos de una mutación. Finalmente, a través de este trabajo de investigación,
se han generado nuevas preguntas, y abierto nuevos enfoques para futuros estudios que permitan
determinar efectos de la mutación M105I de α-SNAP en la homeostasis de la glucosa.

107
5. CONCLUSIONES
α-SNAP es una proteína involucrada en los eventos de exocitosis (rol canónico) y en
otras funciones a nivel celular que permanecen en estudio (rol no canónico). Ha sido descrito
por otros autores previamente, que se expresa de manera ubicua en distintos tipos celulares y en
base a estos antecedentes describimos la expresión de α-SNAP en tejido pancreático a través de
western blot e inmunohistoquímica, donde se observó que en animales mutantes hyh existe el
hipomorfismo descrito en otros órganos para este modelo de estudio, lo que se traduce en una
menor expresión de α-SNAP.
Cuando analizamos la repercusión que tendría la mutación M105I de α-SNAP en la
funcionalidad de la proteína y más aún en la liberación de insulina por parte de las células β,
pudimos concluir que la mutación de α-SNAP produce una alteración en la función celular que
se traduce en una menor liberación de insulina en cultivo primario de islotes de Langerhans, que
se hace más evidente al aplicar un estímulo hiperglicémico. Sin embargo, todos los registros
fisiológicos, señalan que los ratones hyh presentan un balance metabólico normal, a pesar de
mantener algunas diferencias en la dinámica del control de este equilibrio (TTGIP) y de presentar
menores valores de insulinemias, sin dejar de mencionar que no presentan resistencia periférica.
Bajo este contexto, la mutación M105I de α-SNAP, presente desde el desarrollo embrionario
genera un estado metabólico compensado que mantiene los parámetros fisiológicos rangos
normales.
Para analizar este estado compensatorio que presentan los animales mutantes hyh
decidimos evaluar morfometría pancreática, donde se observó que no existen diferencias
significativas en el volumen endocrino de los animales mutantes hyh respecto a los animales WT;

108
sin embargo, es evidente que la mutación M105I de α-SNAP genera una tendencia al aumento
del volumen endocrino que está dado por un mayor número de islotes de Langerhans que a su
vez, presentan una mayor cantidad de células endocrinas. La morfometría realizada a partir de
las inmunohistoquímicas de glucagón e insulina mostraron que las proporciones de células α y β
se mantienen normales, sin embargo, los animales mutantes hyh presentan mayor número de
células β por peso corporal. En este contexto, los ratones mutantes hyh presentarían una
hipofunción de α-SNAP evidencia en los menores niveles de insulina secretado y a su vez
desarrollarían un mecanismo compensatorio a nivel tisular o histológico capaz de contrarrestar
esta hipofunción mediante un aumento de la masa endocrina generada por el mayor número de
islotes pancreáticos acompañado de una mayor proporción de células β, lo que se traduce en una
homeostasis de la glucosa normal.
Tras evaluar la proliferación celular en estadíos adultos, obsevamos que los animales
mutantes hyh poseen una mayor tasa proliferativa, y a juzgar por la ubicación de las células
dentro del islote de Langerhans podrían ser principalmente células β, las cuales comienzan a
proliferar en estadíos perinatales, manteniendo una tasa de proliferación elevada respecto a
animales WT hasta la adultez.
El conjunto de resultados presentados en este trabajo de investigación, apoyan la
hipótesis que la mutación M105I de α-SNAP disminuye la secreción de insulina desde las células
β pancreáticas; sin embargo, no altera la homeostasis de la glucosa en animales mutantes hyh, ya
que ésta se mantiene a expensas de un efecto compensatorio tisular que se traduce en un mayor
volumen endocrino, producido eventualmente por un mayor índice proliferativo de células
endocrinas, que comienza marcadamente en estadíos perinatales.

109
6. BIBLIOGRAFÍA
Afelik S, Rovira M (2017) Pancreatic beta-cell regeneration: Facultative or dedicated progenitors?
Molecular and cellular endocrinology 445:85-94.
Ahlgren JJ, Lena Jonsson,Karin Simu, and Helena Edlund (1998) b-Cell-specific inactivation of
the mouse Ipf1/Pdx1 gene results in loss of the b-cell phenotype and maturity onset
diabetes. GENES & DEVELOPMENT 12:1763–1768.
Akbaraly TN., J Head, K Ritchie, ML Ancelin, A G. Tabak, E Brunner, I Chaudie, M G. Marmot,
J E. Ferrie, M J. Shipley, M Kivimäki (2013) Glycemia, Insulin Resistance, Insulin
Secretion, and Risk of Depressive Symptoms inMiddle Age. Diabetes Care 36:928 - 934.
Arcos A, Paola M, Gianetti D, Acuna D, Velasquez ZD, Miro MP, Toro G, Hinrichsen B,
Munoz RI, Lin Y, Mardones GA, Ehrenfeld P, Rivera FJ, Michaut MA, Batiz LF (2017)
alpha-SNAP is expressed in mouse ovarian granulosa cells and plays a key role in
folliculogenesis and female fertility. Scientific reports 7:11765.
Aslamy A, Thurmond DC (2017) Exocytosis proteins as novel targets for diabetes prevention
and/or remediation? American journal of physiology Regulatory, integrative and
comparative physiology 312:R739-R752.
Bai L, Wang Y, Fan J, Chen Y, Ji W, Qu A, Xu P, James DE, Xu T (2007) Dissecting multiple
steps of GLUT4 trafficking and identifying the sites of insulin action. Cell metabolism
5:47-57.
Barbosa RM SA, Tome AR , Stamford JA, Santos RM and Rosário LM (1998) Control of
pulsatile 5_HTÏinsulin secretion from single mouse pancreatic islets by intracellular
calcium dynamics. Journal of Physiology 510:135-143.
Batiz LF, Paez P, Jimenez AJ, Rodriguez S, Wagner C, Perez-Figares JM, Rodriguez EM (2006)
Heterogeneous expression of hydrocephalic phenotype in the hyh mice carrying a point
mutation in alpha-SNAP. Neurobiology of disease 23:152-168.
Bátiz LF., Michaut M.A., Ramírez AR., Rodríguez F., Ratto MH., Oliver C., Tomes CN.,
Rodríguez EM., Mayorga LS. (2009) Sperm from Hyh Mice Carrying a Point Mutation
in aSNAP Have a Defect in Acrosome Reaction. Plos One 4:1 - 10.

110
Ben-Othman N, Courtney M, Vieira A, Pfeifer A, Druelle N, Gjernes E, Faurite B, Avolio F,
Collombat P (2013) From pancreatic islet formation to beta-cell regeneration. Diabetes
research and clinical practice 101:1-9.
Bisschop PH, and Andries Kalsbeek (2014) Autonomic Regulation of Hepatic Glucose
Production. Comprehensive Physiology 5:147 - 165.
Bonner-Weir S, Guo L, Li WC, Ouziel-Yahalom L, Lysy PA, Weir GC, Sharma A (2012) Islet
neogenesis: a possible pathway for beta-cell replenishment. The review of diabetic
studies : RDS 9:407-416.
Bratanova-Tochkova T K CH, Daniel S, Gunawardana S, Liu YJ, Mulvaney-Musa J,
Schermerhorn T, Straub S G, Yajima H, and Sharp G W G (2002) Triggering and
Augmentation Mechanisms, Granule Pools, and Biphasic Insulin Secretion. DIABETES
51:S83 - S90.
Bronson and Lane (1990) Hydrocephalus with hop gait (hyh): a new mutation on chromosome
7 in the mouse. Developmental Brain Research 54:131-136.
Bryant NJ, Govers R, James DE (2002) Regulated transport of the glucose transporter GLUT4.
Nature reviews Molecular cell biology 3:267-277.
Butler AE, Cao-Minh L, Galasso R, Rizza RA, Corradin A, Cobelli C, Butler PC (2010) Adaptive
changes in pancreatic beta cell fractional area and beta cell turnover in human pregnancy.
Diabetologia 53:2167-2176.
Cefalu W (2001) Novel routes of insulin delivery for patients with type 1 or type 2 diabetes.
Annals of medicine 33:579 - 586.
Collombat P, Mansouri A, Hecksher-Sorensen J, Serup P, Krull J, Gradwohl G, Gruss P (2003)
Opposing actions of Arx and Pax4 in endocrine pancreas development. Genes &
development 17:2591-2603.
Cornejo MP, Hentges ST, Maliqueo M, Coirini H, Becu-Villalobos D, Elias CF (2016)
Neuroendocrine Regulation of Metabolism. Journal of neuroendocrinology 28.
Chae TH, Kim S, Marz KE, Hanson PI, Walsh CA (2004) The hyh mutation uncovers roles for
alpha Snap in apical protein localization and control of neural cell fate. Nature genetics
36:264-270.
Chang L, Chiang SH, Saltiel AR (2004) Insulin signaling and the regulation of glucose transport.
Molecular medicine 10:65-71.

111
Chen S, Wasserman DH, MacKintosh C, Sakamoto K (2011) Mice with AS160/TBC1D4-
Thr649Ala knockin mutation are glucose intolerant with reduced insulin sensitivity and
altered GLUT4 trafficking. Cell metabolism 13:68-79.
Cirulli DB, U. Rutishauser, P. A. Halban, L. Orci and D. G. Rouiller (1994) Expression of neural
cell adhesion molecule (N-CAM) in rat islets and its role in islet cell type segregation.
Journal of Cell Science 107:1429-1436.
Choi K, Kim YB (2010) Molecular mechanism of insulin resistance in obesity and type 2
diabetes. The Korean journal of internal medicine 25:119-129.
Curry DL. (1968) Dynamics of Insulin Secretion by the Perfused Rat Pancreas. Endocrinology
83:572-584.
Dahl H. (1996) Cadherins regulate aggregation of pancreatic b-cells in vivo. Development
122:2895-2902.
Daniel S, Straub S, and Sharp G WG (1999) Identification of the Docked Granule Pool
Responsible for the First Phase of Glucose-Stimulated Insulin Secretion. DIABETES
48:1 - 5.
de Paola M, Bello OD, Michaut MA (2015) Cortical Granule Exocytosis Is Mediated by Alpha-
SNAP and N-Ethilmaleimide Sensitive Factor in Mouse Oocytes. PLoS One
10:e0135679.
Del Prato S MPaBR (2002) Phasic Insulin Release and Metabolic Regulation in Type 2 Diabetes.
DIABETES 51:S109 - S116.
Dhawan S, Georgia S, Tschen SI, Fan G, Bhushan A (2011) Pancreatic beta cell identity is
maintained by DNA methylation-mediated repression of Arx. Developmental cell
20:419-429.
Dodson G. (1998) The role of assembly in insulin's biosynthesis. Current Opinion in Structural
Biology 8:189 - 194.
Dor Y, O I. Martinez & D A. Melton (2004) Adult pancreatic b-cells are formed by self-
duplication rather than stem-cell differentiation. Nature 429:41 -46.
Douglas 0. Clary ICGaJER (1990) SNAPs, a Family of NSF Attachment Proteins Involved in
Intracellular Membrane Fusion in Animals and Yeast. Cell 61:709-721.
Foley K, Boguslavsky S, Klip A (2011) Endocytosis, recycling, and regulated exocytosis of
glucose transporter 4. Biochemistry 50:3048-3061.

112
Fox JE, Seeberger K, Dai XQ, Lyon J, Spigelman AF, Kolic J, Hajmrle C, Joseph JW, Kin T,
Shapiro AM, Korbutt G, MacDonald PE (2013) Functional plasticity of the human
infant beta-cell exocytotic phenotype. Endocrinology 154:1392-1399.
Fu A, Eberhard CE, Screaton RA (2013) Role of AMPK in pancreatic beta cell function.
Molecular and cellular endocrinology 366:127-134.
Fujita H, Hatakeyama H, Watanabe TM, Sato M, Higuchi H, Kanzaki M (2010) Identification
of three distinct functional sites of insulin-mediated GLUT4 trafficking in adipocytes
using quantitative single molecule imaging. Mol Biol Cell 21:2721-2731.
Funai K, Cartee GD (2009) Inhibition of contraction-stimulated AMP-activated protein kinase
inhibits contraction-stimulated increases in PAS-TBC1D1 and glucose transport without
altering PAS-AS160 in rat skeletal muscle. Diabetes 58:1096-1104.
Gembal M (1992) Evidence That Glucose Can Control Insulin Release Independently from Its
Action on ATP-sensitive K+ Channels in Mouse B Cells. Journal Clinical Investigation
89:1288 - 1295.
Gilon P and Henquin JC (1993) Oscillations of Secretion Driven by Oscillations of Cytoplasmic
Ca2+ as Evidencedin Single Pancreatic Islet. The Journal of biological chemistry
268:22265- 22268.
Gittes GK (2009) Developmental biology of the pancreas: a comprehensive review.
Developmental biology 326:4-35.
Gonnissen HK, Hulshof T, Westerterp-Plantenga MS (2013) Chronobiology, endocrinology,
and energy- and food-reward homeostasis. Obesity reviews : an official journal of the
International Association for the Study of Obesity 14:405-416.
Hauge-Evans PES, Shanta J. Persaud, and Peter M. Jones (1999) Pancreatic beta cell to beta cell
Interactions Are Required for Integrated Responses to Nutrient Stimuli. Diabetes
48:1402 - 1408.
Hanley JG, Hanson PI, and Ziff EB (2002) NSF ATPase and a-/b-SNAPs Disassemble the
AMPA Receptor-PICK1 Complex. Neuron 34:53 - 67.
Hardie DG (2011) AMP-activated protein kinase: an energy sensor that regulates all aspects of
cell function. Genes & development 25:1895-1908.
Heinemann L (1993) Clinical pharmacology of human insulin. Diabetes Care 16:90-100.
Hill DJ (2011) Nutritional programming of pancreatic beta-cell plasticity. World journal of
diabetes 2:119-126.

113
Hong HK, Chakravarti A, Takahashi JS (2004) The gene for soluble N-ethylmaleimide sensitive
factor attachment protein alpha is mutated in hydrocephaly with hop gait (hyh) mice.
Proceedings of the National Academy of Sciences of the United States of America
101:1748-1753.
Huang S, Lifshitz LM, Jones C, Bellve KD, Standley C, Fonseca S, Corvera S, Fogarty KE,
Czech MP (2007) Insulin stimulates membrane fusion and GLUT4 accumulation in
clathrin coats on adipocyte plasma membranes. Molecular and cellular biology 27:3456-
3469.
Hunter SJ. (1998) Insulin action and insulin resistance: diseases involving defects in insulin
receptors, signal transduction, and the glucose transport effector system. The American
Journal of Medicine 105:331-345.
Jacobson EF, Tzanakakis ES (2017) Human pluripotent stem cell differentiation to functional
pancreatic cells for diabetes therapies: Innovations, challenges and future directions.
Journal of biological engineering 11:21.
Jouvet N, Estall JL (2017) The pancreas: Bandmaster of glucose homeostasis. Experimental cell
research 360:19-23.
Kangawa MKaK (2005) Ghrelin: Structure and Function. Physiology Review 85:495 - 522.
Kasai H. and Hiroshi Tokumaru (2012) DISTINCT INITIAL SNARE CONFIGURATIONS
UNDERLYING THE DIVERSITY OF EXOCYTOSIS. Physiology Review 92:1915-
1964.
Kawanishi M, Tamori Y, Okazawa H, Araki S, Shinoda H, Kasuga M (2000) Role of SNAP23
in Insulin-induced Translocation of GLUT4 in 3T3-L1 Adipocytes. Journal of Biological
Chemistry 275:8240-8247.
Kiraly-Borri AM, Robert D. Burgoyne, Ulrich WELLERŒ, Claes B. WOLLHEIMand Jochen
Lang (1996) Soluble N-ethylmaleimide-sensitive-factor attachment protein and N-
ethylmaleimide-insensitive factors are required for Ca2+-stimulated exocytosis of
insulin. Biochemical Journal 314:199 - 203.
Kramer HF, Witczak CA, Taylor EB, Fujii N, Hirshman MF, Goodyear LJ (2006) AS160
regulates insulin- and contraction-stimulated glucose uptake in mouse skeletal muscle.
The Journal of biological chemistry 281:31478-31485.
Kwan EP, Gaisano HY (2007) New insights into the molecular mechanisms of priming of
insulin exocytosis. Diabetes, obesity & metabolism 9 Suppl 2:99-108.

114
Lammert E (2009) Cell-cell interactions in the endocrine pancreas. Diabetes, obesity &
metabolism 11 Suppl 4:159-167.
Larance M, Ramm G, Stockli J, van Dam EM, Winata S, Wasinger V, Simpson F, Graham M,
Junutula JR, Guilhaus M, James DE (2005) Characterization of the role of the Rab
GTPase-activating protein AS160 in insulin-regulated GLUT4 trafficking. The Journal
of biological chemistry 280:37803-37813.
Larsen HL, Grapin-Botton A (2017) The molecular and morphogenetic basis of pancreas
organogenesis. Seminars in cell & developmental biology 66:51-68.
Lechuga S, Naydenov NG, Feygin A, Jimenez AJ, Ivanov AI (2017) A vesicle trafficking protein
alphaSNAP regulates Paneth cell differentiation in vivo. Biochemical and biophysical
research communications 486:951-957.
Lefebvre B, Vandewalle B, Balavoine AS, Queniat G, Moerman E, Vantyghem MC, Le Bacquer
O, Gmyr V, Pawlowski V, Kerr-Conte J, Pattou F (2012) Regulation and functional
effects of ZNT8 in human pancreatic islets. The Journal of endocrinology 214:225-232.
Leney SE, Tavare JM (2009) The molecular basis of insulin-stimulated glucose uptake: signalling,
trafficking and potential drug targets. The Journal of endocrinology 203:1-18.
Martin LB, Shewan A, Millar CA, Gould GW, James DE (1998) Vesicle-associated Membrane
Protein 2 Plays a Specific Role in the Insulin-dependent Trafficking of the Facilitative
Glucose Transporter GLUT4 in 3T3-L1 Adipocytes. Journal of Biological Chemistry
273:1444-1452.
Melissa K. Lingohr RBaCJR (2002) Pancreatic β-cell growth and survival a role in obesity-linked
type 2 diabetes? TRENDS in Molecular Medicine 8:375 - 384.
Merkel RPaP (2000) Glucagon-like peptide-1: a major regulator of pancreatic b-cell function.
European Journal of Endocrinology 143:717 - 725.
Mihaylova MM, Shaw RJ (2011) The AMPK signalling pathway coordinates cell growth,
autophagy and metabolism. Nature cell biology 13:1016-1023.
Moore MC, Coate KC, Winnick JJ, An Z, Cherrington AD (2012) Regulation of hepatic glucose
uptake and storage in vivo. Advances in nutrition 3:286-294.
Moreau K, Ravikumar B, Renna M, Puri C, Rubinsztein DC (2011) Autophagosome precursor
maturation requires homotypic fusion. Cell 146:303-317.

115
Nagamatsu S, Yoko Nakamichi, Takashi Watanabei, Hiroshi Katahira, Hiroki Sawa, and Kimio
Akagawa (1996) Expression and Functional Role of Syntaxin 1/HPC-1 in Pancreatic b
Cells. The Journal of biological chemistry 271:1160 - 1165.
Nagamatsu S, Yoko Nakamichi, Chiyono Yamamura, Kimiko Tsuzuki, and Satsuki Matsushima
(1999a) a-Soluble N-Ethylmaleimide-sensitive Factor Attachment Protein Is Expressed
in Pancreatic b Cells and Functions in Insulin but Not g-Aminobutyric Acid Secretion.
The Journal of biological chemistry 274:8053–8060.
Nagamatsu S, Chiyono Yamamura, Satsuki Matsushima, Takashi Watanabe, Sachihiko Ozawa,
Hisasi Furukawa, and Hitoshi Ishida (1999b) Decreased Expression of t-SNARE,
Syntaxin 1, and SNAP-25 in Pancreatic b-Cells Is Involved in Impaired Insulin Secretion
From Diabetic GK Rat Islets. Diabetes 48:2367 - 2373.
Nagamatsu S (1999) a-SNAP Functions in Insulin Exocytosis from Mature, but Not Immature
Secretory Granules in Pancreatic b Cells. Biochemical and Biophysical Research
Communications 260:127 - 132.
Naydenov NG, Harris G, Morales V, Ivanov AI (2012) Loss of a membrane trafficking protein
alphaSNAP induces non-canonical autophagy in human epithelia. Cell cycle 11:4613-
4625.
Naydenov NG, Feygin A, Wang L, Ivanov AI (2014) N-ethylmaleimide-sensitive factor
attachment protein alpha (alphaSNAP) regulates matrix adhesion and integrin processing
in human epithelial cells. The Journal of biological chemistry 289:2424-2439.
Neumiller JJ and Setter J (2009) Pharmacologic Management of the Older Patient With Type 2
Diabetes Mellitus. The American Journal of Geriatric Pharmacotherapy 7:321 - 342.
Nielsen EDG, Annette Møldrup, Birgitte Nissen Friedrichsen, Nils Billestrup, Johnny A.
Hansen, Ying C. Lee, and Carina Carlsson (2001a) Regulation of -Cell Mass by
Hormones and Growth Factors. DIABATES 50:s25 - s29.
Nielsen EDG, Annette Møldrup, Birgitte Nissen Friedrichsen, Nils Billestrup, Johnny A.
Hansen, Ying C. Lee, and Carina Carlsson (2001b) Regulation of Cell Mass by Hormones
and Growth Factors. Diabetes 50.
Obici S, Zhang BB, Karkanias G, Rossetti L (2002) Hypothalamic insulin signaling is required
for inhibition of glucose production. Nature medicine 8:1376-1382.

116
Ohara-Imaizumi M, Fujiwara T, Nakamichi Y, Okamura T, Akimoto Y, Kawai J, Matsushima S,
Kawakami H, Watanabe T, Akagawa K, Nagamatsu S (2007) Imaging analysis reveals
mechanistic differences between first- and second-phase insulin exocytosis. The Journal
of cell biology 177:695-705.
Oho C, Takahashi M (1995) Expression and complex formation of soluble N-ethyl-maleimide-
sensitive factor attachment protein (SNAP) receptors in clonal rat endocrine cells.
Neuroscience Letter 186:208-210.
Park Y, Vennekate W, Yavuz H, Preobraschenski J, Hernandez JM, Riedel D, Walla PJ, Jahn R
(2014) alpha-SNAP interferes with the zippering of the SNARE protein membrane
fusion machinery. The Journal of biological chemistry 289:16326-16335.
Pørksen N HM, Juhl C, Butler P, Veldhuis JD and Schmitz O (2002) Pulsatile Insulin Secretion:
Detection, Regulation, and Role in Diabetes. diabetes 51:s245 - s254.
Prentki SV, M. Clay Glennon, Romano Regazzi, Jude T. Deeney, Barbara E. Corkey (1992)
Malonyl-CoA and Long Chain Acyl-CoA Esters as Metabolic Coupling Factors in
Nutrient-induced Insulin Secretion* The Journal of biological chemistry 267:5802-5810.
Puri S, Hebrok M (2010) Cellular plasticity within the pancreas--lessons learned from
development. Developmental cell 18:342-356.
Qin T, Liang T, Zhu D, Kang Y, Xie L, Dolai S, Sugita S, Takahashi N, Ostenson CG, Banks
K, Gaisano HY (2017) Munc18b Increases Insulin Granule Fusion, Restoring Deficient
Insulin Secretion in Type-2 Diabetes Human and Goto-Kakizaki Rat Islets with
Improvement in Glucose Homeostasis. EBioMedicine 16:262-274.
Rizza RA., M. W. Haymond, and J. E. Gerich (1980) Adrenergic Mechanisms of Catecholamine
Action on Glucose Homeostasis in Man. Metabolism 29:1155 - 1163.
Rizza RA., P. Cryer, C. Verdonk, and J. Gerich (1982) Stimulation of Human Pancreatic
Polypeptide Secretion by Hypoglycemia Is Independent of Adrenergic Mechanisms.
Journal of Clinical Endocrinology and Metabolism 55:1234 - 1236.
Reaven G (2004) The metabolic syndrome or the insulin resistance syndrome? Different names,
different concepts, and different goals. Endocrinology and metabolism clinics of North
America 33:283-303.
Remedi MS, Emfinger C (2016) Pancreatic beta-cell identity in diabetes. Diabetes, obesity &
metabolism 18 Suppl 1:110-116.

117
Roder PV, Wu B, Liu Y, Han W (2016) Pancreatic regulation of glucose homeostasis.
Experimental & molecular medicine 48:e219.
Rogers R. (2007) E-Cadherin and Cell Adhesion: a Role in Architecture and Function in the
Pancreatic Islet. Cellular physiology and biochemistry : international journal of
experimental cellular physiology, biochemistry, and pharmacology 19:987-994.
Roh E, Song DK, Kim MS (2016) Emerging role of the brain in the homeostatic regulation of
energy and glucose metabolism. Experimental & molecular medicine 48:e216.
Rooman LB. (2005) Regulation of Pancreatic Beta-Cell Mass. Physiology Review 85:1255-1270.
Rorsman P, Renström E, Gromada J, Barg S, Göpel S. (2000) The Cell Physiology of Biphasic
Insulin Secretion. New in Physiological sciences 15:72-77.
Roscioni SS, Migliorini A, Gegg M, Lickert H (2016) Impact of islet architecture on beta-cell
heterogeneity, plasticity and function. Nature reviews Endocrinology 12:695-709.
Rubinsztein DC, Marino G, Kroemer G (2011) Autophagy and aging. Cell 146:682-695.
Sandoval DA, Obici S, Seeley RJ (2009) Targeting the CNS to treat type 2 diabetes. Nature
reviews Drug discovery 8:386-398.
Schwartz MW (2000) Staying Slim with Insulin in Mind. Science 289:2066-2067.
Seino S, Shibasaki T, Minami K (2011) Dynamics of insulin secretion and the clinical
implications for obesity and diabetes. The Journal of clinical investigation 121:2118-
2125.
Seargent RJ and Paquet MR. (1993) Effect of insulin on the rates of synthesis and degradation
of GLUT1 and GLUT4 glucose transporters in 3T3-L1 adipocytes. Biochemical Journal
290:913 - 919.
Shih CC, Shlau MT, Lin CH, Wu JB (2014) Momordica charantia ameliorates insulin resistance
and dyslipidemia with altered hepatic glucose production and fatty acid synthesis and
AMPK phosphorylation in high-fat-fed mice. Phytotherapy research : PTR 28:363-371.
Sidney W Whiteheart ICG, Michael Brunner, Douglas O Clary, Thomas Mayer, Susan A Buhrow
and James E Rothman (1993) SNAP family of NSF attachment proteins includes a brain
specific isoform. Nature Publishing group 362:353 - 355.
Skarstrand H, Lernmark A, Vaziri-Sani F (2013) Antigenicity and epitope specificity of ZnT8
autoantibodies in type 1 diabetes. Scandinavian journal of immunology 77:21-29.
Söllner T , Brunner M, Erdjument-Bromage H, Geromanos S, Tempst P and Rothman J E
(1993) SNAP receptors implicated in vesicle targeting and fusion. Nature 362:318 - 323.

118
ST-Denis J-PC, Samuel W. Cushman and Paul A. Roche (1999) SNAP-23 participates in SNARE
complex assembly in rat adipose cells. Biochemical Society 338:709 - 715.
Stanger BZ, Hebrok M (2013) Control of cell identity in pancreas development and regeneration.
Gastroenterology 144:1170-1179.
Tani K, Shibata M, Kawase K, Kawashima H, Hatsuzawa K, Nagahama M, Tagaya M (2003)
Mapping of functional domains of gamma-SNAP. The Journal of biological chemistry
278:13531-13538.
Thorel F, Nepote V, Avril I, Kohno K, Desgraz R, Chera S, Herrera PL (2010) Conversion of
adult pancreatic alpha-cells to beta-cells after extreme beta-cell loss. Nature 464:1149-
1154.
Torrejon-Escribano B, Escoriza J, Montanya E, Blasi J (2011) Glucose-dependent changes in
SNARE protein levels in pancreatic beta-cells. Endocrinology 152:1290-1299.
Treebak JT, Glund S, Deshmukh A, Klein DK, Long YC, Jensen TE, Jorgensen SB, Viollet B,
Andersson L, Neumann D, Wallimann T, Richter EA, Chibalin AV, Zierath JR,
Wojtaszewski JF (2006) AMPK-mediated AS160 phosphorylation in skeletal muscle is
dependent on AMPK catalytic and regulatory subunits. Diabetes 55:2051-2058.
Ueda Y (2000) Activin A increases Pax4 gene expression in pancreatic β cell lines. FEBS Letters
480:101-105.
Unger RH. (1978) Insulin, Glucagon and Somatostatin secretion in the regulation of metabolism.
Annual Reviews Physiology 40:307-343.
Volchuk YM, Lijing He, Zhi Liu, Ernst Habermman, William Trimble and Amira Klip (1994)
Expression of vesicle-associated membrane protein 2 (VAMP-2)/synaptobrevin 11 and
cellubrevin in rat skeletal muscle and in a muscle cell line. Biochemical Journal 304:139-
145.
Volchuk QW, H. Stephen Ewart, Zhi Liu, Lijing He, Mark K. Bennett,t and Amira Klip (1996)
Syntaxin 4 in 3T3-L1 Adipocytes: Regulation by Insulin and Participation in Insulin-
dependent Glucose Transport. Molecular Biology of the Cell 7:1075-1082.
Wang L, Brautigan DL (2013) alpha-SNAP inhibits AMPK signaling to reduce mitochondrial
biogenesis and dephosphorylates Thr172 in AMPKalpha in vitro. Nature
communications 4:1559.

119
Weyer CB, David M. Mott, and Richard E. PratleyWeyer (1999) The natural history of insulin
secretory dysfunction and insulin resistance in the pathogenesis of type 2 diabetes
mellitus. The Journal of clinical investigation 104:787 - 794.
Wideman RD and Kieffer TJ. (2004) Glucose dependent Insulinotropic Polypeptide as a
regulator of beta cell function and fate. Hormonal Metabolic Research 36:782 - 786.
Wilcox G (2005) Insulin and Insulin Resistance. Clinical Biochemistry Review 26:19 - 39.
Wild MB, G Roglic, A Green, R Sicree, H King (2004) Global Prevalence of Diabetes. Diabetes
Care 27:1047 - 1053.
Winder WW (2001) Energy-sensing and signaling by AMP-activated protein kinase in skeletal
muscle. Journal of Applied Physiology 91:1017-1028.
Wirawan E, Lippens S, Vanden Berghe T, Romagnoli A, Fimia GM, Piacentini M, Vandenabeele
P (2012) Beclin1: a role in membrane dynamics and beyond. Autophagy 8:6-17.
Wu ZZ, Sun NK, Chien KY, Chao CC (2011) Silencing of the SNARE protein NAPA sensitizes
cancer cells to cisplatin by inducing ERK1/2 signaling, synoviolin ubiquitination and
p53 accumulation. Biochemical pharmacology 82:1630-1640.
Zawalich WS, Yamazaki H, Zawalich KC (2008) Biphasic insulin secretion from freshly isolated
or cultured, perifused rodent islets: comparative studies with rats and mice. Metabolism:
clinical and experimental 57:30-39.
Zhang M. (2005) Insulin Oxidation and Determination at Carbon Electrodes. Analytical
Chemistry 77:6396 - 6401.
Zhu Y, Liu Q, Zhou Z, Ikeda Y (2017) PDX1, Neurogenin-3, and MAFA: critical transcription
regulators for beta cell development and regeneration. Stem cell research & therapy
8:240.