Ogni globina ha una tasca in cui lega un gruppo EME...
Transcript of Ogni globina ha una tasca in cui lega un gruppo EME...

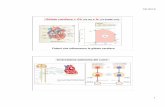
Emoglobina (Hb): tetramero (le globine si associano formando due copie di dimeri αβ (α1β1 e α2β2) che si associano a formare un tetramero attraverso interazioni idrofobiche, legami H e ponti salini che si formano nell’interfaccia α1β1
e α2β2 e α1β2 e α2β1
Ogni globina α possiede 7 α-eliche
Ogni globina β possiede 8 α-eliche
Ogni globina ha una tasca in cui lega un gruppo EME,quindi l’Hb può legare e trasportare 4 molecole di O2
2 catene globiniche α e 2 catene globiniche β

1,00
0.75
0.50
0.25
0.0
Y
20,0 40,0 60,0 80,0
pO2 (mmHg)
Graficamente la relazione esistente fra Y e pO2 è rappresentato da una CURVA DI OSSIGENAZIONE SIGMOIDALE, infatti il legame Hb/O2 è di tipo COOPERATIVO.
a) L’AFFINITA’ DELL’Hb PER L’OSSIGENO AUMENTA MANO A MANO CHE LE MOLECOLE DI O2
OCCUPANO I GRUPPI EME.
b) Esiste una cooperatività positiva fra i siti di legame dell’ossigeno (fra i gruppi EME)
c) Il legame di 1 molecola di O2 ad un gruppo EME facilita il legame di altre molecole di O2
agli altri gruppi EME
Hb a bassa affinità, poco ossigenataSTATO T
Hb semisatura, con minime variazioni di pO2 si deossigena e si ossigena quasi completamente
p50 ~ 26 mm Hg, valore dipO2 che satura il 50% dei sitidi legame dell’Hb
Hb ad alta affinità, raggiunge la saturazione
(STATO R)

Qual’è il vantaggio per un organismo vivente nel possedere una proteina respiratoria che lega l’O2 in modo cooperativo?
Hbrilascia e lega efficientemente
l’ossigeno
HbMb
1,00
0.75
0.50
0.25
0.0
Y
pO2 (mmHg)20,0 40,0 60,0 80,0 100,0
pO2 presente nei capillari tissutali
pO2 presente nei capillari polmonari

Il grado di ossigenazione della Hb dipende dalla pO2 e dalla Kdiss
del complesso Hb(O2)4.
Frazione di saturazione:
Kdiss = p50n
Hb + 4[O2] Hb[O2]4Hb + 4[O2] Hb[O2]4
[Hb(O2)4]Y =
[Hb(O2)4] + [Hb]
[Hb(O2)4]Y =
[Hb(O2)4] + [Hb]
[Hb(O2)4]Y =
[Hb(O2)4] + [Hb]
pO2
Y = p50 + pO2
4
4 4
pO2
Y = p50 + pO2
4
4 4
La Frazione di saturazione è legata alla pO2 e alla Kdiss
secondo la seguente relazione:
pO24
Y = Kdiss+ pO2
4
pO24
Y = Kdiss+ pO2
4
pO24
Y = Kdiss+ pO2
4
n
n n
pO2
Y=p50 + pO2
n
n n
pO2
Y=p50 + pO2
Equazione di HILL

Le diverse emoproteine (per es. le diverse varianti di Hb prodotte a causa di mutazioni)possono avere un grado di cooperatività differente. Il termine “n” dà la misura dellacooperatività
In realtà in condizioni fisiologiche nH dell’Hb è ~ 31< nH <n >> la proteina è Cooperativa e subisce una transizione fra stato a bassa affinità e stato ad alta affinità, per cui, nello stesso momento, avremmo una miscela di molecole di Hb completamente ossigenate, altre non ossigenate e altre parzialmente ossigenate.
nH = 1 >> Non cooperativa (Mb)
nH < 0 >> Cooperatività negativa
n
n n
pO2
Y=p50 + pO2
n
n n
pO2
Y=p50 + pO2
La proteina è completamente cooperativa se il n° dei siti di legame è uguale al coefficiente di Hill, cioè n = nH
Se l’Hb avesse nH = 4 vorrebbe dire che tutte le molecole di Hb sono o completamente legate o completamente dissociate e il legame con l’O2 è
contemporaneo in tutti i siti.

α1
β1 α2
β2
STATO THb a bassa affinità
+ O2
Legame con la molecola di O2 >> cambia la struttura 3aria
della subunità legata
CON LA PARZIALE OSSIGENAZIONE (almeno un sito occupato dall’O2 in ciascuno dei 2 dimeri αβ) L’INTERA
PROTEINA VA INCONTRO AD UNA MODIFICAZIONE DELLA SUA STRUTTURA 4aria ASSUMENDO UNA STRUTTURA PIU’
DISPONIBILE AD ACCETTARE ALTRE MOLECOLE DI O2 .
α1
β1 α2
β2α1
β1 α2
β2
α1
β1 α2
β2
α1
β1 α2
β2
α1
β1 α2
β2
α1
β1 α2
β2
α1
β1 α2
β2
α1
β1 α2
β2
+ O2
+ O2
α1
β1 α2
β2
+ O2
α1
β1 α2
β2
STATO RALTA AFFINITA’
Transizione completa: quando sono occupati gli ultimi siti ormai tutte le molecole di Hb sono nella
forma ad alta affinità

La cooperatività di legame dell’emoglobina è possibile perché lo stato di ossigenazione di un sito può essere comunicato agli altri siti attraverso
un cambiamento della conformazione proteica dell’Hb.
L’Hb passa da uno stato conformazionale a bassa affinità per l’O2
ad uno stato conformazionale ad alta affinità in funzione della concentrazione di O2 (pO2).
IL LEGAME CON L’O2 MODIFICA LA STRUTTURA DELLA PROTEINA
DEOSSI-Hb >> stato T >> conformazione a bassa affinitàOSSI-Hb >> stato R >> conformazione ad alta affinità
PER PASSARE DALLO STATO A BASSA AFFINITÀ A QUELLO AD ALTA AFFINITÀ L’ HB SUBISCE
UNA TRANSIZIONE ALLOSTERICA.
L’Hb è una proteina ALLOSTERICA.

L’Hb è una proteina ALLOSTERICA.
1) Ha più siti di legame per il suo ligando
1) Il ligando è un effettore omoallosterico: occupando uno dei siti di legame della proteina influisce sull’affinità degli altri siti liberi
2) Il legame proteina/ligando causa sempre una modificazione della struttura 3aria e anche della struttura 4aria della proteina che
modifica la sua affinità nei confronti del ligando stesso.
3) Ha siti di legame per altri ligandi che agiscono come molecole regolatrici (effettori eteroallosterici) che influenzano l’affinità
della proteina verso il suo ligando
4) La modulazione e il legame proteina/effettori è sempre REVERSIBILE

Il legame fra l’EME e l’O2 produce il cambiamento strutturale nella proteina.
His93 F8
Ossi-Hb: Il Fe2+, è trascinato all’interno dell’EME pereffetto del legame con l’O2, nel muoversi si tiradietro tutta l’elica F e i segmenti adiacenti rompendole interazioni che stabilizzavano lo stato T.
His64, E7
EME convesso EME
appiattito
|||||
Deossi-Hb:Il legame con l’His prossimale trascina il Fe2+ al di sopra del piano dell’EME.

LA DEOSSI-HB (STATO T) ÈSTABILIZZATA DA UNARETE DI LEGAMIIDROGENO E INTERAZIONIIONICHE INTRA- E INTER-CATENA.
COSA SUCCEDE ALLA STRUTTURA DELLA EMOGLOBINA QUANDO AVVIENE LA TRANSIZIONE T↔ R
Ponti salini molto importanti coinvolgono l’His146 delle catene β che interagisce con l’Asp94 e con la Lys40 delle catene αper mezzo del suo gruppo carbossi-terminale
C-term.
Lys C5 o 40 His HC3
o 146
Asp FG1 o 94

(146)
(146)
Quando l’Hb inizia a ossigenarsi, il legame EME/O2 provoca un CAMBIAMENTO sia DELLA STRUTTURA TERZIARIA sia DELLA QUATERNARIA: un dimero α/β ruota e
scivola rispetto all’altro dimero α/β , questo movimento distorce e indebolisce la rete di legami H e ponti salini che stabilizza o stato T, le catene beta si avvicinano e si
restringe la cavità centrale
(146)
Nello stato R l’estremità C-terminale (His-146, HC3) delle catene β è ruotato verso la cavità centrale e non può più formare ponti salini

Effettori allosterici dell’emoglobina
O2
H+ (pH)CO2
2,3-bisfosfoglicerato
Regolano la transizione allosterica tra stato ad alta affinità e bassa affinità, aumentando l’efficienza dell’Hb nel rilasciare ossigeno ai tessuti.
EFFETTO BOHR
La diminuzione di pH nei capillari abbassa l’affinità dell’Hb verso l’O2 rendendone più efficiente il rilascio.La p50 sale a ~ 40 mm Hg
TESSUTI
POLMONI
Hb · 4O2 + nH+ Hb · nH+ + 4O2Hb · 4O2 + nH+ Hb · nH+ + 4O2

COME SPIEGARE IL MECCANISMO DELL’EFFETTO BOHR?
+-
-
+
COO- terminale delle catene β
(catene β)
La DEOSSI-Hb ha un pI più alto della OSSI-Hb, lega gli ioni H+ con maggiore affinità. L’Hb ha vari siti di legame per gli ioni H+ come:1) ammino-gruppi N-terminali delle catene alfa 2) His 146 (residuo C-terminale delle catene β).
DEOSSI-Hb DEOSSI-Hb: His-146 (C-terminale delle catene β) ha un pKa anormalmente elevato (> 7.2).Poiché nei capillari tissutali il pH scende a ~6.8: l’His-146 si trova nella sua forma PROTONATA e forma un ponte salino intra-catena con l’Asp 94, che stabilizza la forma T deossi.

OSSI-Hb: il pKa dell’His 146 scende a ~6.5 a causa della transizione dallo stato T a quello R Nel pH del sangue circolante (7.2) o dei capillari polmonari (7.6), l’His sarà quasi del tutto DEPROTONATA e non formerà più il ponte salino. Questo contribuisce al cambiamento strutturale che favorisce l’ossigenazione completa della Hb.
Hl146
¯ OOC―C ―
lCH2
l H
C―N
CH
C―N
H H
+
Hl146
¯ OOC―C ―
lCH2
l H
C―N
CH
C―N
H H
+
Hl94
―C ―lCH
2
lC=OlO-
Hl94
―C ―lCH
2
lC=OlO-

La CO2 viene liberata nel circolo sanguigno a livello periferico durante i processi metabolici cellulari. La CO2 è trasportata nel sangue in tre forme:
1) disciolta: obbedisce alla Legge di Henry come l'O2 ma è 20 volte più solubile di questo. In questa forma costituisce il 10% del gas liberato dal sangue venoso nel polmone.
2) Diffonde all’interno degli eritrociti dove:
CO2 + H2O HCO3- + H+ (ANIDRASI CARBONICA)
Gli ioni H+ si legano alla DEOSSI-Hb (che è meno acida dellaforma ossigenata ed è quindi unaccettore di protoni migliore)
il bicarbonato quando aumenta di concentrazione diffonde dal globulo rosso al plasma scambiandosi con ioni Cl-
Contribuisce all’effetto BOHR e quindi al rilascio di O2e aumenta la capacità del sangue di trasportare H+ e CO2 (effetto HALDANE)
ANIDRIDE CARBONICA (CO2)


3) La CO2 in parte si lega all’Hb alle estremità N-terminali libere delle catene globiniche β formando CARBAMMATI = gruppi carichi negativamente che stabiliscono interazioni elettrostatiche con i residui di Arg-141 delle catene α stabilizzando la forma T

CONCENTRAZIONE CO2 Effettore allosterico negativo per l’Hb
1,00
0.75
0.50
0.25
0.0
Y
20,0 40,0 60,0 80,0 100,0
pO2 (mmHg)
Se la pCO2 diminuiscel’affinità aumenta(p50 + bassa) Se la pCO2 aumenta
l’affinità diminuisce(p50 + alta)

2,3-bisfosfoglicerato
È presente nel citoplasma degli eritrociti (ad
una concentrazione ~ 5 mM), dove si forma a
partire dall’1,3-bisfosfoglicerato (intermedio
della glicolisi)
È un effettore allosterico negativo, come gli
ioni H+ e la CO2.
Il 2,3-BPG si lega fortemente alla DEOSSI-Hb
stabilizzando la forma T.
Il 2,3-BPG si lega saldamente nella cavità centrale dell’Hb fra le 4 catene
globiniche nell’Hb DEOSSIGENATA stabilizzandola e riducendo l’affinità
per l’O2

β2
β1α2
α1
+
+
+
+++
+
--
-
Il 2,3-BPG forma interazioni elettrostatiche con gruppi carichi positivamente chesporgono nella cavità centrale della DEOSSI-Hb:NH3
+ N-terminaleLys-82 delle 2 catene βHis-143His-2
ciò rafforza i ponti salini della forma T dell’Hb.
Quando l’Hb lega la prima molecola di O2 si innesca il cambiamentoconformazionale che distrugge i ponti salini, la cavità centrale si restringe e il 2,3-BPG viene espulso.

Se negli eritrociti non ci fosse il 2,3-BPG la curva di ossigenazionedell’Hb diventerebbe iperbolica, l’Hb legherebbe l’O2 in modo noncooperativo
Il 2,3-BPG modula l’ossigenazione dell’Hb in funzione delle condizioni ambientali
in alta montagna >> basse pO2 adattamento alla carenza di ossigeno nei tessuti. Gli eritrociti aumentano la
produzione di 2,3-BPG,>> diminuisce l’affinità dell’Hb per l’O2 (aumenta la p50)>> aumenta il rilascio di O2 ai tessuti che altrimenti non sarebbero sufficientemente ossigenati

Emoglobina fetale: α2γ2Le catene γ hanno un residuo di Ser al posto dell’His-143, manca una coppia di interazione ionica che stabilizza il complesso 2,3-BPG-deossiHb

Le mutazioni alterano la strutturae la funzione dell'emoglobina
Sono state scoperte più di 1000 forme mutanti dell’Hb, spesso con 1 unica sostituzione amminoacidica, non tutte le varianti emoglobiniche conducono a sintomi clinici.
ca il 5% della popolazione mondiale possiede almeno una variante emoglobinica

Eritrociti umani normali Eritrociti umani falciformi
Nell’anemia falciforme viene prodotta Hb-S nella quale il residuo di Glu in posizione 6 delle catene β è sostituito da un residuo di Val.
Nella Deossi-Hb-S questo residuo di Val costituisce un “punto appiccicoso” esposto sulla superficie del tetramero, infatti va ad inserirsi in una tasca idrofobica situata nelle subunità β di un altro tetramero: l’Hb
polimerizza, forma delle fibre insolubili

La deossiemoglobina S: la Val 6 mutante interagisce con la Phe 85

Struttura di una fibra di deossiemoglobina S