Mioglobina ed emoglobina -...
Transcript of Mioglobina ed emoglobina -...


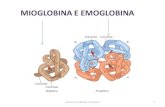
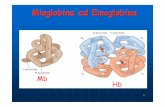
Mioglobina ed emoglobina
α β
α β Muscolo
Deposito di O2 Alta affinità per O2
Globulo rosso Trasporto di O2
Bassa affinità per O2
Cooperativa ed allosterica
• Animali Mb-knockout (2003) : funzionalità praticamente invariata a riposo (meno in ipossia e esercizio)

Contenuto di O2 in 1 litro di:
Aria • Volume occupato da 1 mole di gas: 22.4
litri (STP) • Contenuto di gas in 1 litro di aria:
1/22.4 = 0.045 moli = 45 millimoli • Solo 21% è O2= 9.5 millimoli
Acqua o plasma • Solubilità di O2 in acqua (α): 1.4 x 10-6
moli/l/mmHg (a 37°C) • [O2] = α x pO2 = 1.4 x 10-6 x 150 =
0.00021 moli o 0.21 millimoli Emoglobina (160 g/L, globuli rossi
concentrati) • PM = 16,000 • [Hb ]= 160/16,000 = 10 millimoli • 1 molecola di Hb lega 1 molecola di O2
• [O2] = 10 millimoli
Sangue (50% plasma + 50% RBC) • Plasma: [O2] = 0.21 millimoli • Emoglobina: [O2] = 10 millimoli • Sangue: [O2] = (0.21 x 0.5) + (10 x
0.5) = 0.105 + 5 = 5.105 millimoli (2% + 98%)
98% dell’O2 del sangue è legato a Hb, 2% è fisicamente disciolto nel plasma

Max Perutz with his model of haemoglobin and John Kendrew with his model of myoglobin in
1962
Gruppo eme
(1 eme)
(4 emi)

IL GRUPPO EME E’ IL CENTRO REATTIVO
Fe2+ stato ferroso Fe3+ stato ferrico
Fe-Protoporfirina IX

La forma ossidata si forma quando Fe2+ → Fe3+ Non si combina con O2 Reazione lenta in vivo:
• La globina impedisce l’ossidazione dell’eme • Esistono sistemi riducenti specifici in alcune cellule: NADPH-metHb reduttasi (dipende da glutatione) del globulo rosso riduce il Fe2+ a Fe3+
Le globine ossidate (metaglobine) sono inattive

4 leg. con N pirroli 1 leg. con N His (prossimale)
1 leg. con O2 (CO)

desossigenata = senza ossigeno legato
ossigenata = con ossigeno legato
Le globine ferrose esistono in due forme fisiologicamente attive
Colori delle globine
Deossi-
Ossi-
Carbossi-
Meta-

Mb + O2 <--> MbO2
K= [MbO2 ] / [Mb] [ O2 ] costante di affinità
Curva di dissociazione a pH 7.0
LA CURVA DI DISSOCIAZIONE
DELL’OSSIGENO DALLA MIOGLOBINA È UNA
IPERBOLE
E’ possibile misurare l’affinità delle globine per l’ossigeno


IL LEGAME DELLA PRIMA MOLECOLA DI OSSIGENO
FACILITA IL LEGAME DELLE ALTRE
BASI MOLECOLARI??
LA CURVA DI DISSOCIAZIONE SIGMOIDE INDICA LEGAME COOPERATIVO

La transizione tra due stati (ad alta e bassa affinità) spiega la forma sigmoide della
curva di equilibrio Hb+O2
n=2.8 (fisiologico)
Grafico di Hill
T
R

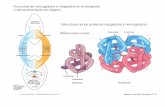
I DUE STATI DELLA EMOGLOBINA HANNO STRUTTURE DIVERSE
Hb desossigenata Hb ossigenata
Stato allosterico T Stato allosterico R O2
Transizione allosterica

Il legame con l’O2 causa una rotazione di 15° di una coppia αβ rispetto all’altra

Elica F
Il legame di O2 su una subunità provoca lo spostamento dell’elica F
Questo spostamento dell’elica F viene trasmesso alla interfaccia tra dimeri della Hb -> transizione allosterica

Modello allosterico di Monod-Wyman-Changeaux (MWC)
2 stati: T e R T=bassa affinità per O2 R=alta affinità per O2
T favorito a basse tensioni di O2 R favorito ad alte tensioni di O2

La transizione allosterica T -->R può essere provocata anche da altre piccole
molecole oltre al ligando (ossigeno). Queste molecole sono dette effettori
allosterici.
Sono effettori allosterici fisiologici della emoglobina:
1. Protone (H+) 2. Anidride carbonica (CO2)
3. Difosfoglicerato (2,3-DPG)

Hb-4O2 + nH+ <=> Hb-nH+ + 4O2
EFFETTO BOHR L’affinità della emoglobina per l’ossigeno
diminuisce abbassando il pH
A livello dei tessuti: H+ fa rilasciare O2
(lattato)
Il protone si lega alla His beta146

La transizione allosterica T -->R può essere provocata anche da altre piccole
molecole oltre al ligando (ossigeno). Queste molecole sono dette effettori
allosterici.
Sono effettori allosterici fisiologici della emoglobina:
1. Protone (H+) 2. Anidride carbonica (CO2)
3. Difosfoglicerato (2,3-DPG)

Come si presenta nel sangue la CO2?
• Bicarbonato (HCO3-) /anidrasi carbonica
• CO2 libera • Carbammati (CO2 + N-terminali di Hb)
– CO2 e O2 NON legano lo stesso sito di Hb!

Anche la CO2 abbassa l’affinità della Hb per l’ossigeno

Trasporto gas respiratori e regolazione acido-base sono collegati O2
O2


ACIDOSI METABOLICA • Diabete mellito (chetoacidosi)
• Acidosi lattica • Diarrea profusa (perdita bicarbonato)
ACIDOSI RESPIRATORIA • Malattie respiratorie croniche
• Arresto cardiaco • Deformazioni torace
• Depressione vie respiratorie ALCALOSI METABOLICA
• Vomito (perdita H+) • Somministrazione bicarbonato ALCALOSI RESPIRATORIA
• Iperventilazione • Malattie polmonari
• Anemia

La transizione allosterica T -->R può essere provocata anche da altre piccole
molecole oltre al ligando (ossigeno). Queste molecole sono dette effettori
allosterici.
Sono effettori allosterici fisiologici della emoglobina:
1. Protone (H+) 2. Anidride carbonica (CO2)
3. Difosfoglicerato (2,3-DPG)

• Non-eritrociti: micromoli/l • Eritrociti: millimoli/l
2,3-disfosfoglicerato (DPG)
2,3-DPG
Pi
2,3-DPG mutasi Glucosio 1,3-DPG
3-PG
2-PG Piruvato
ADP
ATP

Il DPG stabilizza la forma T dell’Hb
Hb R Alta affinità per O2
Hb T Bassa affinità per O2
DPG

DPG ED ALTA QUOTA

L’affinità della Hb per O2 nel sangue è il
risultato della azione combinata dei vari
effettori

Durante lo sviluppo vengono prodotte emoglobine diverse
Emoglobina adulto (HbA) = α2β2 Emoglobina fetale (HbF) = α2γ2

HbF è meno sensibile alla regolazione
allosterica da parte del BPG --> affinità per ossigeno è maggiore di
HbA.