LE PROTEINE: POLIMERI COSTITUITI DA 20 TIPI DI … · Le stesse forze che determinano il...
Transcript of LE PROTEINE: POLIMERI COSTITUITI DA 20 TIPI DI … · Le stesse forze che determinano il...

25/10/2018
1
LE PROTEINE: POLIMERI COSTITUITI DA 20 TIPI DI MONOMERI,
I 20 AMINOACIDI
OGNI PROTEINA PUO’ ESSERE FORMATA DA MOLTE DECINE O
CENTINAIA DI AMINOACIDI CHE SI LEGANO A FORMARE UNA CATENA
NON RAMIFICATA
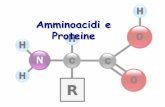
La catena di amminoacidi presenta un buon grado di flessibilità
CH2N
Gruppoaminico
COOH
Gruppocarbossilico
HCarbonio α
GLI AMINOACIDI
RRCatenalateraleCatenalaterale
α
Parte comune a tutti gli aminoacidi
Parte variabile

25/10/2018
2
C+H3N COO-
H
RR
α
In relazione al pH dell’ambiente, il gruppo COOH o il gruppo NH2 possono essere in forma dissociata o indissociata cedendo o accettando protoni
COOHH2NH2N
CH2N COOH
H
IL PIU’ SEMPLICE DEGLI AMINOACIDIGLICINA
HH
Gly G
α
R = H

25/10/2018
3
CH2N COOH
H
UN AMINOACIDO: IL TRIPTOFANO – R può essere un gruppo chimico complesso
Trp W
α

25/10/2018
4
acido aspartico Asp negativaacido glutammico Glu negativa
arginina Arg positivalisina Lys positivaistidina His positiva
Asparagina Asn non carica, polareGlutammina Gln non carica, polareserina Ser non carica, polaretreonina Thr non carica, polaretirosina Tyr non carica, polare
AMINOACIDO CATENA LATERALE (R)
AMINOACIDI POLARI

25/10/2018
5
alanina Ala non polareglicina Gly non polarevalina Val non polareleucina Leu non polareIsoleucina Ile non polareprolina Pro non polareFenilalanina Phe non polareMetionina Met non polareTriptofano Trp non polarecisteina Cys non polare
AMINOACIDO CATENA LATERALE
AMINOACIDI NON POLARI

25/10/2018
6
GLI AMINOACIDI ESSENZIALI
SI DEFINISCONO AMINOACIDI ESSENZIALI QUELLI CHE UN DATO ORGANISMO NON E’ IN GRADO DI SINTETIZZARE AUTONOMAMENTE MA CHE DEVE INTRODURRE CON LA ALIMENTAZIONE
PER L’UOMO GLI AMINOACIDI ESSENZIALI SONO:
TREONINA METIONINA LISINA
VALINA LEUCINA ISOLEUCINA
ISTIDINA FENILALANINA TRIPTOFANO
PER ALTRE SPECIE L’ELENCO POTRA’ ESSERE DIVERSO
ATTENZIONE, ESSENZIALE NON VUOL DIRE AMMINOACIDI PIÙ IMPORTANTI DI ALTRI
Gli aminoacidi si uniscono a formare una catena grazie al LEGAME PEPTIDICO
C
H
RR
C
O
OH
N
H
H
C
H
RR
C
O
OH
N
H
H
+α α
C
H
RR
C
O
OH
N
H
C
H
RR
C
O
N
H
H
H2O
αα

25/10/2018
7
Struttura primaria di una proteina: è la sequenza degli aminoacidi che la compongono: quanti aminoacidi, quali e un quale ordine.
Nota: in questa immagine, che descrive la struttura primaria di una proteina, la sequenza è stata disegnata ripiegata soltanto per motivi di spazio. La struttura primaria non descrive i ripiegamenti della catena polipeptidica.

25/10/2018
8
Quanti tipi di proteine in un organismo ?
In un essere umano alcune decine di migliaia, ciascuna con una sua specifica sequenza di amminoacidi e una sua specifica funzione
Nella stessa specie la maggior parte delle proteine può esistere in più di una variante, in genere con funzione identica o simile ma con piccole differenze nella sequenza di amminoacidi.
Le differenze nella sequenza di amminoacidi sono conseguenza di mutazioni avvenute nel DNA
In specie diverse possono esistere proteine con funzioni identiche o simili e con differenze nella sequenza di amminoacidi proporzionali alla distanza evolutiva
Nella figura la lunghezza dei segmenti è proporzionale alle differenze

25/10/2018
9
SI DEFINISCE STRUTTURA PRIMARIA DI UNA PROTEINA LA SUA SEQUENZA IN AMINOACIDI
MetAspLeuTyrGlyGlyPheCysProTrp………………..
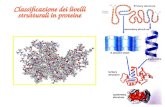
La catena polipeptidica si ripiega per assumere la sua conformazione tridimensionale grazie alla sua flessibilita’ e in seguito alle interazioni degli aminoacidi tra di loro e con l’ambiente circostante
Questi ripiegamenti vengono descritti da ciò che si definisce struttura secondaria e terziaria di una proteina (o eventualmente quaternaria per le proteine formate da più subunità)
Il ripiegamento (FOLDING) delle proteine è dovuto alle interazioni degli aminoacidi tra di loro e con l’ambiente

25/10/2018
10
Piano β

25/10/2018
11
Alcune proteine multimeriche possono essere costituite dai copie multiple di una stessa subunità o di subunità diverse
NELLA SUA STRUTTURA TERZIARIA (O QUATERNARIA), UNA PROTEINA SI PRESENTA COME UN OGGETTO DI FORMA COMPLESSA, CHE POTRÀ PRESENTARE SOLCHI E CAVITÀ ED E’ RICOPERTA DI GRUPPI CHIMICI CAPACI DI FORMARE LEGAMI DEBOLI CON ALTRE MOLECOLE
PERCHE’ UNA PROTEINA POSSA LEGARSI CON UN’ALTRA MOLECOLA (LIGANDO), DOVRA’ESISTERE UNA COMPLEMENTARIETA’ DI FORMA E DI CAPACITA’ DI FORMARE LEGAMI
IL LEGAME SARA’ TANTO PIU’ STABILE QUANTO MAGGIORE E’ IL NUMERO DI INTERAZIONI SIMULTANEE

25/10/2018
12
La precisione della complementarietà, e soprattutto il numero di legami non
covalenti che si possono formare, determina la maggiore o minore affinità tra
due molecole e la stabilità del legame, che è comunque sempre reversibile.
Pochi legami: la agitazione
termica facilmente
determina il distacco
Molti legami: la agitazione
termica difficilmente
determina il distacco
Le stesse forze che determinano il ripiegamento delle proteine determinano anche le interazioni tra una proteina ed altre molecole, come ad esempio tra un enzima e il suo substrato o tra un recettore ed il suo ligando

25/10/2018
13
MOLTE CARATTERISTICHE FUNZIONALI DI UNA
PROTEINA DIPENDONO DALLA SUA CAPACITA’
DI INTERAGIRE CON ALTRE MOLECOLE
LEGANDOLE
QUESTE INTERAZIONI RICHIEDONO UN RICONOSCIMENTO RECIPROCO, LEGATO ALLA FORMA DELLE MOLECOLE ED ALLE CAPACITA’ DI FORMARE LEGAMI
LIGANDO
Perchè una proteina possa
interagire correttamente con
il suo ligando è necessario
che il suo ripiegamento sia
avvenuto correttamente

25/10/2018
14
LA STRUTTURA TRIDIMENSIONALE DI UNA PROTEINA NON E’ RIGIDA, MA DINAMICA
IL CAMBIAMENTO DELLE CONDIZIONI AMBIENTALI O L’INTERAZIONE CON ALTRE
MOLECOLE POTRA’ MODIFICARE REVERSIBILMENTE LA CONFORMAZIONE
DELLA PROTEINA
Ricordiamo infatti che quando una proteina si lega con un’altra molecola (proteica o meno), viene a contatto con gruppi chimici che potranno essere carichi positivamente o negativamente, polari o non polari. Questa nuova situazione potrà modificare reversibilmente il ripiegamento della proteina

25/10/2018
15

25/10/2018
16
Come si ripiegano le proteine.
Il ripiegamento delle proteine è dovuto alle proprietà dei suoi amminoacidi, quindi è una conseguenza della struttura primaria e delle sue interazioni con l’ambiente.Alcune proteine, se artificialmente svolte (denaturate), si ripiegano correttamente in modo spontaneo
Ripiegamenti non corretti “contagiosi” possono essere causa di malattie: il caso dei prioni (la “mucca pazza”)

25/10/2018
17
Una proteina prionica ripiegata in modo anomalo induce il ripiegamento anomalo di altri esemplari







![LE MOTEUR ASYNCHRONE · g: glissement du moteur asynchrone en pourcentage [sans unités] • Si, par le principe de la loi de Lenz, le rotor rattrapait le champ tournant pour tourner](https://static.fdocument.org/doc/165x107/6020a6febb061f7b7628a867/le-moteur-asynchrone-g-glissement-du-moteur-asynchrone-en-pourcentage-sans-units.jpg)