K—nhsh twn iìntwn upì thn ep—drash hlektrikoÔ ped—ou -...
Transcript of K—nhsh twn iìntwn upì thn ep—drash hlektrikoÔ ped—ou -...

Κίνηση των ιόντων υπό την επίδρασηηλεκτρικού πεδίου - Αγωγιμομετρία
Α. Καραντώνης, Χ. Καραγιάννη, Κ. Χαριτίδης, Η. Κούμουλος1 Σκοπός της άσκησηςΣκοπός της άσκησης είναι: (α) Ο προσδιορισμός της οριακής ταχύτητας τωνιόντων υπό την επίδραση ηλεκτρικού πεδίου, ο υπολογισμός της ευκινησίας καιτης ακτίνας τους. Ειδικότερα θα μελετηθεί η κίνηση των ιόντων MnO−
4 , (β) οπροδιορισμός της εξάρτησης της ισοδύναμης αγωγιμότητας από τη συγκέντρω-ση ισχυρών και ασθενών ηλεκτρολυτών καθώς και ο βαθμός διάστασης τους.2 Κίνηση ιόντων σε ηλεκτρικό πεδίο2.1 ΗλεκτρομεταφοράΑς θεωρήσουμε ένα ηλεκτρολυτικό διάλυμα που περιέχει N διαφορετικά είδηιόντων. Ας θεωρήσουμε επίσης ότι το ηλεκτρολυτικό διάλυμα βρίσκεται υπότην επίδραση ηλεκτρικού πεδίου E (π.χ. εμβαπτίζοντας δύο μεταλλικά ηλε-κτρόδια στο διάλυμα και επιβάλλοντας στα άκρα τους διαφορά δυναμικού ∆V ).Επιπλέον, ας κάνουμε τις παρακάτω παραδοχές:
• Η κίνηση των ιόντων στο ηλεκτρολυτικό διάλυμα οφείλεται αποκλειστικάστην ύπαρξη του ηλεκτρικού πεδίου E .
• Η κίνηση των ιόντων λαμβάνει χώρα σε μία διάσταση, δηλαδή κατά μήκοςτου άξονα-x που συνδέει νοητά τα δύο ηλεκτρόδια.
• Τα ιόντα είναι φορτισμένες σφαίρες που κινούνται σε ένα συνεχές μέσο(τον ηλεκτρολύτη).
• Τα ιόντα δεν αλληλεπιδρούν.
Η ένταση του ηλεκτρικού πεδίου σε κάθε σημείο του ηλεκτρολυτικού δια-λύματος θα είναι,
E(x) = −∂φ(x)
∂x(1)
1

Σχήμα 1: Κίνηση των ιόντων υπό την επίδραση ηλεκτρικού πεδίου
όπου φ(x) το ηλεκτρικό δυναμικό στο σημείο x. Εφόσον τα ιόντα θεωρούνταιφορτισμένες σφαίρες, τότε η (ηλεκτρική) δύναμη που ασκείται σε ένα ιόν τύπουk με φορτίο zke0 θα είναι (βλ. Σχ. 1),
Fel = zke0E (2)
ή αλλιώς,
Fel = −zke0∂φ
∂x(3)
όπου e0 το στοιχειώδες φορτίο (1.602 ·10−19 A s). Να σημειώσουμε στο σημείοαυτό ότι ο αριθμός zk είναι προσημασμένος (θετικός για κατιόντα και αρνητικόςγια ανιόντα). Λόγω της κίνησης των ιόντων στο ηλεκτρολυτικό διάλυμα, θαασκείται μία δύναμη τριβής η οποία θα δίνεται από την παρακάτω σχέση, εφόσοντα ιόντα θεωρούνται ως σφαίρες που κινούνται σε ένα συνεχές μέσο,
Ff = −fkvk (4)
όπου vk η ταχύτητα των ιόντων και fk μία θετική σταθερά (ο συντελεστήςτριβής). Η συνισταμένη των δυνάμεων που ασκούνται στο ιόν θα δίνεται απότο αλγεβρικό άθροισμα της δύναμης τριβής και της ηλεκτρικής δύναμης,
Ftot = −zke0∂φ
∂x− fkvk (5)
2

Εφόσον η συνισταμένη Ftot δεν είναι ίση με το μηδέν, το ιόν θα εκτελεί ομαλάεπιταχυνόμενη κίνηση με επιτάχυνση γk =
dvkdt. Συνεπώς, αν η μάζα του ιόντος
είναι mk, θα ισχύει,
mkdvkdt
= −zke0∂φ
∂x− fkvk (6)
Η παραπάνω διαφορική εξίσωση είναι μία συνήθης διαφορική εξίσωση με λύση,
vk(t) = −zke0fk
∂φ
∂x
(1− e
− fkmk
t)
(7)
Εφόσον fk/mk � 1, ο εκθετικός όρος τείνει ταχύτατα στο μηδέν. Συνεπώς,μετά από σύντομο χρονικό διάστημα, το ιόν αποκτά ταχύτητα, 1
vk = −zke0fk
∂φ
∂x(8)
όπου ο συντελεστής αναλογίας uk ≡ zke0/fi ονομάζεται συμβατική ευκινησία2
του ιόντος k. Αν ορίσουμε ως,
uk =uk
zkF(9)
την ευκινησία του ιόντος k, τότε η ταχύτητα του ιόντος γράφεται,
vk = −zkFuk∂φ
∂x(10)
όπου F η σταθερά του Faraday. Πολλαπλασιάζοντας και τα δύο μέλη τηςΕξ. (10) με τη συγκέντρωση των ιόντων τύπου k, ck, προκύπτει,
jk = −zkFukck∂φ
∂x(11)
όπου jk = ckvk η ροή των ιόντων k λόγω της ύπαρξης ηλεκτρικού πεδίουE = −∂φ/∂x. Η ροή αυτή ονομάζεται ροή λόγω ηλεκτρομεταφοράς και τοφαινόμενο της κίνησης των ιόντων λόγω της ύπαρξης ηλεκτρικού πεδίου ονο-μάζεται ηλεκτρομεταφορά. ΄Οπως φαίνεται από την Εξ. (11), το πρόσημο τηςροής ηλεκτρομεταφοράς, δηλαδή η φορά της κίνησης των ιόντων, εξαρτάται απότο φορτίο (το πρόσημο σου zk) και την κλίση της συνάρτησης του δυναμικού ωςπρος την απόσταση (το πρόσημα του ∂φ/∂x). Ας μελετήσουμε την περίπτωσηπου παρουσιάζεται στο Σχ. 2. Στο διάλυμα που περιέχει θετικά (κόκκινα) και
1Στο ίδιο αποτέλεσμα θα καταλήξουμε αν θεωρήσουμε ότι η κίνηση των ιόντων βρίσκεταισε στατική κατάσταση θέτοντας duk/dt = 0 στην Εξ. (6).2Αλλιώς απόλυτη ταχύτητα ή ηλεκτροχημική ευκινησία
3

Σχήμα 2: Η φορά της ροής θετικών (κόκκινων) και αρνητικών (πράσινων)ιόντων υπό την επίδραση ηλεκτρικού πεδίου όπου ∂φ/∂x > 0.
αρνητικά (πράσινα) ιόντα εμβαπτίζουμε δύο μεταλλικά ηλεκτρόδια. Στα άκρατων ηλεκτροδίων εφαρμόζουμε διαφορά δυναμικού έτσι ώστε το αριστερό ηλε-κτρόδιο να δρα ως κάθοδος (είναι αρνητικά φορτισμένο) και το δεξί ως άνοδος(είναι θετικά φορτισμένο). Ο άξονας x συνδέει νοητά την κάθοδο και τηνάνοδο.
• Η κλίση είναι θετική συνεπώς ∂φ/∂x > 0. Για τα θετικά ιόντα z > 0 συ-νεπώς jmigr < 0. Τα θετικά ιόντα κινούνται λόγω ηλεκτρομεταφοράς απόπεριοχές υψηλότερου ηλεκτρικού δυναμικού προς περιοχές χαμηλότερουηλεκτρικού δυναμικού ή αλλιώς τα θετικά ιόντα κινούνται λόγω ηλεκτρο-μεταφοράς από την άνοδο προς την κάθοδο.
• Η κλίση είναι θετική συνεπώς ∂φ/∂x > 0. Για τα αρνητικά ιόντα z < 0συνεπώς jmigr > 0. Τα αρνητικά ιόντα κινούνται λόγω ηλεκτρομεταφο-ράς από περιοχές χαμηλού ηλεκτρικού δυναμικού προς περιοχές υψηλούηλεκτρικού δυναμικού ή αλλιώς τα αρνητικά ιόντα κινούνται λόγω ηλε-κτρομεταφοράς από την κάθοδο προς την άνοδο.
Προφανώς, η συνολική ροή ηλεκτρομεταφοράς λόγω της κίνησης όλων τωνιόντων στο διάλυμα θα δίνεται από το αλγεβρικό άθροισμα της ροής κάθε τύπουιόντος, δηλαδή,
jmigr =N∑k=1
jk = −N∑k=1
zkFukck∂φ
∂x(12)
Εν γένει, η προσανατολισμένη κίνηση ηλεκτρικού φορτίου θεωρείται ηλε-κτρικό ρεύμα και ως εκ τούτου η προσανατολισμένη κίνηση ιόντων σε ένα
4

ηλεκτρολυτικό διάλυμα μπορεί να ορισθεί ως ιονικό ρεύμα. Συνεπώς η ρο-ή ηλεκτρομεταφοράς, η οποία είναι προσανατολισμένη δεδομένου ότι λαμβάνειχώρα κατά τη διεύθυνση της βαθμίδας του ηλεκτρικού δυναμικού ∂φ/∂x αν-τιστοιχεί με ηλεκτρικό ρεύμα. Δηλαδή, η πυκνότητα ρεύματος λόγω της ροήςηλεκτρομεταφοράς των ιόντων k είναι,
ik = zkFjk (13)
Η πυκνότητα ρεύματος λόγω της κίνησης όλων των ειδών των ιόντων πουβρίσκονται στο διάλυμα θα είναι,
imigr =N∑k=1
ik = −N∑k=1
z2kF2ukck
∂φ
∂x(14)
Θα πρέπει να τονισθεί και πάλι ότι το ρεύμα imigr είναι το ρεύμα που οφείλεταιαποκλειστικά στην ύπαρξη του ηλεκτρικού πεδίου.Ας μελετήσουμε τώρα τη φορά του ιονικού ρεύματος, Σχ. 2. Το ιονικό ρεύμα
που αντιστοιχεί σε ιόντα τύπου k γράφεται ik = −z2kF2ukck
∂φ∂x. ΄Οπως φαίνεται
από τη σχέση αυτή, η φορά του ρεύματος (το πρόσημο του ik) δεν εξαρτάταιαπό το φορτίο των ιόντων (το πρόσημο του zk) αλλά μόνο από την κλίση τουηλεκτρικού δυναμικού (το πρόσημο του ∂φ/∂x). Συνεπώς η φορά του ιονικούρεύματος λόγω ηλεκτρομεταφοράς είναι πάντα από περιοχές υψηλού ηλεκτρικούδυναμικού προς περιοχές χαμηλού ηλεκτρικού δυναμικού, ή με άλλη διατύπωση,με φορά από την άνοδο στην κάθοδο. Μία άλλη, ισοδύναμη διατύπωση, είναιότι ο φορά του ιονικού ρεύματος είναι αυτή της ροής των θετικών ιόντων. Αυτόείναι συνεπές με τη σύμβαση ότι ως φορά του ηλεκτρικού ρεύματος ορίζεται ηφορά της προσανατολισμένης κίνησης θετικού φορτίου.Αν ισχύουν αυτά που μόλις περιγράψαμε, πώς είναι δυνατόν να ισχύει η
Εξ. (14) αφού στο ηλεκτρολυτικό διάλυμα έχουμε κίνηση τόσο θετικών όσοκαι αρνητικών ιόντων, και μάλιστα με αντίθετη φορά; Για να κατανοήσουμε ότιόλα τα παραπάνω είναι συμβατά μεταξύ τους, ας φανταστούμε απλά τη κίνησηαρνητικών ιόντων ως κίνηση θετικών οπών προς την αντίθετη κατεύθυνση.2.2 Προσδιορισμός της οριακής ταχύτητας των ιόντωνΣτην περίπτωση που εφαρμοσθεί σταθερή διαφορά δυναμικού ∆E μεταξύ δύοηλεκτροδίων που απέχουν απόσταση l, η ένταση του ηλεκτρικού πεδίου σε κάθεσημείο του ηλεκτρολυτικού διαλύματος θα είναι,
E =∆E
l(15)
5

συνεπώς η Εξ. (10) γράφεται ως εξής,
vk = uk∆E
l(16)
ή, αν λύσουμε ως προς την συμβατική ευκινησία,
uk =∆x
∆t
l
∆E(17)
όπου η ταχύτητα έχει εκφρασθεί ως την απόσταση ∆x που διανύουν τα ιόντασε χρόνο ∆t.Εφόσον προσδιορισθεί η συμβατική ευκινησία των ιόντων, είναι δυνατός ο
προσδιορισμός της ακτίνας rk των ιόντων, θεωρώντας ότι ισχύει ο νόμος τουStokes για το συντελεστή τριβής,
fk = 6πηrk (18)
όπου η το ιξώδες. Δηλαδή,
uk =zke06πηrk
(19)
Συνεπώς, για να προσδιορισθεί η συμβατική ευκινησία και η ακτίνα των ιόν-των θα πρέπει να προσδιορισθεί η ταχύτητα τους, υπό την επίδραση ηλεκτρικούπεδίου σταθερής έντασης.3 Αγωγιμότητα3.1 Αγωγιμότητα, γραμμομοριακή και ισοδύναμη αγωγιμότη-ταΗ Εξ. (14) μπορεί να γραφεί στη μορφή,
imigr = −κ∂φ
∂x(20)
όπου
κ =N∑k=1
z2kF2ukck (21)
Παρατηρούμε ότι η Εξ. (20) είναι μία έκφραση του νόμου του Ohm συνεπώς οπαράγοντας κ είναι η ειδική αγωγιμότητα του ηλεκτρολυτικού διαλύματος (μεμονάδα μέτρησης S·cm−1). Προφανώς,
κ =1
ρ(22)
6

όπου ρ η ειδική αντίσταση του ηλεκτρολυτικού διαλύματος (με μονάδα μέτρησηςΩ·cm). Αν θεωρήσουμε ότι το ηλεκτρολυτικό διάλυμα βρίσκεται μεταξύ δύο με-ταλικών πλακών εμβαδού S που απέχουν απόσταση l τότε η ειδική αγωγιμότηταθα συνδέεται με την αγωγιμότητα G του διαλύματος με τη σχέση,
G = κS
l(23)
και η ειδική αντίσταση θα συνδέεται με την αντίσταση R του διαλύματος με τησχέση,
R = ρl
S(24)
Παρατηρούμε, λοιπόν, ότι ενώ η αντίσταση και η αγωγιμότητα του ηλεκτρολυτι-κού διαλύματος εξαρτώνται από τα γεωμετρικά χαρακτηριστικά του διαλύματος(διατομή S και μήκος l), η ειδική αντίσταση και η ειδική αγωγιμότητα είναιμεγέθη ανεξάρτητα των γεωμετρικών χαρακτηριστικών.Από τη Εξ. (21) παρατηρούμε όμως ότι η ειδική αγωγιμότητα αυξάνεται
γραμμικά με τη συγκέντρωση των ιόντων εφόσον η ευκινησία τους δεν είναισυνάρτηση της συγκέντρωσης.Δεδομένου ότι η ειδική αγωγιμότητα κ εξαρτάται από τη συγκέντρωση,
ένα μέγεθος που είναι πιο εύχρηστο είναι η γραμμομοριακή και η ισοδύναμηαγωγιμότητα ενός ηλεκτρολύτη, οι οποίες εκφράζονται αντίστοιχα ως εξής,
Λm =κ
c(25)
Λeq =κ
ceq(26)
με μονάδες μέτρησης S·cm2·mol−1 και S·cm2·geq−1 αντίστοιχα. Στην πρώτηπερίπτωση, λοιπόν, η συγκέντρωση εκφράζεται σε mol·cm−3 ενώ στη δεύτερησε geq·cm−3.3 Αν η συγκέντρωση c του ηλεκτρολύτη εκφράζεται σε mol·cm−3
τότε για έναν ηλεκτρολύτη τύπου z : z η ισοδύναμη αγωγιμότητα μπορεί ναγραφεί,
Λeq =κ
zc(27)
Ας θεωρήσουμε έναν ηλεκτρολύτη ΑΒ με συγκέντρωση c που διίστανταισύμφωνα με το παρακάτω σχήμα,
ABEGGGGGGCAz1 + Bz2 (28)
3Αν η συγκέντρωση εκφράζεται σε mole/l ή geq/l τότε, Λm = 1000κc και Λeq = 1000κ
ceq
7

και α ο βαθμός διάστασης του ηλεκτρολύτη. Στην περίπτωση αυτή z1 = |z2| =z και c1 = c2 = αc. Συνεπώς, η ειδική αγωγιμότητα θα είναι,
κ = z21F2u1c1 + z22F
2u2c2 = zFαc(u1 + u2) (29)
όπου uk η συμβατική ευκινησία του ιόντος k. Η γραμμομοριακή αγωγιμότηταθα είναι,
Λm =κ
c= αzF (u1 + u2) (30)
Ανάλογα, η ισοδύναμη αγωγιμότητα θα δίνεται από τη σχέση,
Λeq =κ
zc= αF (u1 + u2) (31)
Για άπειρη αραίωση, ο βαθμός διάστασης θα είναι α = 1, δηλαδή η διάστασηθα είναι πλήρης. ΄Ετσι, για άπειρη αραίωση οι παραπάνω σχέσεις γράφονται,
Λ∞m = zF (u1 + u2) (32)
Λ∞eq = F (u1 + u2) (33)
Τα παραπάνω μεγέθη ονομάζονται γραμμομοριακή (ισοδύναμη) αγωγιμότηταάπειρης αραίωσης. Αν ορίσουμε επίσης ως,
λ∞1 = Fu1 (34)
λ∞2 = Fu2 (35)
ως τις ισοδύναμες ιονικές αγωγιμότητες σε άπειρη αραίωση τότε προφανώς,
Λ∞eq = λ∞
1 + λ∞2 (36)
καιΛeq = αΛ∞
eq (37)
Η Εξ. (36) ονομάζεται νόμος του Kohlraush.3.2 Επίδραση της συγκέντρωσης στην ισοδύναμη αγωγιμότη-τα΄Οπως είδαμε στην προηγούμενη παράγραφο, η αγωγιμότητα κ ενός ηλεκτρο-λυτικού διαλύματος εξαρτάται από την συγκέντρωση. Αυτό είναι φυσικό νασυμβαίνει δεδομένου ότι η ποσότητα φορτισμένων σωματιδίων σε ένα ηλεκτρο-λυτικό αγωγό αυξάνει με την συγκέντρωση, σε αντίθεση με τους μεταλλικούςαγωγούς όπου η συγκέντρωση των ηλεκτρονίων δεν μπορεί να μεταβληθεί. Γιατο λόγο αυτό ορίσθηκε ένα νέο μέγεθος, η ισοδύναμη αγωγιμότητα Λeq προ-κειμένου να εξαλειφθεί η εξάρτηση της συγκέντρωσης.
8

Συστηματικά πειράματα από τον F.W.G. Kohlraush έδειξαν ότι και η ισο-δύναμη αγωγιμότητα εξαρτάται από τη συγκέντρωση. Ο ίδιος, λοιπόν, θεώρησεότι η μεταβολή του Λeq με τη συγκέντρωση οφείλεται στη μεταβολή του βαθμούδιάστασης με τη συγκέντρωση, α(c). Λαμβάνοντας υπόψη τη διάσταση Εξ. (28)η σταθερά διάστασης του ΑΒ θα είναι,
K =[Az1 ][Bz2 ]
[AB]=
α2c
1− α(38)
Αν για το βαθμό διάστασης ισχύει α(c) � 1, τότε η παραπάνω σχέση γράφεται,
K ≈ a2c (39)
Αντικαθιστώντας την Εξ. (37), προκύπτει για την εξαρτώμενη από την συγκέν-τρωση ισοδύναμη αγωγιμότητα,
Λeq(c) = Λ∞eq
√K
c(40)
Η Εξ. (40) προβλέπει ως ένα βαθμό την εξάρτηση της ισοδύναμης αγωγιμότηταςαπό τη συγκέντρωση για ασθενείς ηλεκτρολύτες (α � 1) σε μικρή συγκέντρω-ση.Παρόλα αυτά, στην περίπτωση ισχυρών ηλεκτρολυτών έχει βρεθεί πειρα-
ματικά ότι η εξάρτηση της ισοδύναμης αγωγιμότητας από την συγκέντρωσηυπακούει την παρακάτω σχέση, εφόσον η συγκέντρωση είναι χαμηλή,
Λeq(c) = Λ∞eq − A
√c (41)
όπου A μία πειραματική σταθερά. Για υψηλότερες συγκεντρώσεις ισχυρών ηλε-κτρολυτών η εξάρτηση είναι ακόμα πιο πολύπλοκη,
Λeq(c) = Λ∞eq − A 3
√c (42)
Σχηματική αναπαράσταση της εξάρτησης της ισοδύναμης αγωγιμότητας α-πό την συγκέντρωση, σύμφωνα με τις Εξ. (40)-(42) παρουσιάζεται στο Σχ. 3.΄Οπως φαίνεται στο σχήμα αυτό, η ισοδύναμη αγωγιμότητα σε άπειρη αραίω-ση μπορεί να προσδιορισθεί από την αποτέμουνσα για τις περιπτώσεις ισχυρούηλεκτρολύτη ενώ δεν είναι δυνατή στην περίπτωση του ασθενούς ηλεκτρολύτη.4 Πειραματικό μέρος4.1 Προσδιορισμός της οριακής ταχύτηταςΠροκειμένου να υπολογισθεί η ταχύτητα των ιόντων MnO−
4 χρησιμοποιείταιένα ειδικά σχεδιασμένο ηλεκτρολυτικό κελί αποτελούμενο από δύο διαμερίσμα-τα στο κάθε ένα από τα οποία υπάρχει ένα ηλεκτρόδιο νικελίου. Στο ένα δια-μέρισμα τοποθετείται διάλυμα KNO3 (άχρωμο) και στο άλλο διάλυμα KMnO4
9

0 0.1 0.2 0.3 0.4 0.5c (a.u.)
0
50
100
150
200Λ
eq (a
.u.)
Σχήμα 3: Εξάρτηση της ισοδύναμης αγωγιμότητας από την συγκέντρωση. Μα-ύρη καμπύλη: Εξ. (40), κόκκινη καμπύλη: Εξ. (41) και μπλε καμπύλη: Εξ. (42)
(έγχρωμο) με τρόπο τέτοιο ώστε τα δύο διαμερίσματα να βρίσκονται σε ηλε-κτρική επαφή μέσω ενός υμενίου διαλύματος KNO3. Η ταχύτητα των ιόντωνMnO−
4 προσδιορίζεται καταγράφοντας τη μεταβολή της θέσης ενός εγχρώμουμετώπου στο χρόνο, εφόσον μεταξύ των δύο ηλεκτροδίων εφαρμοσθεί σταθερήδιαφορά δυναμικού ∆E (βλ. Σχ. 4)Παρασκευάζεται διάλυμα 0.01 Μ KNO3 διαλύοντας 0.1011 g άλατος σε
100 ml νερού (άχρωμο διάλυμα). Επίσης παρασκευάζεται διάλυμα 0.06 ΜKMnO4 διαλύοντας 0.9482 g άλατος σε 100 ml νερού (έγχρωμο διάλυμα).Τοποθετείται στο ένα διαμέρισμα του κελιού το άχρωμο διάλυμα έτσι ώστε ναπληρωθεί η περιοχή που ενώνει τα δύο διαμερίσματα σχηματίζοντας ένα άχρωμουμένιο. Στη συνέχεια τοποθετείται το έγχρωμο διάλυμα στο άλλο διαμέρισμαέτσι ώστε να πληρωθεί χωρίς να αναμιχθεί με το άχρωμο διάλυμα αλλά ναβρίσκεται σε επαφή με αυτό.Τα ηλεκτρόδια νικελίου συνδέονται με την πηγή δυναμικού έτσι ώστε το
ηλεκτρόδιο που είναι εμβαπτισμένο στο άχρωμο διάλυμα να δρα ως άνοδος (θε-τικός πόλος) και το ηλεκτρόδιο που είναι εμβαπτισμένο στο έγχρωμο διάλυμανα δρα ως κάθοδος (αρνητικό πόλος), Σχ. 5. Εφαρμόζεται διαφορά δυναμικού20 V και παρατηρείται η κίνηση ενός έγχρωμου μετώπου από την κάθοδο προςτην άνοδο. Καταγράφεται ο χρόνος που απαιτείται όταν το μέτωπο καλύπτει α-πόσταση 5, 10, 15, 20, 25 και 30 mm με τη βοήθεια χρονομέτρου. Στη συνέχειακατασκευάζεται το διάγραμμα t ως προς x και από την κλήση υπολογίζεται ηταχύτητα vk. Με γνωστή ταχύτητα υπολογίζεται η συμβατική ευκινησία και ηακτίνα των ιόντων, θεωρώντας η = 1.009 N s m2.
10

Σχήμα 4: Σχηματισμός έγχρωμου μετώπου λόγω της ηλεκτρομεταφοράς ιόντωνMnO−
4
Σχήμα 5: Πειραματική διάταξη για τη μέτρηση της ταχύτητας των ιόντων
11

4.2 Προσδιορισμός της ισοδύναμης αγωγιμότηταςΠροκειμένου να προσδιορισθεί η ισοδύναμη αγωγιμότητα ενός ηλεκτρολυτικούδιαλύματος είναι απαραίτητο να μετρηθεί η αγωγιμότητα του. Η αγωγιμότηταμπορεί να μετρηθεί με μία ειδική διάταξη, το αγωγιμόμετρο.Το αγωγιμόμετρο είναι μία διάταξη που αποτελείται από το αγωγιμομετρικό
κελί και το μετρητικό ηλεκτρικό σύστημα. Στην απλούστερη περίπτωση, τοαγωγιμομετρικό κελί αποτελείται από δύο ηλεκτρόδια που απέχουν απόσταση lκαι έχουν εμβαδό S μεταξύ των οποίων εφαρμόζεται διαφορά δυναμικό V . Υπότην επίδραση του ηλεκτρικού πεδίου τα κατιόντα (θετικά ιόντα) θα κινηθούνπρος το αρνητικό ηλεκτρόδιο (κάθοδο) και τα ανιόντα (αρνητικό ιόντα) προς τοθετικό ηλεκτρόδιο (άνοδος). Λόγω της κίνησης των φορτισμένων σωματιδίων,το ηλεκτρολυτικό διάλυμα δρα ως ηλεκτρικός αγωγός, και εφόσον μετρηθείτο ρεύμα που διαρέει το κελί, η αντίσταση θα δίνεται από το νόμο του Ohm,R = V/I. Η ειδική αγωγιμότητα του διαλύματος θα είναι,
κ = a1
R(43)
όπου a = lSη σταθερά του αγωγιμομετρικού κελιού.
΄Ενας από τους κυριότερους παράγοντες που επιδρούν στη μέτρηση τηςειδικής αγωγιμότητας είναι πόλωση των ηλεκτροδίων. Η εφαρμογή δυναμικούστα ηλεκτρόδια μπορεί να έχει ως αποτέλεσμα την διεξαγωγή ηλεκτροχημικήςαντίδρασης στην επιφάνεια των ηλεκτροδίων. Ως αποτέλεσμα, η αντίσταση πουμετράται δεν αποτελείται αποκλειστικά από την αντίσταση του διαλύματος αλλάσυμπεριλαμβάνει και την αντίσταση πόλωσης των ηλεκτροδίων. Το πρόβλημααυτό μπορεί να αντιμετωπισθεί με τους εξής τρόπους:
• Χρήση εναλλασσόμενου δυναμικού: Η εφαρμογή δυναμικού σχετικά υψη-λής συχνότητας έχει ως αποτέλεσμα το εναλλασόμενο ρεύμα που δημιουρ-γείται να διαρρέει το διάλυμα αλλά να μην πολώνει τα ηλεκτρόδια.
• Χρήση κελιού τεσσάρων ηλεκτροδίων: Στην περίπτωση αυτή συνεχής δια-φορά δυναμικού εφαρμόζεται σε δύο ηλεκτρόδια αλλά η πτώση τάσης στοδιάλυμα μετράται από δύο επιπλέον ηλεκτρόδια τα οποία δεν διαρρέονται α-πό ρεύμα. Η περιγραφή του κελιού τεσσάρων ηλεκτροδίων παρουσιάζεταιστο Παράρτημα.
Στην άσκηση χρησιμοποιούνται διαλύματα οξικού νατρίου και οξικού οξέοςκαι γίνονται οι ακόλουθες μετρήσεις:
• Εξάρτηση της κ από τη συγκέντρωση του CH3COONa: Μετριέται η ειδι-κή αγωγιμότητα διαλυμάτων CH3COONa συγκεντρώσεων Ν/10, Ν/20,Ν/40, Ν/80.
12

• Εξάρτηση της κ από τη συγκέντρωση του CH3COOH: Υπολογισμόςτου βαθμού διαστάσεως. Μετριέται η ειδική αγωγιμότητα διαλυμάτωνCH3COOH 4Ν, 3Ν, 2Ν, 1Ν, Ν/2, Ν/4, Ν/8.
Τα διαλύματα παρασκευάζονται από το πυκνότερο διάλυμα του κάθε ηλε-κτρολύτη με διαδοχικές αραιώσεις.Για τη μέτρηση της ηλεκτρικής αγωγιμότητας κ κάθε διαλύματος γίνονται
οι εξής χειρισμοί: Πλένονται προσεκτικά, το κατάλληλο δοχείο μέτρησης και τοηλεκτρόδιο της διάταξης με απιονισμένο νερό και στεγνώνονται. Στη συνέχειατοποθετείται το εκάστοτε διάλυμα, σε ικανή ποσότητα στο δοχείο μέτρησηςκαι βυθίζεται το ηλεκτρόδιο του οργάνου σε αυτό έως ότου να καλυφθεί ηπεριοχή μέτρησης του ηλεκτροδίου. Το ρυθμισμένο-βαθμονομημένο ψηφιακόαγωγιμόμετρο τεσσάρων ηλεκτροδίων ανοίγει πατώντας το κουμπί Exit/PowerOn-Off. Η μέτρηση γίνεται πατώντας το κουμπί READ/enter και στην οθόνηεμφανίζονται η τιμή της αγωγιμότητας, η μονάδα μέτρησης (mS, µS), καθώςκαι η θερμοκρασία του διαλύματος σε ◦C. Στη συνέχεια με το τέλος της κάθεμέτρησης το όργανο κλείνει πατώντας το κουμπί Exit.Οι μετρήσεις και υπολογισμοί έχουν ως εξής:
• Εξάρτηση της Λ από τη συγκέντρωση του CH3COONa
1. Αναγνωρίζεται και σημειώνεται η σταθερά των ηλεκτροδίων.
2. Καταχωρούνται οι μετρήσεις σε πίνακα (Ι) με στήλες Ceq,√Ceq
ηλεκτρική αγωγιμότητα G, ειδική αγωγιμότητα κ και ισοδύναμη α-γωγιμότητα Λ.
3. Κατασκευάζεται το διάγραμμα Λ = f(√
Ceq)
4. Με τη μέθοδο των ελαχίστων τετραγώνων υπολογίζεται η απο-τέμνουσα του διαγράμματος Λ = f(
√Ceq),
T =
∑x2i
∑yi −
∑xi
∑xiyi
n∑
x2i − (
∑xi)2
(44)
5. Σημειώνεται η τιμή της αποτέμνουσας ως η τιμή της Λ∞ του CH3COONa
• Εξάρτηση των Λ και κ από τη συγκέντρωση του CH3COOH και υπολο-γισμός του βαθμού διάστασής του.
1. Καταχωρούνται οι μετρήσεις σε πίνακα (ΙΙ) με στήλες όπως αυτέςτου πίνακα (Ι).
2. Κατασκευάζονται τα διαγράμματα Λ = f(√
Ceq) και κ = f(Ceq).Χρησιμοποιώντας τις παρακάτω τιμές των ιοντικών ευκινησιών και
13

των ισοδύναμων αγωγιμοτήτων καθώς και την τιμή Λ∞ του CH3COONaπου προσδιορίστηκε προηγούμενα, υπολογίζεται με δύο τρόπους ητιμή της Λ∞ του CH3COOH.
λ∞H3O+ = 350 Ω−1cm2geq−1 Λ∞HCl = 426 Ω−1cm2geq−1
λ∞Cl− = 76 Ω−1cm2geq−1 Λ∞NaCl = 126 Ω−1cm2geq−1
λ∞Na+ = 50 Ω−1cm2geq−1
3. Υπολογίζεται ο βαθμός διάστασης του CH3COOH από το λόγοΛ/Λ∞ για κάθε συγκέντρωση του διαλύματος CH3COOH και οιτιμές που προκύπτουν καταχωρούνται σε πίνακα. Ο υπολογισμόςγίνεται με την τιμή του Λ∞ του CH3COOH που προκύπτει και απότους δύο τρόπους προσδιορισμού του και σχολιάζονται συγκριτικάμεταξύ τους τα αποτελέσματα που προκύπτουν ως προς τις τιμές τουα.Βιβλιογραφία
1. A.J. Bard & L.R. Faulkner, “Electrochemical Methods”, John Wiley& Sons, N.Y., 1980
2. J.O’M. Bockris & A.K.N. Reddy, “Modern Electrochemistry Vol. 1”,Plenum Press, N.Y., 1970
14

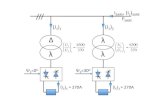
ΠαράρτημαΠροκειμένου να αποφευχθούν προβλήματα στη μέτρηση της αγωγιμότητας ενόςδιαλύματος λόγω της πόλωσης των ηλεκτροδίων χρησιμοποιείται κελί τεσσάρωνηλεκτροδίων. Μία σχηματική παράσταση του κελιού αυτού παρουσιάζεται στοΣχ. 6.
Rel1 Rel2Rsol
R3 R4
V
E
I
κελίτεσσάρων ηλεκτροδίων
I
Σχήμα 6: Σχηματική παράσταση του κελιού τεσσάρων ηλεκροδίων
Στην περίπτωση αυτή εφαρμόζεται συνεχές ρεύμα I στα εξωτερικά ηλε-κτρόδια. Τα ηλεκτρόδια αυτά έχουν αντίσταση Rel1, Rel2 λόγω της πόλωσης.Το ρεύμα I διαρέει το ηλεκτρολυτικό διάλυμα που έχει αντίσταση Rs. Η διαφοράδυναμικού V μετράται στα εσωτερικά ηλεκτρόδια. Δεδομένου ότι δεν ρέει ρεύμαδιαμέσω του βολταμέτρου, το ρεύμα που ρέει από τα εσωτερικά ηλεκτρόδια είναιμηδέν και οι αντιστάσεις τους λόγω πόλωσης είναι μηδενικές R3 = R4 = 0. Γιαγνωστό I και μετρώντας το δυναμικό V το όργανο υπολογίζει την αντίστασηRs από το νόμο του Ohm.
15