files.sld.cufiles.sld.cu/.../files/2013/09/monografia-cirrosis.docx · Web viewMonografía Cirrosis...
Transcript of files.sld.cufiles.sld.cu/.../files/2013/09/monografia-cirrosis.docx · Web viewMonografía Cirrosis...

Monografía Cirrosis
La cirrosis (del griego: kirr- κιρρóς, amarillo anaranjado, y -ō-sis, patología) es una histopatología en la que las células del parénquima de un órgano interno cualquiera son sustituidas, al morir, por un tejido anormal de tipo cicatricial formado a partir del tejido estromal del propio órgano.
El término 'cirrosis' fue acuñado por René Laënnec en 1805 al estudiar la cirrosis hepática y observar la presencia de gránulos amarillentos en el tejido hepático, debido esto a la presencia de pigmentos biliares. En general, el término cirrosis queda reservado para la enfermedad hepática, denominándose la enfermedad pancreática como pancreatitis crónica, sin ninguna relación fisiopatogénica con la hepática, salvo el posible origen etílico coincidente de la primera con algunos casos de la última. Tienen distintos aspectos morfológicos e histopatológicos, con ciertas analogías.
El nombre de Laënnec está asociado a una forma de cirrosis hepática (Cirrosis hepática de Laennec o Cirrosis alcohólica). Curiosamente esto no se debe a que haya hecho algún aporte sobre el tema sino simplemente a una nota a pie de página proponiendo el nombre de cirrosis (kirrós, amarillo) para el hígado granular, indurado y amarillento encontrado en la autopsia de un caso con enfisema pulmonar.
Esencialmente se trata de una enfermedad degenerativa acelerada del parénquima hepático, que como expresión final de múltiples etiologías, traduce una desestructuración del lobulillo hepático, por un estado de regeneración mantenido, que finalmente no consigue sostener la funcionalidad del laboratorio del metabolismo del cuerpo humano, al crecer de forma inapropiada hepatocitos que sin sus adecuados conductos de drenaje, y agravado por la fibrosis intersticial interlobulillar estromal, terminan produciendo insuficiencia hepática progresiva, y cursando por una serie de grados de afectación clínica relativamente correlacionadas con las anormalidades morfológicas crecientes que se van produciendo. Las causas más comunes e importantes son:
Etilismo crónico. Hepatitis crónicas víricas, especialmente la hepatitis C, y menor medida la hepatitis
B, en respuesta a ciertas configuraciones genotípicas del huésped, con anormal respuesta autoinmune celular como origen principal de la patogenia, más que el propio virus en si.
Medicaciones o fármacos de ingesta crónica, que terminan comportandose como el daño alcohólico.
Obesidad y sobrenutricion.
En la evolución de la enfermedad, podemos distinguir dos fases: cirrosis compensada y descompensada. Esta diferenciación tiene en cuenta que los pacientes hayan o no desarrollado las complicaciones propias de la enfermedad.
Mientras se encuentre compensada, los pacientes pueden no presentar ningún síntoma, y esta fase puede vivir años. En esta fase hay un importante número de pacientes que todavía no han sido diagnosticados. Asimismo, los pacientes con cirrosis compensada tienen una supervivencia parecida a la de la población general. Esto es así porque en condiciones normales el organismo no requiere de todo el "potencial" que el hígado tiene. Se puede tener el 100% del hígado afectado y no tener ningún tipo de sintomatología, detectando en todo caso un aumento de las transaminasas en un análisis de sangre.

Las complicaciones que definen la cirrosis descompensada son:
Ascitis: acúmulo de líquido libre intraabdominal con características de transudado Este transudado además puede infectarse (peritonitis bacteriana espontánea), habitualmente a causa de la translocación bacteriana (paso al torrente sanguíneo de las bacterias que conforman la flora intestinal)
Síndrome hepatorrenal: insuficiencia renal prerrenal funcional y reversible sin que exista alteración de la estructura renal. Se produce debido a una intensa vasoconstricción renal que conduce a una insuficiencia renal que se establece en el plazo de días o semanas, de forma muy agresiva y que tiene un pronóstico fatal a corto plazo, en la mayoría de los casos en semanas (síndrome hepatorenal tipo I) o de forma más insidiosa, con un pronóstico ligeramente mejor y una supervivencia media de alrededor de seis meses (síndrome hepatorenal tipo II)
Encefalopatía hepática: deterioro de la función neurológica, habitualmente episódico y reversible, relacionado con el paso desde la circulación portal sustancias no depuradas por el hígado a la circulación general.
Hemorragia digestiva por varices esofágicas Ictericia: tinte amarillento de la piel y las mucosas a consecuencia del acúmulo de
bilirrubina.
La cirrosis descompensada, sin embargo, predice habitualmente una importante disminución de la supervivencia, y un mal pronóstico a corto plazo.
En el desarrollo de estas complicaciones intervienen básicamente dos factores patogénicos:
La hipertensión portal (aumento de la tensión normal de la vena porta) La insuficiencia hepatocelular.
Además de las complicaciones descritas, pueden aparecer otras muchas, entre las cuales destaca el riesgo aumentado que tienen los pacientes con cirrosis hepática de desarrollar un hepatocarcinoma
Definición:
La cirrosis compensada no implica necesariamente un acortamiento de la vida y puede permitir llevar una vida prácticamente normal. Es preciso tratar de evitar la progresión eliminando la causa cuando es posible. Si no lo fuese, existen medidas para prevenir algunas de las complicaciones. Si, a pesar de todo, la enfermedad progresa a fases avanzadas o aparece un hepatocarcinoma, debe valorarse el trasplante hepático, que tiene que ser indicado en el momento oportuno, ni muy pronto ni muy tarde.
Por todo lo dicho, es imprescindible un seguimiento médico periódico, al menos 2 veces al año. Es básico comunicar al médico pronto la aparición de nuevos síntomas o de cambios observados por los familiares. Hay que seguir siempre las indicaciones del médico y preguntar cualquier duda con respecto al tratamiento, el régimen de vida, la alimentación o precauciones especiales (por ejemplo, conducir o no). Debe preguntarse al médico por el pronóstico futuro y los riesgos inmediatos. Tener un conocimiento adecuado de la enfermedad da tranquilidad y

ayuda a tomar las precauciones oportunas. Todos los médicos que le atiendan, además de su médico habitual, deben conocer que tienen cirrosis.
Introducción
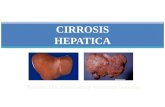
La cirrosis hepática es un proceso de alteración final del hígado, que se caracteriza por el desarrollo progresivo de fibrosis difusa y alteración global de la arquitectura hepática, con formación de nódulos regenerativos y alteraciones hepatocelulares: pleomorfismo, displasia e hiperplasia regenerativa. Según la clasificación morfológica, existe la cirrosis micronodular (menor de 3 mm), que se observa principalmente por alcohol; la cirrosis macronodular (mayor de 3 mm) que puede ser postviral, por virus C o B y la cirrosis con morfología mixta. La clasificación más útil, indudablemente, es la etiológica.
La cirrosis trae aparejado un proceso de alteración morfológica global del hígado, de modo que éste pierde su característica superficie lisa, se vuelve irregular y disminuye de tamaño. Histológicamente se pueden ver nódulos de regeneración, compuestos por hepatocitos rodeados por trabéculas fibrosas; en la cirrosis macronodular los nódulos son más grandes y también se pueden ver en la tomografía axial computarizada (TC). En cortes de hígado cirrótico se puede ver la estructura irregular y heterogénea, con una hipertrofia característica del lóbulo caudado que probablemente se debe a que este lóbulo no sólo es irrigado por la arteria hepática y por la porta, sino que además tiene irrigación sistémica.
Etiología de la cirrosis hepática
La causa global más frecuente en Chile es el alcohol; en segundo lugar, el virus hepatitis C y en tercer lugar, criptogénica; en los Estados Unidos, la hepatitis C y el alcohol también representan las dos causas más importantes. El virus hepatitis B existe en Chile, pero su prevalencia es muy baja, por lo que, entre las causas de cirrosis, es la séptima u octava; el virus D no existe en Chile y cobraría importancia en casos de prevalencia pandémica de virus hepatitis B. La cuarta causa de cirrosis es el grupo de las enfermedades autoinmunes, que producen la hepatitis autoinmune y la cirrosis biliar primaria. En los diez últimos años se ha redescubierto la esteatohepatitis no alcohólica, que es la quinta causa de cirrosis; consiste en una alteración hepática causada por mediadores inflamatorios y se presenta en pacientes diabéticos, obesos y portadores de dislipidemias. Durante muchos años se habló de la cirrosis criptogénica, que constituía alrededor de 20% a 40% de los casos y designaba a aquellos casos en que no había una etiología clara; ahora se sabe que la mayor parte de estos casos cumplen los criterios de esteatohepatitis, lo que, desde el punto de vista epidemiológico, es de suma relevancia.
Otras causas son: la hemocromatosis, alteración genética por depósito de hierro; la enfermedad de Wilson, por depósito de cobre, con una base genética y la colangitis esclerosante primaria o primitiva, que es una enfermedad autoinmune, colestásica, que cursa con fibrosis de la vía biliar intra y extra hepática. Causas menos frecuentes son: el síndrome de Budd-Chiari, que es la trombosis u obstrucción de las venas suprahepáticas y provoca principalmente hipertensión portal, pudiendo llevar a cirrosis hepática; la enfermedad venooclusiva, que también es una obstrucción del flujo venoso hepático portal, pero a nivel sinusoidal y puede estar asociada con algunos fármacos; y el déficit de alfa-1 antitripsina. La cirrosis criptogénica ha disminuído como causa global, en la medida en que se diagnostican más esteatohepatitis no alcohólicas o hepatitis autoinmunes con serología negativa, que pueden quedar comprendidas en este grupo. Finalmente está la toxicidad por fármacos como metotrexato, que puede causar cirrosis, y la hipervitaminosis A, como causa anecdótica.

Según el CDC (Centers for Disease Control) de los Estados Unidos, en 2004 la causa más importante de cirrosis fue el virus hepatitis C, seguida por el alcohol y en tercer lugar, el virus hepatitis C más alcohol. Luego está la cirrosis criptogénica, la causada por el virus hepatitis B, que en Chile no es tan importante. La cirrosis biliar primaria, la hepatitis autoinmune y la esteatohepatitis no alcohólica son destacables.
Manifestaciones clínicas de cirrosis
Asintomático: no es raro que el diagnóstico de cirrosis hepática se haga en un paciente que está totalmente asintomático, en un chequeo médico o por hallazgos hematológicos más un examen de imagenología, por ejemplo, una ecografía abdominal.
Síntomas generales: cuando la cirrosis se manifiesta con claridad, el síntoma principal es la fatiga y el decaimiento; también están presentes anorexia y baja de peso.
Manifestaciones gastrointestinales: el paciente puede presentar parotidomegalia, diarrea intermitente, hemorragia digestiva secundaria a hipertensión portal por várices esofágicas, gástricas, duodenales o ano-rectales, o por gastropatía portal.
Manifestaciones hematológicas: hay anemia y los pacientes con cirrosis hepática avanzada presentan pancitopenia: anemia, leucopenia y trombocitopenia. La anemia siempre es multifactorial: por déficit vitamínico, en el caso de pacientes alcohólicos, en quienes el alcohol actúa como tóxico directo y causa anemia macrocítica; por hemólisis y secuestro esplénico de glóbulos rojos; por ferropenia secundaria a hemorragias, etc. Hay esplenomegalia (bazo de más de 12 cm en su diámetro mayor), por hiperesplenismo secundario a hipertensión portal y la trombocitopenia, que es una constante, se correlaciona con el grado de cirrosis; de hecho, en algunos scores de gravedad de cirrosis, la trombocitopenia se considera como un factor pronóstico. La presencia de leucopenia también es importante; a veces el diagnóstico se realiza durante una evaluación hematológica, en la cual la punción medular demuestra una médula regenerativa. También hay alteraciones de la coagulación por déficit de producción de factores, en especial protrombina y factor V.
Manifestaciones renales: en la cadena de episodios fisiopatológicos que se suceden en la cirrosis hepática está el hiperaldosteronismo secundario: la presencia de hipovolemia activa el eje renina-angiotensina-aldosterona y, por lo tanto, al aumentar la aldosterona ocurre la consecuente retención de sodio y agua; hay glomerulopatías específicas asociadas, por ejemplo, con virus C, con crioglobulinas y con virus B; finalmente, la alteración más característica como complicación renal clásica de la cirrosis, es el síndrome hepatorrenal.
Manifestaciones endocrinas: se puede observar hipogonadismo, atrofia testicular y dismenorrea; o feminización, por aumento de estrógenos debido al metabolismo alterado a nivel hepático, con aparición de telangectasias, eritema palmar, ginecomastia y cambios en el vello pubiano.
Manifestaciones pulmonares: puede haber hipertensión pulmonar primaria; hidrotórax hepático, que es un equivalente ascítico en la cavidad pleural; síndrome hepatopulmonar, debido a mediadores vasodilatadores que se producen en la cirrosis y cuya consecuencia es la hipoxemia, que se manifiesta por platipnea y ortodeoxia. Es fundamental evaluar esto ante un daño hepático y la posibilidad de trasplante hepático.

Manifestaciones cardíacas: se sabe que los pacientes cirróticos tienen un estado hemodinámico muy particular, caracterizado por aumento del gasto cardíaco, como consecuencia de la vasodilatación esplácnica y sistémica causada por los mediadores vasodilatadores que se producen, el principal de los cuales es el óxido nítrico. También hay cardiopatía por cirrosis hepática: en décadas anteriores se describió una cardiopatía asociada con el alcoholismo, no sólo en pacientes cirróticos, sino también en alcohólicos sin cirrosis; se pensó que esta cardiopatía solamente estaba asociada con el alcoholismo crónico, pero en pacientes que tienen cirrosis de causa viral se puede encontrar una clara disfunción diastólica o sistólica; en consecuencia, hay una cardiopatía propia del cirrótico.
Manifestaciones neurológicas: puede haber neuropatía periférica y encefalopatía hepática. Hay también manifestaciones músculoesqueleticas, dermatológicas, etc.
Hipertensión portal: es uno de los aspectos más importantes de la cirrosis y un elemento cardinal en el diagnóstico. Su consecuencia directa son las várices, no sólo esofágicas sino también gástricas, duodenales y también rectales o hemorroidales. La gastropatía portal es una alteración por congestión venosa, habitualmente de la mitad superior del estómago, que aparece como consecuencia de la hipertensión portal y puede causar hemorragia digestiva. Manifestaciones adicionales son la ascitis, que es la acumulación anormal de líquido en el peritoneo; síntomas gástricos de cirrosis e hipertensión portal; esplenomegalia; encefalopatía hepática y circulación colateral, todas como consecuencia de hipertensión portal.
Estudio de laboratorio de la cirrosis hepática
Cuando se sospecha cirrosis hepática, se deben evaluar los siguientes aspectos:
Necrosis hepatocelular: la actividad citolítica se evalúa mediante las pruebas hepáticas (SGOT/SGPT). El perfil característico de la cirrosis consiste en transaminasas elevadas en forma discreta, no más de dos o tres veces lo normal, en un cirrótico compensado. Esto no se correlaciona con pronóstico ni con actividad, salvo que las transaminasas estén muy elevadas, en cuyo caso se debe pensar en la posibilidad de actividad hepatítica secundaria a un virus B o C o bien, que el paciente se haya descompensado por otro motivo, como una hepatitis isquémica. También es posible que un cirrótico alcohólico se enferme de hepatitis aguda por virus hepatitis A o que se ocluya la vena porta.
La colestasia: se evalúa mediante las fosfatasas alcalinas (FA) y la gamma glutamil transpeptidasa (GGT), que están ligeramente alteradas en la cirrosis y muy alteradas en las enfermedades colestásicas, como por ejemplo, la cirrosis biliar primaria y la colangitis esclerosante del hígado. De las pruebas hepáticas, el factor que se ha asociado con pronóstico es la bilirrubina, que está dentro de los scores para el pronóstico de la cirrosis.
La función de síntesis: se evalúa mediante la albúmina, la protrombina, el factor V y el colesterol. En un paciente con cirrosis, disminución de la albúmina, disminución del colesterol y prolongación del tiempo de protrombina significan disminución de la síntesis hepática.
Dentro del estudio etiológico previo de la cirrosis se debe solicitar:
Marcadores virales para virus hepatitis C y B: los marcadores de virus hepatitis C son los anticuerpos anti virus hepatitis C, específicamente anticuerpos de tipo IgG, por técnica de ELISA; en cuanto a hepatitis B, el screening se realiza con antígeno de superficie de virus B y con anticore total de virus B.

Estudio de fierro: para descartar hemocromatosis genética o hemosiderosis asociada con hepatitis C o consumo de alcohol. Se debe solicitar ferritina plasmática y cinética de fierro, con informe de la saturación de transferrina (sobre 55% se debe plantear hemocromatosis). Con ferritina sobre 1000 ng/ml se plantea hemocromatosis genética.
Ceruloplasmina: si está baja en el plasma se debe sospechar enfermedad de Wilson.
Cuantificación de inmunoglobulinas: proporciona información y orienta hacia ciertas etiologías. La cirrosis autoinmune puede tener un peak gamma característico, habitualmente más prolongado. La IgA aumenta en la cirrosis alcohólica y la IgM, en la cirrosis biliar primaria.
Los anticuerpos antinucleares y antimúsculo liso son característicos de la cirrosis autoinmune, mientras que los anticuerpos antimitocondriales son característicos de la cirrosis biliar primaria. Los anticuerpos anti LKM-1 (anticuerpos antiantígenos microsomales de hígado y riñón) son característicos de un subtipo de hepatitis autoinmune, que se ve en general en mujeres jóvenes, no muy frecuente.
El estudio de imágenes en cirrosis es absolutamente necesario; se debe solicitar ecografía abdominal, escáner (TC) abdominal y/o resonancia nuclear magnética (RNM) de abdomen o de hígado. La ecografía permite observar los nódulos de la cirrosis macronodular y la presencia de hepatocarcinoma, complicación temida en la cirrosis; también permite evaluar la dilatación de la vía biliar, la presencia de ascitis o visceromegalia y descartar la trombosis de las venas porta y suprahepáticas. Se puede obtener más información, sobre todo del árbol vascular hepático, agregando a la ecografía abdominal un doppler hepático y agregando a la TC o RNM una angio TC o angio RNM.
La biopsia hepática tiene poca utilidad en presencia de cirrosis avanzada, cuando están presentes las manifestaciones floridas de la enfermedad, ya que en ese caso no se necesita una biopsia para saber que el paciente está cirrótico. Si hay muchas dudas acerca de la etiología y el paciente está en etapa precoz, Child A, se podría utilizar la biopsia hepática como ayuda en el diagnóstico y pronóstico.
Diagnóstico de cirrosis
Se realiza con tres elementos: alteración de la función de síntesis hepática, que se traduce en prolongación del tiempo de protrombina, disminución de colesterol, de factor V y de albúmina; estigmas de daño hepático crónico, como arañas vasculares, eritema palmar, ginecomastia, atrofia testicular y contractura de Dupuytren; y signos de hipertensión portal. Este último aspecto es el más importante, ya que en 95% de los casos, la hipertensión portal tiene como causa la cirrosis. El diagnóstico de hipertensión portal se establece mediante imágenes: endoscopía, ecografía abdominal, TC, RNM y por signos de hipertensión portal: ascitis, visceromegalia, circulación colateral, várices esofágicas, encefalopatía o asterixis y disminución del vello torácico y axilar.
Existe un puntaje pronóstico con base en todos los elementos mencionados: el puntaje de Child-Pugh (Tabla I), que considera dos variables clínicas: encefalopatía hepática y presencia de ascitis, y tres variables de laboratorio: bilirrubina, albúmina y protrombina. El puntaje se asigna de acuerdo a la profundidad de cada alteración.
Este puntaje se desarrolló para evaluar el pronóstico a largo plazo en cuanto a sobrevida, mortalidad y como indicador de riesgo quirúrgico; de hecho, se utilizó con este último objetivo

en una época en que se realizaban muchos shunt espleno-renales, como medida de manejo de la hipertensión portal.
Actualmente se utiliza un nuevo puntaje, que se denomina MELD (Model for End stage Liver Disease), como criterio de asignación para trasplante hepático. Hasta 2006, la lista de trasplante hepático en Chile era una lista única nacional asignada por orden de llegada, con algunas excepciones, como la hepatitis aguda fulminante o las complicaciones post trasplante. En la actualidad, la mortalidad por trasplante hepático en Chile es de 25% y una forma de reducirla es reasignando a los pacientes por orden de gravedad, de modo que se trasplanten primero los más graves. El modelo matemático logarítmico MELD se diseñó a partir de los valores de bilirrubina, creatinina y protrombina, medida por INR y asigna entre 6 y 40 puntos, siendo 40 lo más grave. Hoy este score está ampliamente validado en cirrosis y está reemplazando progresivamente al score de Child. Por ejemplo, un paciente que tenga más de 15 puntos de MELD se va a beneficiar con un trasplante hepático y su sobrevida será mejor si se trasplanta; en cambio, si se somete a trasplante hepático a un paciente que tiene entre 10 y 15 puntos, es probable que su sobrevida sea parecida, por lo tanto no se debe realizar el trasplante; y en un paciente que tiene menos de 10 puntos la sobrevida es mejor sin trasplante.
Tratamiento
Las posibilidades de efectuar una terapia específica sobre la etiología de la cirrosis son limitadas, porque es habitual que en el momento del diagnóstico la enfermedad esté avanzada; cuando un alcohólico que ha desarrollado cirrosis deja de beber, no deja de ser cirrótico y los pacientes que tienen cirrosis por virus C o B no se mejoran; sólo en casos anecdóticos se ha descrito regresión de los nódulos de regeneración.
El efecto de las terapias específicas, como las sangrías, en la hemocromatosis; los antivirales para el virus hepatitis B y C en etapas precoces, antes de llegar a la cirrosis; la quelación del cobre en enfermedad de Wilson, con D-penicilamina; los inmunosupresores como corticoides o azatioprina, en el caso de la hepatitis autoinmune y el ácido ursodeoxicólico en la cirrosis biliar primaria, es limitado.
La terapia definitiva de la cirrosis hepática es el trasplante hepático. La sobrevida a diez años de un paciente con cirrosis compensada es de 50% y en caso de cirrosis descompensada es de 15%, aproximadamente, de modo que la decisión de tratamiento se debe basar en lo que es mejor para el paciente, considerando que actualmente la sobrevida a 5 años de un paciente con trasplante hepático es de alrededor de 80-85%.
Bibliografía:
1. Contreras J. Outpatient management of liver cirrhosis (I). Medwave 2007 Ago;7(7):e1897 doi: 10.5867/medwave.2007.07.1897 Fecha de publicación: 1/8/2007 Disponible en: http://www.mednet.cl/link.cgi/Medwave/PuestaDia/APS/1897
Cirrosis hepática, manejo ambulatorio (II): complicaciones
Ascitis

Es la acumulación anormal de líquido en la cavidad peritoneal; desde el punto de vista fisiopatológico, hay una resistencia aumentada al flujo portal y vasoconstricción sinusoidal hepática, con vasodilatación esplácnica secundaria, que se produce por producción de mediadores vasodilatadores como el óxido nítrico, tanto en la circulación sistémica como en el territorio vascular esplácnico. La vasodilatación esplácnica aumenta la presión del capilar esplácnico y la formación de linfa, lo que explica parte de la ascitis. La otra explicación es que la vasodilatación esplácnica provoca hipovolemia arterial efectiva, que es detectada a nivel de los sistemas barorreceptores carotídeos y de la mácula renal, lo que aumenta la secreción de renina-angiotensina-aldosterona, noradralina y de vasopresina; esto, a su vez, determina retención de sodio y agua, expansión del volumen plasmático y ascitis.
En cuanto al manejo, cuando la ascitis es leve y se encuentra como hallazgo al realizar exámenes imagenológicos, como tomografía axial computarizada (TC) o ecografía, no tiene importancia desde el punto de vista clínico ni es necesario el tratamiento diurético. En cambio, esto es necesario cuando un paciente ya tiene manifestaciones clínicas de ascitis. La principal medida general es la restricción de sodio, que consiste en indicar al paciente que no use salero, cocine sin sal y coma pan sin sal, con lo que se logra un aporte de 2 a 3 gramos en la dieta. La restricción de volumen en general no se recomienda, ya que es excepcional que el paciente cirrótico ambulatorio tenga menos de 128 mEq/L de natremia; sólo se indica restricción de volumen con hiponatremia severa.
En ascitis moderada, que se manifieste en forma clínica en un paciente cirrótico con función renal normal, se recomienda dieta hiposódica y administración de diuréticos: espironolactona en dosis de 50 a 200 mg/día y furosemida, entre 20 y 40 mg/día. La dosis de diuréticos se regula por el peso: si el paciente tiene edema periférico, se considera aceptable que baje de peso, inicialmente, entre 0,8 y 1 kg al día; si el paciente no tiene edema periférico, lo aceptable es que baje hasta 0,5 kg al día. Al iniciar el tratamiento diurético, el paciente se debe controlar por lo menos una vez por semana el primer mes, para establecer la dosis final de diuréticos. Si el paciente funde los edemas con rapidez, como sucede en la mayoría de los pacientes que inician por primera vez un diurético, se debe controlar el nivel de electrolitos y la función renal hasta que el edema periférico y la ascitis hayan disminuido del todo desde el punto de vista clínico; desde ahí en adelante el médico se puede guiar por la dosis mínima de diurético necesaria para mantenerlo sin edema pretibial ni ascitis clínica importante.
En caso de ascitis grave, que interfiere con la actividad diaria en grado importante, con dificultad respiratoria y dificultad para levantarse, moverse o caminar, con función renal normal, pero retención de sodio (Na urinario menor de 10 mmol/L), el paciente va a requerir una dosis elevada de diuréticos; la dosis máxima de espironolactona es de 400 mg/día, pero en general se usa hasta 300 mg/día y, en el caso de furosemida, la dosis máxima es de 160 mg/día.
La ascitis refractaria, que se podría considerar como equivalente al síndrome hepatorrenal tipo 2, se observa en 5% a 10% de los pacientes con ascitis y es una pérdida de respuesta a la dosis máxima de diuréticos. En estos casos, el tratamiento es la paracentesis total: se hospitaliza al paciente para evacuar la ascitis con reposición de albúmina, con el fin de prevenir la insuficiencia renal. Otra alternativa es el TIPS (Transjugular Intrahepatic Portosystemic Shunt), que es la comunicación entre la circulación portal y la venosa sistémica para disminuir la hipertensión portal; da buenos resultados en los pacientes Child B, pero en los Child C es más difícil plantear su beneficio, por la evidencia de encefalopatía, que puede ser en extremo limitante.

Síndrome hepatorrenal (SHR)
Se observa en 10% de las cirrosis avanzadas con ascitis; se caracteriza por insuficiencia renal secundaria a vasoconstricción renal, característicamente oligúrica, en que el sodio urinario es menor de 10 mE/L y la fracción excretada de sodio es menor de 1%. Para hacer el diagnóstico de síndrome hepatorrenal son requisitos indispensables, la ausencia de patología renal específica previa, distinta de la cirrosis y la ausencia de disfunción circulatoria por shock o infección. Desde el punto de vista fisiopatológico, la hipertensión portal causa vasodilatación esplácnica, hipovolemia arterial efectiva y vasoconstricción, con aumento de factores antinatriuréticos circulantes como respuesta a este fenómeno. A nivel renal, la protección que tiene el riñón es la excreción de prostaglandinas vasodilatadoras y protectoras de la perfusión del glomérulo; cuando las prostaglandinas intrarrenales disminuyen se desencadena el fenómeno de vasoconstricción renal y se desarrolla un SHR (Fig. 2).
El SHR puede ser de dos tipos: el tipo 1 se presenta con deterioro progresivo y rápido de la función renal, con creatinina que asciende sobre 2,5 mg/dl en menos de dos semanas; es una gran causa de mortalidad en los pacientes cirróticos. En el SHR tipo 2 se produce un deterioro lento y estable de la función renal y la creatinina se mantiene estable, entre 1,5 y 2 mg/dl, por semanas o meses. Chile cuenta, desde 2005, con el fármaco terlipresina, derivado de la vasopresina que actúa como vasoconstrictor esplácnico; si se administra asociado a albúmina puede revertir el síndrome hepatorrenal tipo 1, con un porcentaje de respuesta que oscila entre 60% y 80%. Los síndromes hepatorrenales puros que se tratan de esta manera se pueden recuperar, es decir, volver a su estado basal; la cirrosis es avanzada.
Várices esofágicas
La hemorragia digestiva alta (HDA) por várices esofágicas conlleva una mortalidad inicial de hasta 50%, y el riesgo de recidiva de la hemorragia, en un paciente sin tratamiento, es de 60%. En cuanto a la profilaxis de HDA, frente un paciente que tiene várices esofágicas grandes se ha demostrado el beneficio del tratamiento con betabloqueadores como propanolol, en dosis suficiente como para betabloquear al paciente (guiado por frecuencia cardíaca). En los pacientes que no toleren esta terapia por asma, bloqueo AV o por cualquier otra causa se podría utilizar mononitrato de isosorbide, ya que en algunas comunicaciones se ha descrito que previene el sangrado por várices. Se ha planteado la ligadura de várices que nunca han sangrado como profilaxis, pero es discutible, aunque cada vez aparece mayor evidencia que sugiere que sería beneficiosa en el caso de várices esofágicas grandes, con alto riesgo de sangrado.
En el tratamiento del episodio agudo de sangrado, la terapia de elección es la ligadura de las várices; en la actualidad, la disponibilidad de la endoscopía de urgencia, tanto en el sistema privado como público, es claramente el medio más efectivo. También está el tratamiento farmacológico con terlipresina y el tratamiento combinado, endoscópico más farmacológico con terlipresina. En Chile se utilizó por muchos años el octeotride, cuyo mecanismo era muy parecido a la somatostatina: disminuye la hipertensión portal y con ello el riesgo de sangrado, pero la literatura nunca logró demostrar disminución de la mortalidad, mientras que sí hay evidencia de que la terlipresina puede disminuir la mortalidad y el sangrado en forma importante; por lo tanto, el tratamiento endoscópico es de elección y se asocia a terlipresina, que se administra por vía endovenosa, en bolo, en dosis de 0,5 a 2 mg cada seis horas por cinco días.

En cuanto a la profilaxis de la recidiva de hemorragia en un paciente que ya ha tenido un evento de hemorragia por várices, se plantea la erradicación endoscópica, que consiste en efectuar dos a cuatro sesiones de ligadura endoscópica, o escleroterapia, para erradicar completamente las várices. Con esto desaparece el riesgo de sangrado por várices esofágicas, pero el paciente cirrótico con hipertensión portal puede sangrar por várices gástricas o de otras localizaciones, o por gastropatía portal.
Si fracasa el tratamiento endoscópico y farmacológico se puede instalar un TIPS, shunt que comunica la circulación venosa sistémica con la porta y que se instala a nivel intrahepático, por vía radioscópica en pacientes previo al trasplante hepático. En caso de hemorragias masivas, o cuando el sangrado arterial no se contiene por vía endoscópica, es una indicación adicional de trasplante hepático, aunque el paciente sea Child A.
El tratamiento quirúrgico, como la derivación quirúrgica portosistémica, actualmente es de excepción.
Encefalopatía hepática
La encefalopatía hepática es un conjunto de manifestaciones neuropsiquiátricas que ocurren como consecuencia de una cirrosis avanzada con retención de toxinas, como amonio y otras; es una constante en la cirrosis avanzada y se caracteriza por manifestaciones que pueden ser discretas, como alteración mental mínima y alteraciones del sueño, hasta la alteración máxima, que es el coma hepático, siendo la asterixis o flapping tremor un signo característico. En un contexto de cirrosis hepática, la encefalopatía es, habitualmente, reversible.
La encefalopatía hepática se clasifica en grados:
grado cero: nivel de conciencia normal, sólo se pesquisa con pruebas psicométricas; grado uno: alteración del ciclo sueño-vigilia, confusión leve, alteración de la memoria,
irritabilidad; grado dos: letargia, desorientación, amnesia y asterixis; grado tres: somnolencia, confusión, tendencia al sopor, también hay asterixis y grado cuatro: coma e incluso elementos de descerebración.
Es de suma importancia hacer el diagnóstico diferencial con encefalopatías metabólicas, como las causadas por hipoglicemia, alteraciones electrolíticas, hipoxia, uremia, cetoacidosis y narcosis por CO2; con encefalopatías tóxicas, por alcohol o drogas como los salicilatos; con lesiones intracraneales, como el hematoma subdural del cirrótico, que es frecuente u otras alteraciones como meningitis, abscesos, encefalitis o encefalopatía de Wernicke, en los alcohólicos, que siempre se deben considerar en el diagnóstico diferencial; y con alteraciones neurosiquiátricas.
Los factores desencadenantes de la encefalopatía son:
exceso de proteínas en la dieta: pero no se debe restringir la ingesta proteica a menos que exista encefalopatía crónica invalidante o descompensación aguda, porque el factor nutricional es importante en el pronóstico de la cirrosis;
constipación, hemorragia gastrointestinal; infecciones; uremia, hipokalemia, alcalosis metabólica; deshidratación, que es frecuente por restricción de volumen o por uso excesivo de
diuréticos, excesiva paracentesis o diarrea por laxantes;

hipotensión arterial, por hemorragia gastrointestinal o por dilatación vascular periférica por sepsis;
hipoxemia, anemia; uso de drogas psicoactivas y benzodiazepinas, que se utilizan con frecuencia en caso
de alteración del ciclo sueño-vigilia. shunts portosistémicos como TIPS, que tiene como principal complicación la
encefalopatía; daño hepático progresivo y hepatocarcinoma.
Entre todas las hipótesis que se han planteado sobre la patogenia de la encefalopatía hepática, la que se considera más exacta es la que postula la importancia del aumento de la producción y absorción de amonio, con alteración del metabolismo y aumento de este compuesto en la circulación, lo que explicaría los síntomas neurológicos. Por esta razón, toda la terapia apunta a disminuir la producción de amonio y su absorción en el tubo digestivo, mediante restricción de proteínas en la dieta, enemas con hidratos de carbono no absorbibles, aunque esto no está completamente validado en la literatura o con el uso de lactulosa oral. La lactulosa actúa por dos mecanismos: por ausencia de disacaridasa para desdoblarla llega intacta al colon, donde aumenta la producción de gas; 7 gr de lactulosa equivalen a la producción de 600 cc de gas hidrógeno en el tubo digestivo, los que estimulan la motilidad; junto con esto, la lactulosa se desdobla en el colon por acción de la flora sacarolítica, con lo que se produce ácido láctico, que acidifica la luz intestinal y disminuye el pH del lumen del colon, lo que hace que disminuya la absorción y aumente la excreción fecal de amoníaco.
Se pueden asociar antibióticos cuando el paciente no responde a lactulosa o si tiene intolerancia a ésta. Desde el punto de vista teórico, para evaluar el beneficio de la asociación de lactulosa y antibióticos, como neomicina o metronidazol, se debe medir el pH en la deposición: si la deposición es ácida, con pH menor de seis o siete, se asegura que la asociación es beneficiosa. Desde el punto de vista práctico, en el paciente que no responde a lactulosa se asocian antibióticos, neomicina o metronidazol, aunque la neomicina se debe administrar con cautela en pacientes con insuficiencia renal. También se pueden asociar probióticos como Lactobacillus acidophilus o Enterococcus faecium.
Peritonitis bacteriana espontánea
Se denomina peritonitis bacteriana espontánea (PBE) a la infección del líquido ascítico por permeación de microorganismos desde el tubo digestivo o bacteremia, en ausencia de perforación de víscera hueca. Se define por la presencia en el líquido ascítico de glóbulos blancos, cuyo punto de corte está sobre 250 polimorfonucleares por ml en líquido ascítico, con predominio de segmentados (sobre 50-80%). No hay que esperar que el cultivo del líquido esté positivo para iniciar tratamiento, basta con el análisis citoquímico. Frente a la evolución de una ascitis nueva o una descompensación de la ascitis en un paciente cirrótico, es obligatorio pensar en PBE y descartarla.
El tratamiento consiste en cefalosporinas de segunda o tercera generación (ceftriaxona), por vía endovenosa; otra alternativa son las quinolonas; se podría tratar la PBE con ciprofloxacino por vía oral, pero esta indicación se debe circunscribir a cierto tipo de pacientes no tan graves. En general, ante la sospecha de PBE se debe indicar hospitalización y tratamiento inicial endovenoso. Las principales complicaciones de la PBE son la insuficiencia renal y el SHR, de modo que su prevención es fundamental para reducir la mortalidad de este cuadro; se ha señalado que la asociación de antibióticos más albúmina disminuiría la mortalidad. Es probable

que los pacientes que no manifiesten otras comorbilidades, sino sólo ascitis y PBE, tengan un Child B; en ellos pudiera ser razonable efectuar una expansión con cristaloides o coloides y no usar albúmina, pero, en general, se debe usar albúmina para prevenir la disfunción renal.
La profilaxis posterior a la PBE se realiza con norfloxacino oral, 400 mg en la noche o ciprofloxacino, 250 mg todas las noches. Los pacientes que nunca han tenido PBE y cuyo líquido tiene bajo contenido de proteínas, menor de 1 g/dl, podrían recibir profilaxis primaria con los mismos antibióticos.
En la bacterioascitis (cultivo positivo sin aumento de polimorfonucleares en líquido ascítico), lo recomendable es repetir la punción y si los polimorfonucleares resultan más de 250, tratar y controlar. En la PBE, si el cultivo resulta positivo polimicrobiano hay dos alternativas: o se puncionó un asa intestinal o hay una peritonitis bacteriana secundaria, por lo que se debe investigar esta última posibilidad.
Carcinoma hepatocelular
Una complicación importante de la cirrosis es el carcinoma hepatocelular, que ocupa el primer o segundo lugar como causa de mortalidad entre los cirróticos. En Chile se ven cada vez más, porque los cirróticos están viviendo más.
El hepatocarcinoma se asocia con alcohol y con cirrosis por hemocromatosis o virus hepatitis C. Sin embargo, el hepatocarcinoma se ha descrito para todos los tipos de cirrosis, incluso para esteatohepatitis no alcohólica; por eso en todos los pacientes con cirrosis, independiente de la etiología, se debe efectuar ecografia cada 3 a 6 meses y alfa-fetoproteína cada 3 a 6 meses. Los pacientes que tienen un tumor único menor de 5 cm o tres tumores menores de 3 cm cada uno son candidatos a trasplante hepático. Cuando el trasplante no es una alternativa existen tratamientos curativos o paliativos, como la cirugía resectiva, la alcoholización percutánea, la ablación por radiofrecuencia y la quimioembolización arterial selectiva.
Referencias:
2. Contreras J. Outpatient management of liver cirrhosis (II): Complications. Medwave 2007 Ago;7(7):e1898 doi: 10.5867/medwave.2007.07.1898 Disponible en: http://www.mednet.cl/link.cgi/Medwave/PuestaDia/APS/1898
Cirrosis hepática: manejo moderno de antiguas complicaciones
Generalidades
Las complicaciones de la cirrosis hepática no han cambiado a lo largo del tiempo, pero sí lo han hecho las opciones de tratamiento, en especial durante los últimos ocho años. En la actualidad, las principales causas de cirrosis hepática son las de etiología alcohólica, los virus hepatotropos que producen hepatitis (en especial por hepatitis C, seguido de hepatitis B), etiología autoinmune (hepatitis autoinmune y cirrosis biliar primaria), y por último la esteatohepatitis no alcohólica (EHNA) que se relaciona en su etiopatogenia con el síndrome metabólico, que ha aumentado notoriamente en el ùltimo decenio, llegando a ser por ejemplo, la principal causa de trasplante hepático en el Hospital Clínico de la Universidad de Chile.

Al enfrentar a un paciente cirrótico, se debe definir si la enfermedad basal se encuentra compensada o descompensada, para lo cual es necesario evaluar la presencia de ictericia, ascitis, desnutrición, hepatocarcinoma o várices con riesgo de sangrado. La mayoría de los pacientes compensados tiene una buena sobrevida de 10 años, pero una vez que ocurre un evento descompensante, la sobrevida cae en forma inexorable a 15% en cinco años; no obstante, la probabilidad que ocurra alguno de estos eventos es de un 10% anual. Así entonces, el rol de los médicos es mantener la enfermedad compensada y así evitar el trasplante hepático junto con lograr una mejor sobrevida.
Estimación de gravedad
Una de las formas disponibles para evaluar la gravedad de la cirrosis hepática es determinar el número y gravedad de las complicaciones mayores, al igual que la estimación de la calidad de vida. En el primer caso, la medición resulta subjetiva y “manipulable”, en tanto que la segunda no es cuantificable ni aplicable.
Otro método más objetivo, que se usa en forma habitual, es el índice de Child-Pugh que tiene ciertas desventajas, pues dos de los criterios a evaluar son subjetivos (ascitis, que se puede modificar con el uso de diuréticos; y encefalopatía) y las variables restantes tienen el problema de presentar un límite superior cuestionable, por ejemplo, no habría diferencia pronóstica entre un paciente con 3 mg/dl de bilirrubina comparado con uno que tenga 15 mg/dl, ya que ambos tendrían igual puntaje en este criterio (Tabla 1).
En el mundo, y en Chile, se comienza a aplicar el sistema de puntaje model for end stage liver disease (MELD) como índice pronóstico, cuya ventaja radica en que sólo utiliza tres variables cuantitativas, objetivas y fáciles de evaluar, con las que se calcula un puntaje total en base de una fórmula matemática, cuyos valores se distribuyen entre 6 y 40. Este score evalúa, en orden de importancia estadística, el INR, creatinina y bilirrubina. La incorporación de la función renal es la gran ventaja con respecto a la clasificación de Child-Pugh.
La mortalidad se relaciona en forma directa con el puntaje obtenido en el score MELD en pacientes en lista de espera para trasplante hepático. Un valor menor a 10 se correlaciona con 2% de mortalidad a tres meses y, por lo tanto, no tendría indicación de trasplante; sin embargo, con valores mayores o iguales a 15 (en especial mayores de 20) la mortalidad aumenta en forma importante. Por lo anterior, a nivel mundial ya no se utiliza la clasificación de Child para definir la gravedad de los pacientes en lista de espera de trasplante hepático, sino el score MELD.
Las potenciales complicaciones más relevantes de la cirrosis hepática son ascitis, síndrome hepatorrenal (SHR), hemorragia variceal, miocardiopatía y hepatocarcinoma.
Ascitis
Los pacientes cirróticos desarrollan con frecuencia hipertensión portal lo cual determina un aumento de factores vasodilatadores como oxido nítrico y otros péptidos, que entonces provocan una vasodilatación arterial esplácnica patológica con la consecuente hipotensión, que se presenta desde la etapa Child B en adelante, y que es sensada como una hipovolemia por los barorreceptores centrales. Se activa así el sistema nervioso simpático, el sistema renina-angiotensina-aldosterona y aumenta la liberación de hormona antidiurética. La activación persistente del sistema produce una vasoconstricción intensa a nivel cutáneo, cerebral, muscular y del territorio renal, cuya máxima manifestación es el SHR. Junto con lo

anterior, se produce una retención de sodio y agua que determina la aparición de ascitis y edema, y la disminución de la excreción de agua libre que se manifiesta como hiponatremia con volumen extracelular expandido.
El eventual tratamiento del estado de hiperaldosteronismo consiste en la utilización de un diurético distal como la espironolactona, para el cual existen dos modalidades de administración. El primer esquema, llamado progresivo, consiste en el uso del medicamento como monoterapia en dosis creciente hasta alcanzar la dosis máxima (100, 200 y por último 400 mg/día); y de no existir respuesta favorable se asocia, a la dosis máxima de espironolactona, furosemida en dosis creciente hasta alcanzar también la dosis máxima (40, 60, 80 y 160 mg/día). La segunda modalidad, o esquema combinado, es el comienzo de una terapia biasociada de espironolactona más furosemida, en dosis de 100 mg/día y 40 mg/día en forma respectiva, y reevaluar el aumento al doble de la dosis cada cuatro días, hasta llegar a un máximo de 400 mg/día de espironolactona y 160 mg/día de furosemida.
La tasa de respuestas para el esquema progresivo es de 94%, en tanto para el esquema combinado es de 98%; con una media de respuesta aproximada de 12 días para ambos esquemas, pero la necesidad de reducir las dosis por hipovolemia, insuficiencia renal, hiponatremia o encefalopatía es mayor si se asocian dos diuréticos en comparación al uso de espironolactona como monoterapia. Por lo tanto, el esquema progresivo es preferible en pacientes con cirrosis y ascitis (2).
Tratamiento ideal de ascitis grado 2. Es importante la determinación de la natriuresis previo al tratamiento diurético, sin importar si se analiza a partir de muestra aislada o mientras se usan diuréticos. Si el paciente tiene menos de 10 mEq/Lt en muestra aislada, lo más probable es que el proceso de antinatriuresis sea grave, por lo que la respuesta a los diuréticos será deficiente y se deberán utilizar altas dosis desde un comienzo. La respuesta ideal en pacientes sin edema es perder entre 200 a 500 gr/día de peso, en tanto en pacientes con edema, será de 500 a 1000 gr/día.
El tratamiento de la ascitis moderada no requiere ingreso hospitalario, ya que puede ser controlada bajo una restricción moderada de sodio de 4 a 5 gr/día, y no absoluta, para evitar desnutrición. Junto a lo anterior, se recomienda una ingesta moderada de líquido, uso de diuréticos antagonistas de la Aldosterona (de preferencia espironolactona) y nunca utilizar furosemida como monoterapia.
Ascitis refractaria. Los pacientes con ascitis refractaria a terapia diurética en dosis máximas y bajo restricción de sodio, tienen riesgo de peritonitis bacteriana espontánea y desnutrición, por lo tanto tienen indicación de paracentesis evacuadora total asociada a albumina 8 gr/Lt más terapia diurética intensa. Si la ascitis recidiva, tienen indicación de trasplante hepático, pero en Chile éste no ocurre antes de 18 meses, por lo que durante todo este período de espera se deberá continuar con paracentesis evacuadora a repetición o utilizar una derivación protésica porto-sistémica o TIPS, la cual está indicada en recidivas frecuentes o ascitis refractaria, y contraindicada en pacientes con encefalopatía crónica y en la trombosis portal.
Al realizar paracentesis total, se debe tener en cuenta el riesgo de producir una disfunción circulatoria inducida por paracentesis (DCIP), la cual es una complicación grave, y cuya clínica se caracteriza por ser silente, pero favorece la aparición abrupta de la ascitis uno a seis días posterior al procedimiento, con insuficiencia renal, lo que puede reducir la sobrevida. Esta complicación se produce cuando aumenta en 50% la actividad de renina periférica por sobre el valor previo al tratamiento (no es rutinaria su medición por ser de alto costo y poco práctico),

hasta un nivel mayor a 4 ng/ml/hora al sexto día postparacentesis, y cuando no se utilizan expansores plasmáticos. Es así que las paracentesis mayores a 5 Lt siempre deben ser asociadas a un expansor plasmático para evitar la insuficiencia renal y el SHR.
Está demostrado que, de realizar paracentesis total sin utilizar expansor plasmático, la posibilidad de desarrollar DCIP sobrepasa el 50%; el cual disminuye con la administración de albúmina hasta alrededor de 10%. Si se extraen volúmenes pequeños, menores a 5 o 6 Lt, es probable que el aporte de expansores plasmáticos pueda ser menos enérgico; por otra parte, cuando se realizan paracentesis repetidas, procedimiento habitual en el servicio de urgencias, los sistemas antinatriuréticos se mantendrán activados y por lo tanto también se deberá utilizar albúmina. El no utilizar expansores es una mala decisión terapéutica, ya que el riesgo de complicación es muy elevado.
Así entonces, la paracentesis total con albúmina endovenosa es el tratamiento estándar en ascitis refractaria al ser eficaz y segura en la eliminación de la ascitis; aunque puede producir DCIP, lo que provoca una mayor recurrencia de la ascitis y reducción de la supervivencia. Sin embargo, no olvidar que corresponde a un tratamiento local que no modifica los mecanismos responsables de la formación de ascitis, por lo que la recidiva es frecuente.
Síndrome hepatorrenal
Hace algunos años se consideraba una entidad intratable y con pronóstico mortal a corto plazo. Hoy en día ha cambiado su enfoque terapéutico y se considera una condición tratable, y con potencial reversibilidad.
Se han definido dos tipos de SHR según el Club Internacional de Ascitis. El SHR tipo 1 corresponde a un deterioro rápido y progresivo de la función renal reflejado en un aumento del 100% en la creatinina plasmática hasta un nivel mayor de 2,5 mg/dl en menos de dos semanas, o una disminución del clearence de creatinina hasta un nivel menor a 20 ml/min en menos de dos semanas; en tanto el SHR tipo 2 se define como un deterioro leve y progresivo de la función renal asociado a una ascitis refractaria a terapia diurética.
La fisiopatología del SHR se inicia con el daño hepático crónico avanzado y con la hipertensión portal secundaria, lo que provoca una disfunción circulatoria grave e hipoperfusión renal con activación del eje renina-angiotensina-aldosterona, el sistema simpático, y el aumento de la síntesis de hormona antidiurética. La isquemia renal resultante provoca un aumento de la síntesis de vasoconstrictores intrarrenales (angiotensina II, adenosina, endotelina –1, leucotrienos, isoprostanos-F2) y disminución de factores vasodilatadores (oxido nítrico, prostaglandinas y calicreína) que perpetuán el ciclo de isquemia. Este proceso explica el SHR tipo 2, que cuando ocurre alguna descompensación con isquemia renal aguda se produce el SHR tipo 1.
Las descompensaciones ocurren por la aparición de infecciones graves, peritonitis bacteriana espontánea, neumonia, pielonefritis aguda, aporte excesivo de diurético, vómitos, diarrea o deshidratación grave; las que determinan una necrosis tubular aguda. Los SHR tipo 1 y 2 se consideran en la actualidad como un continuo, en cuyo caso ya no es requisito la ausencia de alguna causa secundaria que explique la reagudización de la falla renal. Si esta falla se mantiene, pese a la resolución de la causa secundaria, se está frente a un SHR tipo 1.
Tratamiento. Los pilares del tratamiento son el incremento del volumen plasmático efectivo, la disminución de la presión portal y el trasplante hepático ortotópico.

Para el aumento del volumen plasmático efectivo, son necesarias drogas vasoconstrictoras del sistema esplácnico y que, por lo tanto, disminuyen la hipertensión portal. Entre éstas drogas se encuentran los análogos de la vasopresina como la ornipresina y la terlipresina (droga económica que se puede administrar por vía periférica), esta última con una efectividad de hasta 50% cuando se asocia a un expansor plasmático para evitar una disfunción circulatoria secundaria a la droga vasoconstrictora; y los agonistas alfa adrenérgicos como la norepinefrina y midodrine.
El efecto de los vasoconstrictores y de la albúmina se refleja en la disminución de la creatinina plasmática bajo 1,5 mg/dl y en la mejoría hemodinámica sistémica del paciente a través de la normalización de la presión arterial media y de la supresión de los sistemas vasoconstrictores.
El tratamiento con terlipresina (0,5 a 2mg cada 4 horas EV) más albúmina (1gr/kg el primer día y 20 a 40 gr/día después) hasta la desaparición del SHR o tras 15 días de tratamiento, permite prolongar el plazo de trasplante hepático hasta seis meses en pacientes que años anteriores no tenían posibilidad alguna de sobrevivir. Se ha demostrado que la asociación de terlipresina junto a albúmina logra una sobrevida de 87% en un mes, en tanto que el tratamiento sólo con terlipresina alcanza una sobrevida de 13% (9).
Varices esofagogástricas
En el paciente cirrótico recién diagnosticado, las várices esofagogástricas (VEG) están presentes en 30% de los cirróticos compensados y en 60% de los descompensados, y cerca del 30% de estos pacientes desarrollan hemorragia por ruptura de las mismas. La mortalidad inicial por hemorragia puede exceder al 50%, y el riesgo de recidiva hemorrágica en el paciente no tratado es de 60%.
El concepto actual es que los enfermos no deben desarrollar várices, y si las tienen, éstas deben ser de pequeño tamaño y sin signos de riesgo de sangrado (Fig. 5).
El manejo de la VEG consiste en realizar una profilaxis del primer episodio de hemorragia, manejar el episodio agudo de sangrado cuando corresponda y prevenir el resangrado.
Profilaxis del primer episodio. Todo paciente con VEG, aun con cirrosis compensada que no ha sangrado nunca, debe recibir profilaxis farmacológica. La droga indicada para la profilaxis primaria es el propanolol (bloqueador beta no selectivo) en las dosis máximas que la hemodinamia del enfermo admita, lo que permite una reducción del riesgo de sangrado en 30 a 40%.
Sin embargo, al menos 50% de los enfermos no tolera el manejo farmacológico lo que se manifiesta por frialdad de extremidades inferiores, síndrome bronquial obstructivo, claudicación intermitente o impotencia. Por lo tanto, en aquellos pacientes con VEG de moderado a gran tamaño, que no han sangrado, la profilaxis debe considerar la ligadura variceal endoscópica en aquellos Chile B o C. Si bien, no existe evidencia adecuada que demuestre una disminución de la mortalidad ni los beneficios a largo plazo, cada vez son más los estudios que apoyan este tratamiento por ser más eficaz que el manejo farmacológico.
Episodio de sangrado agudo. El manejo se basa en la corrección de la hipovolemia, en la prevención de complicaciones (infecciones, encefalopatía y broncoaspiración), control de la hemorragia y en la prevención de la recidiva hemorrágica precoz.

La corrección de la hipovolemia debe ser cautelosa para evitar sobretransfundir al paciente, por lo que la indicación de uso de hemoderivados se considera a partir de los 8 gr/dl de Hb. La corrección depende de la edad, las comorbilidades asociadas, la presencia de hemorragia activa, etc.
La translocación bacteriana en el tubo digestivo determina que, a las 48 horas, el 50% de los pacientes esté infectado, lo cual predispone al desarrollo de peritonitis bacteriana espontánea y sepsis. Debido a esto, la prevención de infección se realiza con antibióticos por siete días, con ceftriaxona o norfloxacino.
Para la prevención de encefalopatía se utilizan las medidas clásicas como lactulosa o lactitol (polialcohol empleado como edulcorante artificial). Lactulosa ha demostrado utilidad sólo cuando el paciente presenta encefalopatía y no como profilaxis.
La prevención de broncoaspiración en pacientes con sangrado masivo, hematemesis e inestabilidad hemodinámica, se basa en la intubación orotraqueal en pabellón, para disminuir el riesgo de neumonia por aspiración que tiene una gran mortalidad.
Otro punto importante en el tratamiento de la hemorragia variceal aguda es el uso de vasoconstrictores esplácnicos (terlipresina) previo a endoscopía digestiva alta (EDA), los cuales se puede iniciar en el box de urgencia y se deben mantener por cuatro a cinco días. La EDA tiene que ser llevada a cabo dentro de las primeras 12 horas desde el inicio del episodio agudo.
Una vez controlado el episodio hemorrágico agudo se debe realizar la prevención secundaria, que consiste en la ligadura endoscópica de las várices hasta que desaparezcan o el uso de balones a modo de rescate. En la actualidad la hemorragia variceal no debiera ser una causa importante de mortalidad en pacientes cirróticos.
Existe sin embargo, 80% de riesgo de recidiva hemorrágica, por lo que la prevención de esta debe ser instaurada desde el sexto día posthemorragia. El método ideal es la asociación de ligadura de VEG con bloqueadores beta. En caso de fracaso al tratamiento, se propone el procedimiento de derivaciones porto-sistémicas quirúrgicas y no quirúrgicas (anastomosis esplenorrenal distal o TIPS) en pacientes catalogados como Child A o B; y de trasplante hepático en pacientes Child B a C.
TIPS (Transyugular intrahepatic portosistemic shunt)
La derivación porto-sistémica intrahepática transyugular (TIPS) se utiliza con una frecuencia cada vez mayor. Corresponde a un canal de baja resistencia a través de una vena hepática (habitualmente la suprahepática derecha) que se conecta con la porción intrahepática de la porta de alto flujo, a través de técnicas angiográficas cuyo objetivo es descomprimir el sistema portal y tratar sus consecuencias. Funciona como una derivación porto-cava quirúrgica, pero de manera calibrada, no requiere anestesia general ni tampoco una gran cirugía. En Chile y en otras partes del mundo es realizado por radiólogos, pero también por hepatólogos (Fig. 6).
Las indicaciones más importantes en la actualidad son el sangrado variceal masivo y la ascitis refractaria. En el contexto de una hemorragia activa, el TIPS disminuye la tasa de sangrado (16% versus 44% de la aplicación de EDA y fármacos); sin embargo, aún no afecta la sobrevida a largo plazo y además aumenta la incidencia de encefalopatía si se compara con el

tratamiento endoscópico (33 y 17% respectivamente). Su mayor utilidad es el ser una terapia puente para el trasplante en pacientes con un puntaje Child B o mayor con hemorragias.
Por otra parte, el TIPS mejora la hemodinamia portal, al disminuir la vasodilatación esplácnica, y la perfusión renal. Al cabo de 10 días comienza a aumentar la velocidad de filtración glomerular (VFG) junto al flujo plasmático renal, disminuye la resistencia vascular intrarrenal, aumenta la natriuresis a partir de la primera o segunda semana y, por lo tanto, disminuye la reabsorción proximal de sodio e incrementa la oferta del mismo al túbulo distal. En la actualidad, la colocación de un TIPS es una solución razonable si el paciente lo puede costear.
Los candidatos ideales para la colocación de TIPS son aquellos con una enfermedad en estadio Child A o B, con bilirrubina menor a 2 mg/dl, INR menor a 1,5, creatinina menor a 2 mg/dl y sin encefalopatía. Son factores de mal pronóstico una bilirrubina mayor a 3 mg/dl, un INR mayor a 2, creatinina mayor de 2 mg/dl, encefalopatía grado mayor o igual a 2 e hipertensión pulmonar o falla cardiaca.
En el SHR con ascitis refractaria y con riesgo de desarrollar SHR tipo 1, el TIPS es una terapia que muestra resultados favorables. En SHR tipo 1 produce un lento y moderado aumento de VFG, con disminución de la creatinina en 50% de los casos; con lo que logra una sobrevida aproximada de dos a cuatro meses. Sin embargo, no existen estudios comparativos con vasoconstrictores, pero la eficacia parece ser similar.
En SHR tipo 2, se asocia a mejoría del clearence de creatinina, mejor control de la ascitis y disminución del riesgo de progresión a HRS I. Al comparar con paracentesis repetidas y uso de albúmina, no se encontró mejoría en la sobrevida (10). Es necesario sopesar la utilización de TIPS versus el efecto de vasoconstrictores según costo, reacciones adversas y el dudoso efecto en mejoría sobrevida.
Contraindicaciones. Las absolutas corresponden a pacientes con enfermedad avanzada (Child C) debido al riesgo de hipoperfusión hepática lo que empeora la función hepática, insuficiencia cardiaca con capacidad funcional mayor o igual a II, ya que aumenta el retorno venoso en forma significativa; portador de enfermedad poliquística, trombosis de la vena porta o esplénica, y dilatación masiva de la vía biliar intrahepática. Las contraindicaciones relativas son el poseer una infección activa, encefalopatía, tumor vascularizado hepático, coagulopatía grave, hígado pequeño e hipertensión pulmonar.
Complicaciones. El TIPS, aun en las mejores manos, es un procedimiento que tiene una mortalidad de 1 a 2%, la cual se relaciona con la técnica y al shunt porto-cava; y una morbilidad entre 7 a 10% de los casos. El objetivo es que el TIPS tenga un diámetro pre-calibrado, de forma tal que sea lo bastante grande para reducir la gradiente de presión venosa hepática (GPVH) bajo los 12 mm de mercurio (Hg); y que sea lo bastante pequeño para mantener la presión de perfusión portal para evitar acrecentar la insuficiencia hepática y encefalopatía. Lo ideal es que la GPVH se mantenga entre 9 a 12 mm Hg tras el uso de TIPS.
Hoy en día, para evitar los principales problemas del TIPS (estenosis y trombosis) se utilizan prótesis recubiertas con un material siliconado o teflonado que disminuyen el riesgo de trombosis.
Miocardiopatía cirrótica

Enfermedad asociada a cirrosis, por lo general asintomática, caracterizada por una disminución de la respuesta contráctil a estímulos fisiológicos o farmacológicos y puesta en evidencia al existir cierto grado de sobrecarga miocárdica o estrés cardiovascular.
El paciente cirrótico compensado, no azotémico y sin ascitis, presentará en forma progresiva una dilatación paulatina de su territorio esplácnico que determinará la aparición de ascitis. En este continuo, aumentan en forma constante los sistemas antinatriuréticos, la absorción de agua y sodio, y se puede llegar a la complicación más grave que es el SHR. Lo anterior determina una disfunción diastólica del miocardio que aumenta en forma progresiva junto con un deterioro de la capacidad contráctil del mismo. Por lo tanto, mientras los mecanismos fisiopatológicos de los pacientes cirróticos avanzan, la miocardiopatía también lo hace.
El paciente cirrótico es un paciente vasodilatado y rara vez hipertenso, por lo tanto, con una postcarga disminuida, se considera “autotratado” en el sentido de que esta condición favorece el volumen expulsivo; razón por la cual la falla miocárdica es subclínica. Es raro encontrar pacientes Child A o B con disnea de origen cardiogénico, salvo que sean sometidos a una prueba de estrés. Esta prueba puede ser fisiológica, farmacológica o patológica, lo que es relevante en pacientes trasplantados. Cualquier estrés puede desencadenar una respuesta ventricular insuficiente y el desarrollo de una insuficiencia cardíaca.
El TIPS puede desencadenar una descompensación cardíaca al aumentar en forma súbita el retorno venoso, disminuir la vasodilatación esplácnica y al incrementar la postcarga cardíaca. Otro evento en el cual se manifiesta la miocardiopatía es en pacientes trasplantados hepáticos a través de un mecanismo fisiopatológico similar al TIPS, ya que la mejoría de la hipertensión portal post operatoria aumenta el retorno venoso y esto puede hacer claudicar a un ventrículo más rígido. Por otra parte, el TIPS produce un aumento de las presiones cardiopulmonares que puede desencadenar en el 10% de los casos una insuficiencia cardíaca manifiesta. Es necesario tener precaución con esta condición clínica denominada miocardiopatía cirrótica, ya que puede hacer fracasar un trasplante hepático lo que obliga a compensar al paciente en forma previa (11-14).
En conclusión, la miocardiopatía cirrótica es una entidad recientemente descrita, caracterizada por una alteración en la contractilidad cardíaca, cuya causa es multifactorial y que no ha sido aún establecida de manera clara. La disfunción cardíaca es siempre subclínica y se pone de manifiesto en casos de sobrecarga cardíaca como ocurre tras la instalación de un TIPS o posterior al trasplante. El tratamiento no difiere en forma significativa del tratamiento habitual de la insuficiencia cardiaca en pacientes no cirróticos, a excepción de los casos con un debut agudo en donde el pronóstico es ominoso. En la actualidad no existen herramientas adecuadas para el diagnóstico de esta complicación.
Carcinoma hepatocelular
Complicación inherente de la cirrosis hepática, que tiene tratamiento y curación en los casos de diagnóstico precoz; en donde el mejor tratamiento es el trasplante hepático.
Los procedimientos terapéuticos se dividen en terapias radicales, correspondientes al 30% de los casos debido a que la gran mayoría consulta en etapas tardías, y que abarcan la resección quirúrgica, el trasplante hepático y las terapias percutáneas (inyección de alcohol y radiofrecuencia); las terapias paliativas en el 40 a 50% de los casos, como son la embolización transarterial o quimioembolización, la embolización transarterial percutánea, inmunoterapia o tratamiento hormonal, y el sorafenib (fármaco inhibido de la tirosin-quinasa que bloquea la vía

de señales del ciclo celular e impide tanto la proliferación de células tumorales como la formación de vasos sanguíneos que alimentan el tumor) utilizado además en el tratamiento del hipernefroma, y la terapia sintomática utilizada en el 20 a 30% de los casos. En todo paciente cirrótico, independiente de la causa, se le debe seguir permanentemente con imágenes y alfa feto proteína en forma secundaria.
Así entonces, el rol del médico consiste en diagnosticar un tumor en estadio precoz, el cual se define como un tumor menor de 5 cm o tres nódulos menores de 3 cm, sin invasión vascular ni linfática, con tomografía computarizada de tórax y cintigrafía ósea normales. Bajo estas características, en un enfermo curable y según las condiciones locales, el paciente será candidato a trasplante, resección o alguna técnica percutánea.
Al paciente apto para trasplante se le asignará un puntaje MELD de 22 puntos en forma inicial, ya que el hepatocarcinoma crece en forma paulatina. Con el transcurso del tiempo, al puntaje inicial se le agrega 1 punto cada tres meses, lo que permite elevar la posición en la lista de espera de trasplante hepático debido al empeoramiento del pronóstico. Lo anterior, ha generado que la primera causa de trasplante hepático sea el hepatocarcinoma en pacientes Child A con una función hepática conservada.
Referencias:
1. Oksenberg D. Liver cirrosis: modern management of old complications. Medwave 2010 May;10(5):e4518 doi: 10.5867/medwave.2010.05.4518 Disponible en: http://www.mednet.cl/link.cgi/Medwave/Reuniones/4518