Durabilidade: oxidação, corrosão e degradação · 2, que é insolúvel. →Ligando dois metais...
Transcript of Durabilidade: oxidação, corrosão e degradação · 2, que é insolúvel. →Ligando dois metais...
A16Durabilidade: oxidação, corrosão e
degradação
1. Oxidação, flamabilidade, fotodegradação2. Corrosão por líquidos
Velocidades de oxidação
O ganho ou perda de massaΔm é medido para uma fina placade material (para dar uma área superficial elevada)
óxido volátilΔm ∝ t-1
óxido aderente
Δm ∝ t
Δm ∝ t1/2
O estado mais estável da maioria doselementos é como um óxido. Técnicasde termoquímica, electroquímica, e síntese permitem refinar os óxidos paraobter os materiais que utilizamos emengenharia, que não são, em geral, óxidos.A partir do momento em que são fabricados,começam a re-oxidar.
FlamabilidadeCerâmicos e vidros não ardem. Metais também não (em volume, quando dispersos em poeirasfinas são potencialmente combustíveis). A maior parte dos polímeros são inflamáveis:alguns ardem espontaneamente se a combustão fôr iniciada, em outros a combustão auto-extingue-se, ardendo apenas se forem expostos a uma chama.
Limiting oxygen index (LOI): é a concentração em oxigénio necessária, em %,para manter uma queima em estado estacionárioO ar tem 21% de oxigénio → um polímero com LOI inferior arde no ar, umpolímero com LOI mais elevado extinguir-se-à a não ser que seja exposto a uma chama: nesse caso arde
FotodegradaçãoNão é necessário fazer arder um polímero para o oxidar.
Polímeros e elastómeros envelhecem por exposição à luz (em particular UV)e oxigénio, causando perda de resistência mecânica, rigidez, e tenacidade,descoloração e perda de brilho
Este envelhecimento é contrariado por aditivos: antioxidantes, estabilizadoresetc.
Estes aditivos são tão universais que a formulação “standard” dos polímerosjá contêm um ou mais destes: PP, ABS, PS, PET, PMMA, PC, nylons e PUprecisam de protecção contra o UV
Mecanismos da oxidaçãoQuando um metal (com a excepção de Au, Pt, e alguns outros, ainda mais caros) éexposto ao ar, forma-se imediatamente um filme ultra fino de óxido
M(metal) + O(oxigénio) → MO(óxido) + energia
O filme separa o metal do oxigénio. Para a reacção continuar, o oxigénio tem deatravessar o film.
Neste caso, o filme de óxido sobre cracks (fissuras) e não protege o metal
Neste caso, o filme de óxido protegeo metal do oxigénio. Para continuar areagir, ou os átomos de oxigénio sedifundem até ao metal, ou os átomosde metal se difundem até ao oxigénio→ ganho de massa é parabólico
A força motriz é a energia livre de oxidação,mas a velocidade da oxidação é limitada pelavelocidade da difusão através do filme
Mecanismos da oxidação
(Passo 1 – ocorre à superfície do metal)
(Passo 2 – ocorre à superfície do óxido)
taxa de crescimento do filme de óxido, proporcionalao fluxo de átomos que se difundem através do filme
Materiais que resistem à oxidaçãoElementos para aquecedores, fornalhas, geração de potência, fábricas de engenhariaquímica → materiais que possam ser usados a temperaturas elevadas
Proteger metais com uma camada de óxido:(i) um esmalte – camada de vidro, essencialmente SiO2;(ii) uma camada como ZrO2 (zirconia) pulverizado por plasma;→ dispendiosos e, se danificados, já não protegem
Óxidos de crómio (Cr2O3), alumínio (Al2O3), titânio (TiO2) e silício (SiO2) têm pontosde fusão elevados, e portanto a difusão quer do metal, quer do oxigénio atravésdeles é muito lenta→ se Cr, Al ou Si suficientes forem dissolvidos num material como Fe ou Ni (12-20%)uma camada protectora aderente é formada na liga. Se o óxido fôr danificado, mais Cr, Al ou Si imediatamente oxidam, reparando a protecção
Exemplos: aços inoxidáveis (composição típica Fe-18% Cr-8% Ni) – equipamento de alta Tnichromes (Ni com 10-30% crómio) – elementos para aquecedoresbronzes de Al (cobre com 10% de Al)
Flamabilidade de polímerosCombustão: reacção exotérmica em que hidrocarbonetos são oxidados em CO2 e H2O. A combustão é uma reacção em fase gasosa: os polímeros ou os produtos da sua decomposição têm de se tornar gasosos para o fogo começar. Nesta altura, o calor é suficiente para pirolizar mais polímero, mantendo a reacção.
Quando uma fonte de ignição (faísca ou cigarro) faz arder um material combustível, tal comoo papel, o calor radia, causando outros materiais combustíveis (polímeros e tecidos) adecompôr-se numa mistura gasosa inflamavel.
A combustão envolve a reacção de radicais livres, nomeadamente H.. Os aditivos retardadoresde chama consumem radicais livres (compostos com cloro ou bromo, que forma radicaisCl. ou Br. que se ligam ao H.) ou criam uma camada de vapor de água entre o polímero sólidoe os produtos gasosos da decomposição, limitando a transferência de calor, arrefecendo-oe reduzindo a pirólise (e.g., Mg(OH)2, que se decompôe a 300ºC, libertando H20 e formando MgOinerte)
O que é que causa a fotodegradação?
As reacções de foto-oxidação ou fotodegradação, assim como calor, também criam radicais livres, na presença de uma atmosfera com oxigénio → tornam o polímerofrágil e, se fôr transparente originalmente, branco ou cinzento
Moléculas que absorvem UV, tal como a benzofenona, absorvem a radiação UVe retardam a fotodegradação (problema: concentrações elevadas são necessáriaspara protecção eficaz)
HALS Hindered amine stabilizers inibem a degradação do polímero, não absorvemno UV, e o processo é cíclico em que são regeneradas. Baixas concentrações sãosuficientes para dar boa estabilidade.
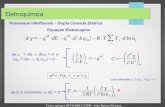
Mecanismos da corrosão – iões em solução e pH
Corrosão por ácidos e bases é uma reacção electroquímica. Metade da reacçãoé a dissociação do metal:
Um meio acídico, com [H+] elevado, estimula esta reacção, e.g.,
Metais resistem a ataque ácido quando o produto da reacção forma uma camadasuperficial de protecção (aqui seria o CuSO4).
Num meio básico, e.g., zinco em soda cáustica,
Nota: a patina turquesa dos telhados de cobre, e os castanho profundos das estátuasde bronze são também criadas pela corrosão
Mecanismos da corrosão – água
Corrosão é a degradação de um metal por umareacção electroquímica com o seu ambiente.
Se o Fe fôr colocado numa solução condutora, comoágua salgada,
O Fe ganha uma carga negativa, que começa a atrairde volta os iões Fe2+. Em estado estacionário, o Fetem um potencial de -0.44 V (relativos a um standard,o do eléctrodo de hidrogénio)
Mecanismos da corrosão – água
Potenciais standard de reduçãodos metais
O Fe dissolve-se, e os iões cobre depositam-seno eléctrodo de Cu.
Mecanismos da corrosão – água
Se o líquido fosse só água, e não sulfato decobre, não há um reservatório de iões cobre.
O Fe continua a dissolver-se e a reacção que se dá é a de hidrólise da água (a água tem oxigénio dissolvido, a não ser que seja especialmente desgasificada)
Enquanto o oxigénio chegar ao cobre, a reacção de corrosão continua,criando iões Fe2+ no ânodo e iões OH- no cátodo. Estes iões reagem para formaro Fe(OH)2, que é insolúvel.
→ Ligando dois metais diferentes em água pura ou água com sais dissolvidos permite a formação de células de corrosão que consomem o metal com o potencial de corrosão mais baixo (mais negativo)
Mecanismos da corrosão – água
Mas...não é necessário ter dois metais – ambasas reacções anódicas e catódicas podemocorrer na mesma superfície
A parte da amostra mais perto da superfícieda água tem acesso fácil a oxigénio, enquantoa parte mais longe não tem
Corrosao por oxidação diferencial é uma das mais frequentes, e mais difíceisde prevenir: sempre que houver água presente, e uma região com acesso a oxigénioe uma região com menor acesso, forma-se uma célula.
Só metais acima do potencial da reacção de hidrólise de +0.81 V são imunes.
Lutar contra a corrosão – the don’ts
Corrosão electroquímica quando doismetais estão em contacto eléctrico→ evitar pares bimetálicos se houverágua e, se tal fôr impossível, isolá-loselectricamente
Corrosão causada por acessodiferencial a oxigénio→ introduzir um selante na junta antes de colocar o rebite
Lutar contra a corrosão – the dos
Protecção de tubos de aço por umânodo sacrificial de Zn→ ligar um metal a outro com umpotencial de redução menor causaque este se corroa, protegendo oprimeiro→ necessário substituir o ânodosacrificial regularmente
Placa de aço galvanizado – o zincoprotege o aço mesmo quando riscado(aço galvanizado é aço com uma finacamada de Zn)
Se estes “truques” não forem possíveis,utilizar uma barreira – tinta – para separaro metal reactivo do meio corrosivo
Próximas aulasProcessamento dos materiais [relação estrutura-propriedades-processamento]Processos de fabrico (A17, dia 15 de Maio)Processamento e propriedades (A18, dia 16 de Maio)
Próxima aula prática P10 (14 de Maio):- discussão do TPC 10- estudo de casos: propriedades ópticas e degradação de materiais
TPC 10 devido sexta-feira, dia 16 de Maio
Miniprojectos – datas : quarta-feira, dia 4 de Junho, de manhã, e segunda-feira, dia 9 de Junho, de manhã.
A última aula teórica A21 será dia 30 de Maio.As aulas práticas P12 (semana de 26 de Maio) e P13 (semana de 2 de Junho) serão dedicadas a apoio à preparação do miniprojecto.