chimie quantique
-
Upload
michael-lee -
Category
Documents
-
view
72 -
download
6
Transcript of chimie quantique

Introduction à Chimie Quantique
Postulat 1: Toute particule, ou plus généralement tout système quantique, est complètement
défini par la donnée des positions (x,y,z) et des vitesses des particules constituant un système. Toutes les informations accessibles concernant le système à l'instant t se déduisent de la connaissance de la fonction complexe ψ (r,t) appelée fonction d'onde.
La chimie quantique est la description des propriétés physico-chimiques, comme la liaison chimique sous la forme de diagrammes d'orbitales moléculaires, la réactivité chimique des molécules ainsi que les mécanismes réactionnels, des objets étudiés au moyen des postulats de la mécanique quantique. Elle est la base de la description des structures électroniques internes des objets chimiques.
Les principes généraux de la mécanique quantique s'énoncent sous la forme de cinq postulats.

Ψ*(r1,..,ri,..rN,t)Ψ(r1,..,ri,..rN,t)dτ1représente la probabilité de trouver chaque particule k (k variant de 1 à N) dans l’élément de volume dτk, au point rk à l’instant et où ψ*(x,y,z,t) est la fonction complexe conjuguée de ψ(x,y,z,t).
1)()(* drr
Elles sont dites normées lorsqu’elles vérifient la condition de normalisation:
Les fonctions Ψ pour qu’elles soient normées doivent faire parti des fonctions dites carré sommable et doivent tendre rapidement vers zéro lorsque les variables tendent vers l’infini.
Il est constitué d’un électron de position re et d’un noyau de position RN.
Postulat2: L'évolution spatio-temporelle de la fonction d'onde obéit à une équation appelée équation de Schrödinger:
Ψ(r,RN,t)
Exemple 2. Le mouvement de translation d’une molécule diatomique AB selon l’axe des x sont décrit par une fonction d’onde Ψ(x,t) où x est la composante selon x du vecteur de position du centre de masse de la molécule.
BA
BBAA
mmxmxmx
Exemple 1: Exemple de L’atome d’hydrogène.

kkkk
kkkk
zyxavec
trVtrVr
),(2m-),(
2m-H 2
N
1k k
2
2
2N
1k k
2
est le Laplacien
Ĥ est l’opérateur hamiltonien.Pour un système à n particules l’hamiltonien est donné par:
m est la masse de la particule, i est le nombre complexe de module 1, V est l’opérateur d’énergie potentielle de la particule. IL décrit l'interaction coulombienne entre deux particules chargées.
ttritrH
),( ),(
2h
En utilisant l’écriture du hamiltonien, l’équation de Schrödinger se réécrit alors pour un système à N particules :
ttrrritrrrtrVtr N
Nr
k
k
),,...,,(),,...,,(),(),(2m- 21
212
2N
1k k
2

Avec r est la distance électron-noyau r = (x2 + y2 + z2 )1/2 et e0 est la permittivité du vide.
L'expression classique de l'énergie cinétique (Ec) d'une particule de masse m est donnée par :
)(21
21
21 22222
zyxc pppm
pm
mvE
P est la quantité de mouvement p = mv.
px= ħ/i ∂ /∂x
py= ħ/i ∂ /∂ypz= ħ/i ∂ /∂z
2m2m2m2m
2
2
22
2
22
2
22
zyx
r4Ze-
2m-
2m-H
0
22
e
22
e
2
eNe
Exemple : L’atome d’hydrogène.
Ze est la charge du noyau

Avec r est la distance électron-noyau r = (x2 + y2 + z2 )1/2 et e0 est la permittivité du vide.
L'expression classique de l'énergie cinétique (Ec) d'une particule de masse m est donnée par :
)(21
21
21 22222
zyxc pppm
pm
mvE
P est la quantité de mouvement p = mv.
px= ħ/i ∂ /∂x
py= ħ/i ∂ /∂ypz= ħ/i ∂ /∂z
2m2m2m2m
2
2
22
2
22
2
22
zyx
r4Ze-
2m-
2m-H
0
22
e
22
e
2
eNe Exemple : L’atome d’hydrogène.
Postulat 3: A chaque grandeur physique A (position, énergie, moment cinétique), correspond
un opérateur  agissant dans l'espace F.Les seuls résultats de mesure possibles de la grandeur physique A sont les valeurs
propres de l' opérateurs Â.
)()(ˆ rarA nnn

Les nombres an sont les seuls résultats de mesure possibles.
<A> = ∫ Ψ* Ψ dτLa valeur moyenne <A> de A associée à l’opérateur  a pour expression:Postulat 4: Soit un système décrit par la fonction d'onde:
et P(r,t) = ψ∗(r,t) ψ(r,t) est la densité de probabilité de présence de la particule au point r et à l'instant t
n
nn trctr ),(),(
t)d(r, t)(r, / (t)c avecτ
**n
La probabilité que le résultat de la mesure de la grandeur physique A soit, à l'instant t, ap est ICp(t)I2
Postulat 5: Si le résultat de la mesure de la grandeur physique A effectuée à l'instant t0 sur le
système décrit par la fonction d'onde ψ(r,, t0) est ap alors, immédiatement après la mesure, la fonction d'onde n'est plus ψ(r,t0) mais elle est égale à la fonction propre ϕp associée à ap.Etats stationnaires
Dans le cas des systèmes conservatifs ou stationnaires pour lesquels l'opérateur ne dépend pas explicitement du temps, il est commode de rechercher les solutions pour lesquelles les variables d'espace et de temps se séparent:

)()(),( tfrtr
ttrrritrrrrVtr N
Nr
k
k
),,...,,(),,...,,()(),(2m- 21
212
2N
1k k
2
ttfrrritfrrrrV
rrtf NNK
k
)(),...,,()(),...,,(),()()(2m 21212
2N
1k k
2
ttftfirV
rrrrr
kN
k
)()()(
),...,,()(
2m 221
2N
1k k
2
Les deux membres dépendent de variables différentes et doivent être égaux pour toutes valeurs de ces variables.
Ils sont donc forcément égaux à une constante notée E. Ceci conduit donc à deux équations :
ErVrrrr
r
kN
k
)(),...,,(
)(2m 2
21
2N
1k k
2
1-
On pose :
),...,,(),...,,()()(2m 21212
2N
1k k
2
NNK
k rrrErrrrVrr
Pour un atome {noyau + électrons}, la résolution de l’équation de Schrödinger donne un couple de solutions: la fonction d’onde (ψ) et l’énergie totale (E) associée.

Ettf
tfi
Ettf
tfi
)()(
)()(
CtkiE)t(f Ln donc
2-
tkiE
Ae)t(f
tkiE
eCe)t(f conséquentpar et
|Y(x,t)|2 = |e+iEt/h (x) . e-iEt/h . (x) | = | e0 (x) (x) |= (x)2
1dx2)x(
La constante A est quelconque et elle peut être ignorée. En fait A sera explicité dans la condition de normalisation puisque une particule quelconque on a:
En effet pour une particule donnée on a :
ErVrrrr
krN
k
k
)(),...,,(
)(2m 2
21
2N
1k k
2
La première équation est:

),...,,(),...,,()()(2m 21212
2N
1k k
2
NNkr
k rrrErrrrVr
k
0)Nr,...,2r,1r(E)Nr,...,2r,1r()r(V2kr
)kr(2N
1k k2m
2
0),...,,( ))(()(2m 212
2N
1k k
2
Nk
r
k rrrErVr
k
C’est l’équation de SCHRÖDINGER indépendante du temps.
Pour une particule k, équation de Schrödinger est :
ttritrrVtr k
kkr
k
),(),()(),(2m-
2
22
donc

Si u 0, les solutions de l’équation auxiliaire seront: x = iu
0 2 ux ux 2
02 vuxx
Cette équation a deux solutions x1 et x2 qui peuvent être, soit toutes les deux réelles, soit toutes les deux imaginaires. A et B sont des constantes quelconques.
L’équation de Schrödinger aura comme solution:
rxrx BeAer 21)(
ruirui BeAer )(
Dans le cas ou l’énergie potentielle est nulle alors on aura:
Considérons l’équation auxiliaire:
xuBxuAr cossin)(
Pour un système monodimentiel on aura

tkiE
e)r(A)t,r(
Si u 0 on pose : a = -u, donc a et x = a
rara BeAer )(
Dans le cas d’un électron astreint à rester sur un segment entre x= 0 et x = L d’un axe de coordonnée x on aura:
xhmEBxhmEAr )/8(cos)/8(sin)( 2222 L’énergie potentielle suit la courbe suivante : E
V = 0La trajectoire L =nl/2 = nh/2mv et puisque Ec =1/2mv2 donc En = n2h2/8mL2

�Etude de cas:Considérons l'équation de Schrödinger stationnaire pour une particule de masse m
sur un axe X plongée dans un potentiel nul.E
2x)x(
)x(2
2m
2
Cette équation a pour solution générale :
xmE2i
Be
xmE2i
Ae)x(
A et B les constantes d'intégration
Si A = B = 1 alors 2)xmE2(cos42)x(
Dualité onde-corpuscule en chimieLa lumière manifeste tantôt un caractère d’onde, tantôt un caractère de corpuscule. Les deux aspects sont reliés par la relation suivante:
l C
hCThhp
P: la quantité de mouvementh :constante de PLANCKT: la périodeC: la vitesse de propagation de la lumièren: la fréquence
hE L’énergie d’une onde électromagnétique est donnée par:
La pulsation d’une onde plane est donnée par: 2w

cos θ = z/r et tan ϕ = y/x élément de volume: dV = r2dr sinθ dθ dϕ
Relation entre coordonnées cartésiennes et coordonnées sphériques:
cossinrx sinsinry
cosrz
0:r,2z2y2xr
0:,2z2y2x
zarccosθ donc rzcos
20:,arccos donc xyan
22
yx
xt
Le Laplacien devient alors :
2
2
2222
22
sin1)(sin
sin1)(1
rrr
rrr

Nombres quantiquesOrbitalesn 0
(couche)0 l n-1
(forme de l’Orbitale)-l m l
(direction de l’Orbitale)1 (K) 0 0 1s (1 orbitale) 2 (L) 0 0 2s (1orbitale)
1 -10
+1
2p (3 orbitales) :x, y, z
3 (M) 0 0 3s (1 orbitale)
1 -10
+1
3p (3 orbitales) :x, y, z
2
-2-10
+1+2
3d (5 orbitales) :xy, xz, yz, z2, x2-y2
etc ...
Ils sont des fonctions d’onde stationnaire Ynlm(r, ,) et ils dépendent de trois nombres quantiques: n: nombre quantique principal; l: nombre quantique azimutal (ou secondaire) et m: nombre quantique magnétique.
Orbitales Atomiques

0 l n-1
-l m l
Le choix des coordonnées sphériques permet la factorisation des orbitales en une partie radiale 𝑅 ,ℓ𝑛 ( ), 𝑟 et une partie angulaire ℓ, ℓ𝑚 ( ,𝜃 ) qui donne la variation de l'orbitale suivant l'orientation du rayon qui relie le noyau à un point de l'espace de coordonnées (r,, ).
Ψ ,ℓ, ℓ𝑛 𝑚 ( , ,𝑟 𝜃 ) = 𝑅 ,ℓ𝑛 ( ) 𝑟 ℓ, ℓ𝑚 ( ,𝜃 )
partie radiale partie angulaire

𝑎 = 52,92 pm : rayon de l’atome de Bohr ; : numéro atomique 𝑍
Parties radiales 𝑅 ,ℓ𝑛 ( ) 𝑟
Parties angulaires 𝑌ℓ, ℓ(𝑚 , )𝜃 𝜙

Exemple: Pour l’état fondamental de l’atome d’hydrogène , la fonction d’onde est :
02/3
01 )1(1 a
r
s ea
Expression mathématique Ψn,ℓ, ℓ𝑚 (r, , )𝜃 𝜙

L’expression générale de la distance moyenne r noyau - électron est donnée par:
)]1(3[2
20 llnZar
1111 )()(*)(//)(r
ssss drrrrrrrr
De manière pratique, le rayon atomique ra correspond au maximum de la densité de probabilité radiale D(r) = r2 𝑅 ,ℓ𝑛 ( )𝑟 2, soit la distance la plus probable séparant l’électron et le noyau.
Rayon atomique
Le calcul montre que ra est donné par la relation : ra = a0n*2/z*.
Z* est la charge effective à laquelle est soumis l’électron porté par l’orbitale envisagén* est le nombre quantique principal effectif.
On obtient la valeur de ra en cherchant les zéros de la fonction dérivée D(r) = r2 𝑅 ,ℓ𝑛 ( )𝑟 2

L’expression générale de la distance moyenne r noyau - électron est donnée par:
)]1(3[2
20 llnZar
1111 )()(*)(//)(r
ssss drrrrrrr
De manière pratique, le rayon atomique ra correspond au maximum de la densité de probabilité radiale D(r) = r2 𝑅 ,ℓ𝑛 ( )𝑟 2, soit la distance la plus probable séparant l’électron et le noyau.
Rayon atomique
Le calcul montre que ra est donné par la relation : ra = a0n*2/z*.
Z* est la charge effective à laquelle est soumis l’électron porté par l’orbitale envisagén* est le nombre quantique principal effectif.
On obtient la valeur de ra en cherchant les zéros de la fonction dérivée D(r) = r2 𝑅 ,ℓ𝑛 ( )𝑟 2
Le rayon: * Dans une ligne, il augmente de droite vers la gauche * Dans un groupe, il diminue de haut vers le bas

Exemple : Déterminer les rayons des atomes et ions suivants: Na, Na+, F et F- et conclure.
Na: 1s2 2s2 2p6 3s1 donc Z* = 11 – (8*0.85 + 2*1) = 2.2 d’où ra = 53 * 32/2.2 = 217 pm Na+: 1s2 2s2 2p6 donc Z* = 11 – (7*0.35 + 2*0.85) = 6.85 d’où ra = 53 * 22/6.85 = 30.9 pm F: 1s2 2s2 2p8 donc Z* = 9 – (6*0.65 + 2*0.85) = 5.2 d’où ra = 53 * 22/5.2 = 40.8pm
F-: 1s2 2s2 2p6 donc Z* = 11 – (7*0.0.35 + 2*0.85) = 4.85 d’où ra = 53 * 22/4.85 = 43.7 pm
Ces résultats montrent qu’un cation a n rayon inférieur à celui de l’atome correspondante et vis versa pour l’anion

Elle est représentée par sa densité de probabilité de présence de l'électron à une distance r du noyau, donnée par : D(r) = r2 𝑅 ,ℓ𝑛 ( )𝑟 2.
Les zones où D(r) = 0 sont celles interdites à l'électron.
1- Fonction radiale

Partie angulaire de l’orbitale s → sphère centrée sur le noyau
Elle est représentée par un diagramme polaire, en portant dans chaque direction de l'espace issue du noyau et caractérisée par les angles et une longueur
OM = ℓ, ℓ𝑚 (𝜃,)
2- Fonction angulaire
Elle est représentée par sa densité de probabilité de présence de l'électron à une distance r du noyau, donnée par : D(r) = r2 𝑅 ,ℓ𝑛 ( )𝑟 2.
Les zones où D(r) = 0 sont celles interdites à l'électron.
1- Fonction radiale

Partie angulaire des Orbitales p → 2 lobes le long d’un axe commun (x, y ou z) de part et d’autre du plan à cet axe, et centrés sur le noyau. Il y a 3 orbitales p (m = -1, 0, +1), px suivant l'axe des x, py suivant l'axe des y et pz suivant l'axe des z.

Parties angulaires des orbitales d → 4 lobes centrés sur le noyau. Il y a 5 orbitales d (m = -2, -1, 0, 1, 2):
dxy dxz
dyz
dx2-y2dz2

Carte s de densitéIl existe deux modes de représentation graphique complète de la distribution de
probabilité électronique :– Courbes d’isodensité: On trace, dans un plan choisi, un réseau de contours sur lesquels la densité totale garde une valeur constante donnée.
a) orbitale 2pz,b) orbitale 3dz
2, c) orbitale 3dx
2-y
2 ,
d) orbitale 3dxy
dPd
Y 2 densité de probabilitéde présence de l'électron
Les courbes d'isodensité électronique sont des surfaces pour lesquelles |Y|2 = k
C'est la représentation des courbes d'isodensité qui donne la meilleure idée de l'extension spatiale de la densité électronique pour chaque orbitale

a) orbitale 2pz,
b) orbitale 3pz
– Cartes de densité, style photographique : La densité dans un état donné y est représenté par la Densité de points clairs sur un fond foncé, rappelant l’impact photonique sur une plaque sensible.

Niveaux d’énergie
L’énergie d’une Yn l m est donnée par:
Hartéenzev
nzjoules
nzmeEn 2
2
2
2
220
24
26.13
2 4
e
Les états de même nombre quantique principal n ont la même énergie, on dit qu’ils sont dégénérés.
Dégénérescence d’une couche
Le degré de dégénérescence est donné par: gn = n2
Par exemple n = 2 on aura 4 niveaux dégénérés qui sont 2s, et les 2p qui sont au nombre de trois.
)11()11(2 4 22222
0
24
pnR
pnzmeE ynp n
e
Ry = 109677 cm-1 est la constante de Rydberg
Avec p n
Les spectres atomiques sont caractérisés, non seulement par les énergies ou les fréquences de la lumière absorbée ou émises mais aussi par les probabilités de ces phénomènes.

La probabilité d’une transition électronique de l’état i défini par Ψn l m(r,θ,ϕ) vers l’état j définit Ψn’l’m’(r,θ,ϕ) est donnée par la formule de Mulliken et Rielke :
2ijijji EkF
K : constante dépendant du système d’unitéΔEij est l’énergie de transitionμij est ce que l’on appelle le moment dipolaire de transition : μij = < Ψj IΣrn I Ψi>rn étant le rayon vecteur du nième électron de l’atome.Seules les transitions pour lesquelles μij 0 sont observées.
Les transitions permises obéissent aux règles de sélection déduites des intégrales suivantes:< Ψn’l’m’IxI Ψnlm> = 0< Ψn’l’m’IyI Ψnlm> = 0< Ψn’l’m’IzI Ψnlm> = 0
Ces règles sont les suivantes : Δm = 0, ± 1 et Δl = ±1 (aucune restriction sur n)
Exemple : La transition 2s 1s est interdite et celle 2s 2p est permise

Il s’agit ici d’une spécificité de la chimie quantique qui régit le comportement de la matière à l’échelle microscopique. Il ne sera pas possible de connaître à la fois temps et énergie ou position et quantité de mouvement (impulsion).Ce sont les inégalités de HEISENBERG qui traduisent mathématiquement cette impossibilité en reliant les incertitudes relatives à E, t, et p (quantité de mouvement mv) et x (position) selon :ΔE Δt ħΔp Δx ħAinsi, si p est connue avec précision (Δp très faible), la position x de la particule n’est pas connue clairement (Δx grand).
Principe d’incertitude d’HEISENBERG
Ca sera le cas si on mesure la vitesse d'une voiture, mais dans le cas d'un électron ou d'un photon, l'inégalité d'Heisenberg prend tout son sens.
Exemple: Déterminer l’incertitude sur sa vitesse dans les deux cas:- Un grain de poussière de masse 6,28 10-6 g, sachant que l’incertitude sur sa position est de 10-4 m. - Un électron dans un atome dont l’incertitude sur sa dimension est 10-10 m (me-= 9,10910-31kg)
Δp Δx ħ donc mΔv Δx ħ d’où Δv h/2mΔx AN : Δv 6.6210-34Js/2 *3.14*6.2810-910-4 kgm = 16.78567 10-19Jskg-1m-1 = 16.78567 10-19kg m2s-2skg-1m-1 = 16.78567 10-19 m/s

Les moments cinétiques
Lx = ypz − zpy Ly = zpx − xpz
Lz = xpy − ypx
On définit le moment cinétique orbital d’une particule, de masse m et de quantité de mouvement p, par rapport à l’origine comme l’ensemble des trois opérateurs:
px= Ћ/i ∂ /∂x
py= Ћ/i ∂ /∂y
pz= Ћ/i ∂ /∂z
On obtient les composantes de cet opérateur en coordonnées sphériques en effectuant le changement de variables suivant :
• Lx = Ћ/i (sin ∂/∂θ - cotgθ cos ∂/∂)Donc • Ly = Ћ/i (- cos ∂/∂θ - cotgθ sin ∂/∂)
• Lz = Ћ/i ∂/∂
cossinrx sinsinry
cosrz Donc L2 = Lx
2+Ly2+Lz
2 = Ћ2[1/sinθ ∂/∂θ (sinθ ∂/∂θ)+ 1/sin2θ ∂2/∂φ2]
Le moment cinétique orbital est quantifié: )1( llL
mLz La projection du moment cinétique selon l’axe z est donnée par:

m est qualifié de magnétique car il traduit le comportement de l’électron en présence d’un champ magnétique. Le moment magnétique est lié au moment cinétique par l’expression:
LM
me
2 est le rapport gyromagnétique ( m est lamasse dans cette formule)
En présence d’un champs magnétique B //à OZ, l’électron voit son énergie modifiée de:
BlBME z
Cet effet est appelé effet Zeeman.
Exemple : si l’électron se trouve à un niveau p alors l =1 donc 2)1( llL
Les niveaux d’énergie sont données par :
= (m1 m2 )/(m1 + m2) est la masse réduite et I = r2 est le moment d’inertie.
22 2/)1( rllEl
Le moment cinétique de spin est quantifié : )1( ssS
sz mS La projection du moment cinétique selon l’axe z est donnée par :

Le couplage LS ou couplage de Russel-Sanders-
Prenons l’exemple d’une sous-couche d remplie. Si on fait la somme de toutes les valeurs de ml d’une part et de toutes les valeurs de ms d’autre part, on trouve 0 dans les deux cas. Le spin total de l’atome est donc s (on peut l’écrire S) et le moment cinétique total de l’atome est l (on peut l’écrire L).
L’atome est donc caractérisé par le couple (L,S) = (l,s) que l’on appelle terme spectral ou plus simplement terme et que l’on note de la manière suivante : 2S + 1Γ
où (2S + 1) est la multiplicité de spin (ici 2 puisque S = 1/2) et Γ est une lettre caractéristique de la valeur de L avec la correspondance suivante :
L 0 1 2 3 4 5 6 7 Γ S P D F G H I J
La dégénérescence totale du terme est (2S+1)×(2L+1). En effet MS, projection de S sur l’axe de référence, peut prendre 2S+1 valeurs (-S ≤ MS ≤ +S) et ML, 2L+1 valeurs(-L ≤ ML ≤ +L). On utilise le M majuscule pour signifier qu’il s’agit ici des moments de l’atome.
Les règles de composition des moments cinétiques montrent que, pour une valeur de L et de S, le nouveau nombre quantique peut prendre plusieurs valeurs données par:L − S ≤ J ≤ L + S

Règle 1 : Le terme fondamental est celui qui possède la plus forte multiplicité de spin.
Règle 2 : Si plusieurs termes ont la même multiplicité de spin alors le terme fondamental est celui qui possède la multiplicité orbitale la plus élevée. Règle 3 : Lorsque la couche est moins qu’à moitié remplie, le niveau le plus bas en énergie (niveau fondamental) est celui qui a la plus petite valeur de J. Les autres niveaux ont des énergies croissantes à mesure que J augmente. Inversement, si la couche est plus qu’à moitié remplie, le niveau fondamental est celui qui a la plus grande valeur de J. L’énergie des niveaux augmente à mesure que J diminue.
Règle de sélection : Seules les transitions électroniques obéissant à: ∆L = ±1 , ∆ J = 0 ± 1 mais la transition J = 0 vers J = 0 est exclue.
Exemple:


Exemple: Un électron 4 p de la dernière couche de l'atome de germanium [Ar] 4s 2 3d 10 4p 2 est excité vers un niveau 4d.
Configuration électronique de cet état excité 4p14d1 .
L’électron 4p a pour nombre quantique: l1=1 et s1 = ½; L’électron 4p a pour nombre quantique : l2=2 et s2 =½ ;
Composition du moment cinétique total : |l1-l2| ≤ L ≤ l1+l2 ; d'où L = 1, 2 ou 3Composition du spin total : |s1-s2| ≤ S ≤ s1+s2 ; d'où S = 0 ; 1 termes spectraux sont du type 2S+1XJ = L + S
couple (L,S) termes spectraux
dégénérescence :(2S+1) (2L+ 1) niveaux
L=1 ; S=0 1P 3 1P1
L=1 ; S=1 3P 9 3P2 ;3P1 ;3P0
L=2 ; S=0 1D 5 1D2
L=2 ; S=1 3D 15 3D3 ; 3D2 ;3D1
L=3 ; S=0 1F 7 1F3
L=3 ; S=1 3F 21 3F4 ; 3F3 ;3F2
Classement énergétique


Application à la formation des liaisons LCAO Une OM Yi s’écrit à partir des OA k: )(
1
ic kk
iki
Prenons l’exemple le plus simple H2+
2211 cci
22112
22
22
12
12 2 cccci
La condition de normalisation :
1 )2( 22112
22
22
12
12 dccccdi
(3) (2) (1)
12 21212
22
22
12
12 dccdcdcdi
En première approximation, on développe en série en se limitant aux termes correspondant au plus haut niveau d'énergie occupé.
Les fonctions 1 et 2 sont ici les OA les plus hautes occupées des atomes d'hydrogène soit 1s1 et 1s2. Les indices 1 et 2 correspondent aux 2 atomes d'hydrogène. On applique l'équation de Schrödinger et on norme la fonction.

(1) : Probabilité de trouver l'électron au voisinage de H1
(2) : Probabilité de trouver l'électron au voisinage de H2
(3) : Probabilité de trouver l'électron entre H1 et H2 ස contribution à la liaison
Les atomes d’hydrogènes sont indistinguables donc :
dcdc 22
22
21
21
1 22
21 dd
Les fonctions 1 et 2 sont normées d’où:
et par conséquent c12 = c2
2 nous déduisons que c1 = ± c2
)(ψou )(ψ 2121 NNNous avons deux solutions pour la fonction d’onde:

On pose:
1 22
dd
entddS recouvrem de intégrale 2112
N+2 + 2N+2S + N+2 = 2N+2(1 +S) =1 donc N+ = 1/2(1+S)
N-2 - 2N-2S + N-2 = 2N-2(1 -S) =1 donc N+ = 1/2(1-S)
Les 2 Orbitales Moléculaires (OM) sont orthogonaux donc :
0 dd
0 ≤ S ≤ 1
Plus S est grand, plus le recouvrement est fort et plus la liaison est forte.

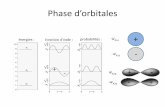
Les énergies E+ et E - n'ont pas la même valeur : ‣ L'OM liante Y+ est stabilisée par rapport au niveau commun des 2 OA 1 et 2
‣ L'OM antiliante Y- est déstabilisée par rapport au niveau commun des 2 OA 1 et 2
(déstabilisation plus importante que la stabilisation
H1 H2
1 2
)(ψ 21 N
)(ψ 21 NE -
E+
Exercice 1: Démontrer que: E+ = ( + )/1+SE- = ( - )/ 1- S
Avec : = 1/H/1 = 2/H/2 0 est l’intégrale coulombienne. = 1/H/2 = 2/H/1 0 est l’intégrale de résonance S = 1/2 est l’intégrale de recouvrement.
Le dérivé de l’énergie par ci donne une valeur nulle.

Il est défini par:N = ½(nombre d’électrons dans des OM liants- nombre d’électrons dans des OM antiliants)
L'indice de liaison correspond au nombre de liaison entre les atomes (un indice de liaison de 2 correspond par exemple à une double liaison). Pour qu'une liaison soit stable, il faut que l'indice de liaison soit strictement positif. Si l'indice de liaison est négatif ou nul, la liaison chimique est instable et tend à se rompre.
L'indice ou ordre de liaison d'une liaison chimique
Types de recouvrement Axial Latéral

Diagramme d’Energie de la molécule d’oxygène

L’énergie de L'oscillateur harmonique classique s'écrivait:
Oscillateur harmonique quantique
Exemple O. H. Q. :Dans une molécule, les liaisons entre atomes sont assimilées à des ressorts.
Imaginons un système que l’’on écarte légèrement de sa position d’équilibre, une force de rappel va essayer de remettre la molécule dans la position d’équilibre.
Du fait que le système est stationnaire. Par conséquent, l'étude quantique de l'oscillateur harmonique se ramène à la résolution de l'équation aux valeurs propres :
H = E Avec donc
où ω est la pulsation propre de l’oscillateur
22
222
21
221
2kx
mP
xmwm
PE xx

Vibration des molécules diatomiques
La solution de cette équation fournit les valeurs possibles de l'énergie totale :
V est le niveau de vibration
Corps de masse m fixé à l’extrémité d’un ressort de raideur k
Equation du mouvement
Déplacer ce corps de x par rapport à la position d’équilibre force de rappel F

Solution générale
où
Expression de l’énergie potentielle
Energie potentielle = f(élongation) Parabole

Fréquence d’oscillation par la loi de Hooke
n k
21
BA
BA
mmmm
)21v(k
2h)1J(J
I8hE 2
2
Energie de rotation – vibration est donnée par:
En général le moment d’Inertie est donné par :
2
iimI ir
Cas de deux particules
I = m1r12 + m2r2
2

J J’=J-1 : BRANCHE P J=0 J’=0 : BRANCHE Q Vibration pure Transition interdite J J’=J+1 : BRANCHE R
Δv = 0,±1 et ΔJ = ±1
a) Δv = 0 : spectre de rotation pure
b) Δv = -1; ΔJ = ±1 : spectre d’émissionc) Δv = +1; ΔJ = ±1 : spectre
d’absorption
Règles de Selection