Aminoácidos, péptidos y proteínas
-
Upload
edali-gloria-ortega-miranda -
Category
Documents
-
view
1.709 -
download
6
Transcript of Aminoácidos, péptidos y proteínas

Aminoácidos. Péptidos. Proteínas
FACULTAD: Ingeniería
EAP: Ingeniería Ambiental
CÓDIGO: BI1002
DOCENTE: Edali Gloria Ortega Miranda
PERIODO ACADÉMICO: 2013-1




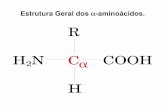
Compuestos que poseen un grupo básico (amino -NH2) y un grupo ácido (carboxílico -COOH).


• El carbono-α (a excepción de la glicina) es un carbono quiral y como tal presenta dos enantiómeros (L- y D-).
• Son 20 los α-aminoácido presentes en las proteínas
• Son de la serie L- y en su representación de Fischer poseen el grupo amino hacia la izquierda.

• La diferencia entre los aminoácidos viene dada por el resto -R, o cadena lateral, unida al carbono-α.
• Técnicamente hablando, se los
denomina alfa-aminoácidos, debido a que el grupo amino (–NH2) se encuentra a un átomo de distancia del grupo carboxilo (–COOH).

Ácidos carboxílicos que contienen una función amina. En determinadas condiciones el grupo amina de una molécula y el carboxilo de otra reaccionan uniendo ambos aminoácidos mediante un enlace amida.

Al poseer H en sus estructuras químicas, son susceptibles a los cambios de pH; por eso, al pH de la célula prácticamente ningún aminoácido se encuentra de esa forma, sino que se encuentra ionizado.

Existe un pH específico para cada aminoácido, donde la carga positiva y la carga negativa son de la misma magnitud y el conjunto de la molécula es eléctricamente neutro. En este estado se dice que el aminoácido se encuentra en su forma de ion dipolar o zwitterión.

• Los iones dipolo (zwitterions) de los aminoácidos son sales internas y por ello tienen muchas de las propiedades físicas asociadas con las sales.
• Poseen momentos dipolares grandes, son solubles en agua e insolubles en hidrocarburos, y son sustancias cristalinas con puntos de fusión altos.

Los aminoácidos son Anfóteros: pueden reaccionar como ácidos o como bases, dependiendo de las circunstancias.





• polaridad y/o carga a pH neutro
• tipo de estructura química
• reactividad
• elementos presentes
• habilidad para formar enlaces de hidrógeno.

GRUPO R APOLARES ALIFÁTICOS
• Apolares e hidrófobos
• Sus cadenas tienden a agruparse entre si en las proteínas, estabilizando las estructura proteica a través de interacciones hidrofóbicas.


• Glicina: La estructura mas simple, aunque formalmente es apolar, su muy pequeña cadena lateral no tiene una contribución real en las interacciones hidrofóbicas.
• Metionina: uno de los dos aminoácidos que contiene azufre (grupo tioester apolar)
• Prolina: Cadena lateral alifática con una estructura cíclica especial.
GRUPO R APOLARES ALIFÁTICOS

GRUPO R AROMÁTICOS
• Cadenas laterales aromáticas
• Relativamente apolares (hidrofóbicos).
• Todos ellos pueden participar en las interacciones hidrofóbicas.


• El grupo hidroxilo de la tirosina puede formar puentes de hidrogeno y constituye un grupo funcional en las enzimas.
• La tirosina y el triptófano son significativamente mas polares que la fenilalanina debido al grupo hidroxilo de la tirosina y al nitrógeno del anillo indólico del triptófano.
GRUPO R AROMÁTICOS

GRUPO R POLARES SIN CARGA
5 α-aminoácidos cuyo resto -R es polar pero sin Carga.

• Serina y treonina: Portadores de un grupo hidroxilo (-OH).
• Asparragina y glutamina: Cadenas laterales portadoras de un grupo amida, y por hidrólisis dan lugar, respectivamente, a aspartato y glutamato, dos aminoácidos con carga negativa.
• Cisteína: debe su polaridad a la presencia de un grupo tiólico (-SH).
GRUPO R POLARES SIN CARGA

GRUPO R CARGADOS POSITIVAMENTE (BÁSICOS)
3 α-aminoácidos con restos –R con carga (+) a pH fisiológico.

GRUPO R CARGADOS POSITIVAMENTE (BÁSICOS)
• Lisina: Cadena lateral de butilamonio
• Arginina: Grupo -R de guanidina
• Histidina: Portadora de un grupo -R de imidazolio.

GRUPOS R CARGADOS NEGATIVAMENTE (ACIDOS)
2 α-aminoácidos con restos –R con carga (-) a pH fisiológico, por la presencia de un grupo carboxilo (- COOH)

AMINOÁCIDOS NO SINTETIZADOS POR EL ORGANISMO, POR LO QUE NECESITAN SER INGERIDOS.

Histidina
Lisina
Leucina
Isoleucina
Triptófano
Treonina
Metionina
Fenilananina
Arginina
Valina

• Los aminoácidos que contienen azufre, metionina y cisteína, se pueden convertir uno en el otro, por lo que por conveniencia se consideran una única fuente.
• La arginina, ornitina y citrulina son interconvertibles, y también se consideran una única fuente de aminoácidos nutricionalmente equivalentes.
• En otros mamíferos, los aminoácidos esenciales pueden ser distintos. Por ejemplo, a los gatos les falta la enzima que les permitiría sintetizar la taurina, que es un ácido derivado de la cisteína, así que la taurina es esencial para los gatos.
• Casi ningún animal puede sintetizar lisina.

Polímeros en los cuales las unidades individuales de aminoácidos, llamados residuos, están unidas mediante enlaces amida, o uniones peptídicas.

El enlace se forma por reacción entre el grupo carboxilo (α-COOH) de un aminoácido y el amino (α-NH2) del siguiente (con pérdida de una molécula de agua) y recibe el nombre de enlace peptídico.



Fr. protéine Gr. πρωτεῖος (proteios)
lo primero, lo principal, lo más importante

• POLÍMEROS DE AMINOÁCIDOS UNIDOS A TRAVÉS DE ENLACES PEPTÍDICOS.
• Biopolímeros (macromoléculas orgánicas), de elevado peso molecular, constituidas básicamente por C,H,O,N; aunque pueden contener también S y P y, en menor proporción, Fe, Cu, Mg, Y, entre otros elementos.

• Unión de un bajo número de aminoácidos: Péptido
• Número de aminoácidos menor de 10: Oligopéptido
• Número de aminoácidos de 10 a 50: Polipéptido
• Número de aminoácidos superior a 50 aminoácidos: Proteína.

TRANSCRIPCIÓN
TRADUCCIÓN

Aminoácido Abreviatura (3 letras) Abreviatura (1 letra) Codones
Ac. Aspártico Asp D GAC GAU
Ac. Glutámico Glu E GAA GAG
Arginina Arg R CGA CGC CGG CGU AGA AGG
Lisina Lys K AAA AAG
Asparagina Asn N AAC AAU
Histidina His H CAC CAU
Glutamina Gln Q CAA CAG
Serina Ser S UCA UCC UCG UCU AGC AGU
Treonina Thr T ACA ACC ACG ACU
Alanina Ala A GCA GCC GCG GCU
Glicina Gly G GGA GGC GGG GGU
Valina Val V GUA GUC GUG GUU
Prolina Pro P CCA CCC CCG CCU
Leucina Leu L CUA CUC CUG CUU UUA UUG
Fenilalanina Phe F UUC UUU
Tirosina Tyr Y UAC UAU
Isoleucina Ile I AUA AUC AUU
Metionina Met M AUG
Triptofano Trp W UGG
Cisteína Cys C UGC UGU
Terminación UAA UAG UGA


Secuencia de aminoácidos en la cadena proteica, es decir, el número de aminoácidos presentes y el orden en que están enlazados.

• Disposición de la secuencia de aminoácidos en el espacio, gracias a la capacidad de giro de sus enlaces, adquiriendo una disposición espacial estable.
• Dos tipos de estructuras: Hélice Alfa y Hoja Beta.

• Plegamiento en espiral de la cadena polipeptídica sobre sí misma.
• En sentido horario • 3,6 aminoácidos por cada vuelta • Estable por medio de puentes de hidrógeno
entre el grupo amino (parte de un enlace peptídico) de un aa y el grupo carboxilo (que forma parte de otro enlace peptídico) del cuarto aa que le sigue en la cadena lineal.
• Las cadenas laterales de los aminoácidos no intervienen en los enlaces y aparecen proyectadas hacia la parte externa de la alfa-hélice.

• Estructura β: configuración espacial de los enlaces covalentes al estirar al máximo la cadena principal de un polipéptido.
• Las cadenas laterales de los aa se sitúan de forma alternante a la derecha y a la izquierda del esqueleto de la cadena polipeptídica.

• Las estructuras β de una misma o distintas cadenas polipeptídicas interaccionan entre sí mediante puentes de hidrógeno, dando lugar a estructuras laminares llamadas por su forma hojas plegadas u hojas β.
• Si las estructuras β tienen el mismo sentido, la hoja β es paralela, y si las estructuras β tienen sentidos opuestos, la hoja plegada es antiparalela.

• Conjunto de plegamientos característicos por la unión entre determinadas zonas de la cadena polipeptídica.
• Estas uniones se realizan por medio de enlaces entre las cadenas laterales R de los aminoácidos.

3 grupos: • Fibrosas (cadenas polipeptídicas
en largas hebras u hojas, insolubles en agua).
• Globulares (cadenas polipeptídicas plegadas en formas globulares o esféricas, solubles en agua).
• Mixtas (estructura fibrosa al centro y globular a la superficie)

• Responsable directa de su FUNCIÓN y sus propiedades biológicas • La disposición espacial de los distintos grupos funcionales determina su
interacción con los diversos ligandos. • Para las proteínas que constan de una sola cadena polipeptídica (carecen de
estructura cuaternaria), esta es la máxima formación estructural.

Enlaces:
• Puentes disulfuro. Enlaces covalentes entre dos grupos -SH que
pertenecen al aa cisteína.
• Fuerzas electrostáticas. Enlaces de tipo iónico entre grupos con cargas
eléctricas opuestas.
• Puentes de hidrógeno. Entre grupos polares no iónicos en los que
existen cargas parciales en su cadena lateral.
• Fuerzas de Van der Waals e interacciones hidrofóbicas. Uniones más
débiles, entre aminoácidos apolares.

• Unión mediante enlaces débiles (no covalentes) de varias cadenas polipeptídicas con estructura terciaria, para formar un complejo proteico.
• Generalmente los aminoácidos apolares se sitúan hacia el interior de la proteína y los polares hacia el exterior

• Cada cadena polipeptídica recibe el nombre de protómero. El número de protómeros varía desde dos hasta varios.

Los protómeros pueden ser: • Exactamente iguales (fosfoglucoisomerasa, hexoquinasa). • Muy parecidos (lactato deshidrogenasa). • Estructura distinta pero con una misma función (hemoglobina). • Estructural y funcionalmente distintos, que una vez asociados forman una
unidad funcional (aspartato transcarbamilasa).

• Solubilidad: Siempre que los enlaces fuertes y débiles estén presentes. Si cambia la temperatura y el pH se pierde la solubilidad.
• Capacidad electrolítica: Se determina a través de la electroforesis.
• Especificidad: Cada proteína tiene una función específica que está determinada por su estructura primaria.
• Amortiguador de pH (efecto tampón): Actúan como amortiguadores de pH debido a su carácter anfótero, es decir, pueden comportarse como ácidos o como bases.


1. Catálisis: enzimas (pepsina, tripsina, lipasa, etc).
2. Reguladoras: hormonas (insulina, glucagón, etc.)
3. Estructural: resistencia y elasticidad (tubulina del citoesqueleto).
4. Defensiva: Glicoproteínas (inmunoglobulinas), queratina (piel), fibrinógeno
y protrombina (coágulos).
5. Transporte: Hemoglobina.
6. Receptoras: En la membrana celular, reciben señales para que la célula
pueda realizar su función (acetilcolina).

Pérdida de las estructuras de orden superior (secundaria, terciaria y cuaternaria), quedando la cadena polipeptídica reducida a un polímero sin ninguna estructura tridimensional fija, con lo que pierde su función.

La solubilidad de las proteínas se reduce hasta producirse precipitación, porque los enlaces que mantienen la conformación globular se rompen y la proteína adopta la conformación filamentosa. Los enlaces peptídicos no se afectan.

• Cambios de ph
• Alteraciones en la concentración
• Agitación molecular
• Variaciones bruscas de temperatura
FACTORES QUE FAVORECEN LA PRECIPITACIÓN DE PROTEÍNAS




MARASMO KWASHIORKOR KWASHIORKOR MARASMÁTICO

27/03/2013 66