Aminoácidos e proteínas
-
Upload
miqueiasgomes -
Category
Documents
-
view
85 -
download
7
Transcript of Aminoácidos e proteínas
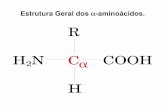
Aminoácidos
Características básicas
-grupo carboxila + grupo amino no carbono α
-diferem em suas cadeias laterais (grupos R)
Asparagina
1° aminoácido
descoberto
(1806)
Treonina
20° AA
descoberto
(1938)
Funções dos aminoácidos
L-aminoácido
Moléculas de transporte para:
Grupos NH2
Percussores de:
CetoácidosAminas biogênicasGlicoseNucleotídeosHeme, Creatina
Componentes de:
PeptídeosProteínasFosfolipídeos
Neurotransmissores:
GlutamatoAspartatoGlicina
Classificação dos aminoácidos
Projeção de Fischer
1. Quanto a isomeria óptica:
-Isômeros do tipo “D” e “L”
L-Gliceraldeído D-Gliceraldeído
L-aminoácido D-aminoácido
Classificação dos aminoácidos
2. Quanto a essencialidade nutricional
- Essencial – obtidos pela dieta
- Não-essencial – sintetizados pelo organismo
Essencial Não-essencial
Fenilalanina Alanina
Histidina Arginina
Isoleucina Aspartato
Leucina Asparagina
Lisina Cisteína
Metionina Glicina
Treonina Glutamato
Triptofano Glutamina
Valina Prolina
Serina
Tirosina
NH2
C
O
HO
CH2
CH2
NH2
C
O
HO
CH CH2 C
O
NH2
Glicina
Glutamina
NH2
C
O
HO
CH CH
CH3
CH3
Valina
CH2
NH2
C
O
HO
CH CH
CH3
CH3
Isoleucina
Classificação dos aminoácidos
3. Quanto a polaridade da cadeia lateral
- Não polares ou polares (não carregado ou carregado)
Aromáticos
Triptofano
Não polar
Valina
Alanina
Leucina Isoleucina
Glicina Prolina
Não-polar, alifáticos
Metionina
Tirosina
Relativamente não polares
Fenilalanina
Classificação dos aminoácidos
GlutaminaAsparagina
Polar, não carregados
Treonina
Serina
Cisteína
Glumato
Aspartato
Polar, carregados
LisinaArginina
Histidina
3. Quanto a polaridade da cadeia lateral
- Não polares ou polares (não carregado ou carregado)
Aminoácidos Abreviação Mr pK1(-COOH)
pK2(-NH3
+)
pKR(grupo R)
pI
Grupo R alifáticos, não polares
Glicina Gly G 75 2,34 9,60 5,97
Alanina Ala A 89 2,34 9,69 6,01
Prolina Pro P 115 1,99 10,96 6,48
Valina Val V 117 2,32 9,62 5,97
Leucina Leu L 131 2,36 9,60 5,98
Isoleucina Ile I 131 2,36 9,68 6,02
Metionina Met M 149 2,28 9,21 5,74
Grupos R aromáticos
Fenilalanina Phe F 165 1,83 9,13 5,48
Tirosina Tyr Y 181 2,20 9,11 10,07 5,66
Triptofano Trp W 204 2,38 9,39 5,89
Propriedades dos aminoácidos
Aminoácidos Abreviação Mr pK1(-COOH)
pK2(-NH3
+)
pKR(grupo R)
pI
Grupo R não carregados, polares
Serina Ser S 105 2,21 9,15 5,68
Treonina Thr T 119 2,11 9,62 5,87
Cisteína Cys C 121 1,96 10,28 8,18 5,07
Asparagina Asn N 132 2,02 8,80 5,41
Glutamina Gln Q 146 2,17 9,13 5,65
Propriedades dos aminoácidos
Aminoácidos Abreviação Mr pK1(-COOH)
pK2(-NH3
+)
pKR(grupo R)
pI
Grupos R carregados positivamente
Lisina Lys K 146 2,18 8,95 10,53 9,74
Histidina His H 155 1,82 9,17 6,00 7,59
Arginina Arg R 174 2,17 9,04 12,48 10,46
Grupos R carregados negativamente
Aspartato Asp D 133 1,88 9,60 3,65 2,77
Glutamato Glu E 147 2,19 9,67 4,25 3,22
Propriedades dos aminoácidos
Aminoácidos como ácidos e bases
- “Zwitterion” = íon híbrido
- Anfólitos - capaz de agir como ácido ou como base
- AA como ácidos = doam prótons
- AA como base = recebem prótons
AA como um ácido: AA como uma base:
Carga líquida: +1 0 -1
Curva de titulação da glicina
OH- (equivalentes)
Glicina
pKa
Medida de
tendência de um
grupo perder
prótons
Carga líquida: +1 0 -1
Curva para
aminoácidos com
grupo R não ionizável
Curva de titulação da glicina
OH- (equivalentes)
Glicina pI
ponto isoelétrico,
onde a carga
líquida é zero
pH < pI
Carga líquida positiva
pH > pI
Carga líquida negativa
Carga líquida: +1 0 -1
pI = pK1 + pK2
2
Curva para
aminoácidos com
grupo R não ionizável
Curvas de titulação da histidina
AA com grupo R ionizáveis possuem curvas com três estágios
pH 7.6(Ponto isoelétrico)
pH 0.5 pH 5
pH 11
Carga líquida
Proteínas
Características gerais
- Polímeros de
aminoácidos unidos por
ligações peptídicas
- Peso molecular acima
de 10.000 Dalton (Da)
Proteínas
Características gerais
- São estabilizadas por
pontes dissulfeto e pelas
interações fracas não
covalentes (pontes de
hidrogênio e interações
iônicas)
Classificação das proteínas
- Quanto ao número de cadeias polipeptídicas
Monoméricas e Oligoméricas
- Quanto aos seus componentes associados
Simples e Conjugadas
C-terminal
N-terminal
C-terminalN-terminal
α1α2
β1β2Monoméricas
Oligoméricas
Classificação das proteínas
- Quanto ao número de cadeias polipeptídicas
Monoméricas e Oligoméricas
- Quanto aos seus componentes associados
Simples e Conjugadas
Classes Grupo prostético
Lipoproteína Lipídeos
Glicoproteína Carboidratos
Fosfoproteína Grupos fosfato
Hemoproteína Heme (Fe)
Flavoproteína Nucleotídeo flavina
Metaloproteína Ferro
Zinco
Cálcio
Molibdênio
Cobre
Estrutura das proteínas
Primária Indica a sequência
linear dos aminoácidos
SecundáriaOs aminoácidos
interagem através de pontes de hidrogênio
São α-hélice e folha β
α-hélice
folha β
Estrutura das proteínas
TerciáriaOcorrem interações
entre α-hélice e folha β
C-terminalN-terminal
α1α2
β1β2
QuaternáriaProteínas com mais de uma
cadeia de aminoácidos
Ligações peptídicas
- Estrutura rígida e planar- Interações de ressonância- Aprox. 40% de característica de dupla ligação- Conformação trans mais frequente que cis
Cadeia principal
Ângulos de torção
Cadeia lateral
Amida plana
Amida plana
Grupo lateral
Ângulos de torção ou ângulos de rotação
Ψ - Cα–N Φ - Cα–C
-São ambos definidos como 180° ou -180°-Aumenta em sentido horário do Cα
Diagrama de Ramachandran
-Indica os ângulos de torção estericamente permitidos;
-Algumas estruturas secundárias já são pré-
determinadas:↑↑ - folha β paralela
↑↓- folha β antiparalelaα - α hélice (direita)
C - hélice do colágenoαL - α hélice (esquerda)
A folha β
Antiparalela (conformação amino-carboxil oposta)
Paralela (conformação amino-carboxil igual)
6.5Å
7Å
Dobras β
- Conecta estruturas de α hélice e folha β
- Conecta folhas β antiparalelas
- Envolve quatro resíduos de AA onde o O do 1° se liga ao H do 4° AA- Glicina e prolina são os AA mais frequentes
As proteínas pode ser fibrosas ou globulares
α-Queratina-Hélice com 5.1Å
-Rica em resíduos de cisteína-Rica em AA hidrofóbicos
protofilamento
Filamentointermediário
superhélice dobrada a esquerda
α-hélice dobrada a direita
As proteínas pode ser fibrosas ou globulares
Colágeno-hélice orientada para esquerda-três resíduos de AA por passo
Cadeia α
Estrutura secundária
As proteínas pode ser fibrosas ou globulares
Fibroína da seda-Formada por cadeias polipeptídicas predominantemente em conformação β-Rica em alanina e glicina-Estrutura mantida por numerosas interações fracas
As proteínas pode ser fibrosas ou globulares
Proteínas globulares-Formada por diferentes arranjos de estruturas secundárias-Enzimas; proteínas transportadoras, motoras e regulatórias; imunoglobulinas; entre outras.
Mioglobina
Padrões estruturais em proteínas globulares
Laço β-α-β Quilha α-α
Conexões típicas em um motivo totalmente β
Conexão cruzada(não observada)
Barril β Folha β retorcida
Conexão orientada para direita entre cadeias β
Conexão orientada para esquerda entre cadeias β
(muito rara)
Padrões estruturais em proteínas globulares
Estrutura quaternária das proteínas
- Proteína multissubunitária ou multímero
- Duas a centenas de subunidades
- Oligômero - poucas subunidades
- Protômero - unidade estrutural repetitiva
C-terminalN-terminal
α1α2
β1β2
Funções das proteínas
-Envolvem ligação reversível com outras moléculas
-Ligante - molécula que se liga à proteína
-Sítio de ligação - complementar ao ligante (tamanho, forma, carga e caráter hidrofílico ou hidrofóbico)
-Podem existir vários sítios de ligação
-Exibem flexibilidade
-Interação proteína-ligante leva a alteração da conformação da proteína
-A interação proteína-ligante pode ser regulada
Proteínas de reconhecimento
MHC“major
histocompatibility complex”
Complexo principal de
histocompatibilidade
Separação das proteínas
Centrifugação diferencial
Tecido
tampão
Homo-geneizador
Filtro
Centrifugação
citosol
Sobrena-dante
Pellet
RibossomosMacromoléculas
Membrana plasmáticaFragmentos de REPequenas vesículasFração microssomal
MitocôndriaLisossomosPeroxissomos (plantas; cloroplastos)
NúcleoCitoesqueleto
Células inteiras, tecidos
conectivos
Preparo do extrato bruto
Fracionamento (tamanho e carga)
Tipos:1. Centrifugação
diferencial
2. Centrifugação pelo gradiente de
densidade (isopícnica)
Separação das proteínas
Preparo do extrato bruto
Fracionamento (tamanho e carga)
Tipos:1. Centrifugação
diferencial
2. Centrifugação pelo gradiente de
densidade (isopícnica)
Gradiente de sacarose
Amostra
Centrifugação pelo gradiente de densidade
Componente menos denso
Componente mais denso
Fracionamento
12345678
Centrifugação
Purificação: precipitação com sal
“salting in”
Solubilidade é maior com menor concentração de sal
“salting out”
Solubilidade é menor com maior concentração de sal
Precipitação com sal
Concentração de sal
Camada de hidratação
Solubilidade
“salting out”
Sobrenadante
Precipitado
Proteína alvo
Purificação: diálise
- Processo físico-químico- Separa as proteínas do solvente- Baseado no tamanho das proteínas
Solução tampão
Solução de proteínas
Saco de diálise
Agitador
No equilíbrioNo início da diálise
Solução tampão
Solução de proteínas
Saco de diálise
Proteínasíon
- Interação diferencial dos seus componentes entre a fase estacionária (líquida/sólida) e a fase móvel (líquida/gasosa)
- Beneficia-se das diferenças de carga, tamanho, afinidade de ligação e outras propriedades da proteína
Purificação: cromatografia
A coluna cromatográfica
deve ser de material inerte: Carvão, sílica,
alumínio, fosfato de cálcio,
hidroxiapatita, etc...
Classificação dos tipos de cromatografia
1. Quanto a forma física do sistemaPlanar, em coluna, centrífuga
2. Segundo o modo de separaçãoAdsorção, partição, troca iônica, afinidade
3. De acordo com a fase estacionáriaSólida, liquida, quimicamente ligadas
4. Segundo a fase estacionáriaLíquida, gasosa, supercrítica
Carga positiva líquida grandeCarga positiva líquidaCarga negativa líquidaCarga negativa líquida grande
Cromatografia de troca iônica
As proteínas são separadas de acordo com suas cargas após passarem por
uma coluna contendo cátions/ânions e geralmente de celulose
A matriz utilizada deve ser:- porosa- inerte - natural ou sintética(compostos inorgânicos,resinas sintéticas ou polissacarídeos)
- Insolúvel em águasolventes orgânicos
- Ligada covalentemente a trocadores iônicos
Trocadores iônicos
Trocadores aniônicos Grupos funcionais
Dietilaminoetil (DEAE) -O-CH2-CH2-N+H(CH2CH3)2
Aminoetil quaternário (QAE) -O-CH2-CH2-N+(C2H5)2-CH2-CHOH-CH3
Amônio quaternário (Q) -O-CH2-CHOH-CH2-O-CH2-CHOH-CH2-N+(CH3)3
Trietilaminoetil (TEAE) -O-CH2-CH2-N+(C2H5)2-CH2-CH3
Tocadores catiônicos Grupos funcionais
Carboximetil (CM) -O-CH2-COO-
Sulfopropil (SP) -O-CH2-CHOH-CH2-O-CH2-CH2-CH2SO3-
Sulfoetil (SE) -O-CH2-CHOH-CH2-O-CH2-CH2SO3-
Fosfo (P) -O-PO4-
Metilsulfonato (S) -O-CH2-CHOH-CH2-O-CH2-CHOH-CH2SO3-
-
+
+ + +
+
+ +
-
-
-
-
-
+
-
- - -
-
- -
+
+
+
+
+
Trocador aniônico com contra-íons
trocavéis
Trocador catiônico com contra-íons
trocavéis
Os contra-íons podem ser trocados reversivelmente
com outros íons sem alterar as propriedades da matriz
Cromatografia de filtração em gel
Esferas com polímero poroso
grânulo de gel
Matriz do gel
Beneficia-se das diferenças de tamanho das
proteínas
Pequenas moléculas
Grandes moléculas
Solvente
As proteínas são purificadas de acordo
com sua especificidade por um substrato ou
cofator particular
Cromatografia de afinidade
Proteínas ligantes da glicose se ligam aos sítios de glicose (G) nas esferas do gel
Adiciona glicose
Proteínas ligantes da glicose são perdidas com
adição da glicose
Proteína de interesse
ligante
Mistura de proteína
Solução do ligante
Cromatografia líquida de alta eficiência (HPLC)
Tempo (minutos)
Ab
so
rbâ
ncia
a 2
20
nm
Coluna do HPLC
Injetor
Solvente
Dados
DetectorBomba Descarte
Bombas de alta-pressão aceleram a movimentação das proteínas pela
coluna, reduzindo o tempo de transito na coluna e aumentando a resolução
Eletroforese
- A proteína é desnaturada e as subunidades se separam- As proteínas migram de acordo com tamanho e forma em um campo elétrico- As moléculas menores migram mais rapidamente através da matriz porosa do gel
Amostra
Poço
Direção da migração
Proteínas
Eletroforese
Gel poroso
Massa (kDa)
Dis
tân
cia