Aldehidos y Cetonas Reacciones
-
Upload
omar-michel-gonzalez -
Category
Documents
-
view
115 -
download
6
Transcript of Aldehidos y Cetonas Reacciones

© 2006 Thomson Higher Education
Chapter 14
Aldehydes and Ketones:
Nucleophilic Additions Reactions
Capítulo 14
Aldehídos y Cetonas:
Reacciones de Adición Nucleofílica

5. Reactividad en el grupo carbonilo
Adición al doble enlace C=O
Sustitución del hidrógeno
del carbono α

5. Reactividad del grupo carbonilo
• Reaccionará con nucleófilos en el carbono
• Se forma un producto tetraédrico, el carbono pasa a sp3
• Es una reacción de adición nucleofílica
• Los aniones H- y R- son bases muy fuertes, malos grupos salientes y no son desplazados por el reactivo.
=>=>

5.1 Adición Nucleofílica de H2O:
Hidratación
Aldehídos y cetonas reaccionan en forma reversible con
agua para dar 1,1-dioles, or dioles geminales (gem)
• El equilibrio favorece al carbonilo por razones estéricas
con la excepción del formaldehído

Adición Nucleofílica de H2O:
Hidratación
Compuesto Keq Conversión a
hidrato (%)
Velocidad
relativa
formaldehido 2300 >99.9 2200
acetaldehido 1.0 50 1.0
2,2-
dimetilpropanal 0.2 17 0.09
acetona 0.0014 0.14 0.0018
hexafluoroace
tona 22000 100

Adición Nucleofílica de H2O:
Hidratación
• Otros hidratos estables, esta vez por factores
electrónicos (más importantes que los
factores estéricos), son
• Hidrato de cloral
• Ninhidrina
H
O
Cl
ClC l
H
O H
Cl
C lC l O H
H2O
O
O
O
O
O
O H
O H
H2O

Es una reacción en dos etapas,
en donde la primera es la
determinante de la reacción.
El cambio de hibridación sp2
sp3 se desarrolla parcialmente
en el primer estado de
transición.
Perfil de energía de la reacción de hidratación de aldehidos

5.2 Reacciones de Adición
Nucleofílica a Aldehidos y Cetonas
Reacción de adición Nucleofílica
• :Nu– se acerca al enlace C=O en un ángulo de 75° y se une al carbono electrofílico del C=O
• El carbono Carbonilo se rehibridiza a sp3
• El par de electrones se mueve del enlace C=O al oxígeno electronegativo produciendo un ion alcóxido tetraédrico como
intermediario • El Intermediario se protona
para dar el alcohol neutro

Reacciones de Adición Nucleofílica a
Aldehidos y Cetonas
Alternativamente, el alcóxido tetraédrico intermediario (o el
alcohol intermediario) puede eliminar H2O y formar un
enlace C=Nu

Adición Nucleofílica a Aldehidos y
Cetonas: reactividad relativa
Los Aldehídos son más reactivos frente a la adición
nucleofílica que las cetonas
• Los Aldehídos tienen menos impedimento estérico que
las cetonas

Adición Nucleofílica a Aldehidos y
Cetonas: reactividad relativa
• El efecto estérico sobre la reactividad relativa
es más evidente en la formación del
intermediario, cuando el carbono carbonilo se
ha rehibridado a sp3.
• En la geometría tetraédrica, los grupos
unidos al carbono están más próximos unos
de otros y el volumen que ocupe cada uno
será significativo.

Adición Nucleofílica a Aldehidos y
Cetonas: reactividad relativa
• Los Aldehídos son más reactivos que las cetonas por
factores electrónicos
• C=O de aldehído se polariza mas que el C=O de cetona

Adición Nucleofílica a Aldehidos y
Cetonas: reactividad relativa
• Los efectos electrónicos también resultan de
los efectos inductivos de grupos unidos al
carbono carbonilo.
• Los aldehídos y cetonas aromáticos son
menos reactivos que los alifáticos, debido a
que el anillo aromático ejerce un efecto
inductivo donador de electrones sobre el
carbono carbonilo, reduciendo así su afinidad
por los nucleófilos.

Adición nucleofílica a aldehídos y
cetonas.
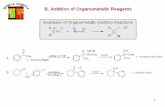
1. Adición de –CN: formación de cianhidrinas
2. Adición de reactivos de Grignard: Formación
de alcoholes con más átomos de carbono
que el compuesto carbonilo original.
3. Adición de hidruros: formación de alcoholes
con el mismo número de carbonos que el
compuesto carbonilo original.
4. Adición de agua y alcoholes: formación de
hidratos, hemiacietales y acetales
5. Adición de amoniaco y compuestos
derivados del mismo.

5.3.1 Adición nucleofílica de HCN:
formación de cianohidrinas
• Su utilidad radica en las transformaciones
que pueden hacerse después sobre el
producto.
• La reactividad del sustrato sigue el orden
HCHO>RCHO>ArCHO>R2CO>>Ar2CO,
cetonas impedidas
CH3CH2
C
O
CH3 + C
CH3CH2 CH3
HOCN
HCN
=>
CH3CH2
C
O
CH3 + C
CH3CH2 CH3
HOCN
HCN
=>

Formación de cianohidrinas:
condiciones de reacción
• La reacción es lenta cuando se usa HCN
puro.
• La reacción es rápida cuando se tiene el
equilibrio HCN/CN, lo que se logra con la
adición de una pequeña cantidad de base.
• El pH de la reacción en óptimas condiciones
es cercano a 8 o 9.

5.3.2 Adición Nucleofílica de Reactivos de
Grignard: Formación de Alcoholes
El reactivo de Grignard reacciona con el grupo C=O de
aldehídos o cetonas para dar un intermediario
tetraédrico que es un alcóxido de magnesio
El intermediario se hidroliza para producir un alcohol
neutro
El reactivo de Grignard reacciona como un carbanión

Adición Nucleofílica de Reactivos de
Grignard: Formación de Alcoholes

5.3.3: Adición Nucleofílica de Hidruros :
Formación de Alcoholes
De manera análoga, la reacción de aldehídos y cetonas
con hidruros puede representarse como la adición
nucleofílica de un ion (:H–) al carbono C=O
• LiAlH4 y NaBH4 actúan como donadores de ion hidruro

Adición Nucleofílica de Hidruros :
Formación de Alcoholes
• El NaBH4 es más fácil de manejar y por lo mismo
se emplea más que el LiAlH4
• Es muy selectivo y generalmente no reacciona
con grupos carbonilo menos reactivos que
aldehídos y cetonas.
• Esto significa que reducirá aldehídos y/o cetonas
pero no afectará a ácidos carboxílicos y/o
ésteres:

Adición Nucleofílica de Hidruros :
Formación de Alcoholes
• El LiAlH4 no es selectivo y es un reductor
muy poderoso, que reducirá también los
grupos carbonilo menos reactivos que
aldehídos o cetonas:
• Los aldehídos reaccionan para dar alcoholes
primarios y las cetonas, secundarios.
O
O
O Me
OH
OH
LiAlH4
1)
H3O +2)

5.3.4 Adición Nucleofílica de H2O:
Hidratación
La adición nucleofílica de agua a un aldehido o cetona es
lenta en condiciones neutras pero es catalizada por
ácido y base
• Mecanismo de hidratación catalizada por Base
• El ion hidróxido es buen nucleófilo

Adición Nucleofílica de H2O:
Hidratación
• Mecanismo catalizado por ácido
• El oxígeno protonado hace al carbono C=O mas
electrofílico

Adición Nucleofílica de H2O:
Hidratación
En general, el equilibrio favorece el aldehído o cetona
frente a nucleófilos como H2O, CH3OH, HCl, HBr, or
H2SO4

5.3.4 Adición Nucleofílica de
Alcoholes: Formación de Acetales
Aldehidos y cetonas reaccionan de manera reversible con dos
equivalentes de un alcohol, en presencia de catálisis ácida para
producir acetales, R2C(OR′)2, a veces llamados cetales si se
derivan de una cetona

Adición Nucleofílica de Alcoholes:
Mecanismo de Formación de Acetales
• Se necesita catálisis ácida
• La adición nucleofílica reversible de alcohol al grupo carbonilo da un hemiacetal
• Hemiacetal: un hidroxi éter análogo al gem diol formado por adición de agua
• El ácido protona el grupo hidroxilo formando –OH2+
• Pérdida de :OH2 forma un ion oxonio, R2C=OR+
• Adición Nucleofílica de una segunda molécula de alcohol da un acetal protonado
• Deprotonación produce un acetal neutro y regenera el catalítico

• Protonación del alcohol
• Ataque del alcohol nucleofílico
OH
+
+ OH
H+
O
=>
HO OCH3+
HO OCH3
H
HOCH3
OH
+ HOCH3H2OCH3+
+
=>
HO OCH3+
HO OCH3
H
HOCH3
OH
+ HOCH3H2OCH3+
+

Adición Nucleofílica de Alcoholes:
Formación de Acetales
• Adiciones nucleofílicas intramoleculares son
comunes en carbohidratos (azúcares) dando
hemiacetales cíclicos

Adición Nucleofílica de Alcoholes:
Formación de Acetales
Un equivalente de un diol como el etilenglicol da un
acetal cíclico
Los acetales se forman únicamente en presencia de catálisis ácida,
mientras que los hemiacetales pueden formarse por ataque de un
ion hidróxido o alcóxido al carbono carbonilo, pero la reacción se
detiene la formación del hemiacetal.
Si se trabaja con un alcohol monohidroxílico, como etanol, se
consumen dos moles de alcohol por mol de carbonilo.

• Protonación del –OH y pérdida de agua
• Ataque de un segundo equivalente de alcohol
+
OCH3HO OCH3
H+
H+
HO OCH3
HOH+
=>
OCH3CH3OOCH3CH3O
H
+
OCH3+
HOCH3
HOCH3
=>
OCH3CH3OOCH3CH3O
H
+
OCH3+
HOCH3
HOCH3

Ejemplo 2 Prediga el producto de reacción entre una
cetona y un alcohol
Muestre la estructura del acetal que se obtendría
por la reacción catalizada con ácido de pentan-
2-ona con propano-1,3-diol

Recuerde que
• La reacción entre un aldehido o cetona con 2
equivalentes de un alcohol monohidroxílico o
con un equivalente de un diol, produce un
acetal, en el cual el oxígeno del carbonilo es
reemplazado por dos grupos –OR del alcohol
• La reacción requiere catálisis ácida

Resolución

Aplicación de la formación de acetales
Reacciones de protección
• Si se desea modificar una parte de una
molécula sin alterar un grupo carbonilo, éste
se puede proteger, es decir, se transforma en
otro grupo funcional menos reactivo.
• Los acetales, al ser éteres, son estables en
medio básico, pero se regeneran al grupo
carbonilo en medio ácido.
• Los aldehídos forman acetales más
fácilmente que las cetonas.
• Generalmente se usa un diol como reactivo
protector.

Ejemplo
O
C
O
H
CH2 CH2
HO OH
O
CO
O
H+
=>
O
C
O
H
CH2 CH2
HO OH
O
CO
O
H+
=>
O
CO
O
CH3MgBr
CO
O
O CH3MgBr
+ _
H3O+
C
O
H
HO CH3
=>
O
CO
O
CH3MgBr
CO
O
O CH3MgBr
+ _
H3O+
C
O
H
HO CH3
=>

5.3.5 Adición Nucleofílica de Aminas:
Formación de Iminas y Enaminas
Aminas primarias, RNH2, se adicionan a aldehídos y
cetonas para dar iminas, R2C=N
El grupo C=N es el análogo nitrogenado del grupo
carbonilo
• Las iminas son intermediarios biológicos importantes

Adición Nucleofílica de Aminas:
Formación de Iminas y Enaminas
• Las iminas son básicas, como las aminas.
• Las iminas sustituidas se conocen como
bases de Schiff.
• La formación de iminas y enaminas son
ejemplos de reaciones conocidas como
condensaciones, que son reacciones en las
que dos (o más) moléculas orgánicas se
unen y eliminan una molécula de agua u otra
molécula pequeña, como producto
secundario de la reacción.

Adición Nucleofílica de Aminas:
Formación de Iminas y Enaminas
Aminas secundarias, R2NH, se adicionan a aldehidos y
cetonas para dar enaminas, R2N-CR=CR2
• en + amina = amina insaturada

Mecanismo de formación de iminas
• La adición nucleofílica de una
amina primaria para dar un
intermediario tetraédrico:
carbinolamina
• Eliminación de agua para
formar un nuevo enlace C=Nu

Mecanismo de formación de enaminas
• Adición nucleofílica de una amina
secundaria para dar un
intemediario tetraédrico:
carbinolamina
• Eliminación de agua produce un
ion iminio
• Pérdida de un protón del átomo
de carbono a- produce la
enamina

Adición Nucleofílica de Aminas:
Formación de Iminas y Enaminas
La reacción de formación de iminas y
enaminas alcanza el máximo a pH = 4 - 5
• a pH > 5 es lenta porque no hay suficiente H+
presente en solución para protonar el –OH de la
carbinolamina y producir el grupo saliente –OH2+
• a pH < 4 es lenta porque el nucleófilo básico se
encuentra protonado y no puede ocurrir la adición
nucleofílica inicial.
Las iminas son útiles para la obtención de
aminas a partir de compuestos carbonilo
(aminación reductiva)

Ejemplo Predecir el producto de reacción entre una
cetona y una amina
Muestre los productos que se obtendrían de la
reacción catalizada por ácido entre 3-pentanona
con metilamina, CH3NH2, y con dimetilamina,
(CH3)2NH

Recordar que
• Un aldehido o cetona reacciona con una amina
primaria, RNH2, para producir una imina, en la cual
el átomo de oxígeno del carbonilo ha sido
reemplazado por el grupo =N-R de la amina.
• La reacción de un aldehido o cetona que posean
átomos de hidrógeno en el carbono –α, con una
amina secundaria, R2NH, produce una enamina, en
la cual el átomo de oxígeno ha sido reemplazado
por el grupo –NR2 de la amina, y el doble enlace se
ha movido a ocupar la posición entre el carbono
carbonilo y el carbono α-

Ejemplo resuelto

Formación de iminas estables
• Estructura Nombre Nombre del
del reactivo producto
HO-NH2 hidroxilamina oxima
H2N-NH2 hidrazina hidrazona
PhNH-NH2 fenilhidrazina fenilhidrazona
2,4-dinitrofenil 2,4-dinitrofenil
hidrazina hidrazona
(2,4-DNFH)
semicarbazida semicarbazona
NO2
O2N
NH- NH2
NH2
N H N H2
O


Ensayo con 2,4-DNFH
Debido a que la 2,4-DNFH
tiene un peso molecular
elevado, reaccionará con
aldehidos y cetonas para
dar derivados sólidos,
utilizados para confirmar la
identidad del compuesto
carbonilo o para detectar
su presencia.
Carbonilos con dobles enlaces
conjugados darán precipitados color
rojo o rojo naranja y carbonilos
saturados o sin enlaces conjugados,
darán precipitados amarillo o amarillo
naranja

Formación de iminas estables.
Derivados de compuestos carbonilo
Furfural 2,4-DNFH
Benzofenona Hidroxilamina Oxima
NO2
O2N
N H- N H2
O
O
O
NN H-
NO2
O2N
H2O+ +
O NHO H
H2O+
NH2O H
+

5.4 Oxidaciones y reducciones de
aldehidos y cetonas

5.4 Oxidaciones y reducciones de carbonilos. • Los aldehídos, al tener un –H unido al carbono
carbonilo, son suceptibles de oxidarse a ácidos
carboxílicos:

5.4.1Oxidación de Aldehídos
Se lleva a cabo a través de intermediarios 1,1-dioles
denominados hidratos
• Los hidratos se forman por la adición reversible de
agua al grupo carbonilo

Oxidación de aldehídos
• Oxidantes suaves pueden usarse para
obtener ácidos carboxílicos y hay varias
reacciones de esta clase que pueden usarse
como pruebas rápidas para distinguir entre
aldehídos y cetonas, las cuales normalmente
resisten oxidación.
• El reactivo de Tollens se prepara al
momento de usarse y consiste en Ag(NH3)2+.
El reactivo oxida al aldehído y la plata se
reduce a plata elemental.

Ensayo de Tollens
La reacción con el reactivo de
Tollens distingue fácilmente
entre aldehídos y cetonas, ya
que el aldehído reduce el
reactivo y esto queda
evidenciado por la aparición de
un espejo de plata (o un
precipitado negro, si el tubo de
ensayo no está lo
suficientemente limpio)
R C
O
H + 2 + 3 + 2+ 4+Ag(NH3)2+
OH_ H2O
2 Ag R C
O
O_
NH3 H2O

5.4.2 Reducciones de aldehídos y
cetonas
• Ambas funciones pueden reducirse a
alcoholes por reacción con hidruros, como se
vio anteriormente.
• También pueden reducirse a alcoholes
mediante una reacción de hidrogenación
catalítica.
• Considerar que si hay enlaces C=C, éstos
son más reactivos que los enlaces C=O
frente a la reacción de hidrogenación
catalítica.

Hidrogenación catalítica de aldehídos y
cetonas
• El catalizador usado más comúnmente es el
níquel Raney.
• Otros catalíticos usados son Platino (Pt) y
rodio (Rh).
• Los aldehídos darán alcoholes primarios y las
cetonas darán alcoholes secundarios:
ORaney Ni
OH
H
=>

Reducción de quinonas
• De la misma forma en que se pueden
obtener por medio de oxidantes suaves, para
reducirlas bastan reactivos reductores
suaves:

5.4.3 Reducción de aldehídos y
cetonas: desoxigenación
• En una desoxigenación, se reemplaza el
átomo de oxígeno de un aldehído o cetona
con dos átomos de hidrógeno, reduciendo el
grupo carbonilo completamente hasta el
grupo metileno:
• Se usa esta reacción para convertir
acilbencenos provenientes de acilaciones de
Friedel-Crafts, en alquilbencenos.
R R´
O
R R´
H H

Desoxigenación: Reducción de
Clemmensen
• Aplicable a compuestos que no son sensibles
a los ácidos en caliente.
C
O
CH2CH3 Zn(Hg)
HCl, H2O
CH2CH2CH3
CH2 C
O
H HCl, H2O
Zn(Hg)CH2 CH3
=>

Desoxigenación: reducción de Wolff -
Kishner
• Se usa para compuestos que no resisten el
tratamiento con ácido en caliente, y que
resisten el tratamiento con bases fuertes,
como KOH o t-butóxido de potasio y calor
CH2 C
O
HH2N NH2
CH2 C
NNH2
H KOH
heat
CH2 CH3
=>

5.4.4 Otras Reducciones
• Las reacciones de adición nucleofílica son
características de aldehídos y cetonas.
• El intermediario Tetraédrico producido por
adición del nucleófilo no puede expulsar un
grupo saliente estable, como sí es el caso de
los derivados de ácidos carboxílicos:

Reacción de Cannizzaro • Excepción a las reacciones características de
aldehídos y cetonas
• OH¯ se adiciona al aldehido para dar el intermediario
tetraédrico.
• El ion H:¯ se expulsa como grupo saliente.

Reacción de Cannizzaro
• El sustrato es ÚNICAMENTE un aldehído
SIN hidrógenos en el carbono alfa.
• Se utiliza base concentrada (25-35%), por lo
que no debe haber otros grupos sensibles a
estas condiciones.
• Es una reacción de desproporción: la mitad
del sustrato se oxida y la otra, se reduce.

Reacción de Cannizzaro cruzada
• Se lleva a cabo entre un aldehído sin
hidrógenos en el carbono α y el
formaldehído.
• El formaldehído, al ser más reactivo
reacciona primero con el ion –OH y cede el
–H al otro aldehído.
• El formaldehído SIEMPRE se oxidará a
ácido fórmico en esta reacción.

Ejemplo
O
H
O
H H
O
H
O
H H O H
O
H
O H
H H O
O
+
O H+
+O
O

Reducciones Biológicas El mecanismo de la reacción de Cannizzaro es análogo a la
reducción biológica en organismos vivos por nicotinamida
adenina dinucleótido, NADH
• NADH dona H:¯ a aldehídos y cetonas, de manera similar al alcóxido
tetraédrico, intermediario en la reacción de Cannizzaro

6. Aldehídos y cetonas α,β-insaturados
• La insaturación imparte a estos compuestos
características diferentes de reactividad
frente a algunos nucleófilos.
• La polarización del enlace C-O y la
deslocalización de electrones pi permite
varias estructuras de resonancia:

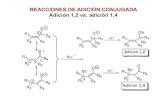
Adición conjugada a carbonilos α,β-
insaturados
Nucleófilos pueden unirse directamente al grupo carbonilo de aldehídos y cetonas, en lo que se conoce como una adición 1,2-
Nucleófilos pueden también adicionarse al enlace C=C conjugado adyacente al grupo carbonilo en compuestos α,β-insaturados en una adición conjugada or adición 1,4-
• El átomo de carbono vecino al carbono carbonilo es el carbono α y el siguiente es el carbono β
• El producto inicial de la adición conjugada es un ion enolato estabilizado por resonancia

Adición conjugada a carbonilos α,β-
insaturados

Adición conjugada a carbonilos a,b-
insaturados
El doble enlace conjugado de un carbonilo a,b-
unsaturado es activado frente a la adición
nucleofílica por el grupo carbonilo

Adición conjugada a carbonilos a,b-
insaturados
• Se da en mayor proporción cuando el
nucleófilo es débilmente básico.
• Comparación entre adiciones 1,2- y 1,4:
O
Y
O H
O
YH
O
+ H-Y
rápida
+ H-Y
lenta
m enos
estable
m ás
estable

6.1 Adición conjugada a aldehidos y
cetonas: adición de aminas
Aminas primarias y secundarias
reaccionan con aldehidos y cetonas a,b-
insaturados para dar b-amino aldehídos
y b-amino cetonas
• Se da tanto la adición 1,2- como la 1,4-
• Estas adiciones son reversibles

Adición conjugada a aldehídos y
cetonas: adición de aminas
• El producto de adición conjugada, mas
estable, se acumula

6.2 Adición conjugada a aldehídos y
cetonas: adición de -CN
• El producto obtenido en mayor cantidad es
un β-ciano aldehido o una β-ciano cetona:
O
H
O
O
C N
H
OC N
KCN, E tanol
HO Ac
KCN, E tanol
HO Ac

6.3 Adición conjugada a aldehídos y cetonas:
adición de reactivos organometálicos
• Los reactivos de Grignard reaccionan
exclusivamente con el carbono carbonilo.
• Alquilcupratos de litio, conocidos como
reactivos de Gillman reaccionan en el
carbono beta.
• Los reactivos se preparan de la siguiente
manera, en condiciones anhidras:
• R-X + 2 Li R-Li + LiX
• 2 R-Li + CuX R2CuLi + LiX

Adición conjugada a aldehídos y
cetonas: adición de reactivo de Gillman
OO
+ LiCu(CH3)
2
1. éter anhidro
H3O2.
La utilidad de la reacción radica en modificar el esqueleto carbonado
del carbonilo, aumentando el número de átomos de carbono.
O O+ LiCu(CH2CH
3)

6.4 Reducción de aldehídos y cetonas
α,β-insaturados
• Dado que los enlaces C=C son más reactivos
que los C=O frente a la hidrogenación
catalítica, no es posible usar este método
para reducir exclusivamente al grupo
carbonilo de aldehídos y cetonas α,β-
insaturados.
• El uso de hidruros, como LiAlH4 y NaBH4
puede resultar en redución del doble enlace
conjugado.

Donadores de hidruro selectivos
• El 9-borabiciclo[3.3.1]nonano (9-BBN) es un
donador de hidruro que reacciona
preferentemente con el carbono carbonilo y
no con el doble enlace en compuestos con
insaturaciones en posición α,β.
B-H

Oxidación de aldehídos insaturados
Dado que los enlaces C=C son sensibles
a los ácidos, al oxidar aldehídos
insaturados, no puede utilizarse
oxidantes ácidos, como el ácido crómico,
y deberá recurrirse al uso de oxidntes
alcalinos, tales como el reactivo de
Tollens o el óxido de plata:

Referencias
• McMurry. Química Orgánica. 7ª. Edición.
Thomson.
• Wade, L. Química Orgánica. 6a Edición.
• Morrison y Boyd. Química Orgánica. 5a
Edición.
• Shriner, Fuson, Curtin. Identificación
Sistemática de Compuestos Orgánicos.
Limusa-Wiley.