ΚΕΦΑΛΑΙΑ ΒΙΟΑΝΟΡΓΑΝΟΥ...
Transcript of ΚΕΦΑΛΑΙΑ ΒΙΟΑΝΟΡΓΑΝΟΥ...

ΑΡΙΣΤΟΤΕΛΕΙΟ ΠΑΝΕΠΙΣΤΗΜΙΟ ΘΕΣΣΑΛΟΝΙΚΗΣ
ΤΜΗΜΑ ΦΑΡΜΑΚΕΥΤΙΚΗΣ
ΤΟΜΕΑΣ ΦΑΡΜΑΚΕΥΤΙΚΗΣ ΧΗΜΕΙΑΣ
Ε.ΧΙΩΤΕΛΛΗΣ Δ. ΠΑΠΑΓΙΑΝΝΟΠΟΥΛΟΥ
ΚΕΦΑΛΑΙΑ
ΒΙΟΑΝΟΡΓΑΝΟΥ ΦΑΡΜΑΚΟΧΗΜΕΙΑΣ
5η ΕΚΔΟΣΗ
ΘΕΣΣΑΛΟΝΙΚΗ 2015

i
Π Ε Ρ Ι Ε Χ Ο Μ Ε Ν Α
ΚΕΦΑΛΑΙΟ 1: ΧΗΜΕΙΑ ΕΝΩΣΕΩΝ ΣΥΝΑΡΜΟΓΗΣ .............................................. 1
1. Ιστορική αναδρομή ..................................................................................................... 1
2. Ορισμός ενώσεων συναρμογής ................................................................................... 3
3. Αριθμός συναρμογής συμπλόκων............................................................................... 4
4. Ονοματολογία συμπλόκων ενώσεων .......................................................................... 5
5. Στερεοχημεία συμπλόκων ενώσεων ........................................................................... 7
6. Iσομέρεια συμπλόκων ενώσεων ............................................................................... 11
7. Παρασκευή συμπλόκων ενώσεων ............................................................................ 16
8. Σταθερότητα συμπλόκων ενώσεων .......................................................................... 18
9. Θεωρίες για το σχηματισμό ενώσεων συναρμογής .................................................. 23
10. Θεωρία του πεδίου των συναρμοτών (Ligand Field Theory) ................................... 28
11. Μαγνητικές ιδιότητες συμπλόκων ............................................................................ 33
12. Χρώμα των συμπλόκων ............................................................................................ 34
ΚΕΦΑΛΑΙΟ 2: ΣΗΜΑΣΙΑ ΜΕΤΑΛΛΩΝ ΣΤΑ ΒΙΟΛΟΓΙΚΑ ΣΥΣΤΗΜΑΤΑ ....... 37
1. Ιχνοστοιχεία .............................................................................................................. 37
2. Ενώσεις συναρμογής μετάλλων στα βιολογικά συστήματα ..................................... 40
3. Σημαντικές βιολογικές λειτουργίες των μετάλλων................................................... 43
4. Ενώσεις συναρμογής στη θεραπεία και τη διάγνωση ................................................ 50
ΚΕΦΑΛΑΙΟ 3: ΧΡΗΣΗ ΣΥΝΑΡΜΟΤΩΝ ΣΤΗ ΘΕΡΑΠΕIA ................................... 53
Ι. ΣΥΝΑΡΜΟΤΕΣ ΚΑΤΑ ΤΗΣ ΟΣΤΕΟΠΟΡΩΣΗΣ .................................................. 53
Ανωμαλίες μεταβολισμού του ασβεστίου ................................................................ 53
Διφωσφονικά παράγωγα .......................................................................................... 55
1. Μηχανισμός Δράσης ........................................................................................ 56
2. Χρήσεις ............................................................................................................ 57
3. Τρόπος χορήγησης ........................................................................................... 57
4. Μεταβολισμός .................................................................................................. 57
5. Άλλες επιδράσεις ............................................................................................. 58
Nατριούχος αλενδρονάτη ........................................................................................ 58
1. Σύνθεση ........................................................................................................... 58
2. Μηχανισμός δράσης ........................................................................................ 59

ii
3. Φαρμακοκινητική ............................................................................................ 59
4. Χρήση –Δόση .................................................................................................. 59
ΙΙ. ΔΗΛΗΤΗΡΙΑΣΕΙΣ ΑΠΟ ΜΕΤΑΛΛΑ-ΑΝΤΙΔΟΤΑ .................................................. 60
1. Ασθένειες οφειλόμενες στα επίπεδα σιδήρου ................................................. 60
2. Ασθένειες οφειλόμενες στα επίπεδα χαλκού ............................................... ...61
3. Μέταλλα και ελέυθερες ρίζες...........................................................................62
4. Τοξικότητα Βαρέων Μετάλλων ...................................................................... 64
Μόλυβδος (Pb) ................................................................................................ 64
Υδράργυρος (Hg) ............................................................................................ 68
Αρσενικό (As3+
, As5+
) ..................................................................................... 70
5. Αντίδοτα .......................................................................................................... 72
Δεσφερροξαμίνη, Δεφερροξαμίνη (Μεθανοσουλφονική) .............................. 73
Δεφεριπρόνη ................................................................................................... 76
Δεφεραζιρόξη .................................................................................................. 77
Διμερκαπρόλη (Dimercaprol) ......................................................................... 77
2,3-Διμερκαπτο-ηλεκτρικό οξύ ...................................................................... 81
Δινάτριο άλας του αιθυλενοδιαμινοτετραοξικού οξέος (EDTA) ................... 82
Αιθυλενο-διαμινο-Ν’,Ν’-τετραοξικό-ασβέστιο-νάτριο .................................. 85
D-πενικιλλαμίνη .............................................................................................. 88
Ν-ακετυλο-πενικιλλαμίνη ............................................................................... 92
Τριαιθυλενο-τετραμίνη ................................................................................... 92
ΚΕΦΑΛΑΙΟ 4: ΧΡΗΣΗ ΕΝΩΣΕΩΝ ΣΥΝΑΡΜΟΓΗΣ ΣΤΗ ΘΕΡΑΠΕΙΑ .............. 95
Ι. ΕΝΩΣΕΙΣ ΣΥΝΑΡΜΟΓΗΣ ΤΟΥ ΛΕΥΚΟΧΡΥΣΟΥ ΜΕ ΑΝΤΙΚΑΡΚΙΝΙΚΗ
ΔΡΑΣΗ .................................................................................................................. 95
1. Ιδιότητες του λευκοχρύσου ............................................................................. 95
2. Σχέση δομής-δράσης ενώσεων του λευκοχρύσου με αντικαρκινική
δράση ............................................................................................................. 96
Cis-διαμινο-διχλωρο-λευκόχρυσος (ΙΙ) .......................................................... 98
1. Σύνθεση ....................................................................................................... 98
2. Μηχανισμός δράσης.................................................................................... 99
3. Χρήσεις ..................................................................................................... 101
4. Τρόπος χορήγησης-Δοσολογία ................................................................. 101
5. Τύχη στον οργανισμό ................................................................................ 102
6. Τοξικότητα-ανεπιθύμητες ενέργειες-αντενδείξεις .................................... 102
(SP-4-2)-Διαμινο(1,1-κυκλοκαρβοξυλατο-κ-Ο)(2-)λευκόχρυσος (ΙΙ) ......... 102

iii
1. Σύνθεση ..................................................................................................... 103
2. Ιδιότητες ..................................................................................................... 103
3. Μηχανισμός δράσης .................................................................................. 103
4. Χρήσεις ...................................................................................................... 104
5. Τρόπος χορήγησης-Δοσολογία-Ανεπιθύμητες ενέργειες .......................... 104
6. Τύχη στον οργανισμό.................................................................................105
ΙΙ. ΑΝΤΙΦΛΕΓΜΟΝΩΔΗ, ΑΝΤΙΑΡΘΡΙΤΙΚΑ ΦΑΡΜΑΚΑ ΤΟΥ ΧΡΥΣΟΥ ....... 106
1. Γενικές ιδιότητες χρυσού ............................................................................... 106
2. Αντιαρθριτικά φάρμακα χρυσού .................................................................... 106
3. Μηχανισμός δράσης ...................................................................................... 108
4. Μεταφορά-Κατανομή-Μεταβολισμός-Απομάκρυνση .................................. 109
5. Προϊόντα βιομετατροπής του χρυσού (Ι) ...................................................... 111
6. Χρήσεις-Αντενδείξεις- Ανεπιθύμητες ενέργειες- Αλληλεπιδράσεις ............. 111
7. Δοσολογία ...................................................................................................... 112
8. Τύχη στον οργανισμό..................................................................................... 113
ΙΙΙ. ΦΑΡΜΑΚΕΥΤΙΚΕΣ ΕΝΩΣΕΙΣ ΤΟΥ ΒΙΣΜΟΥΘΙΟΥ/ΑΡΓΙΛΙΟΥ ΚΑΤΑ ΤΟΥ
ΕΛΚΟΥΣ ......................................................................................................................... 114
Τρικαλιούχο δικιτρικό βισμούθιο ........................................................................... 114
1. Χημική δομή-Μηχανισμός δράσης ................................................................ 115
2. Χρήσεις-Δοσολογία-Παρενέργειες-Αντενδείξεις ......................................... 116
Σουκραλφάτη .......................................................................................................... 116
1. Χρήσεις- Ανεπιθύμητες ενέργειες- Αλληλεπιδράσεις- Δοσολογία ............... 117
Ρανιτιδίνη κιτρικό βισμούθιο.................................................................................. 117
1. Χρήσεις-Βιολογική δράση ............................................................................. 118
2. Δοσολογία – Παρενέργειες – Αντενδείξεις .................................................. 118
ΙV. ΕΝΩΣΕΙΣ ΣΥΝΑΡΜΟΓΗΣ ΓΙΑ ΤΙΣ ΚΑΡΔΙΑΓΓΕΙΑΚΕΣ ΠΑΘΗΣΕΙΣ ............. 119
Νιτροπρωσσικό νάτριο .......................................................................................... 119
1. Χημική Δομή – Σύνθεση .............................................................................. 119
2. Μηχανισμός Δράσης ...................................................................................... 119
3. Ενδείξεις- Αντενδείξει-: Αλληλεπιδράσεις- Ανεπιθύμητες ενέργειες ........... 120
4. Δοσολογία και χορήγηση ............................................................................... 121
ΚΕΦΑΛΑΙΟ 5: ΧΡΗΣΗ ΕΝΩΣΕΩΝ ΣΥΝΑΡΜΟΓΗΣ ΣΤΗΝ ΔΙΑΓΝΩΣΗ ......... 123
Ι. ΑΠΕΙΚΟΝΙΣΗ ΜΕ ΧΡΗΣΗ ΡΑΔΙΟΝΟΥΚΛΙΔΙΩΝ ............................................ 123
1. Απεικονιστικές διατάξεις για in vivo μέτρηση της γ-ακτινοβολίας .............. 125
2. Τεχνήτιο -99m (99m
Tc) ................................................................................... 127

iv
3. Γάλλιο (Ga) και Ίνδιο (In) ............................................................................ 128
ΙΙ. ΑΠΕΙΚΟΝΙΣΗ ΜΕ ΤΗ ΜΕΘΟΔΟ ΤΟΥ ΠΥΡΗΝΙΚΟΥ MΑΓΝΗΤΙΚΟΥ
ΣΥΝΤΟΝΙΣΜΟΥ (MRI) ....................................................................................... 131
1. Μαγνητική Τομογραφία ( Magnetic Resonance Imaging, MRI) .................. 131
2. Αντιδραστήρια αντίθεσης MRI ..................................................................... 133
3. Ιδιότητες ενώσεων του Γαδολινίου ............................................................... 135
4. Αντιδραστήρια αντίθεσης μαγγανίου και σιδήρου..........................................138
ΒΙΒΛΙΟΓΡΑΦΙΑ ................................................................................................... 141

ΧΗΜΕΙΑ ΕΝΩΣΕΩΝ ΣΥΝΑΡΜΟΓΗΣ
1
ΚΕΦΑΛΑΙΟ Ι
ΧΗΜΕΙΑ ΕΝΩΣΕΩΝ ΣΥΝΑΡΜΟΓΗΣ
1. Ιστορική αναδροµή
Ενώσεις συναρµογής ήταν γνωστές και είχαν χρήση από την αρχαιότητα.
Η αλιζαρίνη (Alizarin), χηλική ένωση της 1,2 διυδροξυανθρακινόνης µε Ca ή Al,
αναφέρεται ήδη από τον Ηρόδοτο (450 πχ). Χρησιµοποιήθηκε ως χρώµα µε κόκκινη
απόχρωση και ήταν γνωστή στους Πέρσες, τους Αιγύπτιους και τους Έλληνες. Αλιζαρίνη
βρέθηκε στην Ποµπηία, σε Αιγυπτιακά υφάσµατα που χρονολογούνται από το 1567 πΧ,
και σε ευρήµατα στον Ελλαδικό χώρο.
Ένωση του τετραµινοχαλκού (ΙΙ), [Cu(ΝΗ3)4]2+, σύµπλοκο ιόν κυανού χρώµατος,
παρασκευάστηκε για πρώτη φορά, τυχαία, το 1597 από τον Ανδρέα Λιβάνιο, Libanius
(Libau) Andreas, Γερµανό αλχηµιστή που ασχολήθηκε µε την Ιατρική Χηµεία και την
Φαρµακευτική.
Το Prussian blue, KCN.Fe(CN)2.Fe(CN)3, παρασκευάστηκε επίσης τυχαία, το
1704, από τον Diesbach, κατά την κατεργασία αίµατος βοδιού και χρησιµοποιήθηκε ως
κυανή χρωστική, κυρίως στη φωτογραφία.
Το 1798 ο Γάλλος Χηµικός Tassaert παρασκεύασε χλωριούχο εξαµινοκοβάλτιο
(ΙΙΙ), [Co(ΝΗ3)6]Cl3, διαλύοντας χλωριούχο κοβάλτιο σε υδατικό διάλυµα αµµωνίας. Η
παραχθείσα ένωση είχε διαφορετικές ιδιότητες από αυτές του CoCl3 όπως και της ΝΗ3.
Το τετραχλωροπαλλαδικό(II) τετραµινοπαλλάδιο (tetramminepalladium (II)
tetrachloro palladate), [Pd(NH3)4][PdCl4], έγινε γνωστό ως Vauquelin’s Salt από τον
Γάλλο χηµικό Luis Nicolas Vauquelin (1763-1829) και ως Magnus Green Salt από τον
Γερµανό Μagnus Heinrich Gustov που το παρασκεύασε το 1813.
Αργότερα ο Gmelin (1788-1853) παρασκευάζει διάφορες ενώσεις µεταξύ των
οποίων, το 1822, το οξαλικό εξαµινοκοβάλτιο (III) (Hexamine cobalt (III) oxalate),
[Co(NH3)6]2(C2Ο4)3..
Το 1827 αποµονώθηκε από τον Zeise (1789-1847) η πρώτη οργανοµεταλλική
ένωση µε ακόρεστο οργανικό συναρµοτή, το ένυδρο τριχλωροαιθυλενολευκοχρυσικό
κάλιο (potassium trichloro(ethylene)platinate), Κ[Pt(C2H4)Cl3] γνωστό και σαν Zeise’s
salt.

ΧΗΜΕΙΑ ΕΝΩΣΕΩΝ ΣΥΝΑΡΜΟΓΗΣ
2
Το 1844 o Peyrone παρασκευάζει τον cis-διαµινοδιχλωρολευκόχρυσο(ΙΙ),
Pt(NH3)2Cl2, γνωστό και ως cis-platin, του οποίου η αντικαρκινική δράση διαπιστώθηκε
µόλις το 1969.
Το 1847, ο Genth παρατήρησε, τυχαία, κατά τη διάρκεια µιας εργαστηριακής
άσκησης, τη δηµιουργία έγχρωµων ενώσεων συναρµογής του Co µε αµµωνία. Σε
δηµοσίευση του, το 1851, περιέγραψε ενώσεις που αντιστοιχούσαν στους γενικούς τύπους
[Co(NH3)6]X3 και [Co(NH3)5H2O]X3. Το 1852 ο Genth άρχισε συνεργασία µε τον
Αµερικανό Gibbs (1822-1908), και σε δηµοσίευσή τους, το 1866, περιέγραψαν 35 ενώσεις
συναρµογής που αντιστοιχούσαν στους γενικούς τύπους [Co(NH3)5Cl]X2 και
[Co(NH3)5NO2]X2.
Οι πρώτες προσπάθειες να εξηγηθεί η δοµή των ενώσεων συναρµογής Cu(NH3)2X2
έγιναν, χωρίς επιτυχία, από τους Graham (1837) και Rieset (1844) οι οποίοι τις θεώρησαν
ως προϊόντα υποκατάστασης της αµµωνίας. Το ίδιο σκεπτικό ακολούθησε και ο Hoffman
το 1851.
Το 1898, ο Αlfred Werner (1866-1919) µελέτησε τις ενώσεις συναρµογής του
κοβαλτίου µε αµµωνία [Co(NH3)6]Cl3, [Co(NH3)5Cl]Cl2 και [Co(NH3)4Cl2]Cl και
παρατήρησε ότι ο αριθµός των ιόντων Cl- που κατακρηµνίζονταν µε AgNO3 σε κάθε
ένωση ήταν διαφορετικός. Βασισµένος σ’ αυτήν την παρατήρηση, ο Werner εξήγησε
επιτυχώς τον τρόπο δηµιουργίας των σύµπλοκων ενώσεων διατυπώνοντας τη θεωρία του
πρωτεύοντος και δευτερεύοντος σθένους. Επίσης ο Werner συσχέτισε το δευτερεύον
σθένος µε το σχήµα των ενώσεων συναρµογής. Για τη θεωρία αυτή, o Werner θεωρήθηκε
ο πατέρας των ενώσεων συναρµογής και τιµήθηκε το 1913 µε το βραβείο Nobel.

ΧΗΜΕΙΑ ΕΝΩΣΕΩΝ ΣΥΝΑΡΜΟΓΗΣ
3
2. Ορισµός ενώσεων συναρµογής
Ένωση συναρµογής (coordination compound) ονοµάζεται το προϊόν της αντίδρασης
οξέος-βάσεως κατά Lewis, η οποία περιέχει ένα κεντρικό άτοµο/ιόν το οποίο συνδέεται µε
καθορισµένο αριθµό άλλων ατόµων/ιόντων/µορίων που ονοµάζονται συναρµοτές (ligands
ή complexing agents) µέσω δεσµών συναρµογής.
Οι ενώσεις συναρµογής είναι γενικότερα γνωστές και ως σύµπλοκα (complexes) αν
και o όρος σύµπλοκα χρησιµοποιήθηκε για να χαρακτηρίσει και άλλες ενώσεις όπως τα
διπλά άλατα που δεν ανήκουν στις ενώσεις συναρµογής. Επίσης απαντάται ο όρος
coordination complex. Οι ενώσεις συναρµογής έχουν διαφορετικές φυσικοχηµικές
ιδιότητες από τα άτοµα/ ιόντα που τις απαρτίζουν.
Τα σύµπλοκα µπορεί να είναι ουδέτερα ή φορτισµένα οπότε χαρακτηρίζονται ως
σύµπλοκα ιόντα (complex ions). Το φορτίο των συµπλόκων, είναι το αλγεβρικό άθροισµα
των φορτίων του κεντρικού µεταλλικού ατόµου ή ιόντος και των συναρµοτών.
Παραδείγµατα: Το φορτίο του συµπλόκου Mo(CO)6, όπου Μο=0, 6xCO=0, είναι: 0 + 6.0
= 0. Το φορτίο του συµπλόκου PtCl2(NH3)2, όπου Pt=+2, Cl= -1, NH3=0, είναι: +2 +2.0 +
2(-1) = 0. Το φορτίο του συµπλόκου [Ag(NH3)2]+, όπου Ag=+1, NH3=0, είναι: +1 +2.0 =
+1. Το φορτίο του συµπλόκου [Fe(CN)6]4-, όπου Fe=+2, CN=-1 είναι: +2 + 6(-1) = -4.
Απαραίτητη προϋπόθεση για να θεωρηθεί µία ένωση ως ένωση συναρµογής είναι η
ύπαρξη δεσµού συναρµογής (coordination bond) µεταξύ κεντρικού ατόµου-συναρµοτή. Ο
δεσµός συναρµογής είναι ένας οµοιοπολικός δεσµός όπου το ζεύγος ηλεκτρονίων που
δηµιουργεί το δεσµό προσφέρεται αποκλειστικά από το άτοµο δότη (donor) στο άτοµο
δέκτη (acceptor). O δότης ζεύγους ηλεκτρονίων είναι ο συναρµοτής, ο οποίος δρα ως βάση
κατά Lewis (πυρηνόφιλο), ενώ ο δέκτης του ζεύγους ηλεκτρονίων είναι το κεντρικό
µεταλλικό άτοµο ή ιόν, το οποίο δρα ως οξύ κατά Lewis (ηλεκτρονιόφιλο). Το άτοµο του
συναρµοτή που δίνει το ζεύγος ηλεκτρονίων ονοµάζεται άτοµο δότης (donor atom) ή
κέντρο συναρµογής.
Το κεντρικό άτοµο/ιόν µαζί µε τους συναρµοτές που είναι συνδεδεµένοι µε αυτό
ονοµάζονται σφαίρα συναρµογής (coordination sphere).
Συναρµοτές. Ως συναρµοτές µπορεί να δράσουν ιόντα ή µόρια που περιέχουν
άτοµα µε ασύζευκτο ζεύγος ηλεκτρονίου. Τέτοια είναι τα αλογόνα (F-, Cl-, Br-, I-) , άτοµα
αζώτου (π.χ. N3-, NO, NH3 κ.α.) , οξυγόνου (π.χ. O2-, -OH, OH2, -COO- κ.α.) , φωσφόρου
(PR3), θείου (S2-, RS-, R-S-R), αλλά κι ο άνθρακας σε ενώσεις όπως το µονοξείδιο του
άνθρακα (CO), η κυανιούχος οµάδα (CN-), αλλά και σε ειδικές περιπτώσεις ακόρεστες
οργανικές ενώσεις, (π.χ. αιθυλένιο ) ή και αλκύλια (π.χ. µέθυλο οµάδα)

ΧΗΜΕΙΑ ΕΝΩΣΕΩΝ ΣΥΝΑΡΜΟΓΗΣ
4
Οι συναρµοτές µπορεί να είναι ανιονικοί ή ουδέτεροι. Όταν ένας συναρµοτής
διαθέτει ένα κέντρο συναρµογής ονοµάζεται µονοδραστικός (monodentate) ενώ όταν
διαθέτει δύο, τρία ή περισσότερα κέντρα συναρµογής ονοµάζεται διδραστικός (bidentate),
τριδραστικός (tridentate) ή πολυδραστικός (polydentate).
Όταν ένας πολυδραστικός συναρµοτής συναρµοστεί µε ένα κεντρικό άτοµο ή ιόν
µέσω περισσότερων του ενός ατόµων δοτών, η ένωση που προκύπτει ονοµάζεται χηλική
ένωση (chelate compound, από το χηλή: οπλή, νύχι αλόγου). Tα άτοµα του ίδιου
συναρµοτή που συναρµόζονται µε το κεντρικό άτοµο ή ιόν µπορεί να είναι ίδια ή
διαφορετικά:
NH2
NH2
H2N
H2N
Cu
NH2
O
H2N
OCo
OO
ONH2
O
Σχήµα 1. Σύµπλοκο [Cu(en)2]2+, en: αιθυλενοδιαµίνη, 2 άτοµα δότες Ν ανά µόριο en, σύµπλοκο
Co(Gly)3, Gly: γλυκίνη, ένα άτοµο δότης Ο, ένα άτοµο δότης Ν ανά µόριο Gly.
3. Αριθµός συναρµογής συµπλόκων
Ο αριθµός των συναρµοτών που βρίσκονται σε συναρµογή µε το κεντρικό άτοµο
ονοµάζεται αριθµός συναρµογής (coordination number). O αριθµός συναρµογής
κυµαίνεται από 2 έως 10 και σπανιότερα 12. Συνηθέστεροι αριθµοί συναρµογής είναι οι
αριθµοί 6, 4 και 2.
Ένωση Αριθµός συναρµογής
[Cu(NH3)4]2+ 4
[Co(NH3)6]3+ 6
Στην περίπτωση πολυδραστικών συναρµοτών, ο αριθµός συναρµογής των
συµπλόκων είναι το γινόµενο των συναρµοτών επί την «δραστικότητα» του συναρµοτή.
Για παράδειγµα στο Σχήµα 1, ο αριθµός συναρµογής του συµπλόκου [Cu(en)2]2+ είναι 2 x
2 = 4, ενώ του Co(Gly)3 είναι 3 x 2 = 6.
Ο αριθµός συναρµογής αποτελεί κριτήριο για την κατάταξη µιας ένωσης στις
ενώσεις συναρµογής και επιτρέπει την πρόβλεψη της στερεοχηµείας της. Έτσι, από τις
ενώσεις του βορίου (σθένος: 3), το BF4- είναι σύµπλοκο ιόν ενώ το ΒF3 δεν αποτελεί
σύµπλοκη ένωση.

ΧΗΜΕΙΑ ΕΝΩΣΕΩΝ ΣΥΝΑΡΜΟΓΗΣ
5
4. Ονοµατολογία σύµπλοκων ενώσεων
Α. ΓΡΑΦΗ ΣΥΜΠΛΟΚΩΝ
Η ονοµατολογία των συµπλόκων περιέχει πολλούς κανόνες, εδώ αναφέρονται µόνο οι
βασικοί.
1) Στους τύπους γράφεται πρώτα το κατιόν και µετά το ανιόν.
2) Τα ιόντα συµπλόκων γράφονται σε αγκύλη [ ], µε το σύµβολο του µετάλλου
πρώτο, το οποίο ακολουθείται από τα σύµβολα των ligands, πρώτα των ανιονικών,
µετά των ουδετέρων και τέλος των κατιονικών σε αλφαβητική σειρά και µε δείκτες
που υποδηλώνουν τον αριθµό µορίων του κάθε ligand. Το φορτίο του σύµπλοκου
ιόντος δηλώνεται µε τη µορφή εκθέτη επάνω δεξιά και έξω από την αγκύλη.
Παραδείγµατα: [Pt(ΝΗ3)4]
2+, [PtCl6]2-, [Cu(NH3)4][PtCl4]
Β. ΟΝΟΜΑΤΑ ΣΥΜΠΛΟΚΩΝ
Υπάρχει µια µεγάλη διαφορά κατά την ονοµατολογία των ενώσεων στα αγγλικά και
στα ελληνικά. Στα αγγλικά πάντα προηγείται το κατιόν (όπως και γράφεται) και
ακολουθεί το ανιόν. ∆ηλαδή, NaCl: sodium chloride. Στα ελληνικά προηγείται τον
ανιόν, δηλαδή, NaCl: χλωριούχο νάτριο. Τυπικά στην ονοµασία των συµπλόκων
ακολουθούµε τον τρόπο που εφαρµόζεται στην ελληνική γλώσσα, όµως πολλές φορές
υιοθετείται και ο αγγλικός τρόπος. ∆ηλαδή,
[Cu(NH3)4]SO4: θειικός τετραµµινοχαλκός ή τετραµµινοχαλκός θειικός
1) Εάν το σύµπλοκο είναι κατιονικό ή ουδέτερο, προηγούνται τα ονόµατα των ligand
µε τα προθέµατα δι,-τρι- κλπ ή δις-, τρις- κλπ σε αλφαβητική σειρά και στο τέλος
ακολουθεί το όνοµα του µετάλλου. Σε παρένθεση µε λατινικούς χαρακτήρες
γράφεται και η οξειδωτική κάτασταση αυτού.
Παράδειγµα: [PtCl2(NH3)2], διαµµινοδιχλωρολευκόχρυσος (ΙΙ)

ΧΗΜΕΙΑ ΕΝΩΣΕΩΝ ΣΥΝΑΡΜΟΓΗΣ
6
2) Εαν το σύµπλοκο είναι ανιονικό τότε ισχύουν όλα τα παραπάνω µε τη µόνη
διαφορά ότι το µέταλλο παιρνει την καταληξη –ικό.
Παράδειγµα: Na4[Fe(CN)6], εξακυανοσιδηρικό (ΙΙ) νάτριο
3) Τα ligand που είναι ουδέτερα ονοµάζονται ως έχει,τα ligand που είναι ανιονικά,
δηλαδή ιονίζονται κατά την συναρµογή αποκτούν την κατάληξη –ατο (από το
αγγλικό –ate, πχ. carboxylate, thiolate etc). Παρακάτω ακολουθεί πίνακας µε τις
ονοµασίες κοινών ligand.
4) Τα προθέµατα δι,-τρι- κλπ ή δις-, τρις- κλπ δηλώνουν τον αριθµό των µορίων του
ligand , όπου δι-, τρι- κλπ χρησιµοποιείται για απλά ligand, ενώ δις- τρις- κλπ
χρησιµοποιείται για σύνθετα ligand που περιέχουν στο όνοµά τους το προθεµα δι-
τρι-...
Παράδειγµα: [Pt(bipy)2]Cl2 : χλωριούχος δις(διπυριδίνη)λευκόχρυσος (ΙΙ)
Τύπος ligand Όνοµασία
Ακετυλακετονάτο (acac)
Αιθυλενοδιαµίνη (en)
2,2 -διπυριδίνη (bipy)
∆ις(διφαινυλοφωσφινο)αιθάνιο (dppe)
Κυκλοπεντιαδιενυλο (cp)
NH3 Άµµινο (COO-)2 Οξαλάτο (ox) CO Καρβόνυλο H2O Ύδατο Cl- Χλώρο OH- Υδρόξο CN- Κυανο R-NC Ισοκύανο RS- Θειολάτο O2- Όξο N-3 Νίτριδο

ΧΗΜΕΙΑ ΕΝΩΣΕΩΝ ΣΥΝΑΡΜΟΓΗΣ
7
5. Στερεοχηµεία σύµπλοκων ενώσεων Η στερεοχηµική δοµή των ενώσεων συναρµογής, πολύεδρο συναρµογής, είναι
συνδεδεµένη µε τον αριθµό συναρµογής του κεντρικού ατόµου ή ιόντος.
Οι ιδιότητες των ενώσεων συναρµογής συνδέονται άµεσα µε τη δοµή των
ενώσεων. Κατά συνέπεια ο αριθµός συναρµογής βοηθά στην πρόβλεψη της δοµής και τις
ιδιότητες της ένωσης συναρµογής.
Αριθµός συναρµογής δύο. Σύµπλοκα µε αριθµό συναρµογής 2 σχηµατίζουν τα
µονοσθενή ιόντα της ΙΒ οµάδας του περιοδικού συστήµατος Cu+1, Αg+1 και Αu+1,
[Ag(CN)2]- καθώς και το ιόν Hg2+. Επίσης αριθµός συναρµογής 2 απαντάται σε
τριαλογονίδια. [BrCl2]-, [Ι3]
-.
Tα σύµπλοκα µε αριθµό συναρµογής 2 είναι γραµµικά:
L-M-L
Αριθµός συναρµογής τρία. Τα σύµπλοκα µε αριθµό συναρµογής 3 είναι σπάνια.
Η διάταξη των συµπλόκων µε αριθµό συναρµογής 3 µπορεί να είναι:
α) Επίπεδη τριγωνική µε το κεντρικό άτοµο ή ιόν στο κέντρο του τριγώνου.
β) Πυραµιδική µε το κεντρικό άτοµο στην κορυφή τριγωνικής πυραµίδας.
γ) Ψευδοτετραεδρική, όταν το κεντρικό άτοµο ή ιόν το οποίο βρίσκεται στην κορυφή της
τριγωνικής πυραµίδας, διαθέτει ελεύθερο ζεύγος ηλεκτρονίων.
δ) Σχήµατος Τ (ClF3, BrF3)
Ι ΙΙ ΙΙΙ
Σχήµα 2. ∆οµές συµπλόκων µε αριθµό συναρµογής τρία. Ι. επίπεδη τριγωνική, ΙΙ τριγωνική
πυραµιδική, ΙΙΙ. ψευδοτετραεδρική.

ΧΗΜΕΙΑ ΕΝΩΣΕΩΝ ΣΥΝΑΡΜΟΓΗΣ
8
Αριθµός συναρµογής τέσσερα. Σύµπλοκα µε αριθµό συναρµογής τέσσερα εµφανίζουν
τόσο τα στοιχεία των κύριων οµάδων όσο και τα µεταβατικά στοιχεία.
Στα σύµπλοκα µε αριθµό συναρµογής τέσσερα απαντώνται οι εξής διατάξεις:
α. Τετραεδρική, στην οποία το κεντρικό ιόν διατάσσεται στο κέντρο του τετραέδρου και
οι συναρµοτές στις κορυφές. Τετραεδρική διάταξη εµφανίζουν πολλά σύµπλοκα στοιχείων
των κύριων οµάδων του περιοδικού συστήµατος όπως και µεταβατικών στοιχείων.
[BF4]-, [BeF4]
2-, [Zn(OH)4]2-, [Cd(CN)4]
2-
β. Επίπεδη τετραγωνική στην οποία το κεντρικό άτοµο τοποθετείται στο κέντρο του
τετραγώνου. Επίπεδη τετραγωνική διάταξη εµφανίζουν κυρίως µεταβατικά στοιχεία µε
d8 ηλεκτρονική διαµόρφωση όπως Rh(I), Pd(II), Pt(II) Au(III)
γ. Παραµορφωµένη τετραεδρική ή δισφηνοειδής. Η µορφή αυτή απαντάται όταν το
κεντρικό άτοµο διαθέτει ζεύγος ηλεκτρονίων.
Το ίδιο µεταβατικό στοιχείο είναι δυνατό να σχηµατίζει σύµπλοκα διαφορετικής
διάταξης µε διαφορετικούς συναρµοτές. Σε ορισµένες περιπτώσεις είναι δυνατή η
µετατροπή της τετραεδρικής δοµής σε επίπεδη τετραγωνική και αντίστροφα όταν οι δύο
δοµές εµφανίζουν παρόµοια σταθερότητα (σύµπλοκα Νι(ΙΙ), Co(II), Cu(II)).
Σε ορισµένα σύµπλοκα αν και η σύστασή τους δείχνει αριθµό συναρµογής 3, η δοµή τους
αντιστοιχεί σε τετραεδρική ή επίπεδη τετραγωνική διάταξη λόγω διµερισµού.
Ι ΙΙ ΙΙΙ ΙV
Σχήµα 3. ∆οµές συµπλόκων µε αριθµό συναρµογής τέσσερα.
Ι. επίπεδη τετραγωνική, ΙΙ. τετραεδρική. ΙΙΙ. ∆ισφηνοειδής, IV. Τετραγωνική πυραµιδική
Αριθµός συναρµογής πέντε. Τα σύµπλοκα µε αριθµό συναρµογής 5 παρουσιάζουν
συνήθως δοµή τριγωνικής διπυραµίδας ή τετραγωνικής πυραµίδας µε το κεντρικό άτοµο ή
ιόν να καταλαµβάνει το κέντρο της τριγωνικής διπυραµίδας ή του τετραγώνου της βάσης
της τετραγωνικής πυραµίδας.

ΧΗΜΕΙΑ ΕΝΩΣΕΩΝ ΣΥΝΑΡΜΟΓΗΣ
9
Ι ΙΙ
Σχήµα 4. ∆οµές συµπλόκων µε αριθµό συναρµογής πέντε. Ι. τριγωνική πυραµιδική, ΙΙ.
Τετραγωνική πυραµιδική.
Επειδή οι δύο δοµές είναι ενεργειακά ισοδύναµες, ένα σύµπλοκο είναι δυνατόν να
πάρει τη µία µορφή ή την άλλη ενώ συχνή είναι η αλληλοµετατροπή µεταξύ των δύο
δοµών. Σύµπλοκα µε δοµή τετραεδρικής πυραµίδας είναι δυνατόν να µετατραπούν, σε
διαλύµατά τους, σε σύµπλοκα µε οκταεδρική δοµή όταν ένα µόριο του διαλύτη
καταλαµβάνει τη θέση έκτου συναρµοτή, συνδεόµενο ασθενώς µε το κεντρικό άτοµο ή
ιόν. Σηµειώνεται ότι σε ορισµένες περιπτώσεις, σύµπλοκα που εµφανίζουν αριθµό
συναρµογής πέντε έχουν στην πραγµατικότητα αριθµό συναρµογής έξι λόγω διµερισµού
π.χ.[ΜnI(CO)4] ή τετραµερισµού [ΜοF5].
Αριθµός συναρµογής έξι. Τα σύµπλοκα µε αριθµό συναρµογής 6 αντιπροσωπεύουν το
µεγαλύτερο µέρος των σύµπλοκων ενώσεων και σχηµατίζονται τόσο από στοιχεία των
κύριων οµάδων του περιοδικού συστήµατος όσο και από µεταβατικά στοιχεία. Τα
σύµπλοκα µε αριθµό συναρµογής έξι έχουν δοµή κανονικού οκταέδρου.
Εκτός από τη δοµή αυτή, απαντώνται και διάφορες παραµορφωµένες δοµές, οι πιο
σηµαντικές από τις οποίες είναι, τετραγωνική παραµόρφωση (δοµή τετραγωνικής
πυραµίδας, και δοµή συµπιεσµένου οκταέδρου), ροµβική παραµόρφωση και τριγωνική
παραµόρφωση.
CO CO
CO
CO
CO CO
CO
CO Mn Mn
I
I

ΧΗΜΕΙΑ ΕΝΩΣΕΩΝ ΣΥΝΑΡΜΟΓΗΣ
10
Σχήµα 5. ∆οµές συµπλόκων µε αριθµό συναρµογής έξι. Ι. κανονικό οκτάεδρο, ΙΙ. Τετραγωνική
πυραµίδα, ΙΙΙ. Ροµβική παραµόρφωση, IV. Ισοπεδοµένο (συµπιεσµένο) οκτάεδρο, V. Τριγωνικό
αντιπρίσµα.
Αριθµός συναρµογής επτά. Τα σύµπλοκα µε αριθµό συναρµογής 7 είναι σπάνια και
απαντώνται µε διατάξεις πενταγωνικής διπυραµίδας (Να3[ΖrF7], [UF7]3-,[UO2F5]
3-),
παραµορφωµένου τριγωνικού πρίσµατος πχ. (ΝΗ4)3[ΖrF7] και παραµορφωµένου
οκταέδρου ([ΝbOF6]3-).
Ι ΙΙ ΙΙΙ
Σχήµα 6. ∆οµή συµπλόκων µε αριθµό συναρµογής πέντε. Ι. πενταγωνική πυραµίδα, ΙΙ.
Παραµορφωµένο τριγωνικό πρίσµα, ΙΙΙ. Παραµορφωµένο οκτάεδρο.
Αριθµός συναρµογής οκτώ. Τα σύµπλοκα µε αριθµό συναρµογής 8 παρουσιάζουν τις
δοµές κύβου ([UF8]3-, [PaF8]
3-), εξαγωνικής διπυραµίδας ([UO2(ac)3]-), αντιπρίσµατος
([ΤaF8]3-), δωδεκαέδρου ([Zr(ox)4]
4-, [Mo(CN)8]4-, [Cr(O2)4]
3-).
III
III
ΙV V
III
III
ΙV V
III
III
ΙV V

ΧΗΜΕΙΑ ΕΝΩΣΕΩΝ ΣΥΝΑΡΜΟΓΗΣ
11
Ι ΙΙ ΙΙΙ ΙV
Σχήµα 7. ∆οµές συµπλόκων µε αριθµό συναρµογής οχτώ. Ι.κύβος, ΙΙ. Εξαγωνική πυραµίδα, ΙΙΙ.
Τετραγωνικό αντιπρίσµα, IV. ∆ωδεκάεδρο.
Αριθµός συναρµογής εννέα. Τα σύµπλοκα µε αριθµό συναρµογής 9 είναι εξαιρετικά
σπάνια και παρουσιάζουν δοµή ανάλογη του σχήµατος 7, η οποία προκύπτει από
συνδυασµό ενός τριγωνικού πρίσµατος και τριών τετραγωνικών πυραµίδων η βάση
καθεµιάς των οποίων συµπίπτει µε µία από τις πλευρές του τριγωνικού πρίσµατος.
Παράδειγµα τέτοιων συµπλόκων αποτελούν τα σύµπλοκα (Νd(H2O)9], [ReH9]2-
6. Iσοµέρεια συµπλόκων ενώσεων
Στις σύµπλοκες ενώσεις διακρίνονται πολλές µορφές ισοµέρειας :
Ισοµέρεια ιονισµού, συναρµογής, πολυµερισµού, συνδέσεως, συναρµοτών,
διαµόρφωσης και στερεοϊσοµέρεια.
α. Ισοµέρεια ιονισµού ή δοµής (ionization isomerism):
Η ισοµέρεια αυτή παρατηρείται όταν ένα ιόν µπορεί να συµµετέχει ως συναρµοτής
ή ως απλό ιόν σε ένα σύµπλοκο. Τα ισοµερή ιονισµού παρουσιάζουν διαφορά ως προς το
είδος των ιόντων που αποδίδουν κατά τη διάσταση τους σε υδατικά διαλύµατα:
Πχ. [Co(NH3)5Br]Cl και [Co(NH3)5Cl] Br επίσης
[Co(NH3)5Cl]SO4 και [Co(NH3)5SO4]Cl ή
[Co(NH3)5Cl2]NO2 και [Co(NH3)5Cl (NO2)] Cl
[Co(NH3)5Cl2]NO2 [Co(NH3)5Cl2]+ + NO2
-
[Co(NH3)5Cl (NO2)] Cl [Co(NH3)5Cl (NO2)]+ + Cl-
Ισοµέρεια ιονισµού παρατηρείται σε περιπτώσεις υδατοσυµπλόκων, δηλαδή
συµπλόκων που περιέχουν, ως συναρµοτές, µόρια νερού. Στις περιπτώσεις αυτές το µόριο
του νερού µπορεί να αντικατασταθεί από άλλο ιόν και να µετατραπεί από µόριο

ΧΗΜΕΙΑ ΕΝΩΣΕΩΝ ΣΥΝΑΡΜΟΓΗΣ
12
συναρµογής σε ύδωρ κρυσταλλώσεως. Η µορφή αυτή ισοµέρειας χαρακτηρίζεται
ειδικότερα και ως ισοµέρεια ενυδάτωσης (hydrate isomerism).
Παραδείγµατα ισοµερών υδατοσυµπλόκων αποτελούν τα:
[Cr(H2O)6]Cl3 ιώδες
[CrCl(H2O)5]Cl2.H2O ανοιχτό πράσινο
[CrCl2(H2O)4]Cl.2H2O σκούρο πράσινο
β. Ισοµέρεια συναρµογής (coordination isomerism):
Η ισοµέρεια αυτή παρατηρείται όταν σε µία σύµπλοκη ένωση, τόσο το ανιόν όσο
και το κατιόν, είναι σύµπλοκα ιόντα Αφορά ενώσεις στις οποίες παρατηρείται διαφορετική
κατανοµή των συναρµοτών µεταξύ ανιόντος και κατιόντος.
Π.χ. [Co(NH3)6][Cr(SCN)6] και [Co(NH3)4(SCN)2][Cr(NH3)2(SCN)4]
[Co(en)3] [Cr(CN)6] και [Cr(en)3] [Co(CN)6] ή [Cu(NH3)4] [PtCl4] και [Pt(NH3)4] [CuCl4] ή
[PtII(NH3)4] [PtIVCl6] και [PtIV(NH3)4Cl2] [PtIICl4]
Σε διµεταλλικά σύµπλοκα, τα ισοµερή συναρµογής χαρακτηρίζονται ειδικότερα ως
ισοµερή συναρµογής θέσης (co-ordination position isomers)
γ. Ισοµέρεια πολυµερισµού (Polymerisation isomerism):
Τα σύµπλοκα που παρουσιάζουν ισοµέρεια πολυµερισµού µπορούν να
περιγραφούν µε τον γενικό τύπο (ΜL1m1L2m2)n. Τα ισοµερή πολυµερισµού είναι
σύµπλοκες ενώσεις ενός µεταλλικού ιόντος γύρω από το οποίο συνδέονται δύο ή
περισσότεροι συναρµοτές. Οι ισοµερείς ενώσεις µπορεί να αποτελούνται από ένα
σύµπλοκο µόριο ή από διαφορετικό αριθµό, η κάθε µία, σύµπλοκων ιόντων στα οποία
συµµετέχει το ίδιο κεντρικό µεταλλικό άτοµο ή ιόν ενώ η κατανοµή των συναρµοτών
ποικίλει. Στα ισοµερή πολυµερισµού, η αναλογία κεντρικού µεταλλικού ιόντος –
συναρµοστών διατηρείται σταθερή (1: m1: m2).
Πχ. [Pt(NH3)2Cl2], [Pt(NH3)4][PtCl4], [Pt(NH3)4][PtCl3(NH3)]2

ΧΗΜΕΙΑ ΕΝΩΣΕΩΝ ΣΥΝΑΡΜΟΓΗΣ
13
µε αναλογία Pt : NH3 : Cl 1 : 2 : 2
δ. Ισοµέρεια συνδέσεως (bond isomerism, salt isomerism ή linkage isomerism) :
Παρατηρείται όταν στο σύµπλοκο συµµετέχουν αµφιδραστικοί (ambidentate)
συναρµοτές. Αµφιδραστικοί χαρακτηρίζονται οι συναρµοτές που έχουν περισσότερα από
ένα άτοµα δότες και η συναρµογή µπορεί να γίνει από το ένα ή από το άλλο άτοµο.
Τέτοιοι συναρµοτές είναι τα NO2- όπου η συναρµογή µπορεί να γίνει από το Ν ή το Ο, τα
SCN- όπου η συναρµογή µπορεί να γίνει από το S ή το Ν, τα CN- όπου η συναρµογή
µπορεί να γίνει από τον C ή το Ν. Παραδείγµατα ισοµερών συνδέσεως αποτελούν τα:
[Co(NH3)5(SCN)]Cl και [Co(NH3)5(NCS)]Cl
ή
Ο 2+ Ο2+ (ΝΗ3)5Co - N (ΝΗ3)5Co – O - N O [Co(NH3)5(ΝΟ2)]Cl και [Co(NH3)5(ΟΝΟ)]Cl
Στους αµφιδραστικούς συναρµοτές κατατάσσονται και διδραστικοί ή
πολυδραστικοί συναρµοτές που δεν συναρµόζονται από όλα τα άτοµα δότες.
ε. Ισοµέρεια συναρµοτών (ligand isomerism):
Η µορφή αυτή ισοµέρειας παρατηρείται µεταξύ συµπλόκων στα οποία οι
συναρµοτές που συµµετέχουν είναι ήδη ισοµερείς ενώσεις.
Έτσι πχ. στο σύµπλοκο [CoCl(en)2(NH2C6H4Me)]Cl2 όπου en : αιθυλενοδιαµίνη και Me :
µεθύλιο, η τολουιδίνη, (NH2C6H4Me), µπορεί να είναι ορθο-, µέτα- ή παρα-τολουιδίνη.
στ. Ισοµέρεια διαµόρφωσης (conformational isomerism):
Όπως έχει ήδη επισηµανθεί, ορισµένα σύµπλοκα είναι δυνατόν να εµφανίζουν δύο
διαµορφώσεις. Παράδειγµα αποτελούν τα σύµπλοκα του Νi(ΙΙ), Co(ΙΙ) και Cu(ΙΙ) µε
αριθµό συναρµογής τέσσερα, που απαντώνται τόσο σε τετραεδρική όσο και σε επίπεδη
τετραγωνική διάταξη. Οι δύο διαµορφώσεις του ίδιου συµπλόκου χαρακτηρίζονται ως
ισοµερή διαµόρφωσης.
ζ. Στερεοϊσοµέρεια (stereoisomerism)

ΧΗΜΕΙΑ ΕΝΩΣΕΩΝ ΣΥΝΑΡΜΟΓΗΣ
14
Οι µορφές ισοµέρειας που αναφέρθηκαν παραπάνω και που αφορούν το είδος των
συναρµοτών ή το είδος των δεσµών ανήκουν στην γενικότερη κατηγορία της ισοµέρειας
δοµής (constitutional or structural isomerism).
Η στερεοϊσοµέρεια παρατηρείται µεταξύ συµπλόκων στα οποία οι συναρµοτές
που συνδέονται µε το κεντρικό άτοµο όπως και οι δεσµοί που δηµιουργούνται είναι ίδιοι,
διαφέρουν όµως ως προς την διάταξη των συναρµοτών στον χώρο.
Παρά το γεγονός ότι και η ισοµέρεια διαµόρφωσης που αναφέρθηκε παραπάνω
αφορά τη διάταξη των συναρµοτών στον χώρο, η ισοµέρεια διαµόρφωσης δεν εντάσσεται
στην στερεοϊσοµέρεια.
Η στερεοϊσοµέρεια περιλαµβάνει την γεωµετρική ισοµέρεια και την οπτική ισοµέρεια.
• Γεωµετρική ισοµέρεια (diastereoisomerism, geometric isomerism):
Στην γεωµετρική ισοµέρεια περιλαµβάνεται η cis-trans ισοµέρεια και η fac-mer
ισοµέρεια
α) cis-trans ισοµέρεια
Η cis-trans ισοµέρεια απαντάται στα:
-επίπεδα τετραγωνικά σύµπλοκα τύπου ΜL12L22 που περιέχουν δύο ζεύγη
διαφορετικών συναρµοτών και στα:
-οκταεδρικά σύµπλοκα τύπου ΜL14L22 που περιέχουν τέσσερις όµοιους και δύο
διαφορετικούς συναρµοτές.
Στα cis-ισοµερή οι συναρµοτές βρίσκονται στις πλησιέστερες θέσεις, ενώ στα
trans-ισοµερή οι βρίσκονται στις πιο αποµακρυσµένες θέσεις.
Tα cis-trans ισοµερή παρουσιάζουν διαφορετικές φυσικές και βιολογικές ιδιότητες.
Έτσι το cis-[Pt(NH3)2Cl2], (cis-platin), είναι ανοιχτοκίτρινο δυσδιάλυτο στο νερό και
εµφανίζει αντικαρκινική δράση ενώ το trans-[Pt(NH3)2Cl2] είναι σκούρο κίτρινο,
εµφανίζει ακόµη µικρότερη διαλυτότητα στο νερό και δεν έχει αντικαρκινική δράση.

ΧΗΜΕΙΑ ΕΝΩΣΕΩΝ ΣΥΝΑΡΜΟΓΗΣ
15
Cis-trans συµµετρία παρατηρείται και στα επίπεδα τετραγωνικά σύµπλοκα µε
ασύµµετρους διδραστικούς συναρµοτές.
Η διαπίστωση της cis-trans συµµετρίας γίνεται µε τη χρήση ακτίνων Χ ή µε µέτρηση της
διπολικής ροπής.
β) fac-mer ισοµέρεια
Η ισοµέρεια αυτή παρατηρείται σε οκταεδρικά σύµπλοκα του τύπου ΜL13L23
Αν οι τρείς όµοιοι συναρµοτές καταλάβουν τις κορυφές µίας πλευράς του κανονικού
οκταέδρου το ισοµερές χαρακτηρίζεται ως fac (από το facial).
Αν δύο από τους τρείς όµοιους συναρµοτές καταλάβουν δύο αξονικές θέσεις, το
ισοµερές χαρακτηρίζεται ως mer (από το meridional).
• Oπτική ισοµέρεια (optical isomerism)
Τα οπτικά ισοµερή παρουσιάζουν σχέση αντικειµένου-ειδώλου και σε καµία
περίπτωση δεν ταυτίζονται µεταξύ τους, όπως συµβαίνει µε τα χέρια µας.
Τέτοια συµµετρία εµφανίζουν τετραεδρικά ή οκταεδρικά σύµπλοκα µε έναν ή
περισσότερους διδραστικούς ή πολυδραστικούς συναρµοτές.
Τα οπτικά ισοµερή (οptical isomers) χαρακτηρίζονται και ως εναντιοµερή (enantiomers
or enantiomorphs), οπτικοί αντίποδες, εναντιοστερεοµερή, ή χειρόµορφες ενώσεις
(chiral compounds).
Παρά το γεγονός ότι συχνά τα εναντιοµερή χαρακτηρίζονται και ως εναντιόµοφα,
στην πραγµατικότητα η εναντιοµέρια διαφέρει από την εναντιοµορφία. Στα εναντιοµερή οι
οπτικές ιδιότητες διατηρούνται και σε κατάσταση διαλύµατος ή τήξεως ενώ τα
εναντιόµορφα έχουν τις οπτικές ιδιότητές τους µόνο σε κρυσταλλική κατάσταση.
Τα οπτικά ισοµερή έχουν ίδιες, όλες τις φυσικές και χηµικές τους ιδιότητες µε
µόνη διαφορά, ότι στρέφουν το επίπεδο του πολωµένου φωτός προς αντίθετες
κατευθύνσεις.. Το ισοµερές που στρέφει το επίπεδο του πολωµένου φωτός προς τα δεξιά
χαρακτηρίζεται ως δεξιόστροφο (+), dextro (d or +ve) ενώ αυτό που στρέφει το επίπεδο
του πολωµένου φωτός προς τα αριστερά χαρακτηρίζεται ως αριστερόστροφο (-), laevo (l

ΧΗΜΕΙΑ ΕΝΩΣΕΩΝ ΣΥΝΑΡΜΟΓΗΣ
16
or -ve). Μίγµα των δύο εναντιοµερών σε ίσες ποσότητες χαρακτηρίζεται ως ρακεµικό
και δεν έχει τη δυνατότητα να στρέφει το επίπεδο του πολωµένου φωτός.
Σχήµα 8. Οπτικά ισοµερή των συµπλόκων [Co(en)2Cl2]+, [Co(en)3]
3+.
7. Παρασκευή συµπλόκων ενώσεων
Αντιδράσεις υποκατάστασης. Πραγµατοποιούνται µε αντικατάσταση ενός ή
περισσότερων συναρµοτών της σφαίρας συναρµογής του συµπλόκου από άλλον ή άλλους
συναρµοτές που βρίσκονται στο περιβάλλον του συµπλόκου µε αποτέλεσµα τη δηµιουργία
σταθερότερου συµπλόκου. Η αντίδραση υποκατάστασης περιγράφεται από την
γενικότερη αντίδραση:
[ΜLn] + nL΄ [ΜL΄n] + nL
Η υποκατάσταση πραγµατοποιείται βαθµιαία:
[ΜLn] + L΄ [MLn-1L΄] + L
[ML n-1L΄] + L΄ [MLn-2L΄2] + L
………………………………………
[ML΄n-1L] + L΄ [MLn] + L
Στις αντιδράσεις υποκατάστασης περιλαµβάνονται και οι αντιδράσεις αντικατάστασης
µορίων νερού των υδατοσυµπλόκων.
[Μ(Η2Ο)6]n+ + L [M(H2O)5L] n+ + H2O
Αντιδράσεις προσθήκης. Στις αντιδράσεις προσθήκης πραγµατοποιείται απευθείας
αντίδραση µεταξύ δύο συστατικών του συµπλόκου. Οι αντιδράσεις προσθήκης µπορούν
να πραγµατοποιηθούν και απουσία νερού, παρουσία οργανικών διαλυτών ή και απουσία
διαλύτη. Τα δύο συστατικά µπορεί να είναι στην ίδια φάση (αέρια ή υγρή) ή σε
διαφορετικές φάσεις.

ΧΗΜΕΙΑ ΕΝΩΣΕΩΝ ΣΥΝΑΡΜΟΓΗΣ
17
Παραδείγµατα αντιδράσεων προσθήκης δίνονται παρακάτω:
BF3 + NMe3 Me3N-BF3
(C2H5)2O + BF3 [(C2H5)2O-BF3]
KCl + TiCl4 K2[TiCl 6]
AlCl 3 + NaCl Na[AlCl4]
Αντιδράσεις οξειδοαναγωγής (αντιδράσεις µεταφοράς ηλεκτρονίων ή αντιδράσεις
ανταλλαγής ηλεκτρονίων). Στις αντιδράσεις αυτές κατά τη δηµιουργία του συµπλόκου
πραγµατοποιείται µεταφορά ηλεκτρονίων. Κατά τη µεταφορά ηλεκτρονίων παρατηρείται
συνήθως αλλαγή του βαθµού οξείδωσης του µεταλλικού ιόντος/ατόµου που πρόκειται να
συναρµοστεί.
Στις αντιδράσεις αυτές συµµετέχει ένωση που περιέχει το προς συναρµογή ιόν σε
ορισµένη οξειδωτική βαθµίδα, ένωση που είναι ο συναρµοτής, καθώς και ένα οξειδωτικό
ή αναγωγικό µέσο. Συχνά στις αντιδράσεις οξειδοαναγωγής συµµετέχουν δύο ενώσεις που
περιέχουν το κεντρικό µεταλλικό ιόν σε διαφορετικές οξειδωτικές βαθµίδες και κατά τη
διάρκεια της αντίδρασης παρατηρείται µεταφορά ηλεκτρονίων µεταξύ των δύο
οξειδωτικών µορφών του µετάλλου. Επίσης στη διαδικασία µεταφοράς ηλεκτρονίων είναι
δυνατόν να συµµετέχουν και οι συναρµοτές.
Παραδείγµατα παρασκευής συµπλόκων µε αντιδράσεις οξειδοαναγωγής δίνονται
παρακάτω:
[*Fe(CN)6]3- + [Fe(CN)6]
4- [*Fe(CN)6]4- + [Fe(CN)6]
3-
2 CoCl2 + H2O2 + 10 NH3 + 2 NH4Cl C 2[Co(NH3)6]Cl3 + 2H2O
Αντιδράσεις θερµικής διαστάσεως. Κατά τις αντιδράσεις θερµικής διαστάσεως, µε τη
βαθµιαία άυξηση της θερµοκρασίας, παρατηρείται σταδιακή απόσπαση συναρµοτών από
το σύµπλοκο µε αποτέλεσµα να προκύπτουν νέα σύµπλοκα.
Κατά συνέπεια στις αντιδράσεις θερµικής διασπάσεως συνήθως παρατηρείται
µείωση του αριθµού συναρµογής του κεντρικού ατόµου/ιόντος χωρίς όµως αυτό να είναι
απαραίτητο γιατί σε ορισµένες περιπτώσεις µε την απόσπαση ορισµένων συναρµοτών,
παρατηρείται µετατροπή άλλων συναρµοτών από µονοδραστικούς σε διδραστικούς οπότε
ο αριθµό συναρµογής παραµένει ο ίδιος.
Παραδείγµατα αντιδράσεων θερµικής διαστάσεως δίνονται παρακάτω:
o o o
CuSO4.5H2O 96.5 CuSO4
.4H2O 102 CuSO4.3H2O 115 CuSO4
.H2O

ΧΗΜΕΙΑ ΕΝΩΣΕΩΝ ΣΥΝΑΡΜΟΓΗΣ
18
2 [MnCl(CO)5] 2 CO + [(OC)4Mn
Cl
Mn(CO)4]
Cl
Αντιδράσεις σε συναρµοτές. Σε πολλές περιπτώσεις η παρασκευή ενός συµπλόκου
γίνεται µε τροποποίηση των συναρµοτών που είναι ήδη συνδεδεµένοι µε το κεντρικό
άτοµο ή ιόν.
Οι συνηθέστερες αντιδράσεις είναι αντιδράσεις πρωτονίωσης ή αποπρωτονίωσης,
αντιδράσεις προσθήκης σε διπλό δεσµό και αντιδράσεις υποκατάστασης.
Παραδείγµατα αντιδράσεων σε συναρµοτές δίνονται παρακάτω:
[Cο(ΝΗ3)5(Η2Ο)]3+ [Co(NH3)5(OH)]3+ + H+
R R LnM-NC6H5 LnM-NC6H11
R R
[Cr(NH3)5(H2O)]3+ HNO2 [Cr(NH3)5(ONO)]2+
όπως έδειξαν µελέτες µε επισηµασµένο οξυγόνο, στην παραπάνω αντίδραση δεν
πραγµατοποιείται αντικατάσταση του µορίου του νερού αλλά αντικατάσταση του Η από
ΝΟ στο µόριο του νερού.
8. Σταθερότητα συµπλόκων ενώσεων
Ένας τρόπος ποσοτικής έκφρασης της σταθερότητας ενός συµπλόκου είναι µε τη
χρήση της σταθεράς χηµικής ισορροπίας της γενικής αντίδρασης σχηµατισµού του
συµπλόκου.
Ο σχηµατισµός ενός συµπλόκου µπορεί να παρασταθεί γενικά ως εξής:
Μ + L ML
ML + L ML2
ML2 + L ML3
…………………….
MLn-1 + L MLn
M + nL MLn
Εάν στη συνολική αντίδραση όσο και στις επιµέρους αντιδράσεις εφαρµοστεί ο
νόµος δράσεως των µαζών τότε προκύπτουν οι αντίστοιχες σταθερές ισορροπίας

ΧΗΜΕΙΑ ΕΝΩΣΕΩΝ ΣΥΝΑΡΜΟΓΗΣ
19
[ML] [ML2] [ML3] [MLn] K1= , K2= , K3= , ………. Kn= [M] [L] [ML] [L] [ML2] [L] [MLn-1] [L]
Οι σταθερές Κ1 έως Κn χαρακτηρίζονται ως διαδοχικές σταθερές σταθερότητας ή
σχηµατισµού του συµπλόκου MLn (stepwise stability constants) και οι τιµές τους κατά
κανόνα ελαττώνονται από την K1 προς την Κn.
Το γινόµενο των διαδοχικών σταθερών σταθερότητας, αντιστοιχεί στη σταθερά
χηµικής ισορροπίας της γενικής αντίδρασης σχηµατισµού του συµπλόκου και
χαρακτηρίζεται ως ολική σταθερά σταθερότητας ή σχηµατισµού του συµπλόκου MLn.
(overall stability constant)
[MLn] Κ = Κ1. Κ2
. Κ3. …….. Κn = [M] [L]n
H σταθερά σταθερότητας Κ όπως και ο αρνητικός λογάριθµός της pK = - log K
χρησιµοποιούνται για τον προσδιορισµό της σταθερότητας ενός συµπλόκου.
Όσο µεγαλύτερη είναι η σταθερά σταθερότητας τόσο σταθερότερο είναι το
σύµπλοκο. Αντίστοιχα, όσο µικρότερο είναι το pK τόσο σταθερότερο είναι ένα σύµπλοκο.
Το αντίστροφο της σταθεράς σταθερότητας αντιστοιχεί στη σταθερά ισορροπίας
της αντίδρασης διάσπασης του συµπλόκου και χαρακτηρίζεται ως σταθερά ασταθείας
(instability constant or the dissociation constant).
1 [Κ] [L] n
Kαστ = = Κ [MLn]
Είναι ευνόητο ότι όσο µικρότερη είναι η σταθερά ασταθείας τόσο σταθερότερο είναι ένα
σύµπλοκο.
Παράγοντες που επηρεάζουν την σταθερότητα των συµπλόκων. Η σταθερότητα των
συµπλόκων ενώσεων εξαρτάται από διάφορους παράγοντες οι κυριότεροι από τους
οποίους είναι:
α) η πυκνότητα του ηλεκτρονικού φορτίου
β) η βασικότητα του συναρµοτή
γ) ο σχηµατισµός χηλικού δακτυλίου.

ΧΗΜΕΙΑ ΕΝΩΣΕΩΝ ΣΥΝΑΡΜΟΓΗΣ
20
α) Πυκνότητα ηλεκτρονικού φορτίου του κεντρικού ατόµου. Ως πυκνότητα
ηλεκτρονικού φορτίου ή δυναµικό ιόντος χαρακτηρίζεται ο λόγος (z/r) του φορτίου του
κεντρικού ιόντος (z) προς την ακτίνα του (r).
Σε σύµπλοκα που έχουν τους ίδιους ή παρόµοιους συναρµοστές «τα ιόντα που
έχουν µεγαλύτερη πυκνότητα φορτίου σχηµατίζουν σταθερότερα σύµπλοκα».
Έτσι το σύµπλοκο [FeIII(CN)6]3- είναι σταθερότερο από το σύµπλοκο [FeII(CN)6]
4-.
Με βάση το µέγεθος και το φορτίο του ατόµου ή ιόντος ο Lewis χώρισε τα κεντρικά
άτοµα ή ιόντα των συµπλόκων όπως και τους συναρµοτές σε σκληρά, µαλακά και
ενδιάµεσα οξέα και βάσεις κατά Lewis αντίστοιχα.
Γενικά ως σκληρά οξέα και βάσεις χαρακτηρίζονται άτοµα µε µικρό µέγεθος,
µεγάλο φορτίο και µικρή ικανότητα πολώσεως. Ως µαλακά οξέα και βάσεις
χαρακτηρίζονται άτοµα µε µεγάλο µέγεθος, µικρό φορτίο και µεγάλη ικανότητα
πολώσεως.
Στη συνέχεια ο Pearson κατέληξε στη διατύπωση του «κανόνα των σκληρών και
µαλακών οξέων και βάσεων» σύµφωνα µε τον οποίο «σταθερότερα σύµπλοκα προκύπτουν
από τη σύνδεση σκληρών όξέων µε σκληρές βάσεις και µαλακών οξέων µε µαλακές βάσεις».
Οι Ahrland, Chatt και Davies χώρισαν τα µεταλλικά ιόντα σε τρεις τάξεις ανάλογα
µε την ικανότητά τους να σχηµατίζουν σταθερά σύµπλοκα µε συναρµοτές που έχουν σαν
άτοµα δότες, άτοµα των οµάδων VA, VIA και VII A του περιοδικού συστήµατος:
Τάξη α. Περιλαµβάνει µεταλλικά ιόντα τα οποία σχηµατίζουν σταθερά σύµπλοκα µε
συναρµοτές που έχουν άτοµα δότες Ν, Ο ή F, τα ελαφρύτερα των στοιχείων των οµάδων
VA, VIA και VII A (σκληρές βάσεις).
Οι οµάδα α περιλαµβάνει µέταλλα των αλκαλίων και αλκαλικών γαιών και ορισµένα
µεταβατικά στοιχεία στις υψηλότερες βαθµίδες οξείδωσης. Οι δεσµοί µεταξύ µεταλλικού
ιόντος (Μ) και συναρµοστών (L) είναι περισσότερο ηλεκτροστατικοί. Σε συµφωνία µε τα
παραπάνω, όταν τα στοιχεία της οµάδας α σχηµατίσουν σύµπλοκα µε συναρµοτές που
έχουν ως άτοµα δότες άτοµα των οµάδων VA, VIA και VII A, η σταθερότητα των
συµπλόκων µεταβάλλεται κατά τη σειρά:
F>>Cl>Br>I O>>S>Se>Te N>>P>As>Sb
Τάξη β. Περιλαµβάνει τα µεταλλικά ιόντα τα οποία σχηµατίζουν σταθερά σύµπλοκα µε
συναρµοτές που έχουν δότες P, S ή Cl και γενικότερα µε τα βαρύτερα των στοιχείων των
οµάδων VA, VIA και VII A (µαλακές βάσεις). Επίσης δίνουν σταθερά σύµπλοκα µε

ΧΗΜΕΙΑ ΕΝΩΣΕΩΝ ΣΥΝΑΡΜΟΓΗΣ
21
καρβονύλια (CO) και ολεφίνες. Οι δεσµοί µεταξύ µεταλλικού ιόντος (Μ) και συναρµοτών
(L) είναι περισσότερο οµοιοπολικοί. Σε συµφωνία µε τα παραπάνω, όταν τα στοιχεία της
οµάδας β σχηµατίσουν σύµπλοκα µε συναρµοτές που έχουν ως άτοµα δότες άτοµα των
οµάδων VA, VIA και VII A, η σταθερότητα των συµπλόκων µεταβάλλεται κατά τη σειρά:
F<Cl<Br<<I O<<S~Se~Te N<<P>As>Sb
Ενδιάµεση τάξη. Περιλαµβάνει µεταλλικά ιόντα µε ιδιότητες ενδιάµεσες των τάξεων α
και β.
Όπως θα δούµε στους πίνακες που ακολουθούν, σε συµφωνία και µε τον κανόνα
των σλκηρών και µαλακών οξέων και βάσεων, η τάξη α περιλαµβάνει σκληρά οξέα κατά
Lewis και η τάξη β περιλαµβάνει µαλακά οξέα κατά Lewis. Όσον αφορά τη φύση του
δεσµού γενικά οµοιοπολικός χαρακτήρας επικρατεί στις περιπτώσεις που το φορτίο του
ιόντος και η ακτίνα του είναι µεγάλα.
Πίνακας 1. Τάξεις µετάλλων κατά Ahrland, Chatt και Davies.

ΧΗΜΕΙΑ ΕΝΩΣΕΩΝ ΣΥΝΑΡΜΟΓΗΣ
22
Πίνακς 2. Σκληρά και µαλακά οξέα κατά Pearson
Οι Irving-Williams καθώς και ο Yatsimirski µελέτησαν επίσης τη σταθερότητα
σύµπλοκων ενώσεων και κατέταξαν τα ιόντα που µελέτησαν σε διάφορες σειρές. Τα
αποτελέσµατά τους φαίνεται να επιβεβαιώνουν τις γενικότερες απόψεις που διατυπώθηκαν
παραπάνω.
Οι Irving-Williams, µελετώντας σύµπλοκα δισθενών και τρισθενών ιόντων των
µεταβατικών στοιχείων, κατέληξαν στο συµπέρασµα οτι, γενικά, η σταθερότητά τους
αυξάνει µε την αύξηση του δυναµικού και την ελάττωση της ιονικής ακτίνας του κεντρικού
ιόντος, πράγµα που βρίσκεται σε συµφωνία µε όσα διατυπώθηκαν παραπάνω και
δηµιούργησαν τις εξής σειρές που ισχύουν ικανοποιητικά για σύµπλοκα µε αριθµό
συναρµογής τέσσερα (σειρά Irving-Williams):
Τi2+<V2+<Cr2+ >Mn 2+<Fe2+<Co2+<Ni2+<Cu2+>Zn2+
Τi3+<V3+<Cr3+ <Mn 3+>Fe3+<Co3+<Ni3+<Cu3+>Ga3+

ΧΗΜΕΙΑ ΕΝΩΣΕΩΝ ΣΥΝΑΡΜΟΓΗΣ
23
Οι ίδιοι ερευνητές, µελετώντας σύµπλοκα των κύριων οµάδων, κατέληξαν στο
συµπέρασµα οτι η σταθερότητα αυξάνεται µε την αύξηση του δυναµικού του ιόντος και τη
µείωση της ικανότητας πόλωσης και δηµιούργησαν διάφορες σειρές σταθερότητας όπως:
Li+>Na+>K+>Rb+> Cs+, Mg2+>Ca2+ >Sr2+>Ba2+>Ra2+
Al 3+>Sc3+>Y3+>La3+
O Yatsimirski, µελετώντας τη σταθερότητα συµπλόκων των δισθενών και
τρισθενών µεταβατικών στοιχείων σε σύµπλοκα µε αριθµό συναρµογής έξι, κατέληξε στις
εξής σειρές σταθερότητας (σειρά Yatsimirski):
Τi2+<V2+>Cr2+ >Mn 2+<Fe2+<Co2+<Ni2+>Cu2+>Zn2+
Τi3+<V3+<Cr3+ >Mn 3+>Fe3+<Co3+<Ni3+<Cu3+<Ga3+
Επίσης µελετώντας σύµπλοκα µεταλλικών ιόντων µε παρόµοια ακτίνα, έδωσε τις σειρές
κατάταξης, όπως η ακόλουθη:
Th4+ (0.95)>Y3+(0.93)>Ca2+(0.99)>Na+(0.95)
β) Βασικότητα του συναρµοτή. Γενικά όσο µεγαλύτερη είναι η βασικότητα του
συναρµοτή τόσο σταθερότερο είναι το σύµπλοκο. Σηµειώνεται ότι η σύγκριση είναι
δυνατή µόνο ανάµεσα σε συναρµοτές που έχουν µικρή διαφορά µεταξύ τους πχ ανάµεσα
σε µόρια µε διαφορετικούς υποκαταστάτες και όχι ανάµεσα σε εντελώς διαφορετικά µόρια
µε ίδια άτοµα δότες. Πολύ περισσότερο ανάµεσα σε µόρια ή ιόντα µε διαφορετικά άτοµα
δότες.
γ) Σχηµατισµός χηλικού δακτυλίου. Όταν ο συναρµοτής σχηµατίζει χηλική ένωση, το
παραγόµενο σύµπλοκο είναι πιο σταθερό από αντίστοιχο σύµπλοκο που σχηµατίζεται, µε
τον ίδιο αριθµό συναρµογής και το ίδιο είδος ατόµων δοτών, χωρίς τη δηµιουργία χηλικής
ένωσης. Το φαινόµενο χαρακτηρίζεται ως χηλική επίδραση (Chelate Effect).
Πχ. Το σύµπλοκο [Νi(NH2CH2CH2NH2)3]2+ (logK= 18,2) είναι περίπου 1010 φορές
σταθερότερο από το σύµπλοκο [Νi(NH3)6]2+ (logK = 8,6). Η διαφορά σταθερότητας
αποδίδεται στις διαφορές των θερµοδυναµικών παραγόντων, ενθαλπίας και εντροπίας του
συστήµατος.
9. Θεωρίες για το σχηµατισµό ενώσεων συναρµογής
Για την εξήγηση του σχηµατισµού ενώσεων συναρµογής έχουν προταθεί στη διάρκεια του
20ου αιώνα διάφορες θεωρίες, ξεκινώντας από τη πρώτη απόπειρα κατανόησης των
δεσµών µετάλλων-συναρµοτών από τον Werner, µέχρι τις πιο µεταγενέστερες και πιο

ΧΗΜΕΙΑ ΕΝΩΣΕΩΝ ΣΥΝΑΡΜΟΓΗΣ
24
ολοκληρωµένες θεωρίες του πεδίου συναρµοτών και των µοριακών τροχιακών των
συµπλόκων. Συνοπτικά, θα αναφερθούµε σε µερικές από αυτές.
Θεωρία Werner. Σύµφωνα µε τη θεωρία του Werner(1893), το κεντρικό µεταλλικό
άτοµο εκτός από το κανονικό σθένος, κύριο ή πρωτεύον σθένος, διαθέτει για τον
σχηµατισµό των συµπλόκων και άλλες µονάδες συγγένειας που αντιστοιχούν στο
δευτερεύον σθένος ή παρατοµικότητα. Το κανονικό σθένος κορέννυται µε ανιόντα ενώ το
δευτερεύον σθένος κορέννυται µε ανιόντα, µόρια ή άτοµα.
Με τον κορεσµό του πρωτεύοντος και του δευτερεύοντος σθένους δηµιουργούνται
δύο σφαίρες συναρµογής. Η εσωτερική σφαίρα συναρµογής αφορά το δευτερεύον σθένος
ενώ η εξωτερική αφορά το πρωτεύον σθένος.
Θεωρία Sidgwick. Σύµφωνα µε τη θεωρία του Sidgwick (1940), σταθερές είναι οι
σύµπλοκες ενώσεις, των οποίων το κεντρικό άτοµο αποκτά µετά τη συναρµογή, την
ηλεκτρονική διαµόρφωση του αµέσως επόµενου ευγενούς αερίου. To συνολικό άθροισµα
των ηλεκτρονίων στις σύµπλοκες ενώσεις ονοµάζεται αποτελεσµατικός ατοµικός
αριθµός (Effective Atomic Number : EAN).
Πχ. Το Co3+, µε ηλακτρονική διαµόρφωση 1s2, 2s2, 2p6, 3s2, 3p6, 3d6 προσλαµβάνει
12 e από έξι µόρια NH3 και αποκτά στο σύµπλοκο [Co(NH3)6]+ την ηλεκτρονική
διαµόρφωση του ευγενούς αερίου Kr 1s2, 2s2, 2p6, 3s2, 3p6, 3d10, 4s2, 4p6.
Όσον αφορά τους συναρµοστές, ο Sidgwick υποστήριξε ότι οι συναρµοτές θα
πρέπει να έχουν τουλάχιστον ένα ζεύγος ηλεκτρονίων το οποίο µπορούν να δώσουν ή να
µοιραστούν µε το κεντρικό άτοµο σχηµατίζοντας πολωµένο δεσµό (ηµιπολικό).
Θεωρία του δεσµού σθένους. Ο Pauling (19310 δέχτηκε ότι κατά το σχηµατισµό µιας
σύµπλοκης ένωσης το κεντρικό άτοµο ή ιόν Μ µπορεί να δεχτεί ένα ή περισσότερα ζεύγη
ηλεκτρονίων δηλαδή είναι οξύ κατά Lewis, ενώ οι συναρµοτές L αποτελούν δότες ζεύγους
ηλεκτρονίων δηλαδή είναι βάσεις κατά Lewis.
Κατά τη θεωρία δεσµού σθένους (Valence Bond Theory), η σύνδεση του
κεντρικού ατόµου ή ιόντος µε του συναρµοτές γίνεται µε αλληλεπικάλυψη κενών
υβριδισµένων ατοµικών τροχιακών του κεντρικού ατόµου µε κατάλληλα
κατειληµµένα ατοµικά τροχιακά των συναρµοτών.
Από την αλληλεπικάλυψη προκύπτουν σ-µοριακά τροχιακά και εποµένως οι
δεσµοί που προκύπτουν µεταξύ κεντρικού ατόµου και συναρµοστών είναι σ-δεσµοί.

ΧΗΜΕΙΑ ΕΝΩΣΕΩΝ ΣΥΝΑΡΜΟΓΗΣ
25
Τα υβριδισµένα ατοµικά τροχιακά1 που αλληλεπικαλύπτονται και κατά συνέπεια
τα σ-µοριακά τροχιακά που προκύπτουν είναι ίσα µε τον αριθµό συναρµογής του
κεντρικού ατόµου στην σύµπλοκη ένωση. Επειδή το ζεύγος ηλεκτρονίων του
σχηµατιζόµενου σ-µοριακού τροχιακού δεν προέρχεται από αµοιβαία συνεισφορά αλλά
πάντα εξολοκλήρου από τους συναρµοτές(δότες), ο Pauling χαρακτήρισε τους δεσµούς ως
σ-δοτικούς δεσµούς (σ-dative bonds). Επιπλέον, η διάταξη των υβριδισµένων τροχιακών
του κεντρικού ατόµου καθορίζει και τη στερεοχηµεία του συµπλόκου.
Η δηµιουργία τόσων σ-δοτικών δεσµών µε ένα κεντρικό άτοµο θα σήµαινε
µετατόπιση αρνητικού φορτίου προς το κεντρικό µεταλλικό άτοµο µε αποτέλεσµα την
αστάθεια του σχηµατιζόµενου συµπλόκου. Για να εξηγήσει τη σταθερότητα των
συµπλόκων ο Pauling διατύπωσε δύο λόγους που εµποδίζουν την εµφάνιση αυτού του
φαινοµένου:
α) την Αρχή της Ηλεκτρουδετερότητας, κατά την οποία η µεγάλη διαφορά
ηλεκτραρνητικότητας µεταξύ κεντρικού ατόµου και συναρµοτών έχει σαν συνέπεια το
ηλεκτρονικό νέφος του σ-δοτικού δεσµού να έλκεται ισχυρά από το συναρµοτή, τόσο
ώστε το µεταλλικό κατιόν να αποκτήσει ηλεκτρική ουδετερότητα.
β) η δηµιουργία π-δεσµών επαναφοράς (back bonding)
Οι π-δεσµοί είναι πολλών τύπων ανάλογα µε τα τροχιακά που συµµετέχουν στον π-
δεσµό.
i) π-δεσµός επαναφοράς τύπου Μd Lp ή Lpπ*
Παρατηρείται όταν το κεντρικό άτοµο έχει συµπληρωµένα ή ηµισυµπληρωµένα d
τροχιακά οπότε πραγµατοποιείται πλάγια αλληλεπικάλυψη του ηλεκτρονικού νέφους του
d τροχιακού του κεντρικού ατόµου µε κενό p ή π*pp2 αντιδεσµικό µοριακό τροχιακό του
συναρµοτή. Η αλληλεπικάλυψη µε d τροχιακό του συναρµοτή γίνεται µε συµµετοχή µόνο
των δύο από τους τέσσερις λοβούς του d τροχιακού. Η δηµιουργία του δεσµού
1 Η έννοια των υβριδισµένων τροχιακών εισήχθηκε επίσης από τον Pauling. ∆ύο ή περισσότερα ατοµικά
τροχιακά του ίδιου ατόµου µε παρόµοια ενέργεια µπορεί να συγχωνευτούν µε αποτέλεσµα τη δηµιουργία
ισότιµων υβριδισµένων τροχιακών ίσων σε αριθµό µε το άθροισµα των τροχιακών που συγχωνεύονται. Κάθε
υβριδισµένο τροχιακό µπορεί να δεχθεί έως δύο ηλεκτρόνια. Τα τροχιακά που προκύπτουν από κάθε
υβριδισµό έχουν το ίδιο µέγεθος και σχήµα αλλά διαφορετικό προσανατολισµό (s, sp, sp2, sp3 κλπ) Η
διάταξη των υβριδισµένων τροχιακών στο χώρο εξαρτάται από το είδος των ατοµικών τροχιακών που
υβριδοποιούνται..
2 π*pp ή pπ*: αντιδεσµικό µοριακό τροχιακό που προέκυψε από αλληλεπικάλυψη δύο p τροχιακών.

ΧΗΜΕΙΑ ΕΝΩΣΕΩΝ ΣΥΝΑΡΜΟΓΗΣ
26
συνεπάγεται µεταφορά ηλεκτρονικού νέφους από το κεντρικό άτοµο προς τον συναρµοτή
και ο δεσµός είναι γνωστός ως δεσµός π-επαναφοράς (π-back donation).
Τα µέταλλα που σχηµατίζουν π-δεσµούς επαναφοράς βρίσκονται συνήθως σε
χαµηλές βαθµίδες οξείδωσης.
Συνήθεις συναρµοστές είναι τα: CO, NO2-, NO, CN-, 1,10 φαινανθρολίνη κ.α.
ii) π- ή δ-δεσµός επαναφοράς τύπου MdLd.
Στην περίπτωση αυτή, τα ηµισυµπληρωµένα ή συµπληρωµένα d τροχιακά του
κεντρικού ατόµου αλληλεπικαλύπτονται µε κενά d τροχιακά του συναρµοτή, είτε µε
αλληλεπικάλυψη των δύο λοβών των d τροχιακών, είτε µε αλληλεπικάλυψη και των
τεσσάρων λοβών των d τροχιακών. Στη δεύτερη περίπτωση ο δεσµός είναι γνωστός ως
δεσµός δ-επαναφοράς. Προϋπόθεση τα d τροχιακά βρίσκονται σε παράλληλα επίπεδα.
Και στην περίπτωση αυτή παρατηρείται µεταφορά ηλεκτρονικού νέφους από το κεντρικό
έτοµο προς τον συναρµοτή και ο δεσµός.
Τα µέταλλα που σχηµατίζουν τέτοιους δεσµούς είναι συνήθως µεταβατικά στοιχεία
της 5ης και 6ης περιόδου και βρίσκονται σε υψηλές βαθµίδες οξείδωσης.
Συνήθεις συναρµοστές είναι τα: PF3, PR3, AsR3, SR κ.α.
Εποµένως στα σύµπλοκα όταν υπάρχει δυνατότητα δηµιουργίας δεσµού
επαναφοράς, ο δεσµός µεταξύ κεντρικού ατόµου και συναρµοτή παρουσιάζει µερικώς
χαρακτήρα διπλού δεσµού.
iii) π-δεσµός τύπου LdMd.
Παρατηρείται µε πλάγια αλληλεπικάλυψη συµπληρωµένων p τροχιακών του
συναρµοτή µε κενά d τροχιακά του κεντρικού ατόµου.
Το δεσµό δίνουν µεταβατικά στοιχεία της 4ης περιόδου που βρίσκονται σε υψηλή
βαθµίδα οξείδωσης
Συνήθεις συναρµοτές είναι τα F-, Cl-, OH-, NH2- κ.α.
iv) π-δοτικός δεσµός (Lπ (=) Μ) Παρατηρείται όταν ο συναρµοτής διαθέτει περίσσεια ηλεκτρονινού νέφους που δεν
είναι εντοπισµένο σε ένα άτοµο δότη. Έτσι ο π-δοτικός δεσµός πραγµατοποιείται µεταξύ
π-τροχιακού διπλού ή τριπλού δεσµού του συναρµοτή και κατάλληλων τροχιακών του
κεντρικού ατόµου. Τέτοια παραδείγµατα αποτελούν οι διπλοί και τριπλοί δεσµοί των
ολεφινών και των αλκινίων.
Το συµπληρωµένο π-µοριακό τροχιακό του συναρµοτή, συνεισφέρει στη
µεταφορά ηλεκτρονικού νέφους προς το κεντρικό µέταλλο, µε δηµιουργία δεσµού σ-
συµµετρίας Lπ-M. Παράλληλα, το κενό π* αντιδεσµικό τροχιακό του συναρµοτή

ΧΗΜΕΙΑ ΕΝΩΣΕΩΝ ΣΥΝΑΡΜΟΓΗΣ
27
µοιράζεται τα ηλεκτρόνια του κεντρικού ατόµου (επαναφορά) δηµιουργώντας δεσµό π-
συµµετρίας M Lπ* µε τελικό αποτέλεσµα ενός είδους διπλού δεσµού.
Οµοιοπολικά και ετεροπολικά σύµπλοκα: Με βάση τη θεωρία του σθένους-
δεσµού του Pauling, τα σύµπλοκα χωρίζονται σε δύο κατηγορίες: σε οµοιοπολικά (ή
σύµπλοκα εσωτερικών τροχιακών ή σύµπλοκα συζευγµένου ή χαµηλού spin, «low-spin
complexes») και ιονικά (ή σύµπλοκα εξωτερικών τροχιακών ή σύµπλοκα ελεύθερου ή
υψηλού spin, «high-spin complexes»).
Οµοιοπολικά σύµπλοκα σχηµατίζουν συναρµοτές που είναι ισχυρές βάσεις κατά
Lewis.
Στα οµοιοπολικά σύµπλοκα, τα υβριδισµένα τροχιακά του κεντρικού ατόµου που
θα συµµετάσχουν στο σχηµατισµό των δεσµών συναρµογής, δηµιουργούνται µε
υβριδοποίηση κενών ατοµικών τροχιακών της εξωτερικής στοιβάδας µε κενά ατοµικά
τροχιακά (d ατοµικά τροχιακά) της αµέσως προηγούµενης στοιβάδας (σύζευξη µεταξύ
τροχιακών µε διαφορετικό κύριο κβαντικό αριθµό). Για το σκοπό αυτό µονήρη ηλεκτρόνια
που υπάρχουν στα d τροχιακά του κεντρικού ατόµου να συµπτυχθούν σχηµατίζοντας
ζεύγη ηλεκτρονίων ώστε να δηµιουργηθούν κενά d τροχιακά. Στα οµοιοπολικά σύµπλοκα
οι σχηµατιζόµενοι δεσµοί συναρµογής έχουν περισσότερο οµοιοπολικό χαρακτήρα
Ιονικά σύµπλοκα σχηµατίζονται όταν οι συναρµοτές είναι ασθενείς βάσεις κατά
Lewis. Στα ιονικά σύµπλοκα τα υβριδισµένα τροχιακά του κεντρικού ατόµου που θα
συµµετάσχουν στο σχηµατισµό των δεσµών συναρµογής, δηµιουργούνται µε
υβριδοποίηση κενών ατοµικών τροχιακών της εξωτερικής στοιβάδας (σύζευξη µεταξύ
ατόµων µε τον ίδιο κύριο κβαντικό αριθµό).
Παρακάτω δίνεται η ηλεκτρονική δοµή συµπλόκων του Fe µε βάση την Valence-
Bond Theory (Σηµειώνεται οτι το νερό είναι ασθενής βάση ενώ το CN- είναι ισχυρή βάση
κατά Lewis).
3d 4s 4d
Fe ↑↓ ↑ ↑ ↑ ↑ ↑↓ … … …. … ….

ΧΗΜΕΙΑ ΕΝΩΣΕΩΝ ΣΥΝΑΡΜΟΓΗΣ
28
Fe3+ ↑ ↑ ↑ ↑ ↑ … … … …. … ….
3d sp3d2 4d
Fe3+ ↑ ↑ ↑ ↑ ↑.. … … …. … …. …. … …. ιονικό
[Fe(H2O)6]3+ ↑ ↑ ↑ ↑ ↑.. ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ …. … …. σύµπλοκο
H2O H2O H2O H2O H2O
3d d2sp3 4d
Fe3+ ↑↓ ↑↓ ↑ … … …. … …. …. … …. …. οµοιοπολικό
[Fe(CN)6]3+ ↑↓ ↑↓ ↑. ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ … …. …. σύµπλοκο
CN CN CN CN CN CN
3d 4s 4d
Fe2+ ↑↓ ↑ ↑ ↑ ↑ … … … …. … ….
3d d2sp3 4d
Fe2+ ↑↓ ↑↓ … … …. … …. …. … … …. … …. οµοιοπολικό
[Fe(CN)6]4+ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ … … …. … …. σύµπλοκο
CN CN CN CN CN CN
Από το παραπάνω διάγραµµα φαίνεται πως η θεωρία δεσµού σθένους µπορεί να
προβλέψει και να εξηγήσει ικανοποιητικά τον τρόπο σχηµατισµού και τη δοµή των
συµπλόκων µε ελάχιστες εξαιρέσεις. Επίσης εξηγεί ικανοποιητικά τις µαγνητικές ιδιότητες
των συµπλόκων αφού προβλέπει τον αριθµό των µονήρων ηλεκτρονίων στην ένωση.
10. Θεωρία του πεδίου των συναρµοτών (Ligand Field Theory).
Η θεωρία του πεδίου συναρµοτών είναι η νεότερη προσέγγιση που ενσωµατώνει το
πιο απλουστευµένο µοντέλο του κρυσταλλικού πεδίου και την πιο πολύπλοκης θεώρηση
των µοριακών τροχιακών. Η θεωρία του κρυσταλλικού πεδίου διατυπώθηκε για πρώτη
φορά από τον Bethe το 1928 και εξελίχθηκε αργότερα στην πιό ολοκληρωµένη µορφή της
θεωρίας των υποκαταστατών.
Με βάση τη θεωρία του κρυσταλλικού πεδίου, ο δεσµός στα σύµπλοκα είναι
αποτέλεσµα των ηλεκτροστατικών έλξεων που ασκούνται ανάµεσα στον θετικό πυρήνα
του µεταλλικού κατιόντος και στα αρνητικά ηλεκτρόνια των συναρµοτών και των
ηλεκτροστατικών απώσεων που ασκούνται µεταξύ των ηλεκτρονίων του κεντρικού ιόντος
και των συναρµοτών. Οι συναρµοτές µπορεί να είναι αρνητικά φορτισµένα ιόντα ή

ΧΗΜΕΙΑ ΕΝΩΣΕΩΝ ΣΥΝΑΡΜΟΓΗΣ
29
πολικά µόρια. Κατά την συναρµογή, το αρνητικό τµήµα των συναρµοτών κατευθύνεται
προς το µεταλλικό άτοµο ή ιόν µε αποτέλεσµα αυτό να περιβάλλεται από τα αρνητικά
φορτία των συναρµοτών.
Σχήµα 9. Σχηµατική αναπαράσταση της ηλεκτροστατικής αλληλεπίδρασης του θετικά
φορτισµένου µεταλλικού κατιόντος και των 6 αρνητικά φορτισµένων ατόµων των συναρµοτών σε
οκταεδρικό πεδίο.
Οι συναρµοτές δηµιουργούν ένα πεδίο γύρω τους, το οποίο ασκεί επίδραση στο
κεντρικό άτοµο ή ιόν και ιδιαίτερα στα ηλεκτρόνια της εξωτερικής στοιβάδας,
µεταβάλλοντας την ενέργειά τους. Επειδή τα περισσότερα σύµπλοκα δηµιουργούνται από
µεταβατικά στοιχεία και τα εξώτατα τροχιακά είναι συνήθως τα d τροχιακά, αυτά
υφίστανται και τη µέγιστη επίδραση του πεδίου των συναρµοτών
xy
z
x
y
x
y
x
z
y
z
dz2 dx
2-y
2
dxy dxzdyz
Σχήµα 10. Αναπαράσταση των 5 d τροχιακών των µεταβατικών στοιχείων.
Η επίδραση του πεδίου των συναρµοτών στην ενέργεια των τροχιακών είναι
συνάρτηση του προσανατολισµού των τροχιακών και της θέσης των συναρµοτών.
Τροχιακά, που λόγω του προσανατολισµού τους δέχονται ισχυρότερες απώσεις από τους
-
-
-
--
-
z
y
x
Mm+

ΧΗΜΕΙΑ ΕΝΩΣΕΩΝ ΣΥΝΑΡΜΟΓΗΣ
30
συναρµοτές παρουσιάζουν αυξηµένη ενέργεια (πχ. σε οκταεδρικό πεδίο τα dx2-y2, dz2, σε
τετραεδρικό πεδίο τα dxy, dxz και dyz), ενώ τροχιακά που λόγω του προσανατολισµού
τους δέχονται ασθενέστερες απώσεις από τους συναρµοτές παρουσιάζουν µειωµένη
ενέργεια (πχ. σε οκταεδρικό πεδίο τα dxy, dxz και dyz, ενώ σε τετραεδρικό πεδίο dx2-y2,
dz2) (Σχήµα 11).
Σχήµα 11. d τροχιακά οκταεδρικού και τετραεδρικού συµπλόκου συµπλόκου.
Πάνω σε αυτά, η θεωρία των Μοριακών Τροχιακών διατυπώνει ότι κατά το
σχηµατισµό συµπλόκων, κατάλληλα ατοµικά τροχιακά του κεντρικού ατόµου
αλληλεπικαλύπτονται µε κατάλληλα τροχιακά των συναρµοτών µε αποτέλεσµα τη
δηµιουργία νέων µοριακών τροχιακών σ-δεσµικών και σ-αντιδεσµικών. Στη συνέχεια τα
µοριακά τροχιακά συµπληρώνονται από τα ηλεκτρόνια των συναρµοτών και του
κεντρικού ατόµου αρχίζοντας µε τη συµπλήρωση των τροχιακών χαµηλότερης ενέργειας.
Η αλληλεπικάλυψη ατοµικών τροχιακών για τη δηµιουργία σ-µοριακών τροχιακών
µπορεί να πραγµατοποιηθεί µόνο µεταξύ ατοµικών τροχιακών που έχουν κατάλληλο
προσανατολισµό ώστε να είναι δυνατή η αλληλεπικάλυψη.
Έτσι, κατά τη δηµιουργία οκταεδρικών συµπλόκων από ιόντα των µεταβατικών
στοιχείων µπορεί να συµµετέχουν τα τροχιακά: dx2-y2, dz2, s, px, py, pz,, όπως φαίνεται στο
σχήµα 12, γιατί κατευθύνονται προς τους άξονες του οκταέδρου και µπορούν να
αλληλεπικαλυφθούν µε ίδιας συµµετρίας τροχιακά των συναρµοτών, σχηµατίζοντας
δεσµικά κι αντιδεσµικά µοριακά τροχιακά. Συγκεκριµένα, σχηµατίζονται: ένα δεσµικό κι
ένα αντιδεσµικό τροχιακό συµµετρίας s, 3 δεσµικά και 3 αντιδεσµικά συµµετρίας p και 2
∆ο
dx2
-y2, dz
2
dxy, dxz, dyz
∆t
dx2
-y2, dz
2
dxy, dxz, dyz
Οκταεδρικό Πεδίο
Τετραεδρικό Πεδίο

ΧΗΜΕΙΑ ΕΝΩΣΕΩΝ ΣΥΝΑΡΜΟΓΗΣ
31
δεσµικά και 2 αντιδεσµικά συµµετρίας eg (που έχουν προκύψει από τα d τροχιακά dx2-y2,
dz2). Αντίθετα, τα ατοµικά τροχιακά dxy, dxz και dyz του κεντρικού ατόµου έχουν τους
λοβούς τους ανάµεσα στους άξονες του καρτεσιανού συστήµατος δεν συµµετέχουν στη
δηµιουργία των σ-δεσµών Μ-L, κι ονοµάζονται µη δεσµικά τροχιακά (Σχήµα 13).
px py pz
Σχήµα 12. p τροχιακά και d τροχιακά του κεντρικού ατόµου που µπορούν να συµµετάσχουν στο
σχηµατισµό µοριακών τροχιακών µε αλληλεπικάλυψη µε τροχιακά των συναρµοτών στα
οκταεδρικά σύµπλοκα και p τροχιακά των συναρµοτών που µπορούν να συµµετάσχουν στη
δηµιουργία µοριακών τροχιακών µε το κεντρικό άτοµο.
Σχήµα 13. Μοριακά τροχιακά οκταεδρικού συµπλόκου, στο οποίο συµµετέχουν 6 τροχιακά του
συναρµοτή συµµετρίας σ και 5d, 3p, 1s τροχιακά του µετάλλου.
Επίσης, όπως αναφέρθηκε προηγουµένως στα σύµπλοκα σχηµατίζονται και π-
δεσµοί µετάλλου-συναρµοτή, είτε L M, είτε Μ L. Η π-σύνδεση λαµβάνει χώρα στον
κάθετο άξονα από το σ-δεσµό και γι΄αυτό συµµετέχουν διαφορετικά τροχιακά από αυτά
της σ-σύνδεσης.
y
z
x
y
z
x y
z
x
L
L
L
L
L L
L
L L
L
L L
L
L
L
L L L

ΧΗΜΕΙΑ ΕΝΩΣΕΩΝ ΣΥΝΑΡΜΟΓΗΣ
32
Συγκεκριµένα για οκταεδρικά σύµπλοκα, συµµετέχουν τα µη-δεσµικά τροχιακά
dxy, dxz, dyz τα οποία έχουν το κατάλληλο προσανατολισµό για αλληλεπικάλυψη µε τα pπ ή
dπ τροχιακά του συναρµοτή. Ο προσανατολισµός τους φαίνεται στο παρακάτω σχήµα 14.
Σχήµα 14. Προσανατολισµός dzx τροχιακών του µετάλλου µε τα pπ τροχιακά του συναρµοτή.
Ενέργεια ∆ιαφοροποίησης, ∆. Η ενέργεια διαφοροποίησης (ή ενέργεια
διαχωρισµού ή ενέργεια κρυσταλλικού πεδίου) ∆ των d τροχιακών, εξαρτάται από τη
φύση του µετάλλου και του συναρµοτή. Οι συναρµοτές που προκαλούν µεγαλύτερη
διαφοροποίηση ∆ δηµιουργούν ισχυρότερους σ-δεσµούς µε το κεντρικό άτοµο. Έτσι οι
συναρµοτές έχουν ταξινοµηθεί σε µια σειρά ανάλογα µε την επίδραση τους στην ενέργεια
∆, η οποία ονοµάζεται φασµατοχηµική σειρά: I-< Br-<Cl-< *SCN-< F-< Ουρία< ΟΗ-<
CH3COO-< C2O42-<H2O< *NCS-< Γλυκίνη< Πυριδίνη< ΝΗ3<en< bipy<*NO2
-<CN-< CO.
Επίσης, η ενέργεια διαχωρισµού συµπλόκων των στοιχείων µετάπτωσης µε τους
ίδιους συναρµοτές αυξάνεται ελαφρώς κατά µήκος της ίδιας σειράς. Καθώς και για το ίδιο
µέταλλο αύξηση του οξειδωτικής κάτστασης του µετάλλου συνεπάγεται αύξηση της
ενέργειας διαχωρισµού. Η ενέργεια διαχωρισµού αυξάνεται κατά µήκος της ίδιας οµάδας,
έτσι παρατηρείται αύξηση από τη πρώτη στη δεύτερη και στη στρίτη σειρά των στοιχείων
µετάπτωσης. Έτσι : Mn(II) < Ni (II) < Fe (II) < V(II) < Fe (III) < Cr (III) < Co (III) < Mn
(IV) < Pd (IV) < Pt (IV).
Η διευθέτηση των d ηλεκτρονίων στα d τροχιακά, ακολουθεί τον κανόνα της
µέγιστης πολλαπλότητας spin του Hund που ισχύει µεταξύ τροχιακών ίσης ενέργειας. Για
τις περιπτώσεις όµως που υπάρχουν 4-7 d ηλεκτρόνια στο µέταλλο η διευθέτηση
εξαρτάται από την ενέργεια διαφοροποίησης ∆ και την ενέργεια σύζευξης Ρ. Εάν ο
συναρµοτής είναι αρκετά ισχυρός ώστε η ∆ να είναι µεγαλύτερη της ενέργειας σύζευξης
των ηλεκτρονίων P τότε τα ηλεκτρόνια συζεύγνυται, ενώ εάν ∆<Ρ αυτό δε συµβαίνει
(βλ.Σχήµα 15).
y
z
x

ΧΗΜΕΙΑ ΕΝΩΣΕΩΝ ΣΥΝΑΡΜΟΓΗΣ
33
Σχήµα 15. ∆ιευθέτηση d ηλεκτρονίων σε οκταεδρικό πεδίο συναρµοτών.
Με τα όσα έχουν αναφερθεί τώρα µπορούµε να εξηγήσουµε και τις ιδιότητες των
συµπλόκων δηλαδή το χρώµα τους και τις µαγνητικές τους ιδιότητες.
11. Μαγνητικές ιδιότητες συµπλόκων
Οι µαγνητικές ιδιότητες των συµπλόκων οφείλονται στην ύπαρξη ή µη µονήρων,
ασύζευκτων ηλεκτρονίων. Όταν δύο ηλεκτρόνια συζεύκνυται σε ένα τροχιακό
αλληλοεξουδετερώνεται στο σπιν τους (ηλεκτρονική στροφορµή) µε αποτέλεσµα να
µηδενίζεται η µαγνητική τους διπολική ροπή. Η µαγνητική διπολική ροπή ενός
συµπλόκου εξαρτάται από τον αριθµό των ασύζευκτων ηλεκτρονίων που διαθέτει και
δίνεται από τη σχέση:
Όπου n είναι ο αριθµός των µονήρων ηλεκτρονίων και µ η µαγνητική διπολική ροπή σε
µαγνητόνες Bohr.
Έτσι ένα σύµπλοκο που δεν έχει ασύζευκτα ηλεκτρόνια δε θα εµφανίζει µαγνητική
ροπή και χαρακτηρίζεται ως διαµαγνητικό, ένω τα σύµπλοκα που έχουν ασύζευκτα
ηλεκτρόνια έχουν µαγνητική ροπή και χαρακτηρίζονται παραµαγνητικά. Επιπλέον, µπορεί
κανείς να καταλάβει ότι αφού τα d τροχιακά είναι 5 τότε και ο µεγαλύτερος αριθµός
ασύζευκτων ηλεκτρονίων θα είναι 5. Ετσι µεταξύ των µετάλλων της πρώτης σειράς
µεταβατικών στοιχείων το µαγγάνιο (ΙΙ) που είναι d5 εµφανίζει την υψηλότερη µαγνητική
ροπή.
d1 d2 d3
d8 d9 d10 d4 d5 d6 d7
Υψηλού Spin-Xαµηλού Πεδίου
Xαµηλού Spin-Υψηλού Πεδίου
∆ο>Ρ
∆ο<Ρ
µ=√n (n+2)

ΧΗΜΕΙΑ ΕΝΩΣΕΩΝ ΣΥΝΑΡΜΟΓΗΣ
34
Από το Σχήµα 15, είναι φανερό ότι οι µαγνητικές ιδιότητες µετάλλων που έχουν 4-
7 d ηλεκτρόνια εξαρτώνται από τη φύση των συναρµοτών.
12. Χρώµα των συµπλόκων
Τα περισσότερα σύµπλοκα των στοιχείων µετάπτωσης είναι έγχρωµα. Η ιδιότητα
αυτή οφείλεται στα d ηλεκτρόνια που αυτά διαθέτουν. Τα d ηλεκτρόνια είναι
κατανεµηµένα στα d τροχιακά. Υπό την επίδραση του πεδίου συναµοτών, ο εκφυλισµός
των d τροχιακών αίρεται κι από το διαχωρισµό προκύπτουν διαφορετικές ενεργειακές
στάθµες.
Η ερµηνεία του χρώµατος των συµπλόκων έγινε δυνατή µε τη θεωρία του πεδίου
συναρµοτών. Είναι γνωστό ότι το χρώµα οφείλεται στην απορρόφηση από µια ουσία
ακτινοβολία στη περιοχή του ορατού. Τα µήκη κύµατος του φωτός που απορροφώνται από
το σύµπλοκο, αντιστοιχούν στην ενέργεια διέγερσης των d ηλεκτρονίων του µετάλλου
ενός συµπλόκου για να µεταπηδήσουν από τα χαµηλής ενέργειας d τροχιακά στα
υψηλότερης ενέργειας d τροχιακά. Για παράδειγµα σε ένα οκταεδρικό σύµπλοκο, όπου τα
d τροχιακά έχουν διαχωριστεί σε τροχιακά t2g µη δεσµικά τροχιακά χαµηλής ενέργειας και
δύο eg* αντιδεσµικά τροχιακά, απορροφάται το µήκος κύµατος του ορατού φωτός που
αντιστοιχεί στη διαφορά ενέργειας µεταξύ των t2g και eg τροχιακών, δηλαδή στην ενέργεια
διαφοροποίησης ∆ο. Εξαρτάται δε από τη φύση του µετάλλου και την οξειδωτική του
κατάσταση, και από τη φύση του συναρµοτή.
Το χρώµα ενός συµπλόκου εξαρτάται από το µήκος κύµατος της ενέργειας
απορρόφησης. Για παράδειγµα το εξαϋδατο τιτανικό (ΙIΙ) ιόν (Ti(H2O)63+) απορροφά
ενέργεια στα 510 nm προκειµένου για τη διέγερση του ενός d ηλεκτρονίου που διαθέτει
από τη θεµελιώδη ενεργειακή κατάσταση (ground state) που είναι το t2g τροχιακό, στη
διεγερµένη κατάσταση (excited state) που είναι το eg* τροχιακό. Η απορρόφηση αυτή δεν
είναι στη πραγµατικότητα οξεία αλλά εµφανίζεται σα ταινία απορρόφησης, λόγω του ότι
υπάρχουν διάφορες άλλες ταλαντώσεις κι αλληλεπιδράσεις στο µόριο. Η ταινία αυτή
περιλαµβάνει τη περιοχή του πράσινου και του κίτρινου χρώµατος (από τα 400 nm ως τα
600 nm), ενώ το σύµπλοκο δεν απορροφά τα µήκη κύµατος από 600 nm και πάνω. Σε
Χαµηλής ενέργειας τροχιακό
Υψηλής ενέργειας τροχιακό
∆Ε

ΧΗΜΕΙΑ ΕΝΩΣΕΩΝ ΣΥΝΑΡΜΟΓΗΣ
35
αυτή τη περιοχή αντιστοιχεί το κόκκινο χρώµα, γι’ αυτό το σύµπλοκο εµφανίζει
ερυθροϊώδες χρώµα (Σχήµα 16).
Σχήµα 16. Φάσµα ορατού του Ti(H2O)63+
Εκτός από τις µεταπτώσεις που οφείλονται στα d ηλεκτρόνια των µετάλλων, στα
σύµπλοκα µπορεί να συµβεί µετάπτωση ενός ηλεκτρονίου από τροχιακό του συναρµοτή
σε τροχιακό του µετάλλου. Αυτή η µετάπτωση ονοµάζεται απορρόφηση µεταφοράς
φορτίου από το συναρµοτή στο µέταλλο. Η µετάπτωση αυτή µπορεί να συµβεί όταν το
µέταλλο βρίσκεται σε υψηλή οξειδωτική κατάσταση µε λίγα ηλεκτρόνια και ο συναρµοτής
είναι πλούσιος ηλεκτρονιακά, π.χ. Ο2-, Χ- (τα ιόντα αυτά έχουν συµπληρωµένα τα
τροχιακά τους µε οκτάδα ηλεκτρονίων. Η µετάπτωση αυτή µπορεί να είναι υψηλής
ενέργειας στο υπεριώδες, ή χαµηλότερης ενέργειας στο ορατό. Όταν είναι στο ορατό τότε
το σύµπλοκο αυτό εµφανίζει χρώµα ανάλογο πάλι της απορροφούµενης ακτινοβολίας.
Παράδειγµα αποτελεί το υπερµαγγανικό ανιόν (MnO4-) στο οποίο το µαγγάνιο βρίσκεται
στην οξειδωτική κατάσταση VII όπου είναι d0 κι είναι συναρµοσµένα 4 άτοµα οξυγόνου
µε αποτέλεσµα να υπάρχεια µεταφορά φορτίου στα 555 nm δίνοντας στο σύµπλοκο
σκούρο µωβ χρώµα.
Μια άλλη περίπτωση µετάπτωσης είναι η εξής: από ηλεκτρόνιο µετάλλου σε
χαµηλή οξειδωτική κατάσταση µε πληρωµένα d τροχιακά σε τροχιακό του συναρµοτή µε
χαµηλής ενέργειας κενά τροχιακά. Για παράδειγµα το σύµπλοκο Cu(phen)2+, όπου ο
χαλκός βρίσκεται στην οξειδωτική κατάσταση Ι κι έχει d10 ηλεκτρόνια στη 1, 10-
φαινανοθρολίνη που είναι π-δέκτης ηλεκτρονίων. Η διέγερση αυτή λαµβάνει χώρα
απορροφώντας στα 498 nm και το χρώµα του συµπλόκου είναι σκούρο πορτοκαλί (Σχήµα
17).
A
λmax = 510 nm
λ / nm

ΧΗΜΕΙΑ ΕΝΩΣΕΩΝ ΣΥΝΑΡΜΟΓΗΣ
36
Md
Lσ
Lπ∗
Lπ
t2g*
eg*
Σχήµα 17. Φάσµατα συµπλόκων: d-d µεταπτώσεις (-), φάσµατα µεταφοράς φορτίου από το συναρµοτή στο µέταλλο (----), φάσµατα µεταφοράς φορτίου από το µέταλλο στο συναρµοτή (.......).

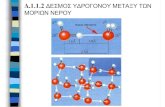
ΣΗΜΑΣΙΑ ΜΕΤΑΛΛΩΝ ΣΤΑ ΒΙΟΛΟΓΙΚΑ ΣΥΣΤΗΜΑΤΑ
37
ΚΕΦΑΛΑΙΟ 2
ΣΗΜΑΣΙΑ ΜΕΤΑΛΛΩΝ ΣΤΑ ΒΙΟΛΟΓΙΚΑ ΣΥΣΤΗΜΑΤΑ
1. Ιχνοστοιχεία
Τα μέταλλα είναι απαραίτητα συστατικά σε πολλές διεργασίες που λαμβάνουν χώρα στον
οργανισμό. Μεταλλικά στοιχεία όπως νάτριο, κάλιο, ασβέστιο και μαγνήσιο αλλά κι
ανόργανα μη-μεταλλικά συστατικά όπως φώσφορος, χλώριο, θείο απαντώνται στους ζώντες
οργανισμούς σε ποσότητες ~1-0,1% του μέσου βάρους και καλούνται ανόργανα συστατικά
(minerals). Άλλα απαραίτητα μεταλλικά στοιχεία όπως τα σίδηρος, χαλκός, χρώμιο, μαγγάνιο,
μολυβδαίνιο, κοβάλτιο, νικέλιο, ψευδάργυρος, απαντώνται σε ποσότητες < 0,01% του μέσου
βάρους κι ονομάζονται ιχνοστοιχεία (trace elements). Από αυτά, μερικά βρίσκονται σε
ποσότητες γραμμαρίων όπως ο σίδηρος, ο ψευδάργυρος και το μαγγάνιο, ενώ ο χαλκός, το
μολυβδαίνιο κι άλλα βρίσκονται σε ποσότητες χιλιοστογραμμαρίων. Έτσι για παράδειγμα το
ανθρώπινο σώμα περιέχει 170 γραμμάρια καλίου, 5 γραμμάρια σιδήρου και 80
χιλιοστόγραμμα χαλκού. Ανεξάρτητα από τη περιεκτικότητά τους στον οργανισμό, ως
ιχνοστοιχεία θεωρούνται τα στοιχεία αυτά, των οποίων η ημερήσια απαραίτητη ποσότητα δεν
υπερβαίνει τα 25 mg. Επιπλέον, στα ιχνοστοιχεία περιλαμβάνονται το πυρίτιο, το αρσενικό
και το βόριο που μέχρι στιγμής δεν έχει αποσαφηνιστεί η σημασία τους (Πίνακας 1).
Τα στοιχεία κατατάσσονται σε απαραίτητα και μη-απαραίτητα για τον οργανισμό. Τα κριτήρια
για να θεωρείται ένα στοιχείο απαραίτητο είναι τα εξής: α) η έλλειψη ενός στοιχείου να
προκαλεί ανεπάρκεια, β) η ανεπάρκεια να αίρεται κατά την πρόσληψη του στοιχείου αυτού
και γ) το στοιχείο αυτό να συμμετέχει σε κάποιο συγκεκριμένο βιολογικό σύστημα-
λειτουργία. Πολλές φορές η έλλειψη ιχνοστοιχείων δεν συνεπάγεται απώλεια ζωής, αλλά η
ύπαρξη τους στον οργανισμό έχει ωφέλιμη δράση. Αυτά τα στοιχεία ονομάζονται ωφέλιμα. Ο
διαχωρισμός των ιχνοστοιχείων σε απαραίτητα και ωφέλιμα δεν είναι πάντα σαφής.
Από τα παραπάνω είναι εμφανές ότι η συγκέντρωση των στοιχείων παίζει κρίσιμο ρόλο στην
υγεία. Πολύ χαμηλή συγκέντρωση αυτών δημιουργεί ανεπάρκεια, αλλά επίσης πολύ μεγάλη
συγκέντρωση είναι τοξική. Συγκεκριμένα, η συγκέντρωση κάθε στοιχείου στον οργανισμό
ακολουθεί μια καμπύλη δόσης-απόκρισης, όπως φαίνεται στο Σχήμα 1. Σε πολύ χαμηλές
συγκεντρώσεις του ιχνοστοιχείου ο οργανισμός δε μπορεί να επιβιώσει, ενώ σε
συγκεντρώσεις ανεπάρκειας μπορεί να επιβιώσει αλλά όχι στο βέλτιστο των φυσιολογικών
λειτουργιών του. Στο πλατώ της καμπύλης, ο οργανισμός λειτουργεί φυσιολογικά, ενώ σε

ΣΗΜΑΣΙΑ ΜΕΤΑΛΛΩΝ ΣΤΑ ΒΙΟΛΟΓΙΚΑ ΣΥΣΤΗΜΑΤΑ
38
συγκεντρώσεις μεγαλύτερες εμφανίζονται συμπτώματα δηλητηρίασης που αν υπερβούν
κάποιο ανώτατο όριο οδηγούν στον θάνατο.
Σχήμα 1. Καμπύλη Δόσης-Απόκρισης.
Η λήψη των ιχνοστοιχείων γίνεται από την τροφή. Για να τηρείται η συγκέντρωση των
ιχνοστοιχείων στα ωφέλιμα όρια ο οργανισμός ρυθμίζει το ποσοστό απορρόφησης και
απέκκρισης των στοιχείων ανάλογα με τις ανάγκες του. Για ορισμένα στοιχεία υπάρχει και
μηχανισμός αποθήκευσης όπως για παράδειγμα για τον σίδηρο, η φεριττίνη και για το
ψευδάργυρο και το χαλκό, η μεταλλοθειονίνη. Άλλα απαραίτητα στοιχεία δεν αποθηκεύονται
αλλά πρέπει να λαμβάνονται καθημερινά από την τροφή. Τα στοιχεία, στις τροφές και το
νερό, βρίσκονται κυρίως με τη μορφή αλάτων. Το μεγαλύτερο μέρος αυτών υδρολύονται στο
όξινο περιβάλλον του στομάχου πριν περάσουν στο έντερο. Σε όξινο pH τα ιχνοστοιχεία είναι
υπό τη μορφή κατιόντων. Στο αλκαλικό pΗ του εντέρου μετατρέπονται σε υδροξείδια που δε
μπορούν να απορροφηθούν. Κάποιο ποσοστό αυτών τελικά απορροφάται από το αίμα με
διευκολυνόμενη ή μη μεταφορά, ύστερα από δέσμευσή τους σε πρωτεϊνικά μόρια των
κυττάρων του εντερικού βλεννογόνου. Το ποσό που προσλαμβάνεται από το αίμα γενικά
εξαρτάται από τη ποσότητα που λαμβάνεται από τη τροφή κι από τα αποθέματα αυτών στον
οργανισμό, εάν υπάρχουν.
Ο έλεγχος των συγκεντρώσεων των μετάλλων για την διατήρηση της υγείας είναι πολύ
σημαντικός. Στο πίνακα 1 αναφέρονται οι ωφέλιμες συγκεντρώσεις των ιχνοστοιχείων. Σε
περιπτώσεις υπερεπάρκειας η συγκέντρωση των μετάλλων μπορεί να ελαττωθεί είτε
Θάνατος
Τοξικότητα Ανεπάρκεια
Όριο
επιβίωσης
Φυσιολογικ
ά
Αντ
ίδρα
ση
Δόση απαραίτητου ιχνοστοιχείου

ΣΗΜΑΣΙΑ ΜΕΤΑΛΛΩΝ ΣΤΑ ΒΙΟΛΟΓΙΚΑ ΣΥΣΤΗΜΑΤΑ
39
αυξάνοντας το ρυθμό απέκκρισης ή με συναρμογή της περίσσειας με κατάλληλο συναρμοτή.
Η έλλειψη μπορεί να βελτιωθεί με τη λήψη συμπληρωμάτων.
Οι ζώντες οργανισμοί μπορούν επίσης να απορροφήσουν μη-απαραίτητα μέταλλα μέσω των
τροφών ή απευθείας από την ατμόσφαιρα. Στον άνθρωπο τέτοια μη-απαραίτητα μέταλλα είναι
τα ρουβήδιο (Rb), ζιρκόνιο (Zr), στρόντιο (Sr), αλουμίνιο (Al), αντιμόνιο (Sb), βάριο (Ba).
Επιπλέον, ρύπανση της ατμόσφαιρας από βαρέα μέταλλα όπως μόλυβδος (Pb), υδράργυρος
(Hg) και κάδμιο (Cd) λόγω ανθρώπινης δραστηριότητας και κατ’ επέκταση συσσώρευση τους
στη τροφική αλυσίδα και στον άνθρωπο έχει επίσης παρατηρηθεί. Τα μη-απαραίτητα στοιχεία
μπορούν να απορροφηθούν από τον οργανισμό λόγω χημικής ομοιότητας με κάποιο
απαραίτητο στοιχείο, (π.χ. Li+/ Rb
+/ Cs
+ ↔ Na
+/ K
+, Sr
2+/ Ba
2+/ Pb
2+/ Cd
2+ ↔ Ca
2+, Al
3+/ Be
3+
↔ Mg2+
Al3+
/ Zr4+
↔ Fe3+
), η οποία οδηγεί σε αντικατάσταση του απαραίτητου στοιχείου από
το μη-απαραίτητο, όταν το δεύτερο σχηματίζει σταθερότερους δεσμούς με τα βιομόρια. Η
συσσώρευση βαρέων μετάλλων σε συγκεντρώσεις ακόμα και στα κατώτερα όρια ανίχνευσης
προκαλεί τοξικές επιδράσεις. Θεραπεία των δηλητηριάσεων γίνεται με αντίδοτα, που δρουν
ως συναρμοτές μετάλλων, οι οποίοι δεσμεύουν πολύ ισχυρά αυτά τα μέταλλα και τα
απομακρύνουν από τον οργανισμό.
Τα μέταλλα στον οργανισμό αλληλεπιδρούν μεταξύ τους συνεργιστικά ή ανταγωνιστικά.
Συνεργιστική καλείται η σχέση μεταξύ δύο στοιχείων όταν το ένα βοηθά τη δράση του άλλου.
Ανταγωνιστική είναι η σχέση όταν το ένα αντιτίθεται στη δράση του άλλου. Έτσι, ο
ψευδάργυρος μπορεί να αντικατασταθεί από το κάδμιο, το μόλυβδο, το χαλκό και το
ασβέστιο. Ενώ την απορρόφηση του σιδήρου ανταγωνίζονται τα μόλυβδος, κοβάλτιο,
μαγνήσιο, στρόντιο και ψευδάργυρος. Επίσης τα τοξικά, βαρέα μέταλλα ανταγωνίζονται τα
απαραίτητα ιχνοστοιχεία και τα αντικαθιστούν από τις ενώσεις τους στον οργανισμό, όπως
προαναφέρθηκε. Αυτές οι μεταβολές επηρεάζουν τη λειτουργία των βιολογικών συστημάτων
κι οδηγούν σε παθολογικές καταστάσεις.

ΣΗΜΑΣΙΑ ΜΕΤΑΛΛΩΝ ΣΤΑ ΒΙΟΛΟΓΙΚΑ ΣΥΣΤΗΜΑΤΑ
40
Πίνακας 1. Περιεκτικότητα και βιολογική δράση ιχνοστοιχείων Στοιχείο Ποσότητα
στον
άνθρωπο
Φυσιλογικός ρόλος Ανεπάρκεια Υπερεπάρκεια
Σίδηρος 3-5 gr Μεταφορά ηλεκτρονίων,
οξυγόνου, ένζυμα,
ανοσοποιητικό σύστημα
Κόπωση, αναιμία Αιμοχρωμάτωση,
αναιμία Cooley, οξεία
δηλητηρίαση
Ψευδάργυρος 2-3 gr > 160 ένζυμα, νουκλεϊνικό
οξύ, πρωτεϊνοσύνθεση,
ανοσοποιητικό σύστημα
Γενετικές ασθένειες, στρες,
κατάθλιψη, καθηστερηση
στη σεξουαλική ωρίμανση,
δερματικές παθήσεις,
ανοσοκαταστολή
Σπάνια. Επηρεάζει
μεταβολισμό Fe, Cu.
Φθόριο 3 gr Δομή δοντιών και οστών Οδοντική πλάκα,
οστεοπόρωση
Οδοντικό φθόριο
Πυρίτιο 2-3 gr Ασβεστοποίηση, συνδετικός
ιστός
Άγνωστη Άγνωστη
Μαγγάνιο 1 gr Ένζυμα μεταβολισμού
πρωτεϊνών, ενέργειας,
υπεροξειδική δισμουτάση,
σύνθεση
μυκοπολυσακχαριτών
Άγνωστη Τοξικότητα από
εισπνοή
Χαλκός 80 mg Ένζυμα για τη σύνθεση
χόνδρων, οστών, μυελίνης
Ατελής διατροφή,
παρεντερική θρέψη,
ουδετεροπενία, σκελετική
και νευρολογική
ανεπάρκεια
Ασθένεια Wilson
Βανάδιο 15 mg Μεταβολισμός λιπιδίων,
ΑΤΡάση, ρύθμιση σύνθεσης
χοληστερόλης
Άγνωστη Άγνωστη
Ιώδιο 15 mg Σύνθεση ορμονών
θυρεοειδούς
Βρογχοκήλη Θυρεοτοξίκωση
Μολυβδαίνιο 10 mg Μεταλλοένζυμα Διαταραχή μεταβολισμού
ξανθίνης, θείου
Σ. Ένωση
Σελήνιο 6-12 mg Υπεροξειδάση της
γλουταθειόνης,
αλληλεπιίδραση με βαρέα
μέταλλα
Ενδημική
καρδιομυοπάθεια, μυική
αδυναμία
Κίνα
Νικέλιο 10 mg Επιδρά στην απορρόφηση του
Fe, μεταβολισμός λιπιδίων,
νουκλεϊνικού οξεός
Άγνωστη Άγνωστη
Χρώμιο 2 mg Ενεργοποίηση ινσουλίνης,
διατήρηση ανοχής γλυκόζης
Ατελής διατροφή,
παρεντερική θρέψη, ανοχή
γλυκόζης, αύξηση λιπιδίων
πλάσματος
Άγνωστη
Κοβάλτιο 1-5 mg Βιταμίνη Β12 ΄Ελλειψη Β12 Άγνωστη
Αρσενικό 1-2 mg Μεταβολισμός σιδήρου Άγνωστη Άγνωστη
2. Ενώσεις συναρμογής μετάλλων στα βιολογικά συστήματα
Τα μέταλλα στον οργανισμό ανευρίσκονται ως ελεύθερα ιόντα ή σε μορφή ενώσεων
συναρμογής με οργανικά μόρια. Ο ρόλος των ελεύθερων ιόντων είναι πολυσχιδής, όπως για
παράδειγμα η ρύθμιση της διαφοράς δυναμικού των κυτταρικών μεμβρανών, η μετάδοση της
ηλεκτρικής ώσης στους νευρώνες μέσω των αντλιών νατρίου/καλίου, ενώ η είσοδος του
ασβεστίου σ’ ένα κύτταρο μπορεί να ενεργοποιήσει ένα συγκεκριμένο ενζυμικό σύστημα. Τα
μέταλλα των στοιχείων μεταπτώσεως που είναι συνήθως σε μορφή ενώσεων συναρμογής,

ΣΗΜΑΣΙΑ ΜΕΤΑΛΛΩΝ ΣΤΑ ΒΙΟΛΟΓΙΚΑ ΣΥΣΤΗΜΑΤΑ
41
έχουν ποικίλες δράσεις στα βιολογικά συστήματα. Έτσι, μπορεί να αποτελούν το ενεργό
κέντρο ενζύμων, όπως ο ψευδάργυρος στην καρβοξυπεπτιδάση. Ο σίδηρος κι ο χαλκός
συμμετέχουν σε ενεργά κέντρα ενζύμων μεταφοράς ηλεκτρονίων. Επίσης, σε άλλες
περιπτώσεις μέταλλα δρουν επηρεάζοντας τη τρισδιάστατη δομή των ενζύμων κι συνεπώς τη
δραστικότητα του ενεργού κέντρου. Άλλες πρωτεϊνες αποθηκεύουν ή μεταφέρουν μέταλλα
συναρμοζόμενες με αυτά.
Τα μέταλλα απαντώνται συναρμοσμένα σε πρωτεϊνες του οργανισμού, οι οποίες ονομάζονται
μεταλλοπρωτεϊνες. Οι μεταλλοπρωτεϊνες που έχουν δράση ενζύμου ονομάζονται
μεταλλοένζυμα. Τα μεταλλικά ιόντα στις μεταλλοπρωτεϊνες είναι συναρμοσμένα στις
πλευρικές αλυσίδες των αμινοξέων της πεπτιδικής αλληλουχίας της πρωτεϊνης ή σε
προσθετική ομάδα της πρωτεϊνης.
α) Σύνδεση με αμινοξέα
Στη πρώτη περίπτωση τα μέταλλα βρίσκονται συναρμοσμένα στις πλευρικές αλυσίδες των
αμινοξέων που φέρουν σε αυτή κατάλληλο άτομο δότη, θείο, άζωτο και οξυγόνο, Σχήμα 2. Τα
πιο συνηθισμένα αμινοξέα κατάλληλα για συναρμογή μετάλλων είναι τα ακόλουθα:
1) Ιστιδίνη (His): Τα δύο άζωτα του ιμιδαζολικού δακτυλίου βρίσκονται σε ισορροπία μεταξύ
των δύο ταυτομερών μορφών. Το μέταλλο συναρμόζεται μέσω του βασικού αζώτου του
ιμιδαζολικού δακτυλίου. Υπάρχει όμως η περίπτωση του ενζύμου υπεροξειδική δισμουτάση
Cu/Zn, όπου και τα δύο άζωτα της ιστιδίνης είναι συναρμοσμένα, το ένα με το Zn και το
δεύτερο με το Cu το οποίο κατά τη συναρμογή αποπρωτονιώνεται (βλ. Σχήμα 7, σελ. 45)
2) Κυστεϊνη (Cys): η βασική ομάδα θειόλης που περιέχει αποπρωτονιώνεται κατά τη
συναρμογή (pKa= 8.5). Επίσης μπορεί να δράσει και σαν άτομο γέφυρα δύο μετάλλων.
3) Τυροσίνη (Tyr): συναρμόζεται μέσω του φαινολικού οξυγόνου. Σε φυσιολογικό pH
βρίσκεται με τη πρωτονιωμένη μορφή και κατά τη συναρμογή αποπρωτονιώνεται. (pKa=10).
4) Ασπαραγινικό και γλουταμινικό οξύ (Asp, Glu). Τα πλευρικά καρβοξυλικά οξέα αυτών των
αμινοξέων στο φυσιολογικό pH βρίσκονται υπό τη μορφή καρβοξυλικού ανιόντος κι όταν
έρθουν σε επαφή μ’ ένα μέταλλο συναρμόζονται συνήθως μέσω του καρβοξυλικού οξυγόνου.
Υπάρχουν όμως περιπτώσεις που λειτουργούν σαν η2 συναρμοτές, δηλαδή σα κέντρο δύο
ατόμων δοτών. Αυτό συνήθως συμβαίνει με σκληρά οξέα όπως το ιόν Ca2+
που έχει και
μεγαλύτερη ιοντική ακτίνα.

ΣΗΜΑΣΙΑ ΜΕΤΑΛΛΩΝ ΣΤΑ ΒΙΟΛΟΓΙΚΑ ΣΥΣΤΗΜΑΤΑ
42
5) Σεληνοκυστείνη (SeCys): είναι ένα σημαντικό αμινοξύ που σχετικά πρόσφατα
ανακαλύφθηκε η ύπαρξή του σε ένζυμα. Η ομάδα της σεληνόλης (SeH) του αμινοξέος
βρίσκεται στην ανιονική μορφή σε φυσιολογικό pH (pKa=5) κι αποτελεί πολύ καλό σ-δότη
για τα μέταλλα.
α-Αμινοξύ
(R-CH(NH3+)(COO
-)
Πλευρική ομάδα
R Οξύ ↔Βάση +Η
+
Συναρμογή Αμινοξέος-
Μετάλλου
Ιστιδίνη N
HNCH2
NH+
HNCH2
N
HNCH2 + H+
pKa=6.5
N
HNCH2
M
Κυστεϊνη CH2-SH pKa=8
CH2-S- + H+CH2-SH CH2-S-M
Σεληνοκυστεϊνη CH2-SeH pKa=5
CH2-Se- + H+CH2-SeH CH2-Se-M
Γλουταμινικό οξύ
Ασπαραγινικό οξύ
CH2-COOH
CH2-CH2-COOH
pKa=5CH2-COOH CH2CH2-COOH
CH2-COO-
CH2CH2-COO-+ H+
n=1, Glun=2, Asp
(CH2)n
O O
M
(CH2)n
O O
M
M=Ca, Bi
Τυροσίνη H2C OH
pKa=10
H2C OH H2C O- + H+
H2C O M
Σχήμα 2. Συναρμογή μετάλλων με τις πλευρικές αλυσίδες αμινοξέων.
β) Σύνδεση με προσθετική ομάδα
Η άλλη περίπτωση συναρμογής του μετάλλου σε μεταλλοπρωτεϊνη είναι μέσω προσθετικής
ομάδας. Προσθετικές ομάδες αποτελούν οι τετραπυρρολικοί δακτύλιοι. Αυτοί είναι
μακροκυκλικοί ακόρεστοι δακτύλιοι, οι οποίοι περιέχουν τέσσερις ομάδες πυρρολίου και
συναρμόζονται με τα μέταλλα μέσω των ατόμων αζώτου που περιέχουν, Σχήμα 3. Οι πιο
κοινοί από αυτούς είναι:
1) η πορφυρίνη που αποτελείται από ένα εκτεταμμένο αρωματικό σύστημα και 4 πυρρολικές
ομάδες, όπου οι δύο από αυτές περιέχουν βασικό ιμινικό άζωτο κι οι άλλες δύο αμινικό
άζωτο. Σύμπλοκο της πρωτοπορφυρίνης με το σίδηρο απαρτίζει τη ομάδα της αίμης που
συμμετέχει στην αιμοσφαιρίνη, τη μυοσφαιρίνη, τα κυτοχρώματα και τις υπεροξειδάσες (βλ.
Σχήμα 4).

ΣΗΜΑΣΙΑ ΜΕΤΑΛΛΩΝ ΣΤΑ ΒΙΟΛΟΓΙΚΑ ΣΥΣΤΗΜΑΤΑ
43
2) η χλωρίνη (2, 3 δι-υδρο-πορφυρίνη) διαφέρει από τη πορφυρίνη στο ότι είναι μερικώς
υδρογονωμένη. Σύμπλοκο χλωρίνης με μαγνήσιο συμμετέχει στο μόριο της χλωροφύλλης.
3) η κορρίνη, ένα εν μέρει ακόρεστο μακροκυκλικό σύστημα, στο οποίο υπάρχουν τρία
ιμινικά άτομα αζώτου και ένα αμινικό άζωτο. Σύμπλοκο της κορρίνης με κοβάλτιο συμμετέχει
στο μόριο της κοβαλαμίνης (βιταμίνη Β12).
3. Σημαντικές βιολογικές λειτουργίες των μετάλλων
Σχήμα 3. Τετραπυρρολικοί δακτύλιοι: 1) πορφυρίνη, 2) χλωρίνη, 3) κορρίνη
NNH
N HN
NNH
N NN HN
HNN
1. 2. 3.
Σχήμα 4. Σύμπλοκα μετάλλων με τετραπυρρολικούς συναρμοτές στον οργανισμό: α) αίμη, β)
χλωροφύλλη, γ) κοβαλαμίνη

ΣΗΜΑΣΙΑ ΜΕΤΑΛΛΩΝ ΣΤΑ ΒΙΟΛΟΓΙΚΑ ΣΥΣΤΗΜΑΤΑ
44
1) Φορείς φορτίου
Απλά ιόντα μπορούν να λειτουργήσουν ως φορείς φορτίου για γρήγορη μεταφορά
πληροφοριών. Η διατήρηση της κλίσης δυναμικού στις κυτταρικές μεμβράνες μέσω των
αντλιών ιόντων, μονάδες πληροφοριών μπορούν γρήγορα να μεταφέρουν το μήνυμα μέσω
απότομης αλλαγής του δυναμικού. Ακόμα και η μυική σύσπαση επιτυγχάνεται με ταχεία
διάχυση ηλεκτρικού φορτίου μέσα στο κύτταρο.
2) Αποθήκευση
Κάποια από τα απαραίτητα μέταλλα που απορροφώνται από τον οργανισμό αλλά δε
χρησιμοποιούνται άμεσα, αποθηκεύονται σε ειδικές αποθηκευτικές πρωτεΐνες.
Η πιο γνωστή μεταλλοπρωτεϊνη αποθήκευσης μετάλλων στον οργανισμό είναι η φερριτίνη, η
οποία χρησιμεύει στην αποθήκευση του σιδήρου. Η φερριτίνη μπορεί να αποθηκεύσει ως και
4500 άτομα Fe(III) υπό μορφή υδροξειδίου, συγκρατούμενα με γέφυρες οξυγόνου μεταξύ
τους.
Επίσης είναι γνωστές κάποιες μικρού μοριακού βάρους, πρωτεϊνες πλούσιες σε θείο, οι
μεταλλοθειονίνες που χρησιμεύουν στην αποθήκευση και μεταφορά χαλκού και ψευδαργύρου.
Στο μόριο της πρωτεϊνης άτομα ψευδαργύρου είναι συναρμοσμένα με άτομα θείου κυστεϊνης.
3) Μεταφορά μορίων
Η κυριότερη πρωτείνη μεταφοράς χημικών μορίων χρήσιμων στον οργανισμό είναι η
μεταλλοπρωτεϊνη αιμοσφαιρίνη, η οποία είναι υπεύθυνη για τη μεταφορά του μοριακού
οξυγόνου από τους πνεύμονες στους ιστούς. Η αιμοσφαιρίνη ανήκει στις αιμοπρωτεΐνες,
δηλαδή πρωτεΐνες αίμης, που επιτελούν διάφορες σημαντικές βιολογικές διαδικασίες. Στη μη
οξυγονωμένη μορφή της, δηλαδή στη δεοξυ-αιμοσφαιρίνη, ο Fe(II) σχηματίζει
πενταϋποκατεστημένο σύμπλοκο υψηλού spin με τα 4 άτομα αζώτου του επίπεδου μορίου της
πορφυρίνης και το ιμιδαζολικό άζωτο της ιστιδίνης της αιμοσφαιρίνης συναρμοσμένο στη
πέμπτη θέση της τετραγωνικής πυραμίδας του συμπλόκου. Στην οξυγονωμένη μορφή ένα
μόριο Ο2 συναρμόζεται στην 6η θέση συναρμογής του Fe(II) και μετατρέπει το σύμπλοκο σε
οκταεδρικό, χαμηλού spin. Η αιμοσφαιρίνη διαθέτει τέσσερις ομάδες αίμης.

ΣΗΜΑΣΙΑ ΜΕΤΑΛΛΩΝ ΣΤΑ ΒΙΟΛΟΓΙΚΑ ΣΥΣΤΗΜΑΤΑ
45
Σχήμα 5. Διάσχιση d τροχιακών συμπλόκου αίμης στην αιμοσφαιρίνη, πριν και μετά τη συναρμογή
του οξυγόνου.
Η μυοσφαιρίνη είναι πρωτεΐνη, ανάλογης δομής με την αιμοσφαιρίνη που περιέχει μόνο μία
ομάδα αίμης. Διαθέτει το Ο2 για την οξείδωση της γλυκόζης που επιτελείται στους μυς με
ταυτόχρονη παραγωγή CO2. Το διοξείδιο του άνθρακα παραλαμβάνεται από τη δεοξυ-
αιμοσφαιρίνη, δεσμεύοντας το στην ίδια θέσης δέσμευσης με το Ο2 και μεταφέρεται δια του
φλεβικού αίματος στους πνεύμονες.
Σχήμα 6. Λειτουργία αιμοσφαιρίνης. Μεταφορά Ο2 και CO2.

ΣΗΜΑΣΙΑ ΜΕΤΑΛΛΩΝ ΣΤΑ ΒΙΟΛΟΓΙΚΑ ΣΥΣΤΗΜΑΤΑ
46
Λειτουργία αιμοσφαιρίνης-μυοσφαιρίνης.
Οι 4 υπο-ομάδες της αιμοσφαιρίνης σχηματίζουν μια διάταξη περίπου τεταεδρική,
συγκροτούμενες με τις "γέφυρες άλατος" –ΝΗ3+....
-ΟΟC-. Η πρόσληψη του O2 διαταράσσει
τις υπο-ομάδες κατά τρόπον ώστε να ανοίγουν οι "τσέπες" που περιέχουν τις ομάδες της αίμης
και να εκτίθεται η έκτη θέση συντάξεως του σιδήρου. Φαίνεται ότι αυτό είναι το αποτέλεσμα
της μετακινήσεως του χαμηλού spin Fe2+
στο επίπεδο της πορφυρίνης, που έλκοντας το μόριο
της ιστιδίνης προς το μέρος του πυροδοτεί, στερεοχημικές μεταβολές στην αλυσίδα της
σφαιρίνης, οι οποίες μεταβιβάζονται και στις υπόλοιπες τρεις υπο-ομαδες μεσώ των γεφυρών
άλατος. Συνέπεια του γεγονότος αυτού είναι ότι η πρόσληψη ενός μορίου Ο2 από την
αιμοσφαιρίνη, αυξάνει την τάση για πρόσληψη περισσοτέρων. Αντίθετα, η απομάκρυνση ενός
Ο2 από την οξυ-αιμοσφαιρίνη προκαλεί τις αντίθετες στερεοχημικές αλλαγές και μειώνει την
τάση για πρόσληψη Ο2. Αυτό είναι ένα φαινόμενο "συνεργικότητας" και η φυσιολογική
σημασία του βρίσκεται στο γεγονός ότι επιτρέπει την ικανοποιητική μεταφορά του Ο2 από την
οξυ-αιμοσφαιρίνη στη μυοσφαιρίνη. Η μυοσφαιρίνη περιέχει μία μόνο μονάδα αίμης και και
σε χαμηλότερες μερικές πιέσεις η μυοσφαιρίνη έχει μεγαλύτερη τάση προσλήψεως Ο2 από
ό,τι η αιμοσφαιρίνη. Η αιμοσφαιρίνη είναι κορεσμένη με Ο2 στους πνεύμονες, όμως σε
χαμηλότερες μερικές πιέσεις Ο2 (στην περιοχή των ιστών), η τάση της για πρόσληψη Ο2
ελαττώνεται πολύ πιο γρήγορα από ό,τι εκείνη της μυοσφαιρίνης κι έτσι ευνοείται η μεταφορά
του Ο2 . Επειδή το CO2 που ελευθερώνεται στους ιστούς χαμηλώνει το pΗ, διευκολύνεται
ακόμη περισσότερο η μεταφορά του οξυγόνου στη μυοσφαιρίνη από την οξυ-αιμοσφαιρίνη.
Το CO2 στη συνέχεια απομακρύνεται από τους ιστούς, με μεταφορά του από τη δεοξυ-
αιμοσφαιρίνη, εν μέρει, αλλά κυρίως υπό τη μορφή του διαλυτού HCO3- του οποίου ο
σχηματισμός διευκολύνεται από την πρωτεϊνική αλυσίδα της δεοξυ-αιμοσφαιρίνης, που δρα
ως ρυθμιστικό προσλαμβάνοντας τα σχηματιζόμενα πρωτόνια:
CO2 + Η2Ο ↔ HCO3- + Η
+
Η δηλητηριώδης δράση μορίων, όπως τα CO και PF3 προκύπτει από την ικανότητα τους να
συνδέονται αντιστρεπτά με την αίμη, με τον ίδιο τρόπο όπως και το O2, αλλά πολύ πιο
ισχυρά, ώστε να παρεμποδίζεται η μεταφορά του οξυγόνου. Τα ιόντα CN- αντικαθιστούν
επίσης το O2 από την οξυ-αιμοσφαιρίνη, αλλά η πολύ μεγάλη τοξικότητα τους σε μικρές
συγκεντρώσεις οφείλεται στη δράση τους στο κυτόχρωμα α.

ΣΗΜΑΣΙΑ ΜΕΤΑΛΛΩΝ ΣΤΑ ΒΙΟΛΟΓΙΚΑ ΣΥΣΤΗΜΑΤΑ
47
4) Αποτοξίνωση
Αποτοξίνωση είναι η διαδικασία του οργανισμού να μετατρέπει τοξικές ουσίες σε μη τοξικές.
Η αποτοξίνωση από μεταλλικά ιόντα επιτυγχάνεται με τη δέσμευσή τους σε σύμπλοκα
σταθερά σε φυσιολογικό pH που απομακρύνονται εύκολα από τη κυκλοφορία. Για
παράδειγμα οι μεταλλοθειονίνες είναι πρωτεΐνες που περιέχουν πολλές σουλφυδρυλομάδες
(SH) και δεσμεύουν ισχυρά, τοξικά μέταλλα όπως Cd2+
, Ag+, Hg
+ και Ηg
2+.
Οι μεταλλοπρωτεΐνες επίσης εμπλέκονται στην διαδικασία αποτοξίνωσης από ανεπιθύμητα
οργανικά και ανόργανα μόρια. Για παράδειγμα η αιμoσφαιρίνη απομακρύνει το διοξείδιο του
άνθρακα δεσμεύοντας το στην ίδια θέση δέσμευσης όπως και το οξυγόνο και η υπεροξειδική
δισμουτάση, ένα ένζυμο που περιέχει σίδηρο, μαγγάνιο ή χαλκό, μετατρέπει την υπεροξειδική
ρίζα σε υπεροξείδιο του υδρογόνου (2Η2Ο + ·Ο2
- 2 Η2Ο2), δεσμεύοντας το ηλεκτρόνιο της
ρίζας (σχήμα 7).
Σχήμα 7. Cu/Zn SOD. Δομικές αλλαγές κατά την αναγωγή Cu2+
/Cu+.
5) Μεταφορά ηλεκτρονίων
Η μεταφορά ηλεκτρονίων είναι απαραίτητη για την άμεση μετατροπή ενέργειας, κι εξαρτάται
από τα δυναμικά οξειδοαναγωγής των συστημάτων που συμμετέχουν. Οι αντιδράσεις
μεταφοράς ηλεκτρονίων είναι οξειδοαναγωγικές αντιδράσεις κατά τις οποίες ένα ηλεκτρόνιο
μεταφέρεται από τη μια πρωτεϊνη σε μια άλλη (διαμοριακή μεταφορά) ή μεταξύ δύο
διαφορετικών θέσεων της ίδιας πρωτεϊνης (ενδομοριακή μεταφορά). Η μεταφορά ηλεκτρονίου
μπορεί στη συνέχεια να ενεργοποιήσει μια σειρά από άλλες αντιδράσεις μεταφοράς,
ενεργοποιώντας τελικά μια πρωτεϊνη ή ένζυμο που συμμετέχει σε μια φυσιολογική
διαδικασία.
Μέταλλα με πολλαπλές οξειδωτικές καταστάσεις μπορούν να πραγματοποιήσουν αυτή τη
μεταφορά αλλάζοντας οξειδωτικές καταστάσεις σε αυτή τη διαδικασία. Στον οργανισμό

ΣΗΜΑΣΙΑ ΜΕΤΑΛΛΩΝ ΣΤΑ ΒΙΟΛΟΓΙΚΑ ΣΥΣΤΗΜΑΤΑ
48
τέτοια οξειδοαναγωγικά ζεύγη είναι τα στοιχεία μετάπτωσης. Γενικά ένα σύστημα που έχει
υψηλό δυναμικό οξειδοαναγωγής μπορεί να δράσει ως οξειδωτικό ενώ ένα σύστημα που
εμφανίζει αρνητικό δυναμικό οξειδοαναγωγής δρά ως δότης ηλεκτρονίων ή αναγωγικό.
Τέτοια οξειδοαναγωγικά ζέυγη είναι: Fe(II) /Fe (III), Cu(I)/Cu(II), Mn (II)/ Mn(III), Mo(V)/
Mo(VI) κα.
Ένα πολύ σημαντικό τέτοιο σύστημα είναι τα κυτοχρώματα που ανήκουν στις αιμοπρωτεϊνες,
όπου ο σίδηρος κατά τη μεταφορά ηλεκτρονίων μεταπίπτει από τη (ΙΙ) στη (ΙΙΙ) οξειδωτική
κατάσταση.
Στα κυτοχρώματα, η ομάδα της αίμης βρίσκεται υπό μορφή εξαϋποκατεστημένου συμπλόκου
της πορφυρίνης με δισθενή σίδηρο. Στη 5η θέση συναρμογής συμμετέχει το άζωτο
ιμιδαζολικού δακτυλίου και στην 6η θέση μια θειαιθερική ομάδα μεθειονίνης. Έτσι το
σύμπλοκο καθίσταται αδρανές όχι μόνο στο οξυγόνο αλλά και σε δηλητήρια που επηρεάζουν
τους μεταφορείς οξυγόνου. Τα κυτοχρώματα δρουν ως ενδιάμεσα στη μεταβολική οξείδωση
της γλυκόζης από το μοριακό οξυγόνο, μια διαδικασία με πολλά στάδια, όπου η οξειδωτική
κατάσταση του σιδήρου (που βρίσκεται σε κατάσταση χαμηλού spin) ταλαντεύεται μεταξύ +
2 και +3. Επειδή εμπλέκονται διαφορετικά κυτοχρώματα με τη σειρά b, c, a το δυναμικό
αναγωγής κάθε σταδίου αυξάνεται κλιμακωτά κι έτσι πρoκύπτει μια "οξειδοαναγωγική
βαθμίδα", που επιτρέπει τη βαθμιαία απελευθέρωση ενέργειας από την οξείδωση της
γλυκόζης και την αποθήκευση της υπό τη μορφή της τριφωσφορικής αδενοσίνης (ΑΤΡ).
6) Κατάλυση
Ο σχηματισμός κι η διάσπαση χημικών δεσμών είναι αντιδράσεις που για να
πραγματοποιηθούν στο φυσιολογικό pH του οργανισμού απαιτούν καταλύτες. Οι καταλύτες –
μεταλλοένζυμα, διακρίνονται σε δύο κατηγορίες: α) στα οξειδοαναγωγικά ένζυμα, όπου το
μέταλλο βρίσκεται μεταξύ δύο οξειδωτικών καταστάσεων, και β) στα μη οξειδοαναγωγικά
ένζυμα. Στη δεύτερη κατηγορία συμμετέχουν μέταλλα που δρουν σαν οξέα κατά Lewis, έχουν
δηλαδή κατάλληλη οξύτητα αλλά επιπλέον είναι σταθερά σε μία οξειδωτική κατάσταση.
Τέτοια μέταλλα είναι το Mg2+
και Zn2+
. Από τα δύο ο ψευδάργυρος είναι πιο ισχυρό οξύ κατά
Lewis και μάλιστα η σταθερά διάστασης του συναρμοσμένου νερού είναι pKa =8,8: Zn-
OH2 Zn-OH- + H
+. Ένα μεγάλο ποσοστό μη-οξειδοαναγωγικών ενζύμων είναι
μεταλλοένζυμα του ψευδαργύρου.

ΣΗΜΑΣΙΑ ΜΕΤΑΛΛΩΝ ΣΤΑ ΒΙΟΛΟΓΙΚΑ ΣΥΣΤΗΜΑΤΑ
49
Δομικά χαρακτηριστικά των συμπλόκων των μη-οξειδοαναγωγικών μεταλλοενζύμων επίσης
είναι τα εξής: α) Το σύμπλοκο έχει κενή θέση στη σφαίρα συναρμογής. Δηλαδή για τους πιο
συνήθεις αριθμούς συναρμογής 4, 6, λείπει ένα συναρμοτής ή υπάρχει ένας ευκίνητος
συναρμοτής, όπως το νερό. Αυτό το χαρακτηριστικό είναι απαραίτητο για την ενζυμική
δράση του συμπλόκου, αφού πρέπει να υπάρχει χώρος για τη συναρμογή του υποστρώματος
(υπόστρωμα: το βιομόριο που θα μεταβολιστεί από το ένζυμο). β) Επιπλέον, στα
μεταλλοένζυμα με αριθμούς συναρμογής 4 ή 6 έχει παρατηρηθεί ότι το σύμπλοκο βρίσκεται
σε μια «τεταμένη» κατάσταση, δηλαδή είναι γεωμετρικά παραμορφωμένο. Αυτό έχει
αποτέλεσμα το σύμπλοκο να βρίσκεται σε υψηλή ενεργειακά κατάσταση, γεγονός που
διευκολύνει τη καταλυτική αντίδραση να λάβει χώρα, αφού η ενέργεια του τεταμένου
συμπλόκου προσεγγίζει έτσι την ενέργεια ενεργοποίησης του μεταβατικού σταδίου της
καταλυόμενης αντίδρασης.
7) Τρισδιάστατη δομή βιομορίων
α) Συγκρότηση στέρεων δομών
Οι κυτταρικές μεμβράνες χρειάζονται τη παρουσία μετάλλων για τη διασύνδεση των
οργανικών αλυσίδων που τις απαρτίζουν και τη διατήρηση της μεμβρανικής συνοχής. Επίσης
σύμπλοκες ενώσεις του ασβεστίου με φωσφορικά ανιόντα απαρτίζουν τα οστά με τη μορφή
υδροξυαπατίτη, Ca5(PO4)3(OH).
β) Αλληλεπιδράσεις με νουκλεϊνικά οξέα
Η συναρμογή μεταλλικών ιόντων με το DNA, RNA θεωρείται πως i) συμβάλλει στη
σταθεροποίηση της δομής του DNA, αφού ιόντα Na+, Mg
2+ αντισταθμίζουν το αρνητικό
φορτίο του DNA κι έτσι δεν απωθούνται οι αρνητικά φορτισμένες έλικες όταν έρχονται σε
επαφή η μια με την άλλη. Επιπλέον, ii) μεταλλικά ιόντα δρουν ως συμπαράγοντες. Δισθενή
ιόντα Mg2+
ενεργοποιούν ένζυμα όπως τη DNA πολυμεράση.
γ) Τρισδιάστατη δομή μεταλλοενζύμων.

ΣΗΜΑΣΙΑ ΜΕΤΑΛΛΩΝ ΣΤΑ ΒΙΟΛΟΓΙΚΑ ΣΥΣΤΗΜΑΤΑ
50
Κατά τη συναρμογή του Zn2+
με αμινοξέα πεπτιδικής αλληλουχίας δημιουργείται
ενδομοριακή κάμψη στο μόριο που προσδίδει σε αυτό συγκεκριμένη δραστικότητα στον
οργανισμό. Έτσι ο ψευδάργυρος συνδέεται με κάποια ρυθμιστικά ένζυμα όπως το
μεταγραφικό παράγοντα ΙΙΑ και τη πολυμεράση του DNA κατά τρόπο που προκαλεί
ενδομοριακή κάμψη 12-15 αμινοξέων γνωστή ως δάκτυλος ψευδαργύρου, (zinc finger). Στους
δάκτυλους ψευδαργύρου σχηματίζονται τετραεδρικά σύμπλοκα του Zn2+
με κατάλοιπα
αμινοξέων όπως ιστιδίνη, κυστεϊνη, φαινυλαλανίνη και τυροσίνη.
4. Ενώσεις συναρμογής στη θεραπεία και τη διάγνωση
Σήμερα ένας μεγάλος αριθμός ενώσεων συναρμογής χρησιμοποιούνται στην θεραπευτική
αγωγή ή εφαρμόζονται ως μέσα διάγνωσης διαφόρων ασθενειών. Ιδιαίτερα στον τομέα της
διάγνωσης, οι ενώσεις συναρμογής κατέχουν σημαντική θέση, καθόσον παρέχουν πολύτιμες
πληροφορίες για την παθοφυσιολογία οργάνων ή ιστών του ανθρώπινου σώματος. Η
ανάπτυξη σύγχρονης διαγνωστικής τεχνολογίας στηρίζεται σήμερα σε μεγάλο μέρος, στην
ανάπτυξη ενώσεων συναρμογής. Επιπλέον, η ολοένα μεγαλύτερη κατανόηση της λειτουργίας
μεταλλοενζυμικών συστημάτων κι η ανάπτυξη συνθετικών χημικών αναλόγων αυτών, ανοίγει
νέους ορίζοντες στην ανάπτυξη φαρμακευτικών ενώσεων που μιμούνται τη δράση
μεταλλοενζύμων. Έτσι δημιουργείται ένας συνεχώς αναπτυσσόμενος κλάδος, η Βιοανόργανη
Φαρμακοχημεία, που έχει σαν στόχο τον σχεδιασμό και ανάπτυξη ενώσεων συναρμογής για
φαρμακευτική χρήση.
Σχήμα 8. Δάκτυλος ψευδαργύρου, με συναρμογή δύο ομάδων κυστεϊνης και δύο ομάδων ιστιδίνης

ΣΗΜΑΣΙΑ ΜΕΤΑΛΛΩΝ ΣΤΑ ΒΙΟΛΟΓΙΚΑ ΣΥΣΤΗΜΑΤΑ
51
Οι φαρμακευτικές ενώσεις που αναπτύσσονται στα επόμενα κεφάλαια, διακρίνονται σε δύο
κατηγορίες:
α) σε συναρμοτές, οι οποίοι κατά την χορήγησή τους, σχηματίζουν ενώσεις συναρμογής στον
οργανισμό. Η ένωση συναρμγογής είναι αυτή που τελικά θα παράσχει το επιθυμητό
φαρμακολογικό αποτέλεσμα, όπως την απομάκρυνση μεταλλικών ιόντων, η υπερφόρτωση
των οποίων, είναι δυνατό να προκαλέσει βλάβες ή σε άλλες περπτώσεις τη ρύθμιση μιας
βιολογικής διαδικασίας που σχετίζεται με τη δράση κάποιου μετάλλου.
β) σε ενώσεις συναρμογής που θα δράσουν στον οργανισμό ως έχει, ή μετά από μικρή
τροποποίηση τους. Οι ενώσεις συναρμογής μπορεί να εφαρμοστούν για θεραπεία ή για
διάγνωση παθήσεων.

ΣΗΜΑΣΙΑ ΜΕΤΑΛΛΩΝ ΣΤΑ ΒΙΟΛΟΓΙΚΑ ΣΥΣΤΗΜΑΤΑ
52

ΧΡΗΣΗ ΣΥΝΑΡΜΟΤΩΝ ΣΤΗ ΘΕΡΑΠΕΙΑ
53
ΚΕΦΑΛΑΙΟ 3
ΧΡΗΣΗ ΣΥΝΑΡΜΟΤΩΝ ΣΤΗ ΘΕΡΑΠΕΙΑ
Ι. ΣΥΝΑΡΜΟΤΕΣ ΚΑΤΑ ΤΗΣ ΟΣΤΕΟΠΟΡΩΣΗΣ
Η οστεοπόρωση αποτελεί μεγάλο πρόβλημα στην δημόσια υγεία καθόσον σήμερα
τα οστεοπορωτικά κατάγματα είναι περισσότερο συχνά απο τα εγκεφαλικά επεισόδια,
καρδιακά επεισόδια και καρκίνο του μαστού.
Η οστική εναλλαγή αποτελει συνεχή κύκλο απορρόφησης και σχηματισμού των
οστών. Η διατήρηση της οστικής μάζας εξαρτάται από την ισορροπία αυτής της
απορρόφησης και σχηματισμού. Έτσι στους ασθενείς με οστεοπόρωση ο ρυθμός
απορρόφησης υπερέχει του σχηματισμού με αποτέλεσμα την οστική απώλεια.
Το ασβέστιο συμμετέχει στην δομή των οστών υπό την μορφή δυσδιάλυτου
φωσφορικού άλατος, του υδροξυαπατίτη. Από την άποψη αυτή εμπλέκεται στην
διαδικασία της οστεογένεσης.
Μέσα επιτυχούς αντιμετώπισης της οστεοπόρωσης αποτελούν τα διφωσφονικά
παράγωγα, τα οποία δίδουν σταθερές ενώσεις συναρμογής με ιόντα ασβεστίου.
Ανωμαλίες μεταβολισμού του ασβεστίου
Το ασβέστιο είναι ένα απαραίτητο στοιχείο του οργανισμού και συμμετέχει σε
πολλές σημαντικές διεργασίες, όπως μεταφορά μηνυμάτων, αλλά και ενεργοποίηση
ενζύμων. Το ασβέστιο επίσης συμμετέχει στη δομή των οστών, με τη μορφή του
δυσδιάλυτου άλατος του υδροξυαπατίτη, Ca5(PO4)3OH. Ο υδροξυαπατίτης αποτελεί το
50% της οστικής μάζας και είναι υπεύθυνος για την αντοχή των οστών στην πίεση.
Το 99 % του συνολικού ασβεστίου του οργανισμού βρίσκεται στα οστά. Απ’ αυτό
το 1% είναι διαθέσιμο, μπορεί δηλαδή να διατεθεί στην κυκλοφορία ή να εναποτεθεί πάλι,
ανάλογα με τις ανάγκες του οργανισμού. Η συγκέντρωση του ασβεστίου στο αίμα
κυμαίνεται μεταξύ 2.2-2.6 mmol/L. Το 40% της ποσότητας αυτής βρίσκεται συνδεδεμένο
με πρωτεΐνες και κυρίως με αλβουμίνη, ενώ το υπόλοιπο 60% βρίσκεται με τη μορφή
ελεύθερων ιόντων ασβεστίου ή συναρμοσμένο με φωσφορικά και κιτρικά ιόντα. Η
δέσμευση του ασβεστίου στις πρωτεΐνες του αίματος εξαρτάται από το pH. Σε περιπτώσεις
οξέωσης, μειώνεται το ασβέστιο που είναι συνδεδεμένο με πρωτεΐνες και αυξάνεται το
ελεύθερο ασβέστιο στο αίμα, ενώ το αντίθετο συμβαίνει στις περιπτώσεις αλκάλωσης. Η
επιτρεπτή συγκέντρωση ασβεστίου στο αίμα συνδέεται άμεσα με την συγκέντρωση των

ΚΕΦΑΛΑΙΟ 3
54
φωσφορικών ιόντων, καθόσον το ασβέστιο σχηματίζει με αυτά δυσδιάλυτα άλατα. Το
γινόμενο διαλυτότητας των ιόντων ασβεστίου και των φωσφορικών ιόντων είναι
φυσιολογικά περίπου 60 mEq/L. Σε τιμές μεγαλύτερες του 70 παρατηρείται καθίζηση
κρυστάλλων φωσφορικού ασβεστίου σε μαλακούς ιστούς όπως τα τοιχώματα των
αρτηριών με αποτέλεσμα την αρτηριοσκλήρυνση.
Η εναπόθεση ασβεστίου στα οστά είναι μια δυναμική διαδικασία που λαμβάνει
χώρα συνεχώς και στα ενήλικα άτομα. Η οστική ύλη ανανεώνεται συνεχώς μέσα από
συντονισμένη δράση των οστεοκλαστών που διασπούν την οστική ύλη και των
οστεοβλαστών που παράγουν οστική ύλη και αποκαθιστούν τα κενά που δημιουργούν οι
οστεοκλάστες. Η διαταραχή της ισορροπημένης ανανέωσης της οστικής ύλης συνδέεται με
διάφορες ασθένειες όπως η οστεοπόρωση.
Υποασβεσταιμία: Ως υποασβεσταιμία χαρακτηρίζεται η μειωμένη συγκέντρωση
ασβεστίου στο αίμα (<2.2 mΜ). Αυτή μπορεί να προκληθεί: α) από μειωμένη έκκριση
παραθυρεοειδικής ορμόνης (υποπαραθυρεοειδισμός), ή από αδυναμία της
παραθυρεοειδικής ορμόνης να αλληλεπιδράσει με τους υποδοχείς της σε καταστάσεις
όπως ψευδοπαραθυρεοειδισμός, κληρονομική οστεοδυστροφία Albright, περιπτώσεις
μερικής ή ολικής αφαίρεσης παραθυρεοειδικών αδένων, ή γενετικές ανωμαλίες που
οδηγούν σε απουσία τη ορμόνης ή υπολειτουργία του παραθυρεοειδούς, ασθένεια
Addison β) από μειωμένα επίπεδα ενεργούς βιταμίνης D ή αδυναμία αλληλεπίδρασης της
βιταμίνης D με τα κύτταρα στόχους, γ) από αδυναμία απορρόφησης ασβεστίου που
οφείλεται σε διάφορα αίτια (πχ. σύνδεση του ασβεστίου με συναρμοτές που εκκρίνονται
από το πάγκρεας σε περίπτωση οξείας παγκρεατίτιδας), δ) από κακή νεφρική λειτουργία.
Καθόσον το Ca συμμετέχει σε τόσους διαφορετικούς βιοχημικούς μηχανισμούς
είναι αναμενόμενο, ότι η έλλειψη ασβεστίου μπορεί να έχει πολλαπλά αποτελέσματα
ανάλογα με το βαθμό και τη διάρκεια της έλλειψης. Γνωστή συνέπεια της έλλειψης
ασβεστίου είναι η οστεοπόρωση. Ωστόσο με την έλλειψη ασβεστίου συνδέονται και
νευρομυικές διαταραχές που χαρακτηρίζονται από κράμπες έως τετανία σε σοβαρή
υποκαλσιαιμία όπως και εγκεφαλικές διαταραχές, εγκεφαλοπάθεια, κατάθλιψη ή ψύχωση.
Επίσης με την έλλειψη ασβεστίου συνδέεται η πρόκληση καταρράκτη. Για την
αντιμετώπιση της υποασβεσταιμίας χορηγείται ασβέστιο. Η χορήγηση γίνεται ενδοφλέβια,
με τη μορφή κυρίως γλουταμινικών αλάτων, ή από το στόμα με τη μορφή γλουταμινικών ή
ανθρακικών αλάτων.

ΧΡΗΣΗ ΣΥΝΑΡΜΟΤΩΝ ΣΤΗ ΘΕΡΑΠΕΙΑ
55
Διφωσφονικά παράγωγα
Τα διφωσφονικά παράγωγα έχουν σχεδιαστεί ως μιμητές του πυροφωσφορικού
οξέος, όπου το οξυγόνο στον δεσμό Ρ-Ο-Ρ έχει αντικατασταθεί από ένα άτομο άνθρακα,
το οποίο καθιστά την ένωση σταθερή στην υδρόλυση. Αφού το πυροφωσφορικό είναι
φυσικό συστατικό των οστών, τα ανάλογα αυτά εκλεκτικά συνδέονται με τον
υδροξυαπατίτη των οστών. Επιπλέον τα διφωσφονικά παράγωγα αναστέλλουν το
πολλαπλασιασμό των οστεοκλαστών καθώς και τη διάρκεια ζωής τους και ως αποτέλεσμα
ελλαττώνουν την οστεόλυση. Χορηγούνται κατά της οστεοπόρωσης.
Τα διφωσφονικά παράγωγα έχουν τον γενικό τύπο που φαίνεται στο σχήμα :
Σχήμα 1: Γενικός τύπος διφωσφονικών παραγώγων
Στο εμπόριο κυκλοφορούν διάφορα παρασκευάσματα που διαφέρουν ως προς τις
ομάδες R. Όταν η ομάδα R1 είναι το υδροξύλιο τα παράγωγα που προκύπτουν εμφανίζουν
μεγαλύτερη χημική συγγένεια προς τον υδροξυαπατίτη, επειδή το υδροξύλιο αποτελεί μια
επιπλέον ομάδα σύνδεσης με το ασβέστιο. Η ομάδα R2 προκαλεί μείωση της οστεολυτικής
διαδικασίας. Ενώσεις που περιέχουν αμίνη στην ομάδα R2, όπως τα ανάλογα παμιδρονάτη,
αλενδρονάτη κλπ. είναι 100-1000 πιο δραστικά ως προς το βαθμό αναστολής της
οστεόλυσης, έναντι της ετιδρονάτης που δεν φέρει καμία R2 υποκατάσταση. Ακόμα πιο
δραστικά είναι τα ανάλογα που φέρουν ετεροκυκλικό άζωτο, όπως ρισενδρονάτη,
ζολενδρονάτη κ.λ.π. Στο παρακάτω πίνακα φαίνονται οι υποκαταστάσεις R1, R2 των
κυριοτέρων διφωσφονικών αναλόγων.

ΚΕΦΑΛΑΙΟ 3
56
Πίνακας 1: Πλευρικές αλυσίδες διφωσφονικών
1. Μηχανισμός Δράσης
Η μείωση της οστικής απώλειας με την επίδραση των διφωσφονικών ενώσεων
οφείλεται σε συνδυασμό δράσεων, ορισμένες από τις οποίες δεν έχουν πλήρως
διευκρινιστεί. Τα διφωσφονικά παράγωγα συναρμόζονται με το ασβέστιο του
υδροξυαπατίτη, σχηματίζοντας μία νέα ένωση που δεν μπορεί να διασπαστεί από τους
οστεοκλάστες. Τα παράγωγα αυτά, είναι κυρίως διδοτικοί συναρμοτές. Διφωσφονικά
παράγωγα στα οποία η μία ομάδα R είναι υδροξύλιο, αποτελούν τριδοτικούς συναρμοτές,
οι οποίοι συνδέονται ισχυρότερα με τον υδροξυαπατίτη των οστών.
Τα διφωσφονικά παράγωγα παραμένουν ενσωματωμένα στην οστική ύλη για
μεγάλο χρονικό διάστημα. Το γεγονός αυτό δεν φαίνεται να δημιουργεί προβλήματα
ευθραυστότητας των οστών σε φυσιολογικές δόσεις, ενώ παρατείνει την δράση των
ενώσεων ακόμη και για χρόνια μετά τη χορήγηση.
Εκτός από την άμεση σύνδεση με τον υδροξυαπατίτη, τα διφωσφονικά παράγωγα
εισέρχονται στο εσωτερικό των οστεοκλαστικών όσο και των οστεοβλαστικών
κυττάρων. Ο ακριβής μηχανισμός δράσης στο εσωτερικό του κυττάρου δεν είναι
γνωστός, το τελικό αποτέλεσμα όμως είναι η αναστολή του πολλαπλασιασμού των
οστεοκλαστών και απόπτωση καθώς και η αναστολή σύνθεσης οστικής ύλης από τους
οστεοβλάστες.
Η δράση των διφωσφονικών ενάντια στην ασβεστοποίηση και την εκτοπική
οστεοποίηση, πιστεύεται ότι οφείλεται στην τάση τους να συνδέονται με το ασβέστιο και

ΧΡΗΣΗ ΣΥΝΑΡΜΟΤΩΝ ΣΤΗ ΘΕΡΑΠΕΙΑ
57
να εμποδίζουν το σχηματισμό κρυστάλλων φωσφορικού ασβεστίου καθώς και τη
συσσώρευση κρυστάλλων υδροξυαπατίτη.
2. Χρήσεις
Τα διφωσφονικά χρησιμοποιούνται κυρίως: 1) ως παρεμποδιστές της οστεολυτικής
διαδικασίας, 2) ως παρεμποδιστές ασβεστοποίησης και εκτοπικής οστεοποίησης ενώ 3)
βρίσκουν εφαρμογές επίσης στη ραδιοδιαγνωστική.
α) Χρήση διφωσφονικών παραγώγων για την παρεμπόδιση της οστεολυτικής
διαδικασίας.
Τα παράγωγα αυτά μειώνουν την απώλεια οστικής ουσίας και αυξάνουν την
οστική πυκνότητα σε ανθρώπους με οστεοπόρωση που επέρχεται μετά την εμηνόπαυση ή
οφείλεται σε άλλα αίτια όπως τη χρήση κορτικοστεροειδών. Το ίδιο αποτέλεσμα έχει η
χρήση τους σε υγιείς ανθρώπους. Αποτελεσματική μείωση της οστικής απώλειας με τη
χρήση διφωσφονικών ενώσεων παρατηρείται και σε περιπτώσεις καρκίνου των οστών,
όπου μάλιστα η δράση συνοδεύεται από μείωση του πόνου και της μεταστατικής
ικανότητας του όγκου.
β) Χρήση για την παρεμπόδιση ασβεστοποίησης και εκτοπικής οστεοποίησης.
Διφωσφονικές ενώσεις χρησιμοποιήθηκαν αποτελεσματικά για τοπική εφαρμογή
με σκοπό την παρεμπόδιση σχηματισμού της οδοντικής πέτρας και αποτελούν πρόσθετα
σε πολλές οδοντόκρεμες. Μελέτες της δράσης τους έναντι της ασβεστοποίησης μαλακών
ιστών αλλά και της επικάθισης αλάτων ασβεστίου σε τεχνητές βαλβίδες, βρίσκονται σε
πειραματικό στάδιο και είναι πολλά υποσχώμενες για τη πιθανή αντιμετώπιση ασθενειών
όπως η αρτηριοσκλήρυνση καθώς και για χρήση τους στην καρδιοχειρουργική.
3. Τρόπος χορήγησης
Τα διφωσφονικά παράγωγα χορηγούνται από το στόμα. Επειδή η χορήγηση τους
από το στόμα, δημιουργεί προβλήματα οισοφαγικού έλκους, εφαρμόζεται αργή
ενδοβλέβια χορήγηση. Γρήγορη ενδοφλέβια χορήγηση των ενώσεων, οδηγεί σε νεφρική
δυσλειτουργία, πιθανώς λόγω σχηματισμού στο αίμα δυσδιάλυτων διφωσφονικών αλάτων.
4. Μεταβολισμός

ΚΕΦΑΛΑΙΟ 3
58
Τα διφωσφονικά παράγωγα δεν μεταβολίζονται. Απορροφώνται πολύ λίγο από το
στομάχι και το έντερο (1-10%) με απλή διάχυση. Η απορρόφησή τους μειώνεται όταν
χορηγούνται με ασβέστιο και σίδηρο, λόγω δημιουργίας δυσδιάλυτων συμπλόκων, ενώ
αυτή αυξάνεται παρουσία άλλων συναρμοτών. Στο αίμα τα διφωσφονικά παράγωγα
συνδέονται με πρωτεΐνες.
5. Άλλες επιδράσεις
Εκτός από τις επιδράσεις που έχουν αναφερθεί, οι διφωσφονικές ενώσεις,
προκαλούν και ορισμένα άλλα θετικά ή αρνητικά αποτελέσματα, τα οποία δεν έχουν
ακόμα εξηγηθεί. Στα αποτελέσματα αυτά περιλαμβάνεται η αναστολή του ανοσοποιητικού
συστήματος εξαιτίας κυρίως της επίδρασης των διφωσφονικών στα μονοπυρηνικά
φαγοκύτταρα, τα μονοκύτταρα και τα μακροφάγα, η αναστολή στη σύνθεση
προσταγλανδινών και η αύξηση της συγκέντρωσης των HDL λιποπρωτεΐνών στο αίμα.
Nατριούχος αλενδρονάτη
(4-αμινο-1-υδρόξυβουτυλιδενο) δις [φωσφονικό οξύ] νατριούχο άλας
Αlendronate sodium
1. Σύνθεση
Η σύνθεση επιτυγχάνεται με επίδραση φωσφορώδους οξέος στο γ-αμινοβουτυρικό οξύ,
σύμφωνα με το σχήμα:

ΧΡΗΣΗ ΣΥΝΑΡΜΟΤΩΝ ΣΤΗ ΘΕΡΑΠΕΙΑ
59
2. Μηχανισμός δράσης
Η αλενδρονάτη επεμβαίνει στην οστική απορρόφηση αναστέλλοντας εκλεκτικά
τους οστεοκλάστες. Μειώνει έτσι την αναλογία απορρόφησης της οστικής μάζας,
συντελλώντας στην αύξηση της. Έχουν προταθεί τρείς μηχανισμοί: α) μειωμένη
δραστηριότητα των οστεοκλαστών, β) μειωμένος σχηματισμός των οστεοκλαστών, γ)
μειωμένη διάρκεια ζωής των οστεοκλαστών .
Η μειωμένη οστεοκλαστική δραστηριότητα της αλενδρονάτης, φαίνεται να
οφείλεται, στην εκλεκτική της πρόσδεση στις ενεργές θέσεις οστικής απορρόφησης,
π.χ.κάτω από τους οστεοκλάστες.
Κατά την έναρξη της απορρόφησης, οι οστεοκλάστες καθιστούν όξινη την
επιφάνεια των οστών, με αποτέλεσμα την απελευθέρωση της αλενδρονάτης στην
κοιλότητα του οστού που επισυμβαίνει η οστική απορρόφηση. Εκεί παρεμβαίνει στον
σχηματισμό της κυματοειδούς επιφάνειας των οστεοκλαστών με την οποία
προσκολλώνται στο οστούν, αναστέλλοντας έτσι την οστική απορρόφηση.
Η μειωμένη διάρκεια ζωής των οστεοκλαστών οφείλεται σε παρέμβαση στην
βιοσύνθεση της χοληστερόλης, που είναι βασική για την λειτουργία και την επιβίωση των
οστεοκλαστών.
3. Φαρμακοκινητική
Μετά από ενδοφλέβια χορήγηση, περίπου το μισό της ποσότητας της
αλενδρονάτης προσλαμβάνεται από τα οστά, ενώ το άλλο μισό αποβάλλεται από τα ούρα.
Μέρος ενσωματώνεται στην θεμέλια ουσία των οστών, όπου παραμένει φαρμακολογικά
ανενεργό με χρόνο ημίσειας ζωής 10 περίπου χρόνια. Η βιοδιαθεσιμότητα της
αλενδρονάτης επηρρεάζεται από την λήψη τροφής και ροφημάτων εκτός νερού. Για τον
λόγο αυτό πρέπει να λαμβάνεται μισή ώρα προ του πρώτου γεύματος ή ροφήματος ή
άλλου φαρμάκου.
Δεν υπάρχουν στοιχεία ότι η αλενδρονάτη μεταβολίζεται. Περίπου ποσοστό 50%
αποβάλλεται από τα ούρα ανέπαφο, σε 72 ώρες μετά την χορήγηση.
4. Χρήση –Δόση
Χορηγείται για την θεραπεία της μετεμμηνοπαυσιακής οστεοπόρωσης υπο μορφή
δισκίων σε δόση 70 mg μια φορά την εβδομάδα.

ΚΕΦΑΛΑΙΟ 3
60
ΙΙ. ΔΗΛΗΤΗΡΙΑΣΕΙΣ ΑΠΟ ΜΕΤΑΛΛΑ-ΑΝΤΙΔΟΤΑ
Μέταλλα τα οποία δεν είναι απαραίτητα, μπορούν να απορροφηθούν από τον
οργανισμό και να εισέλθουν στη κυκλοφορία προκαλώντας βλάβες αντιστρεπτές ή μη.
Επίσης, διαταραχές στον μεταβολισμό μπορεί να προκαλέσουν συσσώρευση ενδογενών ή
απαραίτητων μετάλλων σε συγκεντρώσεις μεγαλύτερες της ωφέλιμης για τον οργανισμό.
Και οι δυο παραπάνω καταστάσεις αντιμετωπίζονται θεραπευτικά με τη χορήγηση
φαρμακευτικών σκευασμάτων, τα οποία καλούνται αντίδοτα. Τα αντίδοτα είναι χηλικοί
συναρμοτές οι οποίοι δεσμεύουν ισχυρά τα μέταλλα και τα απομακρύνουν από τον
οργανισμό.
1. Ασθένεις οφειλόμενες στα επίπεδα σιδήρου
Ομοιόσταση του σιδήρου. Ο σίδηρος αποτελεί ένα από τα πιο σημαντικά μέταλλα του
οργανισμού. Από τα πέντε περίπου γραμμάρια σιδήρου στον άνθρωπο, περίπου το 65%
είναι δεσμευμένο στην αιμογλοβίνη, 10% απαρτίζει την μυογλοβίνη, τα κυτοχρώματα και
τα μεταλλοένζυμα του σιδήρου ενώ το 25% βρίσκεται στις αποθήκες του σιδήρου, την
φερριτίνη και την αιμοσιδερίνη. Η φερριτίνη είναι μια πρωτείνη υψηλής χωρητικότητας σε
σίδηρο (4500 άτομα σιδήρου ανά μόριο) και βρίσκεται κυρίως στο ήπαρ αλλά και σε
άλλους ιστούς. Μια άλλη πρωτεΐνη χαμηλής χωρητικότας σε σίδηρο είναι η τρανσφερρίνη
(2 άτομα σιδήρου ανά μόριο) και μεταφέρει τον σίδηρο στο πλάσμα.
Ο σίδηρος παραλαμβάνεται από την τροφή. Στις τροφές περιέχεται ως ανόργανο
συστατικό με τη μορφή αλάτων τρισθενούς σιδήρου ή στις οργανικές τροφές περιέχεται με
τη μορφή της αίμης. Στο όξινο περβάλλον του στομάχου τα άλατα του σιδήρου
διαλυτοποιούνται και στη συνέχεια στον εντερικό αυλό ανάγονται σε δισθενή σίδηρο. Με
αυτή τη μορφή μεταφέρονται στα επιθηλικά κύτταρα του εντέρου μέσω των μεταφορέων
των δισθενών μετάλλων (DMT1). Ο σίδηρος της αίμης μεταφέρεται μεσω διαφορετικού
μεταφορέα. Στη συνέχεια ο σίδηρος περνά στην κυκλοφορία μέσω της πρωτεΐνης
μεταφοράς (ferroportin 1) αφού προηγουμένως οξειδωθεί σε τρισθενή σίδηρο. Στο πλάσμα
μεταφέρεται με την τρανσφερρίνη στους διάφορους ιστούς. Όλο αυτό το σύστημα
μεταφοράς και αξιοποίησης του σιδήρου αποσκοπεί στην εκμετάλλευση του σιδήρου για
τις ανάγκες του οργανισμού αλλά επιπλέον προφυλλάσσει τον οργανισμό από τις
βλαπτικές δράσεις του ελεύθερου, μη-δεσμευμένου σιδήρου.
Παθολογικές καταστάσεις που οδηγούν σε υψηλά επίπεδα σιδήρου

ΧΡΗΣΗ ΣΥΝΑΡΜΟΤΩΝ ΣΤΗ ΘΕΡΑΠΕΙΑ
61
Η αιμοχρωμάτωση είναι μία κληρονομική νόσος που χαρακτηρίζεται από αύξηση των
επιπέδων του σιδήρου στον οργανισμό και αυξημένη εναπόθεσή του στα παρεγχυματικά
όργανα (ήπαρ, πάγκρεας, καρδιά). Είναι η πιο συχνή αυτοσωματική υπολειπόμενη
γενετική διαταραχή και η πιο συχνή κληρονομική ηπατοπάθεια στη λευκή φυλή με
συχνότητα ομοζυγωτών στην Ευρώπη 1:300 άτομα. Αντιμετωπίζεται θεραπευτικά με
αφαιμάξεις καθώς και με χρήση αντιδότων.
Στην ασερουλοπλασμιναιμία παρατηρείται έλλειψη δραστικότητας του ενζύμου της
οξειδάσης του σιδήρου του πλάσματος (plasma ferroxidase, ceruloplasmin) η οποία
προκαλείται είτε από ελαττωματικό γονίδιο του ενζύμου αυτού (σπάνια αυτοσωμική
υπολειπόμενη κληρονομική νόσος), είτε ως αποτέλεσμα της νόσου του Wilson (κατά την
οποία παρατηρούνται χαμηλά επίπεδα χαλκού πλάσματος) γιατί περιέχει στο ενεργό του
κέντρο χαλκό. Το αποτέλεσμα της νόσου αυτής είναι η σωσσώρευση του σιδήρου στο
ήπαρ κλπ.
Η β-θαλασσαιμία καθώς και η δρεπανοκυτταρική αναιμία είναι αυτοσωμικές
υπολειπόμενες γενετικές διαταραχές κατά τις οποίες παρατηρούνται ανωμαλίες στα
γονίδια των σφαιρινών της αιμοσφαιρίνης. Τα άτομα που πάσχουν από τις παθήσεις αυτές
κάνουν συχνές μεταγγίσεις αίματος, με αποτέλεσμα να προκαλείται δευτερογενής
υπερφόρτωση σιδήρου, και για την αντιμετώπισης της τελευταίας χορηγούνται αντίδοτα.
Άλλες παθήσεις που οδηγούν σε υπερφόρτωση σιδήρου είναι και η αιμολυτική ανιαμία.
2. Ασθένειες οφειλόμενες στα επίπεδα χαλκού
Ο χαλκός είναι ένα απαραίτητο μέταλλο για τον οργανισμό και συμμετέχει σε
σημαντικά ενζυμικά συστήματα. Προσλαμβάνεται από τα εντεροκύτταρα μέσω του
μεταφορέα των δισθενών μετάλλων (DMT1) καθώς και του ειδικού μεταφορέα του
χαλκού (Ι) (CTr1) και στη συνέχεια μεταφέρεται στους ιστούς μέσω των ειδικών
μεταφορέων με δράση ΑΤΡάσης (ΑΤΡ7Α, ΑΤΡ7Β). Στον οργανισμό δεν βρίσκεται ως
ελεύθερο κατιόν αλλά πάντα συναρμοσμένος με πρωτεΐνες. Στο πλάσμα είναι
συνδεδεμένος με την σερουλοπλασμίνη (90%) και την αλβουμίνη (5%), ενώ στο ήπαρ και
στους νεφρούς με την μεταλλοθειονίνη. Ο χαλκός εισέρχεται στο εσωτερικό των ηπατικών
κυττάρων με τη μορφή μονοσθενούς χαλκού μέσω μιάς μεταφέρουσας πρωτεΐνης της
κυτταρικής μεμβράνης. Στο εσωτερικό των κυττάρων, ο χαλκός συνδέεται με άλλες
μεταφέρουσες πρωτεΐνες (χαλκοσαπερονίνες). Με τη βοήθεια αυτών των πρωτεϊνών

ΚΕΦΑΛΑΙΟ 3
62
οδηγείται στα διάφορα υποκυτταρικά οργανίδια όπου παραλαμβάνεται από άλλες
χαλκοπρωτεΐνες.
α) Αυξημένη συγκέντρωση χαλκού. Η πρωτεΐνη WDP (Wilson disease protein)
είναι μία πρωτεΐνη της μεταφοράς του χαλκού στο σύστημα Golgie των ηπατοκυττάρων,
που έγινε γνωστή γιατί συνδέθηκε με την ασθένεια Wilson. Στην ασθένεια Wilson, η
πρωτεΐνη αυτή είναι μεταλλαγμένη με αποτέλεσμα την συσσώρευση του χαλκού στα
ηπατοκύτταρα αλλά και στον εγκέφαλο. Η πάθηση αυτή αντιμετωπίζεται μέσω χορήγησης
αντιδότων του χαλκού για την διευκόλυνση της αποβολής του. Εναλλακτικά, μπορεί να
χορηγηθεί (NH4)2MoS4, ένωση που εμποδίζει την απορρόφηση του χαλκού ή και ΖnSO4
καθώς ο Zn προκαλεί τη σύνθεση μεταλλοθειονεΐνης, η οποία δεσμεύει τα ελεύθερα ιόντα
χαλκού.
β) Χαμηλά επίπεδα χαλκού. Μια άλλη γενετική διαταραχή, οδηγεί στην ασθένεια
Menkes, κατά την οποία η πρωτεΐνη ενδοκυτταρικής μεταφοράς του χαλκού (πρωτεΐνη
Menkes) είναι ελαττωματική κι έτσι υπάρχει μειωμένη απορρόφηση και συνεπώς έλλειψη
χαλκού στον οργανισμό. Η έλλειψη αυτή μπορεί να αντιμετωπιστεί με χορήγηση χαλκού
στον ασθενή. Η πιο καλά απορροφούμενη μορφή για το χαλκό έχει βρεθεί ότι είναι το
σύμπλοκο χαλκού – ιστιδίνης. Η δομή του συμπλόκου δεν είναι ακριβώς γνωστή, θεωρείται
όμως ότι η ιστιδίνη δρα σαν τριδραστικός συναρμοτής, (Ν,Ν,Ο) κι ότι δύο μόρια ιστιδίνης
συναρμόζονται με ένα ιόν δισθενούς χαλκού: σύμπλοκο τύπου [Cu(N,N,O)2].
3. Μέταλλα και ελεύθερες ρίζες
Κατά τη διάρκεια της αναπνευστικής αλυσίδας είναι δυνατόν να σχηματιστούν στο
κύτταρο ελεύθερες ρίζες οξυγόνου (ως ελεύθερη ρίζα ορίζεται ένα άτομο ή ιόν που
διαθέτει ένα ασύζευκτο ηλεκτρόνιο), καθώς κι άλλες δραστικές μορφές οξυγόνου (reactive
oxygen species, ROS). Άλλοι μηχανισμοί κατά τους οποίους παράγονται ελεύθερες ρίζες
λαμβάνουν χώρα στα λευκά κύτταρα στη διαδικασία της φυσικής άμυνας του οργανισμού.
Το υπεροξείδιο του υδρογόνου που σχηματίζεται στα μακροφάγα είναι πολύ τοξικό και
καταστρέφει τα βακτήρια. Παρακάτω φαίνονται μερικά τέτοια ιόντα και μόρια.
Σχήμα 2. Ηλεκτρονική διαμόρφωση δραστικών μορφών οξυγόνου-ελευθέρων ριζών.
ρίζα υπεροξειδίου
(·Ο2-)
υπεροξείδιο του
υδρογόνου (Η2Ο2) ρίζα υδροξυλίου
(·ΟΗ)
O O O O
H H
OH

ΧΡΗΣΗ ΣΥΝΑΡΜΟΤΩΝ ΣΤΗ ΘΕΡΑΠΕΙΑ
63
Η ρίζα του υπεροξειδίου (Ο2-) σχηματίζεται στα μιτοχόνδρια ως παραπροϊόν από
τη μεταφορά ηλεκτρονίων. Είναι πολύ βλαπτική για το κύτταρο γιατί έλκει ηλεκτρόνια
από γειτονικά μόρια και προκαλεί δομικές αλλαγές στη δομή τους ώστε δε μπορούν να
λειτουργήσουν φυσιολογικά, οδηγώντας έτσι στη καταστροφή του κυττάρου. Η
υπεροξειδική δισμουτάση είναι ένα μεταλλοένζυμο κι αποτελεί τον πρώτο επιδιορθωτικό
μηχανισμό αποτοξίνωσης του κυττάρου από τις ελεύθερες ρίζες. Συγκεκριμένα, τα ένζυμα
αυτά περιέχουν χαλκό, μαγγάνιο ή σίδηρο, μέταλλα τα οποία μπορούν να προκαλέσουν
την αναγωγή της ρίζας του υπεροξειδίου και να την απενεργοποιήσουν στο λιγότερο
δραστικό μόριο υπεροξείδιο του υδρογόνου. Οι αντιδράσεις που καταλύονται από την
υπεροξειδική δισμουτάση (Zn/Cu SOD, Mn SOD) φαίνονται παρακάτω:
·Ο2- + Μ
n+1 O2 + M
n+
·Ο2- + Μ
n+ + H
+ H2O2 + M
n+1
Το υπεροξείδιο του υδρογόνου είναι βλαπτικό, αλλά λιγότερο δραστικό από τη
ρίζα του υπεροξειδίου. Περαιτέρω το υπεροξείδιο του υδρογόνου μπορεί να
απενεργοποιηθεί σε υδατικό περιβάλλον από το ένζυμο καταλάση όπως φαίνεται στη
παρακάτω αντίδραση προς σχηματισμό νερού:
2Η2Ο2 2H2O + O2
Το οξυγόνο που σχηματίζεται, δημιουργεί τον αφρισμό που παρατηρείται κατά τη
χορήγηση υπεροξειδίου του υδρογόνου σε μια πληγή. Πολλά βακτήρια δεν έχουν
καταλάση και καταστρέφονται.
Σε λιπιδικό περιβάλλον, το κύτταρο μπορεί να χρησιμοποιήσει και το ένζυμο
υπεροξειδάση της γλουταθείονης που οδηγεί πάλι στο σχηματισμό νερού με ταυτόχρονη
οξείδωση της σουλφυδρυλομάδας σε δισουλφίδιο:
Η2Ο2 + R-SH H2O + R-S-S-R
Είναι δυνατόν όμως, εάν οι συγκεντρώσεις μετάλλων, όπως δισθενούς σιδήρου και
χαλκού, στα κύτταρα είναι υψηλές, να μετατρέψουν το υπεροξείδιο του υδρογόνου σε ρίζα
του υδροξυλίου που είναι επίσης πολύ δραστική:
Fe2+
+ H2O2 Fe3+
+ OH- + ·OH

ΚΕΦΑΛΑΙΟ 3
64
Η παραπάνω αντίδραση είναι γνωστή και ως αντίδραση Fenton και εμπλέκεται
στην εμφάνιση νευροεκφυλιστικών παθήσεων όπως Alzheimer’s και Parkinson.
Σχήμα 3. Ο μηχανισμός παραγωγής και απενεργοποίησης ελευθέρων ριζών στα κύτταρα αι η
εμπλοκή των μετάλλων.
4. Τοξικότητα Βαρέων Μετάλλων
Μόλυβδος (Pb)
Πηγές Έκθεσης-Απορρόφηση- Κατανομή
O μόλυβδος έχει ευρεία εφαρμογή στη βιομηχανία και οι ενώσεις του είναι
διαδεδομένες στο περιβάλλον. Ιδιαίτερα διαδεδομένη ήταν μέχρι το 1980 η χρήση
χρωμάτων με βάση το μόλυβδο1 για το βάψιμο των σπιτιών. Ο μόλυβδος μπορεί να
απορροφηθεί από το δέρμα, από τους πνεύμονες και από το ΓΕΣ. Από το δέρμα
1 Ανθρακικός μόλυβδος (2 PbCO3.Pb(OH)2) βάση για λευκό χρώμα (στουπέτσι), επιτεταρτοξείδιο του
μολύβδου (Pb3O4) αντιδιαβρωτικό μεταλλικών επιφανειών (μίνιο).
Καταλάση
Υπεροξειδάση της
Γλουταθειόνης
Αναγωγάση της
Γλουταθειόνης
Μιτοχόνδρια
Ρ 450 οξειδάσες
Δισμουτάση του
υπεροξειδίου
Fe, Cu, Co, Cr, Ni, V
Fe, Cu, Co, Cr, Ni, V

ΧΡΗΣΗ ΣΥΝΑΡΜΟΤΩΝ ΣΤΗ ΘΕΡΑΠΕΙΑ
65
απορροφούνται περισσότερο οι λιπόφιλες οργανικές ενώσεις του μολύβδου, όπως ο
τετρααιθυλο-μόλυβδος2, όχι όμως οι ανόργανες ενώσεις του. Ο μόλυβδος επίσης μπορεί να
εισέλθει στη κυκλοφορία από εισπνοή αιωρούμενων σωματιδίων. Οι ενώσεις του
μολύβδου που λαμβάνονται με κατάποση, έχουν μέτρια γαστρεντερική απορρόφηση στους
ενήλικες (5-10%), σε αντίθεση με τα παιδιά, όπου η απορρόφηση είναι πολύ μεγαλύτερη
(50%). Η πρόσληψη του μολύβδου από τον γαστρενετρικό σωλήνα επηρεάζεται από τις
διατροφικές ανάγκες του ατόμου, και επιπλέον εξαρτάται από την πρόσληψη σιδήρου,
ψευδαργύρου αλλά και ασβεστίου.
Ο μόλυβδος, όταν εισέρχεται στη κυκλοφορία του αίματος προσλαμβάνεται από τα
ερυθροκύτταρα και κατανέμεται στους μαλακούς ιστούς (νεφρό και ήπαρ). Το 95% του
μολύβδου συσσωρεύεται στα οστά, τα δόντια και τα μαλλιά ως φωσφορικό άλας.
Απελευθερώνεται κατά την οστεόλυση (εγκυμοσύνη, εμμηνόπαυση). Το 4% κατανέμεται
στον εγκέφαλο, στο ήπαρ, τους νεφρούς, και 1% στο αίμα. Ο μόλυβδος διεισδύει τον
πλακούντα. Ο ρυθμός απορρόφησης και κατανομής επηρεάζεται από τη λήψη από τις
τροφές και από τα αποθέματα φωσφορικών, ιόντων ασβεστίου και σιδήρου. Έτσι υψηλή
συγκέντρωση φωσφορικών (ΡΟ43-
) και ασβεστίου (Ca2+
) οδηγεί σε αποθήκευση του στα
οστά, ενώ χαμηλή συγκέντρωση φωσφορικών και υψηλή συγκέντρωση βιταμίνης D
οδηγεί την συσσώρευσή του στο μαλακό ιστό.
Ο χρόνος ημιζωής του μολύβδου στο αίμα είναι 30-60 ημέρες, στα οστά 20-30 έτη.
Μηχανισμοί τοξικότητας
Ο μόλυβδος είναι «μαλακό» οξύ κατά Lewis κι έτσι συναρμόζεται ισχυρά με τις
σουλφυδρυλικές ομάδες (- SH ομάδες) πρωτεϊνών, αναστέλλοντας με αυτό το τρόπο
σημαντικά ένζυμα. Η τοξικότητα του μολυβδου οφείλεται κυρίως στην παρεμπόδιση της
βιοσύνθεσης της αίμης που είναι βασικό συστατικό των αιμοπρωτεϊνών. Συγκεκριμένα
συνδέεται σταθερά με τις σουλφυδρυλικές ομάδες των ενζύμων δ-αμινολεβουλικής
συνθετάσης, δ-αμινολεβουλενικής αφυδρογονάσης, της οξειδάσης του κοπροπορφυρινογόνου
και της σιδηροχηλετάσης όπως φαίνεται στο σχήμα 1. Έτσι κατά τη δηλητηρίαση από
μόλυβδο παρατηρείται αυξημένη συγκέντρωση πρωτοπορφυρίνης στο αίμα κι εμφανίζεται
αναιμία. Επιπλέον, μια από τις τοξικές δράσεις του μολύβδου είναι η μίμηση των δράσεων
του ασβεστίου με αποτέλεσμα την τροποποίηση των μηχανισμών που εμπλέκεται το
ασβέστιο.
2 Ο τετρααιθυλο-μόλυβδος χρησιμοποιούνταν σα βελτιωτικό ανάφλεξης στα καύσιμα. Λόγω της
τοξικότητάς του έχει πλέον καταργηθεί στις περισσότερες χώρες του κόσμου.

ΚΕΦΑΛΑΙΟ 3
66
Διάγνωση
Η διάγνωση της δηλητηρίασης από μόλυβδο γίνεται από το ιστορικό της έκθεσης
κι από το προσδιορισμό των επιπέδων μολύβδου στο αίμα. Θεραπευτική αγωγή για την
αντιμετώπιση της δηλητηρίασης εφαρμόζεται στους ανηλίκους όταν τα επίπεδα μολύβδου
υπερβούν τα 25µg/dl. Στους ενήλικες, η δηλητηρίαση θεωρείται συμπτωματική σε
συγκεντρώσεις μεγαλύτερες των 50 µg/dl. Ποσά μεγαλύτερα από 120 µg/dl συνοδεύονται
από εγκεφαλοπάθεια.
Τα επίπεδα πρωτοπορφυρίνης στα ερυθροκύτταρα είναι συνήθως ανυψωμένα με
συγκέντρωση μολύβδου που υπερβαίνει τα 40 µg/dl, κι η απέκκριση μολύβδου στα ούρα
εμφανίζεται μεγαλύτερη των 80 µg/dl, συνοδευόμενη από τη παρουσία δ-
αμινολεβουλινικού οξέος. Στους ενήλικες πάντως πρέπει να λαμβάνεται υπ’όψη ότι η
ποσότητα μολύβδου στο αίμα δεν αντιπροσωπεύει όλη τη ποσότητα του μετάλλου που έχει
συσσωρευτεί στον οργανισμό, δεδομένου ότι το μεγαλύτερο ποσοστό αυτού βρίσκεται στα
οστά.

ΧΡΗΣΗ ΣΥΝΑΡΜΟΤΩΝ ΣΤΗ ΘΕΡΑΠΕΙΑ
67
Σχήμα 4. Τοξική επίδραση μολύβδου στη βιοσύνθεση της αίμης.
Συμπτώματα
Τα συμπτώματα ύστερα από δηλητηρίαση από μόλυβδο είναι μυικός πόνος,
παραισθήσεις, κόπωση, επιθετικότητα, εκνευρισμός, λήθαργος και κοιλιακός πόνος
Στην περίπτωση οξείας δηλητηρίασης παρουσιάζεται αρθραλγία, κόπωση, τρόμος,
κεφαλγία, έντονοι κοιλιακοί πόνοι, απώλεια βάρους, ναυτία, εμετός, δίψα,
διάρροια/δυσκοιλιότητα, αιμογλοβινουρία, κι ολιγουρία.
Τα συμπτώματα που παρουσιάζονται από χρόνια δηλητηρίαση στο γαστρεντερικό
σύστημα είναι κολικός (ναυτία, εμετός, κοιλιακός πόνος), στο νευρομυικό σύστημα
παράλυση και στο ΚΝΣ εγκεφαλοπάθεια (πονοκέφαλος, ζάλη, αϋπνία, οίδημα).
ΜΗΧΑΝΙΣΜΟΣ ΤΟΞΙΚΟΤΗΤΑΣ ΜΟΛΥΒΔΟΥ:
ΒΙΟΣΥΝΘΕΣΗ ΑΙΜΗΣ
Ηλεκτρυλο-Συνένζυμο Α + Γλυκίνη
δ-Aμινολεβουλινικό οξύ
δ-αμινολεβουλινική συνθετάση
δ-αμινολεβουλινική
αφυδρογονάση
Πορφοχολινογόνο
Ουροπορφυρινογόνο ΙΙΙ
Κοπροπορφυρινογόνο ΙΙΙ
Πρωτοπορφυρίνη ΙΧ
ΑΙΜΗ
Οξειδάση του
Κοπροπορφυρινογόνου
Σιδηροχηλετάση + Fe(II)
Απαμινάση του πορφοχολινογόνου
Συνθάση ουροπορφυρινογόνου
Αποκαρβοξυλάση του
ουροπορφυρινογόνου
Pb
Pb
Pb
Pb

ΚΕΦΑΛΑΙΟ 3
68
Θεραπεία
Η θεραπευτική αγωγή για την αντιμετώπιση της δηλητηρίασης είναι αρχικά η
απομάκρυνση από την έκθεση και στη συνέχεια η χορήγηση αντιδότων. Κατάλληλα
αντίδοτα είναι τα CaNa2EDTA, 2,3-διμερκαπρόλη (BAL), 2,3-διμερκαπτοηλεκτρικό οξύ
(DMSA) και D-πενικιλλαμίνη.
Υδράργυρος (Hg)
Απορρόφηση, βιοκατανομή
Στοιχειακός Υδράργυρος (Hg0) : Έχει ελάχιστη απορρόφηση από το γαστρεντερικό
σύστημα (ΓΕΣ). Οι ατμοί υδραργύρου όμως απορροφούνται πλήρως από τους πνεύμονες
και μεταφέρονται στα ερυθρά αιμοσφαίρια και στον εγκέφαλο. Στα ερυθρά αιμοσφαίρια, ο
στοιχειακός υδράργυρος οξειδώνεται από το ένζυμο καταλάση σε δισθενή υδράργυρο
Hg2+
.
Ανόργανος Υδράργυρος (άλατα του Hg2+
): Τα άλατα του υδραργύρου, όπως ο
χλωριούχος υδράργυρος (HgCl2), εμφανίζουν μέτρια απορρόφηση (~10%) από το ΓΕΣ και
κατανέμονται κυρίως στο αίμα και τους νεφρούς. Τα ιόντα υδραργύρου συναρμόζονται με
πυρηνόφιλα άτομα δότες όπως η θειόλη της γλουταθειόνης. Έχουν αυξημένη
νεφροτοξικότητα και προκαλούν νέκρωση του επιθηλίου των νεφρικών σωληναρίων.
Οργανικός υδράργυρος (CH3Hg+) : Οι οργανοϋδραργυρικές ενώσεις έχουν υψηλό
ποσοστό απορρόφησης από το ΓΕΣ > 90% . Στη φύση, συνήθως βρίσκονται με τη μορφή
του μεθυλο-υδραργύρου που σχηματίζεται από αναερόβια βακτήρια με οξείδωση του
στοιχειακού υδραργύρου. Τα ανόργανα άλατα υδραργύρου μπορούν επίσης να
μετατραπούν σε οργανοϋδραργυρικές ενώσεις (από τη χλωρίδα του εντέρου).
Ο μεθυλο-υδράργυρος συναρμόζεται επίσης ισχυρά με τις θειόλες.
Ο μεθυλο-υδράργυρος είναι μια πολυ ισχυρή νευροτοξίνη (ανώτατο ανεκτό όριο
0,1 μg/ kg/ημέρα). Λόγω του ότι είναι λιπόφιλη ένωση κατανέμεται σε όλους στους
ιστούς, διαπερνά το αιματοεγκεφαλικό φραγμό και τον πλακούντα. Έχει εντερική
απέκκριση. Συγκεντρώνεται στον εγκέφαλο, όπου προκαλεί καταστροφή συγκεκριμένων
περιοχών του εγκεφάλου, όπως τον φλοιό και τη παρεγκεφαλίδα. Έχει νευροτοξική δράση
στα έμβρυα. Ο βιολογικός χρόνος ημιζωής του μεθυλο-υδραργύρου είναι 74 ημέρες, αλλά
ο νευροεκφυλισμός που προκαλεί μπορεί να εμφανιστεί αργότερα.

ΧΡΗΣΗ ΣΥΝΑΡΜΟΤΩΝ ΣΤΗ ΘΕΡΑΠΕΙΑ
69
Μια άλλη οργανοϋδραργυρική ένωση είναι ο αιθυλο-υδράργυρος (EtHg+) που
αποτελεί προϊόν μεταβολισμού του Thiomerosal, αντιμικροβιακού φαρμάκου του
υδραργύρου που χρησιμοποιείται στα εμβόλια ως συντηρητικό.
Πηγές έκθεσης
Οι κυριότερες πηγές έκθεσης στο περιβάλλον προέρχονται από τη βιομηχανία
πλαστικών και ηλεκτρονικών. Οι ατμοί υδραργύρου στην ατμόσφαιρα μετατρέπονται από
το όζον σε δισθενή υδράργυρο.
Επιπλέον, ενώσεις υδραργύρου χρησιμοποιούνται στη γεωργία με τη χρήση
μυκητοκτόνων, καθώς επίσης στην οδοντιατρική (γέφυρες).
Μηχανισμοί τοξικής δράσης
Τα ιόντα υδραργύρου ως μαλακά οξέα συναρμόζονται πολύ σταθερά με μαλακούς
δότες όπως θειόλες αλλά και ιμινικό άζωτο. Τέτοια άτομα δότες υπάρχουν σε πολλά
βιολογικά μόρια, έτσι η τοξική δράση του υδραργύρου οφείλεται στις σταθερές ενώσεις
συναρμογής που σχηματίζει στον οργανισμό.
Σε περίπτωση κατάποσης, προκαλεί στο ΓΕΣ κατακρήμνιση πρωτεϊνών και
καταστροφή των μεμβρανών του βλεννογόνου. Τα άλατα υδραργύρου έχουν κυρίως
νεφρική απέκκριση και μπορούν να προκαλέσουν νέκρωση επιθηλίου των νεφρικών
σωληναρίων.
Γενικά τα οργανικά άλατα του υδραργύρου, λόγω της μεγάλης λιποφιλικότητάς
τους διαπερνούν τις κυτταρικές μεμβράνες και συνδέονται σταθερά με ένζυμα που φέρουν
σουλφυδρυλικές ομάδες (- SH) αναστέλλοντας τη δράσης τους.
Συμπτώματα
Τα ανόργανα άλατα του υδραργύρου επιδρούν κυρίως στο ΓΕΣ όπου εμφανίζεται
εκφυλισμός του βλεννογόνου· γαστρεντερικοί πόνοι, έμετος, διούρηση, αναιμία,
COO-Na+
S
Hg
COO-Na+
SH+Hg
+
Thiomerosal

ΚΕΦΑΛΑΙΟ 3
70
νεφροτοξικότητα. Επιπλέον μυικός τρόμος, σπασμοί, απώλεια μνήμης, κατάθλιψη,
οξυθυμία και πτυαλισμός.
Οι οργανικές ενώσεις του υδραργύρου έχουν τοξικές επιδράσεις κυρίως στο ΚΝΣ,
οι οποίες περιλαμβάνουν διαταραχή ακοής-όρασης, εξασθένιση των μυων, τρόμο και
πνευματική κατάπτωση.
Θεραπεία
Η θεραπευτική αγωγή για την αντιμετώπιση της δηλητηρίασης είναι αρχικά η
απομάκρυνση από την έκθεση και στη συνέχεια η χορήγηση αντιδότων. Κατάλληλα
αντίδοτα που μπορούν να χρησιμοποιηθούν για επίπεδα Hg(0) και Hg2+
μεγαλύτερα των 4
µg/dl είναι η 2.3-διμερκαπρόλη (bal), η D-πενικιλλαμίνη, και πιο αποτελεσματικά, η Ν-
ακετυλο-D-πενικιλλαμίνη. Για το μεθυλο-Hg κατάλληλα αντίδοτα είναι επίσης το DMSA,
DMPS.
Αρσενικό, (As3+
, As5+
)
Πηγές Έκθεσης-Απορρόφηση- Κατανομή
Η έκθεση σε αρσενικό μπορεί να προέρχεται από το νερό των πηγών και τα
τρόφιμα, καθώς κι από τη μόλυνση του περιβάλλοντος λόγω χρήσης του αρσενικού στη
βιομηχανία (παραπροϊόν σύντηξης μεταλλευμάτων, χρήση AsGa στους ημιαγωγούς).
Επιπλέον, γίνεται χρήση αρσενικού σε ζιζανιοκτόνα και φυτοφάρμακα από τη γεωργία.
Τοξικοί επίσης είναι οι ατμοί και η σκόνη του αρσενικού. Οι οργανικές κι οι ανόργανες
ενώσεις των As3+
, As5+
παρουσιάζουν υψηλό ποσοστό απορρόφησης από το ΓΕΣ > 90%.
Απορρόφηση του αρσενικού μπορεί να γίνει και με εισπνοή κι η πρόσληψη εξαρτάται από
το μέγεθος των σωματιδίων.
Το αρσενικό συσσωρεύεταιι σε πνεύμονες, καρδιά, νεφρούς, ήπαρ, μυς και νευρικό
ιστό, καθώς και στο δέρμα, τα νύχια και τα μαλλιά.
Ο χρόνος ημιζωής του στον οργανισμό είναι 7 έως 10 ώρες.
Μηχανισμοί τοξικής δράσης
α) Τα αλογονίδια των άλκυλο και διάλκυλο αρσινών (RAsCl2, R2AsCl)3 είναι
ιδιαίτερα τοξικές ενώσεις για τον οργανισμό και μπορεί να προκαλέσουν διάρρηξη των
μεμβρανών του δέρματος, του βλεννογόνου και των κυττάρων. Οι ενώσεις αυτές είναι
3 Η 2-χλώροβινυλοδιχλωροαρσίνη (ClCH=CH-AsCl2) γνωστή όπως «λεβιζίτης» είναι ένα πολεμικό αέριο
που προκαλεί πληγές στο δέρμα κι έντονο πόνο στο λαιμό και στο στήθος.

ΧΡΗΣΗ ΣΥΝΑΡΜΟΤΩΝ ΣΤΗ ΘΕΡΑΠΕΙΑ
71
λιπόφιλες, επομένως εισέρχονται βαθιά στη μεμβράνη. Επειδή ο δεσμός As-Cl υδρολύεται
αργά, απελευθερώνεται HCl σύμφωνα με την αντίδραση:
RAsCl2 + 2H2O RAs(OH)2 + 2 HCl
κι η έκλυση υδροχλωρίου προκαλεί τη καταστροφή της μεμβράνης, οδηγώντας τελικά σε
καταστροφή των επιθηλίων των τριχοειδών αγγείων, με συνέπεια αυξημένη αγγειακή
διαπερατότητα και αγγειοδιάλυση.
β) Επίσης τα αλογονίδια των μονοαλκυλοαρσινών εισέρχονται στο εσωτερικό των
κυττάρων και δεσμεύονται ισχυρά από τις σουλφυδρυλικές ομάδες (-SH) των πρωτεϊνών
οδηγώντας σε αναστολή των ενζύμων στα οποία αυτές συμμετέχουν:
RAsCl2 + 2HSR΄ RAs(SR΄)2 + 2 HCl
Ιδιαίτερα με 1,2-διθειόλες ή με 1,3-διθειόλες σχηματίζουν σταθερούς διθειο-
κυκλοπεντανικούς και κυκλοεξανικούς δακτυλίους αντίστοιχα. Αυτές οι αντιδράσεις
μπορεί να λάβουν χώρα με θειόλες των ενζύμων, όπως για παράδειγμα η αντίδραση
αλκυλοαρσινών με το συνένζυμο λιποϊκό οξύ του ενζύμου πυροσταφυλικής
αφυδρογονάσης, που όπως φαίνεται στο Σχήμα 2 σχηματίζει με διθειο-κυκλοεξανικό
δακτύλιο με το αρσενικό, μέσω της 1,3-διθειόλης που διαθέτει. Οι διαλκυλοαρσίνες δε
σχηματίζουν τόσο σταθερές ενώσεις, γιατί δε σχηματίζεται δακτύλιος που επιφέρει
σταθερότητα στην ένωση. Η διμερκαπρόλη αντιδρά με όμοιο τρόπο με τις ενώσεις του
αρσενικού (βλ. σελ. 70).
γ) Επιπλέον το αρσενικικό οξύ (H3AsO4) προκαλεί αναστολή της αναερόβιας και
οξειδωτικής φωσφορυλίωσης καθώς αντικαθιστά τα PO43-
στη σύνθεση ATP. Οι εστέρες
του αρσενικικού οξέος, (RO)(HO)2As=O, (RO)2(HO)As=O, (RO)3As=O, υδρολύονται πιο
εύκολα από τους εστέρες του φωσφορικού οξέος. Έτσι, λόγω ομοιότητας το αρσενικικό
οξύ μπορεί να δεσμευτεί στο ένζυμο της γλυκολυτικής πορείας, γλυκοκινάση, που
προκαλεί τη φωσφορυλίωση της γλυκόζης σε 6-φωσφορική γλυκόζη. Όμως η αρσενο-
γλυκόζη θα υδρολυθεί κι έτσι η γλυκόζη δε μπορεί να μεταβολιστεί περαιτέρω. Παρόμοιοι
μηχανισμοί λαμβάνουν χώρα και σε άλλα ενζυμικά συστήματα.
Συμπτώματα
Συμπτώματα οξείας δηλητηρίασης από αρσενικό είναι η καταστροφή του
βλεννογόνου, πυρετός, γαστρεντερικός πόνος, ανορεξία.
Συμπτώματα χρόνιας δηλητηρίασης είναι αδυναμία, ηπατομεγαλία (ίκτερος >
κίρρωση), μελάνωση, αρρυθμίες, περιφερική νευροπάθεια, περιφερική αγγειακή νόσος.

ΚΕΦΑΛΑΙΟ 3
72
Το αρσενικό ενοχοποιείται και για καρκινογένεση όπως αγγειοσάρκωμα ήπατος,
καρκίνος δέρματος και πνευμόνων.
Διάγνωση- Θεραπεία
Η διάγνωση δηλητηρίασης από αρσενικό γίνεται με λήψη του ιστορικού έκθεσης
και με ανίχνευση των επιπέδων του αρσενικού στο αίμα και στα ούρα. Η χρόνια έκθεση
σε αρσενικό μπορεί να διαγνωστεί κι από τα επίπεδα του αρσενικού στα μαλλιά και στα
νύχια.
Οι πρώτες βοήθειες στα επείγοντα περιστατικά οξείας δηλητηρίασης είναι η
αντικατάσταση ηλεκτρολυτών, χορήγηση υγρών και στήριξη της πίεσης του αίματος. Στη
περίπτωση χρόνιας δηλητηρίασης γίνεται χορήγηση αντιδότων όπως, πενικιλλαμίνης
χωρίς διάλυση, διμερκαπτοηλεκτρικού οξέος (DMSA), διμερκαπτοπροπανοσουλφονικού
οξέος (DMPS) και διμερκαπρόλης (BAL).
Εάν η δηλητηρίαση έχει προκληθεί από αέρια αρσινών (AsH3) πρέπει να γίνει
μετάγγιση του αίματος (σε αυτή τη περίπτωση τα αντίδοτα δεν είναι αποτελεσματικά).
5. Αντίδοτα
Οι ενώσεις αυτές σχηματίζουν υδατοδιαλυτά σύμπλοκα με τα βαρέα μέταλλα, τα
οποία στην συνέχεια απομακρύνονται από το αίμα και αποβάλλονται κυρίως απο τους
νεφρούς, σε μορφή λιγότερο τοξική. Ορισμένες φορές απεκκρίνονται δια της χολής και
ανευρίσκονται στα κόπρανα. Κατά την οξεία δηλητηρίαση, ο χρόνος αντιμετώπισης είναι
κρίσιμος. Συνήθως για την αντιμετώπιση τους, χορηγούνται μεγάλες ποσότητες
συναρμοτών, οπότε υπάρχει μια ταχεία μεταφορά των ενώσεων συναρμογής που
σχηματίζονται στούς νεφρούς, με κίνδυνο νεφροτοξικότητα. Κατά την χορήγηση των
συναρμοτών επομένως, η διάλυση είναι απαραίτητη. Εάν η θεραπεία αρχίσει αργά, τότε οι
βλάβες καθίστανται μη αντιστρεπτές.
Οι συναρμοτές που χρησιμοποιούνται για την αντιμετώπιση των δηλητηριάσεων με
βαρέα μέταλλα, είναι συνήθως υδατοδιαλυτές ενώσεις, χημικά σταθερές. Οι συναρμοτές
αυτοί πρέπει να πληρούν τις παρακάτω προϋποθέσεις:
Να είναι ειδικοί για το συγκεριμένο μέταλλο του οποίου η απομάκρυνση του από
τον οργανισμό επιδιώκεται.
Να μην διαταράσσουν κατά το δυνατό άλλα μέταλλα απαραίτητα στον οργανισμό.
Η μέση θανατηφόρος δόση LD50 να είναι μεγαλύτερη του 400 mg/Kg βάρους.

ΧΡΗΣΗ ΣΥΝΑΡΜΟΤΩΝ ΣΤΗ ΘΕΡΑΠΕΙΑ
73
Nα παρέχουν σταθερές χηλικές ενώσεις με το μέταλλο (δύο ή περισσότεροι
δακτύλιοι συναρμογής).
Να παρέχουν χηλικές ενώσεις με το μέταλλο διαλυτές στο νερό.
Οι χηλικές ενώσεις που σχηματίζονται, να είναι λιγότερο τοξικές απο το μέταλλο.
Οι ενώσεις συναρμογής που προκύπτουν να απεκκρίνονται από τα συστήματα
απέκκρισης, χωρίς να προκαλούν βλάβες σε αυτά.
Να μην υφίστανται στον οργανισμό περαιτέρω μεταβολισμό.
Στερεοχημικές παρεμποδίσεις πρέπει να λαμβάνονται υπόψη.
Δεσφερροξαμίνη, Δεφερροξαμίνη (Μεθανοσουλφονική)
Desferroxamine, Deferroxamine (mesylate)
Η δεφερροξαμίνη λαμβάνεται από καλλιέργειες του μικροοργανισμού
Streptomyces pilosus με τη μορφή συμπλόκου με τρισθενή σίδηρο,ή συνθετικά.
Ιδιότητες
Η δεσφερροξαμίνη σχηματίζει λευκούς κρυστάλλους, πολύ διαλυτούς στο νερό.
Για την ανακρυστάλλωσή χρησιμοποιείται υδατικό διάλυμα αλκοόλης. Υδατικό διάλυμα
δεφερροξαμίνης είναι σταθερό σε θερμοκρασία δωματίου για δύο εβδομάδες.
Μηχανισμός δράσης-Χρήσεις
Η δεφερροξαμίνη σχηματίζει σταθερό σύμπλοκο με τον Fe+++
και μπορεί να
χρησιμοποιηθεί για την απομάκρυνσή του από τον οργανισμό. Συναρμόζεται με το σίδηρο

ΚΕΦΑΛΑΙΟ 3
74
μέσω των ομάδων οξυγόνου 3 αμιδίων και 3 οξιμών. Η δεφερροξαμίνη μπορεί να
αποσπάσει τον Fe+++
που είναι αποθηκευμένος με τη μορφή φερριτίνης και σε μικρότερο
βαθμό με τη μορφή αιμοσιδηρίνης. Η δυνατότητα απόσπασης Fe+++
από την
τρανσφερρίνη είναι πολύ μικρή, ενώ δεν μπορεί να αποσπάσει σίδηρο συνδεδεμένο με την
αιμοσφαιρίνη ή τα κυττοχρώματα. Η δεφερροξαμίνη ενώνεται με τον Fe+++
και σχηματίζει
οκταεδρικό σύμπλοκο με αριθμό συναρμογής 6 και πολύ υψηλή σταθερά σταθερότητας
(logK=31). Η αναλογία δεφερροξαμίνης/σιδήρου σε mg είναι 100/8.5. Πλεονέκτημα της
δεφερροξαμίνης θωρείται ο σχηματισμός πολύ ασταθών συμπλόκων με το ασβέστιο
(logK=2).
Σχήμα 5. Σχηματισμός συμπλόκου δεσφερροξαμίνης με σίδηρο (ΙΙΙ).
Χρησιμοποιείται στη θεραπεία σοβαρής δηλητηρίασης από Fe3+
, υπερφόρτωση
από Fe που οφείλεται σε αιμόλυση προερχόμενη από φάρμακα, μεσογειακή αναιμία,
δρεπανοκυτταρική αναιμία, συχνές μεταγγίσεις ή βλάβες του μηχανισμού αποθήκευσης
σιδήρου.
Η δεφερροξαμίνη συνδέεται και με τον δισθενή σίδηρο, σχηματίζει όμως
σύμπλοκο πολύ μικρότερης σταθερότητας. Παρόλα αυτά έχει θετική επίδραση και σε
δηλητηριάσεις από Fe2+
. Η ευνοϊκή αυτή δράση πρέπει να οφείλεται στο γεγονός ότι μέρος
της τοξικότητας του Fe2+
οφείλεται στην οξείδωσή του σε Fe3+
. Η χορήγηση ασκορβικού
οξέος αυξάνει την αποτελεσματικότητα της δεφερροξαμίνης. Η απομάκρυνση του
Fe2+
πιθανώς πραγματοποιείται μέσω οξείδωσής του σε Fe3+
και απομάκρυνση του
παραγόμενου τρισθενούς σιδήρου.
Δεφερροξαμίνη έχει χρησιμοποιηθεί και για τη δέσμευση Al σε ασθενείς που
υφίστανται αιμοκάθαρση.

ΧΡΗΣΗ ΣΥΝΑΡΜΟΤΩΝ ΣΤΗ ΘΕΡΑΠΕΙΑ
75
Μορφή - Τρόπος χορήγησης – Δοσολογία
Η δεφερροξαμίνη χορηγείται συνήθως παρεντερικά. Σε σοβαρή δηλητηρίαση
(συγκεντρώσεις σιδήρου στον ορό μεγαλύτερες από 500 μg/dL) προτιμάται η ενδοφλέβια
έγχυση. Χορηγούνται 10 – 15 mg δεφερροξαμίνης / Κg βάρους σώματος ανά ώρα με
σταθερή έγχυση. Γρηγορότεροι ρυθμοί έγχυσης έχουν αναφερθεί, αλλά συνδέονται με
πρόκληση υπότασης.
Σε λιγότερο σοβαρές καταστάσεις (σίδηρος ορού 350-500 μg/dL) η δεφερροξαμίνη
μπορεί να χορηγηθεί ενδομυικά σε μία δόση των 50 mg/kg βάρους σώματος με μέγιστη
δόση 1g. Υπόταση μπορεί να παρατηρηθεί και σε ενδομυική χορήγηση.
Σε χρόνιες καταστάσεις όπως στην περίπτωση θαλασσαιμίας συνιστάται η
ενδομυική χορήγηση 0.5 – 1.0 gr ημερησίως. Μπορεί ωστόσο να γίνει και συνεχής
υποδόρια χορήγηση 1-2 gr ημερησίως, όπως και ενδοφλέβια χορήγηση.
Όταν γίνεται μετάγγιση αίματος σε άτομα με θαλασσαιμία, συνιστάται η
ενδοφλέβια έγχυση 2 gr δεφερροξαμίνης με ρυθμό 15 mg/kg ανά ώρα, ταυτόχρονα με την
μετάγγιση, αλλά όχι από την ίδια φλέβα.
Τύχη στον οργανισμό
Η δεφερροξαμίνη απορροφάται πολύ λίγο μετά από λήψη από το στόμα.
Μεταβολίζεται από τα ένζυμα του πλάσματος αλλά ο μηχανισμός μεταβολισμού δεν είναι
γνωστός.
Τοξικότητα – ανεπιθύμητες ενέργειες – αντενδείξεις
Η δεφερροξαμίνη προκαλεί μια σειρά από αλλεργικά φαινόμενα μεταξύ των
οποίων εξανθήματα και αναφυλαξία. Άλλα συμπτώματα είναι δυσουρία, διάρροια,
πυρετός, κράμπες στα πόδια και ταχυκαρδία. Σπανιότερα αναφέρεται δημιουργία
καταρράκτη. Η δεφερροξαμίνη μπορεί να δημιουργήσει νευροτοξικότητα σε
παρατεταμένη θεραπεία με υψηλές δόσεις που εφαρμόζεται κυρίως στις περιπτώσεις
θαλασσαιμίας. Σε εφαρμογή υψηλών δόσεων μπορεί να παρατηρηθεί ταχύπνοια,
υποξυαιμία, πυρετός και εωσινοφιλία.
Η δεφερροξαμίνη δεν πρέπει να χορηγείται σε ασθενείς που πάσχουν από νεφρική
ανεπάρκεια ή ανουρία.

ΚΕΦΑΛΑΙΟ 3
76
Νεότεροι συναρμοτές για την υπερφόρτωση σιδήρου είναι και οι ακόλοθοι:
Δεφεριπρόνη, Deferiprone (1,2 διμεθυλο-3-υδροξυπυριδ-4-όνη)
Η σύνθεση της δεφεριπρόνης πραγματοποιείται με επίδραση μεθυλαμίνης σε μαλτόλη και
είναι μια κλασική αντίδραση παρασκευής πυριδόνης από πυρόνη, σύμφωνα με το
παρακάτω σχήμα:
O
O
OH
CH3
maltol
+ CH3NH2
N
O
OH
CH3
CH3
deferiprone
+ H2O
Ιδιότητες: Είναι λευκό κρυσταλλικό προϊόν, διαλυτό σε μαθανόλη, νερό, λίγο διαλυτό σε
αιθανόλη και χλωροφόρμιο, κυρίως αδιάλυτο σε αιθέρα και ακετόνη καθώς και διαλυτό σε
ανόργανα οξέα και βάσεις.
Μηχανισμός δράσης
Η δεφεριπρόνη λειτουργεί ως διδραστικός συναρμοτής, μέσω του καρβονυλίου και του
φαινολικού οξυγόνου. Τρία μόρια δεφεριπρόνης συναρμόζονται με ένα ιόν Fe3+
.
Τρόπος Χορήγησης-Δοσολογία: Η δεφεριπρόνη χορηγείται per os. Η συνιστώμενη δόση
είναι 25 mg/kg ως 33 mg/kg τρεις φορές την ημέρα.
N
OO
H3C
N
O
O
CH3
N
O
O
CH3
Fe
Fe3+-(deferiprone)3

ΧΡΗΣΗ ΣΥΝΑΡΜΟΤΩΝ ΣΤΗ ΘΕΡΑΠΕΙΑ
77
Δεφεραζιρόξη, Deferasirox, Exjade (4-(3,5-δις(2-υδροξυφαινυλο)-1,2,4-τριαζολ-1-
υλο)βενζοϊκό οξύ)
N
NN
OH
HO
OHO
Σύνθεση: Παρασκευάζεται από συμπύκνωση σαλικυλικού οξέος, σαλικυλαμιδίου και 4-
υδραζινο-βενζοϊκού οξέος.
Μηχανισμός δράσης: Η δεφεραζιρόξη συνδέεται με τον Fe(III) μέσω των δυο φαινολικών
υδροξυλιών και του αρωματικού αζώτου του τριαζολικού δακτυλίου. Δύο μόρια
δεφεραζιρόξης συνδέονται με ενα ιόν Fe(III). Η δεφεραζιρόξη απομακρύνει τον σιδηρο
απο το αίμα, το ήπαρ και τα μυοκύτταρα. Το σύμπλοκο του σιδήρου-δεφεραζιρόξης
αποβάλλεται ηπατοχολικά. Το αντίδοτο λαμβάνεται από το στόμα.
Διμερκαπρόλη (Dimercaprol)
Χημική ονομασία: 2,3-διμερκαπτο-1-προπανόλη.
Συνώνυμα: Dicaptol, Sulfactin, Dithioglycerol, British anti-Lewisite, BAL.
CH2
CH
CH2HS
HS
HO
Σύνθεση
CH2OH
CH
CH2HS
HS
CH2OH
HC
CH2
Br2
CH2OH
CH
CH2Br
Br NaSH
Ιδιότητες
Άχρωμο, ελαιώδες υγρό με ισχυρή δυσάρεστη οσμή, ειδικό βάρος 1.242-1.244 και
σ.ζ. 66-68οC. Ένωση λίγο διαλυτή στο νερό (1g σε 20ml), διαλυτή σε αιθανόλη, αιθέρα,
βενζόλιο, μεθυλική αλκοόλη και οργανικούς διαλύτες. Διαλυτότητα σε φυτικά έλαια 1

ΚΕΦΑΛΑΙΟ 3
78
προς 18. Είναι ασταθής σε υδατικό διάλυμα γι αυτό και στα φαρμακευτικά σκευάσματα
βρίσκεται σε μορφή διαλύματος συνήθως σε αραχιδέλαιο.
Δίνει τις αντιδράσεις των μερκαπτανών και των πρωτοταγών αλκοολών.
Έλεγχος περιεκτικότητας
Βασίζεται στην οξείδωση των σουλφυδρυλικών ομάδων από I2.
CH2OH
HC
H2C SH
SH I2/ HCl
CH2OH
HC
H2C S
S
CH2OH
CH
CH2S
S+ HI
Μηχανισμός δράσης
Η διμερκαπρόλη χρησιμοποιείται στην αντιμετώπιση της δηλητηρίασης από βαρέα
μέταλλα και κυρίως από As, Au και Hg. Δευτερευόντως, η διμερκαπρόλη χρησιμοποιείται
σε δηλητηρίαση από αντιμόνιο (Sb), Θόριο (Th) και βισμούθιο (Bi) και σε συνδυασμό με
CaNa2EDTA σε δηλητηρίαση από μόλυβδο (Pb). (αντενδείκνυται σε περιπτώσεις
δηλητηρίασης από σίδηρο (Fe), κάδμιο (Cd), σελήνιο (Se) και ουράνιο (U)).
Η δράση της οφείλεται στο σχηματισμό χηλικού διθειο-κυκλοπεντανικού
συμπλόκου με διάφορα μέταλλα μέσω της 1,2 διθειόλης που περιέχει. Η χηλική ένωση
έχει μεγάλη θερμοδυναμική σταθερότητα και το σύμπλοκο παραμένει σταθερό στον
οργανισμό μέχρι την απέκκρισή του από αυτόν.
H πρώτη εφαρμογή της ήταν για την αντιμετώπιση προσβολής από το χημικό αέριο
λεβιζίτη (Lewisite), Cl2AsCΗ=CΗCl, που αποτελεί οργανομεταλλική ένωση του
αρσενικού. Όπως προαναφάρθηκε (βλ. σελ. 65) οι αλκυλοαρσίνες σχηματίζουν
διθειοκυκλοεξανικούς δακτυλίους με την 1,3 διθειόλη του λιποϊκού οξέος, σημαντικού
συνενζύμου της γλυκολυτικής πορείας.
Οι σουλφυδρυλικές ομάδες της διμερκαπρόλης ανταγωνίζονται τις σουλφυδριλικές
ομάδες του λιποϊκού οξέος για τη σύνδεση με το αρσενικό. Παρουσία περίσσειας
διμερκαπρόλης η ισορροπία της αντίδρασης αντικατάστασης μετατοπίζεται προς τον
σχηματισμό συμπλόκου με το αντίδοτο με αποτέλεσμα να ελευθερώνεται το λιποϊκό οξύ.

ΧΡΗΣΗ ΣΥΝΑΡΜΟΤΩΝ ΣΤΗ ΘΕΡΑΠΕΙΑ
79
As
R
S S
CH2OH
HS SH
CH2OH
S S
As
R
+ λιποϊκό οξύ
αρσενο-λιποϊκό οξύ
BAL
Η αντικατάσταση γίνεται με ενδιάμεσο σχηματισμό τετραεδρικού συμπλόκου, στο
οποίο η οργανομεταλλική ένωση του Αs συναρμόζεται τόσο με το λιποϊκό οξύ όσο και με
τη διμερκαπρόλη.
As
R
S S
CH2OH
HS SHAs
R
S S
CH2OHS
HS
Το υδροξύλιο της διμερκαπρόλης διευκολύνει την αποβολή της από τα ούρα. Η
σύνδεση της διμερκαπρόλης με το αρσενικό δεν ευνοείται σε όξινο περιβάλλον. Για να
αποφευχθεί η απελευθέρωση αρσενικού στους νεφρούς, χορηγείται ταυτόχρονα η
διμερκαπρόλη, με σκευάσματα που εξασφαλίζουν αλκαλικότητα στα ούρα.
Ανάλογα σύμπλοκα δημιουργούνται και κατά την αλληλεπίδραση της
διμερκαπρόλης με άλλα μεταλλικά ιόντα, όπως με τον Hg.
CH2OH
S S
Hg
CH2OH
S S
Hg
HOH2C
SS
Τρόπος χορήγησης – Δοσολογία
Η διμερκαπρόλη χορηγείται με τη μορφή διαλύματος σε αραχιδέλαιο (300mg/3ml),
με βαθιά ενδομυική ένεση. Δεν χορηγείται ποτέ ενδοφλέβια ή υποδόρια ούτε και από το
στόμα. Δίνεται σε δόσεις των 2.5-5mg/kg κάθε 4 ώρες την πρώτη μέρα, κάθε 4-5 ώρες τη
δεύτερη και κάθε 12 ώρες τις επόμενες εάν χρειαστεί.
Απορροφάται από το δέρμα, 3 mΜol (124 mg)/cm2 ανά ώρα, και είναι δυνατή η εφαρμογή
της στο δέρμα για τοπική αντιμετώπιση.
Η χορήγηση της διμερκαπρόλης είναι αποτελεσματικότερη όταν χορηγηθεί αμέσως
μετά την λήψη του μετάλλου. Αυτό συμβαίνει γιατί δεν έχει προκληθεί ακόμα σημαντική

ΚΕΦΑΛΑΙΟ 3
80
κυτταρική βλάβη, αλλά και διότι η δέσμευση του μετάλλου από τη διμερκαπρόλη, είναι
πολύ ευκολότερη πριν αυτό συνδεθεί με τα βιομόρια.
Τύχη στον οργανισμό
Μετά την ενδομυϊκή χορήγηση απορροφάται σχετικά εύκολα. Εξαιτίας της
λιποφιλικότητάς της εισέρχεται εύκολα στο εσωτερικό των κυττάρων. Οι μεγαλύτερες
συγκεντρώσεις διμερκαπρόλης παρατηρήθηκαν στο ήπαρ, τους νεφρούς και τον
εγκέφαλο. Η μέγιστη συγκέντρωση στα ούρα εμφανίζεται μετά από 30-60 min. Η
βιολογική ημιπερίοδος ζωής είναι μικρή και σε 4 ώρες έχει απομακρυνθεί. Η αποβολή της
γίνεται από τα ούρα και φαίνεται να σχετίζεται με σύνδεση με το γλυκουρονικό οξύ. Μετά
τη χορήγηση της διμερκαπρόλης παρατηρείται αύξηση του αποβαλλόμενου ποσού θείου
και γλυκουρονιδίων στα ούρα όχι όμως και του αιθερικού θείου.
Τοξικότητα – ανεπιθύμητες ενέργειες – αντενδείξεις
Η χορήγηση διμερκαπρόλης παρουσιάζει ανεπιθύμητες ενέργειες που εξαρτώνται
από τη δόση. Συνήθως εμφανίζεται αύξηση διαστολικής και συστολικής πίεσης μέχρι και
50 mm Hg, ταχυκαρδία, φαινόμενα που παρέρχονται σε 4 ώρες. Άλλα φαινόμενα είναι
ναυτία και σπανιότερα εμετός, πονοκέφαλος, αίσθημα καύσου στα χείλη το στόμα και τον
λάρυγγα, αίσθημα πνιγμονής και μερικές φορές πόνος στα χέρια το λαιμό και το θώρακα,
επιπεφυκίτιδα, βλεφαροσπασμός, δάκρυσμα, ριννόρροια, σιελόρροια, εφίδρωση στο
μέτωπο τα χέρια και αλλού, υπογάστριος πόνος και σπάνια άσηπτες οδυνηρές κύστες στο
σημείο της ένεσης.
Η διάσπαση του συμπλόκου μπορεί να οδηγήσει κάτω από ορισμένες συνθήκες σε
νεφρική βλάβη.
Η χρήση διμερκαπρόλης αντενδείκνυται σε περίπτωση ηπατικής βλάβης που δεν
οφείλεται στο μέταλλο ή οξείας νεφρικής ανεπάρκειας. Επίσης πρέπει να χορηγείται με
προσοχή σε υπερτασικά άτομα. Η διμερκαπρόλη μειώνει την αποτελεσματικότητα της
ινσουλίνης λόγω καταστροφής των δισουλφιδικών δεσμών.
Εξαιτίας της δυνατότητας εισόδου στον εγκέφαλο θεωρείται υπεύθυνη για την αυξημένη
συγκέντρωση As στον εγκέφαλο μετά από δηλητηρίαση από οργανικό αρσενικό.
Πιστεύεται επίσης ότι προκαλεί ανακατανομή βαρέων μετάλλων, όπως του Hg στον
εγκέφαλο και σε αυτό οφείλεται εν μέρει η τοξικότητά της.

ΧΡΗΣΗ ΣΥΝΑΡΜΟΤΩΝ ΣΤΗ ΘΕΡΑΠΕΙΑ
81
2,3-Διμερκαπτο-ηλεκτρικό οξύ
Συνώνυμα: meso-dimercaptosuccinic acid, succimer, chemet ή DMSA
Μηχανισμός δράσης - Χρήσεις
Το succimer είναι αντίδοτο, συγγενές της διμερκαπρόλης και σχηματίζει σταθερά
διθειο-κυκλοπεντανικά χηλικά σύμπλοκα με μέταλλα. Ωστόσο οι καρβοξυλικές ομάδες
που περιέχει, τροποποιούν τις ιδιότητες, την κατανομή της και την ικανότητα συναρμογής
της ένωσης. Χρησιμοποιείται για την αντιμετώπιση δηλητηριάσεων από Pb, Hg ή As.
HOOC CHHC COOH
S S
M Μ=μέταλλο
Επειδή είναι λιγότερο τοξικό από τη διμερκαπρόλη προτιμάται από αυτήν στην
αντιμετώπιση δηλητηριάσεων από As. Στην αντιμετώπιση δηλητηριάσεων από μόλυβδο
είναι ένα από τα πλέον χρησιμοποιούμενα αντίδοτα. Η τοξική δράση του μολύβδου
οφείλεται όπως και του Αs στη σύνδεσή του με τις σουλφυδρυλικές ομάδες των
πρωτεϊνών. Η κυριότερη επίδραση του Pb πιστεύεται ότι οφείλεται στην αναστολή
σύνθεσης της αίμης (βλ.σελ 61).
Ένα από τα επιθυμητά χαρακτηριστικά του succimer είναι ότι δεν κινητοποιεί
σημαντικά άλλα απαραίτητα μέταλλα στον οργανισμό όπως ο ψευδάργυρος, ο χαλκός και
ο σίδηρος.
Τρόπος χορήγησης – Δοσολογία
Σε αντίθεση με την διμερκαπρόλη το succimer χορηγείται από το στόμα με τη
μορφή κάψουλας (ΗΠΑ).
Η δοσολογία για την αντιμετώπιση δηλητηρίασης από μόλυβδο είναι 10 mg
succimer ανά Κg βάρους σώματος, κάθε οκτώ ώρες για πέντε ημέρες, για τους ενήλικες.
Η δοσολογία είναι η ίδια για παιδιά από 1-11 ετών. Μετά την πέμπτη ημέρα, η ίδια δόση
δίνεται κάθε 14 ώρες για 19 συνολικά ημέρες θεραπείας. Η χρήση του succimer έχει γίνει

ΚΕΦΑΛΑΙΟ 3
82
αποδεκτή στις Η.Π.Α. και για παιδιά κάτω του 1 έτους όταν τα επίπεδα του μολύβδου στο
αίμα ξεπερνούν τα 45 μg/dl. Η δοσολογία δεν είναι ορισμένη και καθορίζεται κάθε φορά
από τον γιατρό.
Τύχη στον οργανισμό
Στο αίμα το 95% του DMSA είναι δεσμευμένο στην αλβουμίνη. Το succimer μετά
την απορρόφησή του σχηματίζει δισουλφιδικούς δεσμούς με κυστεΐνη δίνοντας την ένωση
που φαίνεται παρακάτω:
COOH
HC
CH
COOH
S
S
NH2
CH
C
H2C
OH
O
S NH2
CH
C
H2C
OH
O
S
Το succimer απομακρύνει τον μόλυβδο από το αίμα σχηματίζοντας ένωση
συναρμογής η οποία απομακρύνεται από τα ούρα. Μέρος του συμπλόκου ελευθερώνεται
με τη χολή και ακολουθεί την ηπατοεντερική κυκλοφορία.
Τοξικότητα – ανεπιθύμητες ενέργειες - αντενδείξεις
Η τοξικότητα του succimer είναι πολύ χαμηλότερη της διμερκαπρόλης πιθανόν
εξαιτίας της σχετικά χαμηλότερης λιποφιλικότητας της ένωσης η οποία ελαχιστοποιεί την
εισαγωγή του στα κύτταρα. Κατά τη θεραπεία με succimer παρατηρείται παροδική
αύξηση των ηπατικών ενζύμων. Τα πιο συχνά συμπτώματα περιλαμβάνουν ναυτία, εμετό,
διάρροια και απώλεια όρεξης. Έχουν αναφερθεί επίσης εξανθήματα, τα οποία μπορεί να
επιβάλλουν διακοπτόμενη εφαρμογή της θεραπείας. Η χρήση του succimer μπορεί να
επιδεινώσει την κατάσταση σε ασθενείς με σοβαρή ηπατική βλάβη.
Δινάτριο άλας του αιθυλενοδιαμινοτετραοξικού οξέος, EDTA
Συνώνυμα: Disodium edetate, Endurate (Abbott)

ΧΡΗΣΗ ΣΥΝΑΡΜΟΤΩΝ ΣΤΗ ΘΕΡΑΠΕΙΑ
83
N N
CH2 -COO- +NaNa+ -OOC- H2C
CH2 -COOHHOOC- H2C
Σύνθεση
Το πρώτο στάδιο πραγματοποιείται με θέρμανση στους 20 οC για 10 min.
Ακολουθεί οξίνιση του παραγόμενου προϊόντος. Το παραγόμενο EDTA διαλύεται σε
νερό, προστίθενται δύο ισοδύναμα ΝαΟΗ και αφήνεται για κρυστάλλωση.
4 ClCH2-COOH + H2NCH2CH2NH2
Na2CO3
(Na+ -OOC-CH2)2NCH2CH2N(CH2-COO- +Na)2- NaCl
H+
(HOOC-CH2)2NCH2CH2N(CH2-COOH)2
2 NaOH
N N
CH2 -COO- +NaNa+ -OOC- H2C
CH2 -COOHHOOC- H2C
Ιδιότητες
Είναι λευκή κρυσταλλική σκόνη διαλυτή στο νερό. Τα υδατικά διαλύματα της
ένωσης έχουν pH 4.0 έως 6.0.
Μηχανισμός δράσης-Χρήσεις
Το δινάτριο άλας του ΕDΤΑ σχηματίζει υδατοδιαλυτά σύμπλοκα με διάφορα μέταλλα
(Η περιγραφή της συναρμογής του δίνεται παρακάτω στη παράγραφο για το CaNa2EDTA). Η
χορήγηση του δινάτριου άλατος του EDTA όπως και του ελεύθερου EDTA προκαλεί
σημαντική απώλεια του ασβεστίου του οργανισμού καθιστώντας το έτσι τοξικό. Για το
λόγο αυτό δεν μπορεί να χρησιμοποιηθεί ως αντίδοτο σε περιπτώσεις δηλητηριάσεων,
χρησιμοποιείται όμως σε περιπτώσεις υπερασβεσταιμίας για την μείωση των επιπέδων
ασβεστίου στο αίμα. Μπορεί να χρησιμοπιηθεί για παράδειγμα σε περιπτώσεις
εμφράγματος του μυοκαρδίου και καρδιακής αρρυθμίας όταν συνδέονται με υψηλά
επίπεδα ασβεστίου.

ΚΕΦΑΛΑΙΟ 3
84
Το EDTA χρησιμοποιείται επίσης ως αντιοξειδωτικό για την συντήρηση
φαρμάκων που οξειδώνονται παρουσία μεταλλικών ιόντων. Παράδειγμα τέτοιων
φαρμάκων αποτελούν η βιταμίνη ασκορβικό οξύ, η επινεφρίνη και η πενικιλλίνη.
Μορφή - Τρόπος χορήγησης – Δοσολογία
Το δινάτριο άλας του EDTA διατίθεται σε μορφή ενέσιμου διαλύματος με
συγκέντρωση 150 mg/ml. Στην πραγματικότητα το διάλυμα περιέχει μίγμα δινάτριου και
τρινάτριου άλατος λόγω της ρύθμισης του pH.Ο συνήθης τρόπος χορήγησης είναι με τη
μορφή ενδοφλέβιας έγχυσης.
Η συνήθης δοσολογία είναι 50 mg/kg βάρους σώματος. Το διάλυμα αραιώνεται σε
500 ml διαλύματος χλωριούχου νατρίου ή σε 5% δεξτρόζη και η έγχυση γίνεται μία φορά
την ημέρα και διαρκεί 3 – 4 ώρες. Η θεραπεία διαρκεί πέντε μέρες.
Τύχη στον οργανισμό
Το δινάτριο άλας του EDTA απορροφάται από το γαστρεντερικό σύστημα σε
ποσοστό 5-15%. Η παρουσία του στο γαστρεντερικό εμποδίζει την απορρόφηση του
ασβεστίου. Η απορρόφησή του από το δέρμα είναι πρακτικά μηδενική. Το
απορροφούμενο δινάτριο EDTA κατανέμεται σχεδόν αποκλειστικά στον εξωκυττάριο
χώρο. Ένα μικρό ποσοστό περνά στο εγκεφαλονωτιαίο υγρό αλλά αυτό δεν μεταβάλλει το
ποσοστό του ασβεστίου σε αυτό. Το EDTA δε μεταβολίζεται. Μετά την χορήγηση
δινάτριου άλατος του EDTA το 50% της ποσότητας που εισέρχεται στο πλάσμα,
αποβάλλεται στα ούρα εντός της πρώτης ώρας
Τοξικότητα – ανεπιθύμητες ενέργειες – αντενδείξεις
Ανεπιθύμητες ενέργειες από τη θεραπεία με δινάτριο EDTA μπορεί να είναι:
ναυτία, έμετος, διάρροια, πυρετός, κράμπες, ολιγουρία, πρωτεϊνουρία, νεφρική
ανεπάρκεια (πολύ σπάνια), δερματοπάθεια, θρομβοφλεβίτης, τετανία, υποκαλσιαιμία,
ανακοπή(σε περίπτωση γρήγορης ένεσης). Η χορήγηση δινάτριου άλατος του EDTA
αντενδείκνυται σε ασθενείς που πάσχουν από υποκαλσιαιμία, φυματίωση και νεφρική
ανεπάρκεια.

ΧΡΗΣΗ ΣΥΝΑΡΜΟΤΩΝ ΣΤΗ ΘΕΡΑΠΕΙΑ
85
Αιθυλενο-διαμινο-Ν,Ν’ -τετραοξικό-ασβέστιο-νάτριο
Συνώνυμα: CaNa2-EDTA, Calcium disodium Edetate, Calcium disodium Versenate,
edathamil.
Ca2+
N
O
N
O
CH2 -COO- +NaNa+ -OOC- H2C
O O
Σύνθεση
Το CaNa2-EDTA μπορεί να συντεθεί από το δινάτριο άλας του EDTA κατά την
αντίδραση:
Na2EDTACaCO3
CaNa2EDTA
Το ανθρακικό ασβέστιο που προστίθεται είναι λίγο περισσότερο από την ισοδύναμη
ποσότητα. Η προσθήκη σταματά όταν πάψει η έκλυση διοξειδίου του άνθρακα. Το προϊόν
διηθείται εν θερμώ και κρυσταλλώνεται.
Ιδιότητες
Το CaNa2EDTΑ είναι λευκή κρυσταλλική σκόνη, άοσμη, ελαφρά υγροσκοπική, με
ασθενή αλατώδη γεύση. Είναι σταθερό στον αέρα, πολύ υδατοδιαλυτό στο νερό. Το pH
του υδατικού διαλύματος είναι μεταξύ 6.5 και 8.0.
Έλεγχος περιεκτικότητας
Ο προσδιορισμός στηρίζεται στην ογκομέτρηση του αντίδοτου με νιτρικό μόλυβδο
και δείκτη πορτοκαλόχρουν της ξυλενόλης. Η ογκομέτρηση ολοκληρώνεται όταν το
χρώμα γίνει πορτοκαλέρυθρο.
Η ογκομέτρηση μπορεί να γίνει και με προσθήκη περίσσειας διαλύματος νιτρικού αργύρου
και ογκομέτρηση της περίσσειας με διάλυμα του μετά νατρίου άλατος του EDTA με
δείκτη πορτοκαλόχρουν της ξυλενόλης. Η ογκομέτρηση ολοκληρώνεται όταν το διάλυμα
γίνει κίτρινο.
Μηχανισμός δράσης-Χρήσεις
Το CaNa2-EDTA σχηματίζει ένωση συναρμογής με πολλά δισθενή και
τρισθενή μέταλλα με τον ίδιο τρόπο όπως και το Na2EDTA. Στα σύμπλοκα αυτά το EDTA

ΚΕΦΑΛΑΙΟ 3
86
συμμετέχει σχηματίζοντας δύο ημιπολικούς δεσμούς με δότες ηλεκτρονίων τα άτομα αζώτου
και τέσσερις ομοιοπολικούς δεσμούς με συμμετοχή των ατόμων οξυγόνου των τεσσάρων
καρβοξυλομάδων. Έτσι δρα σα εξαδραστικός συναρμοτής [Ν2Ο4] σχηματίζοντας πέντε
πενταμελείς δακτυλίους. Η σταθερότητα των συμπλόκων διαφέρει για τα διάφορα μέταλλα.
Παρακάτω δίνονται ορισμένα μεταλλικά ιόντα κατά ελαττούμενη σταθερά σταθερότητας
των συμπλόκων τους με EDTA. Σε παρένθεση δίνεται ο λογάριθμος της σταθεράς
σταθερότητας στους 25οC.
Fe+++
(25.0) > Hg++
(22.0) > Cu++
(19.0) > Ni++
(18.5) > Pb++
(18.0) > Zn++
(16.5) = Cd++
(16.5) > Co++
(16.3) > Al+++
(16.1) > Fe++
(14.5) > Mn++
(14.0) > Ca++
(11.0) > Mg++
(8.7)
> Sr++
(8.5) > Ba++
(8.0) > Ag+ (7.5)
Σχήμα 4. Δομή χηλικών ενώσεων μετάλλου με EDTA. Μ= Συνδεδεμένο μέταλλο.
Το CaNa2-EDTA κινητοποιεί στον οργανισμό όλα τα μέταλλα που μπορούν να
αντικαταστήσουν το ασβέστιο δίνοντας σύμπλοκο με μεγαλύτερη σταθερά σταθερότητας.
Το CaNa2-EDTA δεσμεύει επιτυχώς τον Pb2+
καθώς η σταθερά σταθερότητας του
συμπλόκου Pb2+
-ΕDTA είναι 107
φορές μεγαλύτερη από αυτήν του συμπλόκου με Ca-
EDTA. ΄Ετσι η κύρια κλινική χρήση του CaNa2-EDTA είναι η αντιμετώπιση
δηλητηριάσεων από Pb2+
. Το προκύπτον σύμπλοκο απομακρύνεται τελικά από τους
νεφρούς.
Παράλληλα με την εφαρμογή του στην αντιμετώπιση δηλητηριάσεων, το CaNa2-
EDTA μπορεί να χρησιμοποιηθεί και για τη διάγνωση δηλητηρίασης από Pb. Λίγο μετά τη
λήψη, παρατηρούνται αυξημένα ποσά Pb στα ούρα.

ΧΡΗΣΗ ΣΥΝΑΡΜΟΤΩΝ ΣΤΗ ΘΕΡΑΠΕΙΑ
87
Αν και το σύμπλοκο Hg2+
-EDTA έχει ακόμη μεγαλύτερη σταθερά σταθερότητας,
το CaNa2-EDTA δεν μπορεί να χρησιμοποιηθεί στην αντιμετώπιση δηλητηριάσεων από
Hg2+
για δύο κυρίως λόγους:α) Ο Hg2+
σχηματίζει πολύ σταθερές ενώσεις συναρμογής με
τις σουλφυδρυλικές ομάδες των βιομορίων με τα οποία συνδέεται και τα άτομα δότες Ν, Ο
του EDTA δεν μπορούν να ανταγωνιστούν τις θειόλες από τη θέση συναρμογής τους με
τον υδράργυρο β) ότι ο Hg2+
συγκεντρώνεται στο εσωτερικό των κυττάρων. Τόσο όμως το
CaNa2-EDTA όσο και το ελεύθερο EDTA δεν μπορούν να περάσουν την κυτταρική
μεμβράνη καθόσον είναι υδρόφιλα μόρια.
Μορφή - Τρόπος χορήγησης – Δοσολογία
Διατίθεται σε ενέσιμο διάλυμα, 180 – 220 mg της ένωσης ανά ml. Επίσης σε
μορφή δισκίων των 500 mg. Χορηγείται κυρίως με δύο τρόπους:
α) Με ενδοφλέβια έγχυση
Χορηγούνται 50 - 75 mg/kg βάρους του σώματος. Η ημερήσια δόση διαιρείται σε
δύο. Το διάλυμα έγχυσης περιέχει 1g της ένωσης σε 250 - 500 ml διαλύματος 5%
δεξτρόζης ή ισοτονικού διαλύματος χλωριούχου νατρίου. Η διάρκεια έγχυσης είναι
περίπου 1 ώρα. Η διάρκεια της θεραπείας είναι 3-5 ημέρες. Η θεραπεία μπορεί να
επαναληφθεί μετά την πάροδο 2 εβδομάδων. Στα παιδιά, η ημερήσια δόση ανέρχεται σε 35
mg/kg βάρους σώματος ή 850 mg/m2 επιφάνειας σώματος, ισότονου διαλύματος 0.2 –
0.1% .Η χορήγηση πρέπει να συνοδεύεται από έντονη διούρηση.
β) Με ενδομυϊκή χορήγηση
Χορηγούνται 50 - 75 mg/kg βάρους του σώματος. Επειδή η ενδομυϊκή ένεση είναι
εξαιρετικά επώδυνη, χορηγείται μαζί με αναλγητικό. Το διάλυμα περιέχει 1 g της ένωσης
σε 0.5% διαλύματος προκαΐνης. Η χορήγηση γίνεται σε δύο ημερήσιες δόσεις. Στα παιδιά,
η ημερήσια δόση ανέρχεται σε 35 mg/kg βάρους σώματος. Στις περιπτώσεις εγκεφαλικού
οιδήματος (Pb encephalopathy) και αυξημένης ενδοκρανιακής πίεσης η λήψη υγρών
αποφεύγεται και η χορήγηση γίνεται αποκλειστικά ενδομυϊκά.
γ) Χορήγηση από το στόμα
Η χορήγηση από το στόμα είναι δυνατή αλλά υπάρχει περίπτωση να επιδεινώσει
την κατάσταση. Η ένωση απορροφάται λίγο από το γαστρεντερικό σύστημα και είναι
πιθανόν να διευκολύνει την απορρόφηση του Pb.

ΚΕΦΑΛΑΙΟ 3
88
Τύχη στον οργανισμό
Το CaNa2-EDTA απορροφάται από το γαστρεντερικό πολύ λίγο, σε ποσοστό
περίπου 5%. Χορηγούμενο παρεντερικά απορροφάται καλά και περιορίζεται στον
εξωκυττάριο χώρο. Περίπου το 4.5% διαπερνά την κυτταρική μεμβράνη. Ένα 5%
εμφανίζεται στο νωτιαίο υγρό. Μετά από ενδοφλέβια χορήγηση το CaNa2-EDTA
παραμένει στην κυκλοφορία του αίματος 20 – 60 min. H αποβολή του γίνεται από τους
νεφρούς με σπειραματική διήθηση. Το 50% της δόσης απομακρύνεται σε μια ώρα ενώ το
95% απομακρύνεται σε 24 ώρες.
Τοξικότητα – ανεπιθύμητες ενέργειες – αντενδείξεις
Η τοξικότητα του CaNa2-EDTA συνδέεται με βλάβες νεφρών. Είναι δυνατόν να
προκληθεί αρχικά αντιστρεπτή εκφύλιση των ουροφόρων σωληναρίων και τελικά μόνιμη
βλάβη. Αυτό μπορεί να οφείλεται είτε σε αυξημένη συγκέντρωση βαρέων μετάλλων στα
νεφρικά σωληνάρια είτε σε απόσπαση σημαντικών μεταλλικών στοιχείων από τα κύτταρα
των νεφρικών σωληναρίων. Για ελάττωση της τοξικής αυτής δράσης γίνεται ενυδάτωση
του ασθενή.
Άλλες λιγότερο σοβαρές ανεπιθύμητες ενέργειες του CaNa2-EDTA είναι αδυναμία,
αδιαθεσία, έμετος, μυαλγία, ανορεξία, τάση προς ούρηση, ρινική συμφόρηση, φτάρνισμα,
αναιμία, δερματίτιδα, ελάτωση πηκτικότητας του αίματος.
D-πενικιλλαμίνη
Συνώνυμα: D-β,β-διμεθυλοκυστεΐνη, D-3-μερκαπτοβαλίνη, cuprimine
H2N CH C
C
OH
O
SH
H3C CH3
Σύνθεση
Παρασκευάζεται από όξινη υδρόλυση της πενικιλλίνης:

ΧΡΗΣΗ ΣΥΝΑΡΜΟΤΩΝ ΣΤΗ ΘΕΡΑΠΕΙΑ
89
Ιδιότητες
Η πενικιλλαμίνη είναι στερεό κρυσταλλικό, λευκό ή σχεδόν λευκό προϊόν με
ελαφρά χαρακτηριστική οσμή και λίγο πικρή γεύση. Είναι σχετικά σταθερή στο φως και
τον αέρα. Έχει σ.ζ. 200οC. Υδατικό διάλυμα πενικιλλαμίνης 1% έχει pH 4.5-5.5. Είναι
πολύ διαλυτή στο νερό, λίγο στην απόλυτη αλκοόλη και αδιάλυτη στο χλωροφόρμιο και
τον διαιθυλαιθέρα
Έλεγχος περιεκτικότητας
Ο ποσοτικός προσδιορισμός της πενικιλλαμίνης στηρίζεται στην ογκομέτρηση με
(CH3COO)2Hg με δείκτη διφαινυλοκαρβαζόνη (Ph-N=N-CO-NH-NH-Ph). Στο τέλος της
αντίδρασης εμφανίζεται ρόδινο-ιώδες χρώμα που οφείλεται στο σύμπλοκο του Hg2+
με τη
διφαινυλοκαρβαζόνη. Η αντίδραση γίνεται σε περιβάλλον όξινο. Το όξινο περιβάλλον
εξασφαλίζεται με ρυθμιστικό διάλυμα οξικού οξέος.
Μηχανισμός δράσης- Χρήσεις
Η πενικιλλαμίνη σχηματίζει χηλικές ενώσεις συναρμογής με πολλά βαρέα μέταλλα
όπως χαλκό (Cu), μόλυβδο (Pb), υδράργυρο (Hg), χρυσό (Au), οι οποίες εύκολα
απομακρύνονται από τα ούρα. Με τα περισσότερα μέταλλα δρα ως διδραστική
αμινοθειόλη, δότης (N,S). Σε ορισμένες περιπτώσεις μπορεί να δράσει και ως
τριδραστικός συναρμοτής (S,N,O).
Σχήμα 6: Σύμπλοκα πενικιλλαμίνης με χαλκό(ΙΙ)
Θεωρείται ισχυρός συναρμοτής για τον σχηματισμό συμπλόκων, όπως η κυστεΐνη.
Η κυστεΐνη, που είναι ανάλογη ένωση με τη πενικιλλαμίνη, επίσης μπορεί να δράσει
όμοια με τη πενικιλλαμίνη. Δεν μπορεί όμως να χρησιμοποιηθεί αποτελεσματικά ως
αντίδοτο, γιατί μεταβολίζεται εύκολα μετά την εισαγωγή της στον οργανισμό, με τη
δράση των ενζύμων αποσουλφουράση και οξειδάση των L-αμινοξέων.

ΚΕΦΑΛΑΙΟ 3
90
Η πενικιλλαμίνη χρησιμοποιείται στην περίπτωση δηλητηριάσεων από Cu αν και
το μέταλλο αυτό δεν είναι πολύ τοξικό και δεν προκαλεί εύκολα δηλητηριάσεις.
Χρησιμοποιείται επίσης για την αντιμετώπιση δηλητηριάσεων από μόλυβδο και υδράργυρο.
Όπως έχει ήδη αναφερθεί σε προηγούμενο κεφάλαιο, πενικιλλαμίνη
χρησιμοποιείται στην ηπατοφακοειδή εκφύλιση (νόσος Wilson) κατά την οποία
παρατηρείται συσσώρευση χαλκού στο ήπαρ, στους νεφρούς, αλλά και στον εγκέφαλο. Η
πενικιλλαμίνη διευκολύνει την κινητοποίηση του χαλκού από τα όργανα αυτά και την
αποβολή του από τα ούρα.
Η πενικιλλαμίνη είναι αρκετά αποτελεματική σε ρευματοειδείς καταστάσεις όπως
η ρευματοειδής αρθρίτιδα αν και ο ακριβής μηχανισμός δράσης δεν είναι γνωστός. Είναι
γεγονός ότι η ρευματοειδής αρθρίτιδα χαρακτηρίζεται από αύξηση του ασβεστίου καθώς
και του παράγοντα IgM στο αίμα. Τα επίπεδα και των δύο αυτών παραγόντων μειώνονται
με χορήγηση πενικιλλαμίνης.
Η πενικιλλαμίνη επίσης χρησιμοποιείται στην κυστινουρία. Η κυστινουρία είναι
κληρονομική νόσος η οποία χαρακτηρίζεται από αδυναμία επαναρρόφησης της κυστίνης
από τα ουροφόρα σωληνάρια. Η αυξημένη συγκέντρωση της κυστίνης και η μικρή
διαλυτότητα της στο νερό και ειδικότερα στα ούρα έχει σαν αποτέλεσμα την
κατακρήμνιση της και τη δημιουργία λίθων. Πενικιλλαμίνη χορηγείται στην περίπτωση
αυτή, όταν αύξηση της ούρησης κατόπιν λήψης ύδατος και αλκαλοποίηση των ούρων με
NaHCO3 ή ακεταζολαμίδιο δεν έχουν αποτέλεσμα. Η πενικιλλαμίνη αντιδρά με την
κυστίνη και σχηματίζει ευδιάλυτο μικτό δισουλφίδιο κυστεΐνης-πενικιλλαμίνης.
ΗΟΟC-CH(NH2)CH2-S-S-CH2-CH(NH2)-COOH + HS-C(CH3)2CH(NH2)-COOH
HOOC-CH(NH2)CH2-S-S-C(CH3)2CH(NH2)COOH + HOOC-CH(NH2) CH2 - SH
Η πενικιλλαμίνη χρησιμοποιείται επίσης στη θεραπεία της πρωτογενούς κίρρωσης
του ήπατος και της σκληροδερμίας. Η δράση της στις περιπτώσεις αυτές πιθανόν να
σχετίζεται με ανοσολογικούς μηχανισμούς.
Τρόπος χορήγησης – Δοσολογία
Χορηγείται σε κάψουλες των 125 και 250 mg. Ο τρόπος χορήγησης διαφέρει
ανάλογα με την περίπτωση.

ΧΡΗΣΗ ΣΥΝΑΡΜΟΤΩΝ ΣΤΗ ΘΕΡΑΠΕΙΑ
91
- Σε περιπτώσεις δηλητηριάσεων με βαρέα μέταλλα χορηγούνται 250-500 mg δύο φορές
την ημέρα στους ενήλικες και 125 mg τρεις φορές την ημέρα σε παιδιά.
- Στην ρευματοειδή αρθρίτιδα χορηγούνται 125 mg μία ή δύο φορές την ημέρα με
βαθμιαία αύξηση σε 250 mg και τελικά σε 1g την ημέρα για διάστημα 12 εβδομάδων.
- Στην κυστινουρία χορηγούνται 500 mg τέσσερις φορές την ημέρα εως ότου οι
συγκεντρώσεις του χαλκού στο αίμα μειωθούν κάτω των 0.5 μg/ml. Στα παιδιά
χορηγούνται 7.5 mg/Kg τέσσερις φορές την ημέρα.
- Στη νόσο Wilson και την κίρρωση του ήπατος χορηγούνται 250 mg την ημέρα σε χυμό
φρούτων.
Τύχη στον οργανισμό
Η πενικιλλαμίνη απορροφάται από τον γαστρεντερικό σωλήνα. Η μέγιστη τιμή της
στο αίμα παρατηρείται 1-2 ώρες μετά τη χορήγηση. Ο μεταβολισμός γίνεται στο ήπαρ σε
δισουλφίδιο και απεκκρίνεται από τους νεφρούς. Λόγω στερεοχημικής παρεμπόδισης δεν
αποτελεί υπόστρωμα για τα ένζυμα που μεταβολίζουν την κυστεΐνη, αποσουλφουράση και
οξειδάση των L-αμινοξέων.
Τοξικότητα – ανεπιθύμητες ενέργειες – αντενδείξεις
Η πενικιλλαμίνη αποτελεί φάρμακο με σημαντική τοξικότητα. Εμφανίζει τις εξής
παρενέργειες οπως: εκχυμώσεις, δερματίτιδα, κνίδωση, πέμφυγες, οίδημα, ερυθρηματώδη
λύκο, λευκοπενία, θρομβοκυττοπενία, ακοκκιοκυτταραιμία, νεφροτοξικότητα με
λευκωματουρία, αιματουρία (ανατάξιμη στην αρχή της). Ακόμη είναι δυνατόν να
προκαλέσει πυρετό, οπτική νευρίτιδα, ανορεξία, ναυτία, έμετο, ανωμαλίες στη γεύση
(αναισθησία στο γλυκό και το αλμυρό) που παρέρχονται με χορήγηση Cu(II). Σε χρόνια
θεραπεία πρέπει να γίνονται συχνά αιματολογικές αναλύσεις.

ΚΕΦΑΛΑΙΟ 3
92
Ν-ακετυλο-πενικιλλαμίνη
Η N-ακετυλο-πενικιλλαμίνη έχει ανάλογη δράση με τη D-πενικιλλαμίνη σαν
αντίδοτο, όμως φαίνεται να είναι αποτελεσματικότερη για την αντιμετώπιση
δηλητηρίασης από Hg(II). Αυτό οφείλεται στη δυσκολία του μεταβολισμού της και και
στη μεγαλύτερη λιποφιλικότητα, που της επιτρέπει να διεισδύει στο εσωτερικό βιολογικών
μεμβρανών.
Τριαιθυλενο-τετραμίνη
Συνώνυμα: Trientine (TRYE-en-teen), CUPRID, syprin (USA), trine
Η2Ν-CH2-CH2-NH- CH2-CH2 –NH-CH2-CH2 –NH2 . 2HCl
Μηχανισμός δράσης-Χρήσεις
Η τριεντίνη είναι ένας τετραδραστικός τετραμινικός συναρμοτής και δίνει πολύ
σταθερά σύμπλοκα με τη δισθενή χαλκό [Cu-N4]. Η σταθερότητα οφείλεται στους τρεις
πενταμελείς δακτυλίους που σχηματίζονται κατά τη συναρμογή του μετάλλου. Ο χαλκός
επιπλέον, δίνει σύμπλοκα με τετραγωνική παραμόρφωση έτσι η σφαίρα συναρμογής τους
χαλκού είναι πληρωμένη. Το σχηματιζόμενο σύμπλοκο είναι σταθερό και οδηγεί στην
αποβολή του χαλκού από τα ούρα.
Cu2+
NH
NH2
NH
NH2
Η τριαιθυλενο-τετραμίνη μπορεί να χρησιμοποιηθεί αντί της πενικιλλαμίνης σε
άτομα που εμφανίζουν έντονες παρενέργειες από την πενικιλλαμίνη, για την απομάκρυνση
της περίσσειας του χαλκού, όπως στην περίπτωση της ασθένειας Wilson. Η τριαιθυλενο-

ΧΡΗΣΗ ΣΥΝΑΡΜΟΤΩΝ ΣΤΗ ΘΕΡΑΠΕΙΑ
93
τετραμίνη είναι αποτελεσματική αν και αποτελεί λιγότερο ισχυρό αντίδοτο από την
πενικιλλαμίνη.
Τρόπος χορήγησης – Δοσολογία
Η τριαιθυλενο-τετραμίνη διατίθεται σε μορφή κάψουλας και χορηγείται από το
στόμα. Η δοσολογία διαφέρει κατά περίπτωση. Για την αντιμετώπιση της ασθένειας
Wilson, η συνήθης δόση για τους ενήλικες είναι 750 mg - 1.25 gr ημερησίως. Η δόση
μπορεί να χωριστεί σε δύο ή τέσσερα μέρη. Η μέγιστη ημερήσια δόση μπορεί να φτάσει
και τα 2 gr.
Για τα παιδιά, η συνήθης δόση είναι 500 – 750 mg ημερησίως. Η δόση μπορεί
επίσης να χωριστεί σε δύο ή τέσσερις μικρότερες. Η μέγιστη δόση που μπορεί να
χορηγηθεί είναι 1.5 gr.
Τοξικότητα – ανεπιθύμητες ενέργειες – αντενδείξεις
Τόσο η ελεύθερη ένωση, όσο και το σύμπλοκο του trientine είναι λιγότερο τοξικά
από αυτά της πενικιλλαμίνης. Τα συχνότερα ανεπιθύμητα συμπτώματα είναι συμπτώματα
αναιμίας: χλωμό δέρμα και αίσθημα κόπωσης. Τέτοια συμπτώματα παρατηρούνται κυρίως
σε παιδιά, γυναίκες σε έμμηνο ρύση και εγκύους επειδή αυτά τα άτομα έχουν μεγαλύτερες
ανάγκες σε σίδηρο. Τα συμπτώματα μπορούν να αντιμετωπιστούν με χορήγηση σιδήρου
αλλά ο σίδηρος και το trientine θα πρέπει να χορηγούνται με διαφορά μεγαλύτερη των δύο
ωρών. Σπανιότερα, παρατηρείται πυρετός, γενική αδιαθεσία, αδυναμία, πόνοι στις
αρθρώσεις, εξανθήματα, φλύκταινες, κνησμός και πρήξιμο στους αδένες.

ΚΕΦΑΛΑΙΟ 3
94

ΧΡΗΣΗ ΕΝΩΣΕΩΝ ΣΥΝΑΡΜΟΓΗΣ ΣΤΗ ΘΕΡΑΠΕΙΑ
95
ΚΕΦΑΛΑΙΟ 4
ΧΡΗΣΗ ΕΝΩΣΕΩΝ ΣΥΝΑΡΜΟΓΗΣ ΣΤΗ ΘΕΡΑΠΕΙΑ
Ι. ΕΝΩΣΕΙΣ ΣΥΝΑΡΜΟΓΗΣ ΤΟΥ ΛΕΥΚΟΧΡΥΣΟΥ ΜΕ ΑΝΤΙΚΑΡΚΙΝΙΚΗ ΔΡΑΣΗ
1. Ιδιότητες του λευκοχρύσου
Ο λευκόχρυσος απαντάται κυρίως στις οξειδωτικές καταστάσεις Pt(II) όπου είναι d6
και σχηματίζει επίπεδα τετραγωνικά σύμπλοκα και Pt (IV) όπου είναι d8 και σχηματίζει
οκταεδρικά σύμπλοκα. Στην οξειδωτική κατάσταση ΙΙ σχηματίζει επίπεδα τετραγωνικά μόρια
(Α.Σ.=4) και η χημεία σύνθεσης συμπλόκων του χαρακτηρίζεται από το φαινόμενο trans.
Σύμφωνα με το φαινόμενο trans μπορεί να αντικατασταθεί από τη σφαίρα συναρμογής του
επίπεδου τετραγωνικού συμπλόκου του Pt (II) ο συναρμοτής αυτός που βρίσκεται σε θέση
trans από συναρμοτή που παρουσιάζει ισχυρότερη επίδραση trans, σύμφωνα με τη κατάταξη
των συναρμοτών βάσει της επίδρασης trans:
CN-, CO, NO, C2H4 > PR3, H
- > CH3
-, C6H5
-, SC(NH2)2, SR2 >SO3H
- > NO2
-, I
-, SCN
- > Br
- >
Cl- > py > RNH2, NH3 > OH
- > H2O
Έτσι για παράδειγμα η αντίδραση αντικατάστασης στο αμινο-τρίχλωρο-
λευκοχρυσικό(ΙΙ) ανιόν από ένα μόριο αμμωνίας θα δώσει μόνο το cis-διαμινο-διχλωρο-
λευκόχρυσο(ΙΙ). Το χλώριο έχει ισχυρότερη trans επίδραση από την αμμωνία, έτσι θα
αντικατασταθεί ο συναρμοτής που βρίσκεται trans από το χλώριο στο αρχικό σύμπλοκο:
Cl
PtCl Cl
NH3
NH3
Cl
PtCl
NH3
NH3
Ενώ η αντίδραση αντικατάστασης στο κατιονικό σύμπλοκο τριαμινο-χλωρο-
λευκόχρυσο (ΙΙ) από ένα ιόν χλωρίου θα δώσει κατά αντιστοιχία trans-διαμινο-διχλωρο-
λευκόχρυσο (ΙΙ).
Έτσι ισχύει:

ΚΕΦΑΛΑΙΟ 4
96
Επιπλέον, τα σύμπλοκα του Pt(II) είναι αδρανή στις αντιδράσεις αντικατάστασης
(k~10-6
-10-3
s1) και συνεπώς είναι σταθερά.
2. Σχέση δομής δράσης ενώσεων του λευκοχρύσου με αντικαρκινική δράση
Οι ενώσεις συναρμογής με αντικαρκινική δράση ανήκουν γενικά, στα
χημειοθεραπευτικά φάρμακα. Κατά συνέπεια είναι κυτταροτοξικά και προκαλούν μη
αντιστρεπτές μεταβολές, με τελικό αποτέλεσμα το θάνατο του κυττάρου.
Η πρώτη ένωση συναρμογής που διαπιστώθηκε ότι έχει αντικαρκινική δράση είναι ο
cis-διχλωροδιαμινολευκόχρυσος(ΙΙ) γνωστός ως cisplatin (Rosenberg & συνεργάτες 1969).
Cl
PtCl
NH3
NH3
Pt
Cl
Cl
NH3H3N
cisδιαμινοδιχλωρολευκόχρυσος(ΙΙ) trans-διαμινοδιχλωρολευκόχρυσος(ΙΙ)
Η cisplatin μελετήθηκε διεξοδικά για την αντικαρκινική της δράση και βάσει αυτής
προτάθηκε μια σειρά προϋποθέσεων που πρέπει να πληρούν τα σύμπλοκα του λευκοχρύσου
για την εμφάνιση αντικαρκινικής δράσης:
α) Να είναι ουδέτερο, τετραγωνικό σύμπλοκο του λευκοχρύσου (ΙΙ). Η ουδετερότητα
εξασφαλίζει την είσοδο του συμπλόκου στο εσωτερικό του κυττάρου με παθητική διάχυση
μέσω της κυτταρικής μεμβράνης. Νεότερες προσεγγίσεις στα σύμπλοκα του λευκοχρύσου
έχουν δείξει ότι αντικαρκινική δράση μπορεί να εμφανίζουν και φορτισμένα σύμπλοκα. Έτσι
πολυπυρηνικά σύμπλοκα του λευκοχρύσου με ολικό θετικό φορτίο +2 και +4 δοκιμάστηκαν
K2[PtCl4]+ NH3
- KCl
K[PtCl3(NH3)]
+ NH3
- KClcis-[PtCl2(NH3)2]
[Pt(NH3)4]Cl2+ Cl-
[PtCl(NH3)3]Cl trans-[PtCl2(NH3)2]
-NH3
+ Cl-
-NH3

ΧΡΗΣΗ ΕΝΩΣΕΩΝ ΣΥΝΑΡΜΟΓΗΣ ΣΤΗ ΘΕΡΑΠΕΙΑ
97
με επιτυχία. Καθώς και οκταεδρικά σύμπλοκα Pt(IV) μπορεί να εμφανίζουν αντικαρκινική
δράση.
β) Το σύμπλοκο να περιέχει δύο αμινομάδες με αμινικό πρωτόνιο ( π.χ.ΝΗ3, ΝΗ2) σε cis
διάταξη μεταξύ τους. Οι ενώσεις του λευκοχρύσου που δοκιμάστηκαν με επιτυχία διαθέτουν,
στην πλειοψηφία τους, δύο αμινομάδες με διαθέσιμο αμινικό υδρογόνο (πρωτοταγείς ή
δευτεροταγείς) με cis-στερεοχημική διάταξη. Θεωρείται ότι το αμινικό υδρογόνο σχηματίζει
δεσμό υδρογόνου με το καρβονυλικό οξυγόνο C6 του μορίου της γουανοσίνης. Παρά το
γεγονός οτι οι περισσότερες αντικαρκινικές ενώσεις του λευκοχρύσου έχουν cis-γεωμετρική
διαμόρφωση και έχουν υδρογόνα ενωμένα με τα άτομα δότες άζωτο, σήμερα έχουν συντεθεί
σύμπλοκα με αντικαρκινική δράση που δεν υπακούουν ούτε σε αυτό το κριτήριο.
γ) Το σύμπλοκο να περιέχει δύο ιόντα χλωρίου. Τα άτομα χλωρίου θεωρούνται ευκίνητοι
συναρμοτές και στα βιολογικά υγρά μπορούν να αντικατασταθούν από μόρια νερού ή από
άλλους ισχυρότερους δότες, όπως θειόλες κι αμινομάδες που υπάρχουν στα κύτταρα. Σήμερα,
έχουν αναπτυχθεί σύμπλοκα του λευκοχρύσου με αντικαρκινική δράση που δεν περιέχουν
ιόντα χλωρίου, αλλά άλλους ευκίνητους συναρμοτές.
Κατωτέρω παρουσιάζονται αντιπροσωπευτικές ενώσεις του λευκοχρύσου διαφόρων
δομών οι οποίες παρουσιάζον αντικαρκινική δράση.
Σχήμα 1. Ενώσεις του λευκοχρύσου με αντικαρκινική δράση.

ΚΕΦΑΛΑΙΟ 4
98
Σήμερα θεωρείται οτι πιθανόν το σημαντικότερο κριτήριο αντικαρκινικής δράσης των
ενώσεων του λευκοχρύσου αποτελεί η κατάλληλη ταχύτητα ανταλλαγής των συναρμοτών που
μπορεί να συμβαίνει in vivo και η σταθερότητα των δευτερογενών ενώσεων συναρμογής που
προκύπτουν.
Ο μηχανισμός δράσης των ενώσεων του λευκοχρύσου δεν έχει πλήρως διευκρινιστεί
και υπάρχει το ενδεχόμενο το τελικό αποτέλεσμα να οφείλεται σε συνδυασμό δράσεων. Έχει
αποδειχθεί ότι η δράση των ενώσεων του λευκοχρύσου εντοπίζεται στο εσωτερικό του
κυττάρου και ειδικότερα στον πυρήνα όπου πιστεύεται ότι συνδέονται με το DNA
προκαλώντας αναστολή της αντιγραφής, της μεταγραφής και της πρωτεϊνοσύνθεσης με τελικό
αποτέλεσμα την απόπτωση. Αν και όλες οι ενώσεις του λευκοχρύσου πιστεύεται ότι
συναρμόζονται με το DNA ενδεχομένως, υπάρχουν διαφορές στον τρόπο και το αποτέλεσμα
της σύνδεσης ενώσεων του λευκοχρύσου που ανήκουν σε διαφορετικές κατηγορίες
συμπλόκων (πχ. μονοπυρηνικά, πολυπυρηνικά σύμπλοκα). Ως εκ τούτου, οι ενώσεις
συναρμογής του λευκοχρύσου θα πρέπει επιπλέον να έχουν τις κατάλληλες ιδιότητες που να
επιτρέπουν την εσωτερίκευση τους στο κύτταρο.
Cis- Διαμινο-διχλωρο-λευκόχρυσος(ΙΙ)
Cis-diamine dichloroplatinum(II) Platinol
Cl
PtCl
NH3
NH3
1. Σύνθεση
Παρασκευάζεται κατόπιν επιδράσεως αμμωνίας σε τετραχλωρο-λευκοχρυσικό κάλιο
σύμφωνα με το σχήμα:
2 Κ2[PtCl6] + NH2-NH2.HCl 2 K2[PtCl4] + N2 + 6 HCl
K2[PtCl4] + 2 NH3 cis-[Pt(NH3)2Cl2] + 2 KCl
Κατά τη παρασκευή του συμπλόκου είναι σημαντικό να καθαριστεί πλήρως από
περίσσεια τετραχλωρολευκοχρυσικού καλίου το οποίο είναι ισχυρό αλλεργιογόνο.

ΧΡΗΣΗ ΕΝΩΣΕΩΝ ΣΥΝΑΡΜΟΓΗΣ ΣΤΗ ΘΕΡΑΠΕΙΑ
99
2. Μηχανισμός δράσης
α) Υδρόλυση
Το cis-platin περιέχει δύο ιόντα ευκίνητα χλωρίου (σκληρές βάσεις), με αποτέλεσμα την
αντικατάστασή τους από άλλους συναρμοτές. Στα βιολογικά υγρά, το cis-platin είναι δυνατόν να
υδρολυθεί και να δώσει υδροξυσύμπλοκα ως αποτέλεσμα της οξύτητας του λευκοχρύσου. Τα
επίπεδα τετραγωνικά σύμπλοκα του λευκοχρύσου είναι όπως προαναφέρθηκε σχετικά αδρανή,
έτσι η ισορροπία υδρόλυσης θα αποκατασταθεί περίπου σε 2,5 ώρες.
Η ισορροπία μεταξύ των διαφόρων μορφών εξαρτάται από τη συγκέντρωση των
ιόντων χλωρίου και από το pH. Στο αίμα, όπου η συγκέντρωση των ιόντων χλωρίου είναι
υψηλή (100 mM), το cis-platin δεν υδρολύεται. Αντίθετα στο εσωτερικό του κυττάρου το
σύμπλοκο υδρολύεται και το νερό του νέου συμπλόκου μπορεί εύκολα να υποκατασταθεί από
άλλους συναρμοτές (δραστική μορφή συμπλόκου).
β) Αλληλεπίδραση με πρωτεΐνες και με το DNA
To cis-platin είναι δυνατόν να συνδεθεί με πρωτεΐνες, κυρίως μέσω της σουλφυδρυλικής ομάδας
των πρωτεϊνών (-SH: μαλακή βάση) αλλά και των αζωτούχων ομάδων των πρωτεϊνών (ενδιάμεσες
βάσεις). Η ανάπτυξη δεσμών του cis-platin με πρωτεΐνες θεωρείται υπεύθυνη για την νεφροτοξικότητα
της ένωσης αλλά και για τη μερική αντίσταση που εμφανίζουν τα κύτταρα στη δράση του φαρμάκου.
Στο κύτταρο το cisplatin συνδέεται με θειόλες όπως τη γλουταθειόνη ( τριπεπτίδιο γλουταμινικού
Σχήμα 2. Υδρόλυση του συμπλόκου cis-platin

ΚΕΦΑΛΑΙΟ 4
100
οξέος-κυστεϊνης-γλυκίνης, όπου το γλουταμινικό οξύ είναι συνδεδεμένο μέσω του πλευρικού
καρβοξυλικού οξέος με την αμινομάδα της κυστεϊνης). Η γλουταθειόνη αποτελεί μέρος της
μεταλλοθειονίνης (μεταλλοπρωτεϊνης που συνδέεται με μέταλλα μέσω των σουλφυδρυλικών ομάδων
που διαθέτει).
Η αντικαρκινική δράση του cis-platin οφείλεται στη σύνδεσή του με το DNA. Η δραστική
μορφή του συμπλόκου εισέρχεται στον πυρήνα και αρχικά αλληλεπιδρά με τις φωσφορικές
ομάδες (σκληρές βάσεις) του σκελετού του DNA, τελικά όμως σχηματίζει σταθερό σύμπλοκο με
τις βάσεις αδενίνη και γουανίνη, μέσω του αζώτου Ν7 του πουρινικού δακτυλίου. Ισχυρότερα
συνδέεται με τη γουανίνη κι αυτό γιατί το αμιδικό οξυγόνο Ο6 σχηματίζει δεσμούς υδρογόνου με
τα άτομα υδρογόνου της αμμωνίας του μορίου του cisplatin.
Σχήμα 3. Α. Θέση αζώτων πουρινικών δακτυλίων που συναρμόζονται με τον Pt του cis-platin. Β.
Άλλοι τρόποι συναρμογής του cis-platin με το DNA.

ΧΡΗΣΗ ΕΝΩΣΕΩΝ ΣΥΝΑΡΜΟΓΗΣ ΣΤΗ ΘΕΡΑΠΕΙΑ
101
Το cisplatin μπορεί να συνδεθεί με μια βάση του DNA γουνίνη ή αδενίνη, ή μπορεί να
σχηματίσει διμερή παράγωγα με σύνδεση με δύο γειτονικές βάσεις (ενδοαλυσιδική
διασύνδεση) ή με δύο βάσεις από τις δύο συμπληρωματικές αλυσίδες του DNA (διαλυσιδική
διασύνδεση).
Παρουσιάζει ανάλογο μηχανισμό με τα αλκυλιωτικά αντικαρκινικά φάρμακα και
εντάσσεται στην κατηγορία τους. Η συναρμογή του cis-platin στο DNA πιστεύεται ότι
προκαλεί κάμψη του DNA. Η κάμψη αυτή θεωρείται υπεύθυνη για την αναστολή της
πρωτεϊνοσύνθεσης. Η αναστολή της πρωτεϊνοσύνθεσης συνδέεται με παρεμπόδιση από το cis-
platin της μεταγραφής του ριβοσωμικού RNA. 1
3. Χρήσεις
Χρησιμοποιείται κυρίως για τη θεραπεία καρκίνου της ουροδόχου κύστης, των
ωοθηκών και των όρχεων αλλά μπορεί να χρησιμοποιηθεί για την αντιμετώπιση και άλλων
τύπων καρκίνου.
4. Τρόπος χορήγησης – Δοσολογία
Το cis-platin διατίθεται σε ενέσιμη μορφή με συγκέντρωση 1 mg/ml. Χορηγείται
ενδοφλέβια, πάντα υπό παρακολούθηση γιατρού και η δοσολογία διαφέρει ανάλογα με το
είδος του καρκίνου που πρέπει να αντιμετωπισθεί, το βάρος του ατόμου, την λήψη άλλων
φαρμάκων κλπ.
Σε περιπτώσεις μεταστατικών καρκίνων των όρχεων χορηγούνται 20 mg/m2/day για 5
ημέρες σε κάθε κύκλο θεραπείας.
Σε μεταστατικό καρκίνων των ωοθηκών χορηγούνται 75-100 mg/m2 σε μία δόση κάθε
τέσσερις εβδομάδες. Η θεραπεία συνδυάζεται με χορήγηση κυκλοφωσφαμίδη 600 mg/m2 σε
1 Η μεταγραφή του ριβοσωμικού RNA αρχίζει με τη σύνδεση στην περιοχή του εκκινητήρα του rRNA
γονιδίου ενός μεταγραφικού παράγοντα. Ο μεταγραφικός παράγοντας έχει την δυνατότητα να συνδέεται σε
περιοχές όπου το DNA κάμπτεται φυσικά. Μετά τη σύνδεσή του προκαλεί επιπλέον δομικές αλλαγές στο DNA
και ενεργοποιεί την RNA-πολυμεράση με αποτέλεσμα την έναρξη της μεταγραφής.
Τα σημεία κάμψης που δημιουργήθηκαν από το cis-platin δρούν ανταγωνιστικά ως προς τα φυσικά
σημεία κάμψης, προσελκύωντας επίσης τον μεταγραφικό παράγοντα ο οποίος όμως μετά τη σύνδεσή του δεν
μπορεί να προκαλέσει επιπλέον μεταβολή της δομής του DNA και να ενεργοποιήσει την μεταγραφή.
Τα σημεία κάμψης του cis-platin προσελκύουν και άλλες πρωτεΐνες που περιέχουν περιοχές αγχιστείας προς
κεκαμένες περιοχές του DNA (HMG recognition sites) με αποτέλεσμα να δημιουργούν προστατευμένους
κόμβους, οι οποίοι αναστέλλουν τους επιδιορθωτικούς μηχανισμούς του κυττάρου. Σε κύτταρα που εμφανίζουν
αντίσταση στη cisplatin δεν υπάρχουν οι πρωτεϊνες HMG με αποτέλεσμα η κάμψη, η οφειλόμενη στο σύνδεση
του συμπλόκου του λευκοχρύσου να επιδιορθώνεται.

ΚΕΦΑΛΑΙΟ 4
102
μία δόση κάθε τέσσερις εβδομάδες. Η χορήγηση cis-platin και κυκλοφωσφαμίδης γίνεται
διαδοχικά.
Στις περιπτώσεις προχωρημένου καρκίνου της ουροδόχου κύστης χορηγούνται 50-70
mg/m2 σε μία δόση κάθε 3-4 εβδομάδες ανάλογα με το αν προηγήθηκε θεραπεία με
ακτινοβολία ή χημοθεραπεία.
5. Τύχη στον οργανισμό
Ο χρόνος ημιζωής του cis-platin στο πλάσμα είναι 20-30 min ενώ ο συνολικός χρόνος
παραμονής του στο αίμα (εντός των κυττάρων του αίματος) είναι 36-47 ημέρες. Αποβάλλεται
αργά από τα ούρα (35-51% μετά από 5 ημέρες). Συγκεντρώνεται στο ήπαρ, τα νεφρά και το
λεπτό και παχύ έντερο. Παρατηρείται μικρή διείσδυση στο ΚΝΣ.
6. Τοξικότητα – ανεπιθύμητες ενέργειες – αντενδείξεις
Η τοξικότητα των ενώσεων του λευκοχρύσου έχει συνδεθεί με τη δέσμευσή του από
άτομα θείου κυστεϊνης και μεθειονίνης της αλβουμίνης του αίματος, καθώς και με υψηλή
νεφροτοξικότητα.
Επιπλέον, προκαλεί μείωση των επιπέδων των ηλεκτρολυτών (ασβεστίου, μαγνησίου,
φωσφορικών, καλίου και νατρίου), σπασμούς, απώλεια γεύσης και περιφερειακές
νευροπάθειες (Η νευροτοξικότητα μπορεί να εμφανιστεί 4-7 μήνες μετά από παρατεταμένη
θεραπεία). Προκαλεί ωτοτοξικότητα. Στα μάτια μπορεί να προκαλέσει οπτική νευρίτιδα,
θαμπή όραση και σύγχυση χρωμάτων. Τέλος μπορεί να προκαλέσει αναφυλακτικές
αντιδράσεις. Η χορήγηση cis-platin αντενδείκνυται κατά το θηλασμό. Επίσης σε άτομα με
σοβαρή νεφρική ανεπάρκεια, προβλήματα ακοής και ιστορικό αλλεργίας σε ενώσεις του
λευκοχρύσου. Κατά τη θεραπεία καλό είναι να μη λαμβάνονται άλλα φάρμακα.
(SP-4-2)-Διαμινο(1,1-κυκλοκαρβοξυλατο-κ-Ο)(2-)λευκόχρυσος

ΧΡΗΣΗ ΕΝΩΣΕΩΝ ΣΥΝΑΡΜΟΓΗΣ ΣΤΗ ΘΕΡΑΠΕΙΑ
103
1,1 κυκλοβουτανοδικαρβοξυλάτο Ο,Ο΄-διαμμινολευκόχρυσος (ΙΙ).
Συνώνυμα: paraplatin, paraplatin-AQ
1. Σύνθεση
α) Από cis platin με επίδραση νιτρικού αργύρου και 1,1-κυκλοβουτανο-
δικαρβοξυλικού οξέος
β) Από cis διαμινο-διιωδο-λευκόχρυσο και 1,1-κυκλο-βουτανο-δικαρβοξυλικό οξύ
μετα ασβεστίου άλας.
2. Ιδιότητες
Το carboplatin είναι λευκή κρυσταλλική ουσία με διαλυτότητα 14mg/ml στο νερό.
Υδατικό διάλυμα 1% έχει pH 5-7. Είναι αδιάλυτη στην αιθανόλη, την ακετόνη και το
διμεθυλακεταμίδιο.
Σε μορφή σκόνης, διατηρείται σε θερμοκρασία δωματίου. Σε μορφή διαλύματος
έτοιμου για χρήση μπορεί να διατηρηθεί σε θερμοκρασία δωματίου έως 8 ώρες.
3. Μηχανισμός δράσης
Το carboplatin δεν περιέχει ιόντα χλωρίου ως συναρμοτές, όμως η δικαρβοξυλική
ομάδα αντικαθίσταται από μόρια νερού όπως συμβαίνει και με το cisplatin, αλλά η υδρόλυση
λαμβάνει χώρα λιγότερο εύκολα. Το carboplatin αντιδρά δυσκολότερα με τις
σουλφυδρυλοομάδες (-SH) των πρωτεϊνών και σε αυτό πιθανόν να οφείλεται η μειωμένη
νεφροτοξικότητα του φαρμάκου.

ΚΕΦΑΛΑΙΟ 4
104
Αντίθετα, συνδέεται με θειαιθερικές ομάδες πρωτεϊνών και μ’ αυτή τη μορφή
πιστεύεται οτι εισέρχεται στον πυρήνα των κυττάρων. Εκεί οι θειαιθερικές ομάδες
αντικαθίστανται εύκολα από τα άζωτα των πουρινών.
4. Χρήσεις
Το carboplatin ανήκει στα αλκυλιωτικά αντινεοπλασματικά φάρμακα και
χρησιμοποιείται για τον επιθηλιακό καρκίνος ωοθηκών και το μικροκυτταρικό καρκίνο
πνεύμονος.
5. Τρόπος χορήγησης-Δοσολογία- Ανεπιθύμητες ενέργειες
Διατίθεται σε μορφή λυοφυλοποιημένης λευκής σκόνης, σε περιέκτες μιας δόσης, που
περιέχουν 50 mg, 150 mg, and 450 mg carboplatin, για χορήγηση με ενδοφλέβια έγχυση. Ο
περιέκτης έχει επίσης ποσότητα μανιτόλης.
Επειδή το carboplatin μπορεί να αντιδράσει με το αργίλλιο δίνοντας ίζημα, πρέπει να
αποφεύγεται η επαφή του φαρμάκου με βελόνες και εξαρτήματα που περιέχουν αργίλλιο
Η δοσολογία εξαρτάται από διάφορους παράγοντες όπως επίπεδα ουδετερόφιλων και
αιμοπεταλίων. Για την αντιμετώπιση επανερχόμενου καρκίνου των ωοθηκών χορηγείται μία
δόση των 360 mg/m2
κάθε τέσσερις εβδομάδες, με συνεχή παρακολούθηση των
ουδετερόφιλων και των αιμοπεταλίων. Για την αντιμετώπιση προχωρημένου καρκίνου των
ωοθηκών, ακολουθείται συνήθως συνδυαστική θεραπεία. Σε περιπτώσεις νεφρικής
ανεπάρκειας η δοσολογία ρυθμίζεται ανάλογα με το ρυθμό αποβολής κρεατινίνης.
Η κυριότερη τοξική δράση της είναι η καταστολή του μυελού των οστών με σοβαρή
αναιμία, λευκοπενία και θρομβοπενία. Eπίσης προκαλεί ναυτία, έμετο, διάρροια και
Pt
H3N
H3N Cl
Cl
Pt
H3N
H3N O
O
O
O
Pt
H3N
H3N OH2
OH2
cisplatin
carboplatin

ΧΡΗΣΗ ΕΝΩΣΕΩΝ ΣΥΝΑΡΜΟΓΗΣ ΣΤΗ ΘΕΡΑΠΕΙΑ
105
δυσκοιλιότητα, νεφροτοξικότητα, περιφερική νευροπάθεια, δυσγευσία, ωτοτοξικότητα με
ελάττωση της οξύτητος της ακοής σε υψηλές συχνότητες, αυξήσεις ηπατικών ενζύμων,
ηλεκτρολυτικές διαταραχές (υπομαγνησιαιμία, υποκαλιαιμία, υπασβεστιαιμία), αλλεργικές
αντιδράσεις, αλωπεκία, γριππώδη αντίδραση και σπάνια αντίδραση στη περιοχή της ένεσης.
6. Τύχη στον οργανισμό
Η κατανομή του carboplatin στο πλάσμα γίνεται σε δύο φάσεις με ημιζωή 1.1-2 h και
2.6-5.9 h αντίστοιχα. Το carboplatin δεν συνδέεται με τις πρωτεΐνες του πλάσματος. Ο Pt
όμως συνδέεται ισχυρά και απομακρύνεται δύσκολα (ελάχιστος χρόνος ημιζωής: 5 ημέρες). Η
αποβολή του carboplatin γίνεται από τα ούρα. Ασθενείς με ρυθμό αποβολής κρεατινίνης 60
ml/min ή μεγαλύτερο αποβάλλουν το 65% της δόσης σε 12h και το 71% της δόσης σε 24h. Το
carboplatin παρουσιάζει γραμμική φαρμακοκινητική για δόσεις 300-500 mg/ml.
Μηχανισμός δράσης αναλόγων της cisplatin
Το trans-platin συνδέεται επίσης με το DNA και τις πρωτεΐνες. Υδρόλυση του trans-
platin δημιουργεί το trans-υδατοσύμπλοκο που μπορεί να συνδεθεί με το DNA, με ομάδες
γουανοσίνης, όχι όμως γειτονικές (GpGp), όπως το cisplatin. Επιπλέον, μπορεί να συνδεθεί
και με πρωτεϊνες και να σχηματίσει συμπλέγματα πρωτεϊνη-Pt(NH3)-DNA. Πάντως δε μπορεί
να προκαλέσει κάμψη στο DNA. Η δυνατότητα αντικατάστασης των ιόντων χλωρίου από το
transplatin επίσης είναι δυσκολότερη, λόγω της trans διαμόρφωσης. Έτσι, σχηματίζονται
ασθενέστερα σύμπλοκα που αποβάλλονται ευκολότερα από το κύτταρο. Ίσως αυτός είναι
ένας από τους κύριους λόγους για τους οποίους το trans-platin δεν παρουσιάζει αντικαρκινική
δράση.
Η αντικαρκινική δράση των νεότερων ενώσεων συναρμογής του λευκοχρύσου
φαίνεται να παρουσιάζει ομοιότητες αλλά και διαφορές από το cis-platin ως προς το
μηχανισμό δράσης.
Έτσι, τα πολυπυρηνικά σύμπλοκα του λευκοχρύσου είναι σχετικά εύκαμπτα μόρια
και δεν προκαλούν κάμψη στο DNA με το οποίο συνδέονται. Κατά συνέπεια η αντικαρκινική
δράση που παρουσιάζουν δεν σχετίζεται με την κάμψη του DNA όπως συμβαίνει με το cis-
platin. Όμως η διαλυσιδική διασύνδεση των πολυπυρηνικών αυτών συμπλόκων προσελκύει
τη προστατευτική πρωτεϊνη HMG κι έτσι να μεν επιδιορθωθεί η βλάβη στο DNA.

ΚΕΦΑΛΑΙΟ 4
106
ΙΙ. ΑΝΤΙΦΛΕΓΜΟΝΩΔΗ, ΑΝΤΙΑΡΘΡΙΤΙΚΑ ΦΑΡΜΑΚΑ ΤΟΥ ΧΡΥΣΟΥ
1. Γενικές ιδιότητες χρυσού
Ο χρυσός βρίσκεται στη τρίτη σειρά των μεταβατικών στοιχείων του περιοδικού
πίνακα. Κυριότερες οξειδωτικές καταστάσεις του είναι η Ι και η ΙΙΙ. Η σταθερότερη
οξειδωτική κατάσταση είναι η ΙΙΙ στην οποία έχει διαμόρφωση d8 και συνήθως σχηματίζει
επίπεδα τετραγωνικά σύμπλοκα με αριθμό συναρμογής 4. Μια άλλη σχετικά σταθερή
οξειδωτική κατάσταση είναι η Ι στην οποία έχει διαμόρφωση d10
και σχηματίζει γραμμικά
σύμπλοκα με αριθμό συναρμογής 2 (πχ. (AuS)n, [Au(CN)2]-, Au(PR3)SR’). Ο Au(I)
σχηματίζει σταθερά κι ευδιάλυτα in vivo κυανιούχα σύμπλοκα:
AuI + 2CN
- Au(CN)2
-
Επίσης, σταθερά γραμμικά σύμπλοκα Au(I) λαμβάνονται από την αναγωγή του Au
(III) με τριτοταγείς φωσφίνες σε αιθανόλη.
Γενικά στην οξειδωτική κατάσταση Ι ο χρυσός μπορεί να υποστεί αυτοξειδοαναγωγή:
3AuI 2Au
0 + Au
III
κι επιπλέον είναι ισχυρό οξειδωτικό μέσο:
Au(I) + e- Au(s) 1.7 V
Au(III) + 3e- Au(s) 1.5 V
2. Αντιαρθριτικά φάρμακα χρυσού
Αντιαρθριτικά φάρμακα πρώτης γενιάς: Υπάρχουν διάφορα ενέσιμα φάρμακα του
θειολάτο-χρυσού(Ι) (AuI-SR) που χρησιμοποιούνται κλινικά στην θεραπεία των βαριών
περιπτώσεων της ρευματοειδούς αρθρίτιδας και περιλαμβάνουν το νάτριο θειομηλονικό
χρυσό (Myocrisin, Μυοχρυσίνη, Θειομαλικό χρυσό), το θειογλυκοζικό χρυσό (Solganol,
Χρυσοθειογλυκόζη), και του συμπλόκου του χρυσού με θειοπροπανολικό σουλφονικό νάτριο
(Allochrysine) (Σχήμα 4).

ΧΡΗΣΗ ΕΝΩΣΕΩΝ ΣΥΝΑΡΜΟΓΗΣ ΣΤΗ ΘΕΡΑΠΕΙΑ
107
Σχήμα 4. Αντιαρθριτικά φάρμακα του χρυσού πρώτης γενιάς.
Είναι πολυμερή γραμμικά σύμπλοκα Au(Ι) με άτομα θείου S γέφυρες, σε αναλογία
χρυσού : θειόλη 1:1. Η δομή τέτοιων πολυμερών συμπλόκων φαίνεται παρακάτω:
Αντιαρθριτικά φάρμακα χρυσού δεύτερης γενιάς:
(1-θειο-β –D-γλυκοπυρανοσο- S) (τριαιθυλοφωσφινο)χρυσός 2,3,4,6,τετροξικός εστέρας
Auranofin, Αουρανοφίνη
Συνώνυμα: Aktil (Lek, Σλοβενία), Ridaura (Smith Kline Beecham, ΗΠΑ), Ridauran
(Robapharm, Γαλλία).
Auranofin.
Μυοχρυσίνη Χρυσοθειογλυκόζη Αλλοχρυσίνη

ΚΕΦΑΛΑΙΟ 4
108
Η μόνη αντιαρθριτική ένωση του χρυσού κατάλληλη για λήψη από το στόμα είναι η
ένωση auranofin, η οποία βρίσκεται σε κλινικό στάδιο. Η ένωση αυτή εμφανίζει επίσης
υψηλή κυτοτοξικότητα σε καρκινικά κύτταρα, επιπλέον δε δρα τοπικά κατά της ψωρίασης.
Σύνθεση Auranofin: Από τη β-D-γλυκοπυρανόζη λαμβάνεται το τετρα-ακετυλο-πυρανοσυλο-
θειουρόνιο. Κατόπιν με επίδραση τριαιθυλοφωσφινο-χλωροχρυσού(Ι), λαμβάνεται η
χρυσανοφίνη. Ο τριαιθυλοφωσφινο-χλωροχρυσός(Ι) παρασκευάζεται με επίδραση
τριαιθυλοφωσφίνης σε αιθανόλη σε τετραχλωροχρυσικό (ΙΙΙ) ανιόν. Στο σύμπλοκο που
σχηματίζεται η θειόλη δρα σαν ανιονικός δότης και η τριαιθυλοφωσφίνη σαν ουδέτερος δότης
ηλεκτρονίων προς το χρυσό(Ι) και σχηματίζεται γραμμικό, ουδέτερο μόριο.
3. Μηχανισμός δράσης
Η χρυσοθεραπεία εφαρμόστηκε για πρώτη φορά πριν 70 χρόνια από τον Jacques
Forestier. Χρησιμοποιείται για την αντιμετώπιση της ρευματοειδούς αρθρίτιδας. Είναι πιο
αποτελεσματικό στα πρώτα στάδια ενεργούς τενοντίτιδας. Η ρευματοειδής αρθρίτις συνδέεται
με εξασθένιση του ανοσοποιητικού συστήματος και προκαλεί τραύματα στους ιστούς και
φυσική εξασθένιση. Τα φάρμακα του χρυσού ανήκουν στα αντιαρθριτικά φάρμακα βραδείας
δράσης (3-6 μήνες) που δρουν τροποποιώντας το ανοσοποιητικό σύστημα και χορηγούνται ως
δεύτερη θεραπεία (πρώτη θεραπεία: μη στεροειδή αντιφλεγμονώδη).
Η ρευματοειδής αρθρίτιδα είναι μια αυτοάνοση νόσος, κατά την οποία δημιουργείται
φλεγμονή στις αρθρώσεις (οξειδωτικό στρες οφειλόμενο στη δράση κυττάρων του
ανοσοποιητικού συστήματος). Κατά τη δημιουργία της φλεγμονής, τα λεμφοκύτταρα
Au2Cl6 + 2HCl 2 [AuCl4]-
[AuCl4]- + PEt3 AuCl(PEt3)
OH S
H
H
H
OO
O
O
OO
OO
Au P
Auranofin
OH
OH
OH
H
H
OHH
OH
HO
OH S
H
H
H
OO
O
O
OO
OO
NH2
NHH3C
O
O CH3
O
S NH2
NH2
1. Acetic anhydride
2. thiourea
Au(I)Cl(PEt3)

ΧΡΗΣΗ ΕΝΩΣΕΩΝ ΣΥΝΑΡΜΟΓΗΣ ΣΤΗ ΘΕΡΑΠΕΙΑ
109
παράγουν ελεύθερες ρίζες υπό μορφή Ο2-, Η2Ο2,
.ΟΗ, οι οποίες προκαλούν βλάβες στους
αρθρικούς θύλακες.
Τα αντιαρθριτικά φάρμακα χρυσού εμφανίζουν πληθώρα δράσεων, όπως:
αντιφλεγμονώδη, αντιμικροβιακή, ελάττωση κυτταρικής και χυμικής ανοσοαντίδρασης,
αναστολή του Συμπληρώματος, επίδραση στα λεμφοκύτταρα, στα μονοκύτταρα και στα
ουδετερόφιλα και επιπλέον αναστολή ενζύμων. Το auranofin φαίνεται ότι αναστέλλει την
αναγωγάση της θειρεοδοξίνης (TR), η οποία συμβάλλει στην παραγωγή ριζών υδροξυλίου.
Αυξημένα επίπεδα TR ανευρίσκονται κατά το οξειδωτικό stress στην ρευματοειδή αρθρίτιδα.
Έτσι το auranοfin μπορεί να περιορίσει την παραγωγή των ριζών αυτών και κατά συνέπεια να
έχει ευεργητική επίδραση στην ρευματοειδή αρθρίτιδα.
4. Μεταφορά-Κατανομή-Μεταβολισμός-Απομάκρυνση
Οι ενώσεις του χρυσού είναι προφάρμακα. Μετά τη χορήγησή τους εισέρχονται στη
κυκλοφορία του αίματος, όπου αλληλεπιδρούν με πρωτεϊνες του αίματος και συγκεκριμένα με
την αλβουμίνη, μέσω της θειόλης της κυστεϊνης-34, κι έτσι μεταφέρονται στους διάφορους
ιστούς. Δεν υπάρχουν σαφείς ενδείξεις ότι οι μονομερείς ή ολιγομερείς χρυσοθειόλες
(Au(SR)2-, [Au(SR)n]) καθώς και οι μεταβολίτες αυτών εισέρχονται στο εσωτερικό των
κυττάρων. Πιθανώς ο μηχανισμός δράσης τους να περιλαμβάνει μόνο τη πρόσδεσή τους στην
εξωτερική μεμβράνη των κυττάρων και μ΄αυτό τον τρόπο να προκαλούν αλλαγές στην
εισρροή θρεπτικών συστατικών στο κύτταρο.
Η αουρανοφίνη όμως, πιστεύεται ότι εισέρχεται μέσα στα κύτταρα, καθώς η ομάδα
Et3PAu+ αυτής αλληλεπιδρά με μεμβρανικές πρωτεΐνες μεταφοράς, που περιέχουν
σουλφυδρυλομάδες, και αποτελούν το όχημα μεταφοράς της ομάδας της χρυσοφωσφίνης στο
κύτταρο. Το ποσοστό του χρυσού που εισέρχεται στο κύτταρο βρίσκεται σε ισορροπία με τον
εξωκυττάριο χρυσό.
Μέσα στα κύτταρα η αουρανοφίνη αλληλεπιδρά με θειόλες του κυτταροπλάσματος
και με το σελήνιο των σεληνοπρωτεϊνών (π.χ. με την σεληνοκυστεϊνη, που βρίσκεται σε
σεληνοπρωτεΐνες, όπως η αναγωγάση της θειορεδοξίνης). Μια άλλη πρωτεΐνη με την οποία
αλληλεπιδρά ο χρυσός είναι η μεταλλοθειονίνη. Η πρωτεΐνη αυτή χαρακτηρίζεται από την
ιδιότητα να δεσμεύει βαρέα μέταλλα, μέσω των πολλών ομάδων κυστεϊνικής θειόλης που
περιέχει.

ΚΕΦΑΛΑΙΟ 4
110
Η αλληλεπίδραση των ενώσεων του χρυσού με τις θειόλες στον οργανισμό είναι μια
αντίδραση αντικατάστασης συναρμοτών όπως φαίνεται στις παρακάτω αντιδράσεις, κατά την
οποία η θειόλη που είναι συναρμοσμένη με το χρυσό στην αρχική ένωση ανταλλάσσεται με
κάποια πρωτεϊνική θειόλη. Η διαδικασία αυτή λαμβάνει χώρα στα πρώτα 20 λεπτά μετά την
χορήγηση της ένωσης. Οι ενώσεις του χρυσού μέσω τέτοιων αντιδράσεων τελικά
κατανέμονται σε όλο τον οργανισμό:
Αλβουμίνη-SH + Auranofin Αλβουμίνη-S-Au-PEt3
Αλβουμίνη-S-Au-PEt3 +RSH Αλβουμίνη-S-Au-SR + Et3P
Μια ομάδα κυστεΐνης μπορεί να αντικαταστήσει επιπλέον και τη φωσφίνη από το
μόριο της αουρανοφίνης, ενώ η φωσφίνη καθώς απελευθερώνεται δρά ως αναγωγικό, με
τελική οξείδωση αυτής σε οξείδιο της τριαιθυλοφωσφίνης.
Et3P + (Αλβουμίνη-S)2 2 Αλβουμίνη-SH + Et3P=O
Ο μηχανισμός μεταφοράς της αουρανοφίνης μπορεί να παρασταθεί από το παρακάτω
σχήμα:
Σχήμα 5. Μεταφορά της αουρανοφίνης από το πλάσμα στο κυτταρόπλασμα μέσω
πρωτεϊνικών θειολών
Οι ενώσεις του χρυσού συγκεντώνονται κυρίως στο πλάσμα του αίματος αλλά και στα
μακροφάγα, στο ήπαρ και στα νεφρά. Ο αουρανοφίνη επίσης, εντοπίζεται και μέσα στα
ερυθρά αιμοσφαίρια. Ο χρυσός απομακρύνεται μέσω των νεφρών. Ο χρόνος απομάκρυνσης
του χρυσού από τον οργανισμό είναι μεγάλος, με βιολογικό χρόνο ημιζωής περίπου 20
ημέρες.
• RSH: εξωκυτταρικές θειόλες (αλβουμίνη)
• MSH: μεμβρανικές πρωτεϊνες μεταφοράς με σουλφυδρυλικές ομάδες)
• CSH : κυτοσολικές θειόλες (GSH)

ΧΡΗΣΗ ΕΝΩΣΕΩΝ ΣΥΝΑΡΜΟΓΗΣ ΣΤΗ ΘΕΡΑΠΕΙΑ
111
Ο μηχανισμός δράσης των φαρμάκων του χρυσού δεν έχει διευκρινιστεί πλήρως, η
αουρανοφίνη φαίνεται πως αναστέλλει τη δράση της κολλαγενάσης των ουδετερόφιλων,
ένζυμο που περιέχει ομάδες Cys κι με αυτό το τρόπο εντοπίζεται στις αρθρώσεις. Επίσης
υπάρχουν ενδείξεις ότι ο χρυσός αναστέλλει την αναγωγάση της θειορεδοξίνης. (Η αναγωγάση
της θειορεδοξίνης είναι ένα ένζυμο που συμμετέχει στη φυσιολογική διαδικασία
αποτοξίνωσης του οργανισμού από τις ελεύθερες ρίζες, αλλά και ενοχοποιείται για την
συμμετοχή της στην ενεργοποίηση του ανοσοποιητικού συστήματος).
5. Προϊόντα βιομετατροπής του χρυσού (Ι)
Ένας κοινός μεταβολίτης που εμφανίζεται στα ούρα και το πλάσμα ασθενών που
υποβάλλονται σε θεραπεία χρυσού είναι η ένωση [Au(CN)2]-. Ο δικυανοχρυσός(Ι)
σχηματίζεται στα λευκοκύτταρα από τη μυελο-υπεροξειδάση η οποία μπορεί να μετατρέψει
τα ιόντα θειοκυανίου ( SCN-) σε ιόντα κυανίου (CN
-). Το σύμπλοκο αυτό παρεμποδίζει την
οξειδωτική έκρηξη στα κύτταρα αυτά και εμφανίζει αντιαρθριτική κι αντικαρκινική δράση
αλλά και δράση κατά του ιού HIV. Η υψηλή συγκέντρωση χρυσού στα ερυθρά αιμοσφαίρια
των καπνιστών πιθανώς να οφείλεται στην εισπνοή HCN από τον καπνό.
Στο εσωτερικό του κυττάρου σχηματίζεται σύμπλοκο χρυσού(Ι) με τη γλουταθειόνη.
Au(SR)2- + GSH [Αu(SG)2]
-
Άλλα προϊόντα βιομετατροπής του χρυσού είναι η οξείδωση του χρυσού από Au(I) σε
Au(III) από μερικά από ισχυρά οξειδωτικά όπως το H2O2 και τα υποχλωριώδη ιόντα (ClO
-)
που είναι διαθέσιμα στις φλεγμονές.
1/n[AuSR]n + 4OCl- + 2H
+ AuCl4
- + RSO3
- + H2O
Et3PAuSR + 5OCl- +2H
+ AuCl4
- + AtgSO3
- + Et3P=O + H2O + Cl
-
Ο AuΙΙΙ
Cl4-
που σχηματίζεται, μπορεί προκαλέσει τη τροποποίηση της αναγνώρισης
πεπτιδίων από Τ λευκοκύτταρα, την αποπρωτονίωση αμιδίων καθώς και την οξείδωση των
δισουλφιδικών δεσμών στην λευκωματίνη και την ινσουλίνη. Ο σχηματισμός των προϊόντων
αυτών μπορεί να ευθύνεται για τη τοξική δράση των φαρμάκων του χρυσού.
6. Χρήσεις-Αντενδείξεις- Ανεπιθύμητες ενέργειες- Αλληλεπιδράσεις:
Οι ενώσεις του χρυσού χρησιμοποιούνται για την αντιμετώπιση της βαριάς ενεργούς
ρευματοειδούς αρθρίτιδας, της χρόνιας νεανικής αρθρίτιδας, της ψωριασικής αρθρίτιδας,

ΚΕΦΑΛΑΙΟ 4
112
καθώς και για το σύνδρομο Sjorgen με ρευματοειδή αρθρίτιδα αλλά και για τον παλίνδρομο
ρευματισμό. Τα φάρμακα αυτά δεν πρέπει να χορηγούνται εάν υπάρχει ιστορικό
υπερευαισθησίας στο φάρμακο ή σε άλλα βαρέα μέταλλα, ηπατική ή νεφρική ανεπάρκεια,
κύηση, βαριές δερματοπάθειες, συστηματικός ερυθηματώδης λύκος. Επίσης, σε αρρώστους
που έχουν παρουσιάσει κατά το παρελθόν τοξικές αντιδράσεις από το μυελό των οστών.
Η αουρανoφίνη που χορηγείται από το στόμα, μπορεί να συνοδεύεται από
ανεπιθύμητες ενέργειες στο γαστρεντερικό σύστημα, όπως: διάρροια, μεταλλική γεύση,
στοματίτιδα, γλωσίτιδα, ανορεξία, δυσκοιλιότητα, φούσκωμα, δυσπεψία, δυσκολία γεύσης και
σπάνια δυσφαγία, αιμοραγία από το γαστρεντερικό, ελκώδη εντεροκολίτιδα. Στο δέρμα
μπορεί να εμφανιστούν εξανθήματα, φαγούρα, αλωπεκία, οιδήματα. Στο αιμοποιητικό
σύστημα: λευκοπενία, αναιμία, θρομβοκυττοπενία, ουδετεροπενία, εωσινοφιλία, αναιμία,
απλαστική αναιμία. Στα νεφρά: πρωτεϊνουρία, αιματουρία και στο ήπαρ: ίκτερος, ηπατίτιδα,
τοξική ηπατίτιδα, χολόσταση. Επίσης μπορεί να παρατηρηθεί: χολοστατικός ίκτερος, πυρετός,
εντερική ίνωση, περιφερική νευροπάθεια.
Ανεπιθύμητες ενέργειες μπορούν να εμφανισθούν και μετά πάροδο μηνών από τη
διακοπή του φαρμάκου. Τα φάρμακα του χρυσού δεν πρέπει να χορηγούνται μαζί με
χλωροκίνη και υδροξυχλωροκίνη, γιατί αυξάνεται η τοξικότητά του χρυσού. Με παρααμινο-
βενζοϊκό οξύ μπορεί να επιδεινωθούν υπάρχοντα εξανθήματα. Tα κορτικοειδή μειώνουν τη
δραστικότητα και αυξάνουν την τοξικότητά του.
Η χρυσοθεραπεία πρέπει να γίνεται κάτω από άμεση ιατρική παρακολούθηση. Κλινική
εξέταση, εξέταση ούρων και αίματος (γενική και αιμοπετάλια) να γίνονται πριν από την ένεση
και κάθε 15 μέρες. Ιδιαίτερη προσοχή σε ηλικιωμένα άτομα ή άτομα με δερματοπάθειες ή
κολίτιδα και σε θηλάζουσες. Επίσης σε διαβητικά άτομα ή άτομα με καρδιακή ανεπάρκεια.
Διακοπή της θεραπείας σε περιπτώσεις διαταραχών αίματος (π.χ. λευκοπενία), νεφρικής
βλάβης (έκδηλης λευκωματουρίας), γενικευμένου εξανθήματος, εξελκώσεων στόματος ή αν
δε σημειωθεί κλινικοεργαστηριακή βελτίωση της νόσου μετά από συμπλήρωση ολικής δόσης
1 g.
7. Δοσολογία
Η χορήγηση του θειομαλικού χρυσού γίνεται ενδομυϊκά μία φορά την εβδομάδα.
Πρώτη ένεση 10mg, δεύτερη 25mg και ακολούθως 25-50mg μέχρι να συμπληρωθεί ολική

ΧΡΗΣΗ ΕΝΩΣΕΩΝ ΣΥΝΑΡΜΟΓΗΣ ΣΤΗ ΘΕΡΑΠΕΙΑ
113
δόση 1-1,2 g. Στη συνέχεια χορηγούνται 50 mg κάθε 2 ή 3 εβδομάδες, ανάλογα με την
απόκριση του ασθενούς, και ακολούθως μία ένεση των 50 mg κάθε μήνα για διάρκεια πολλών
ετών και κατά περίπτωση. Το Auranofin χορηγείται από το στόμα 3 mg δύο φορές την ημέρα
ή 6 mg μια φορά την ημέρα. Στην περίπτωση αυτή αναφέρονται και ανεπιθύμητες ενέργειες
από το πεπτικό (ναυτία, δυσπεψία, επιγαστρικός πόνος, διάρροια). Σε παιδιά κάτω των 25 kg
η εβδομαδιαία δόση να μην υπερβαίνει τα 10 mg και για παιδιά πάνω από 25-50 kg να μην
υπερβαίνει τα 20 mg.
8. Τύχη στον οργανισμό
Η απορρόφηση του auranofin που λαμβάνεται από το στόμα ανέρχεται στο 25%. Ο
χρόνος ημιζωής του στο πλάσμα ανέρχεται σε 26 ημέρες. Περίπου 3 μήνες απαιτούνται για
την σταθεροποίηση των επιπέδων του φαρμάκου στο αίμα. Η ένωση μεταβολίζεται και
αποβάλλεται από τα ούρα όσο και κόπρανα.

ΚΕΦΑΛΑΙΟ 4
114
ΙΙΙ. ΦΑΡΜΑΚΕΥΤΙΚΕΣ ΕΝΩΣΕΙΣ ΤΟΥ ΒΙΣΜΟΥΘΙΟΥ/ΑΡΓΙΛΙΟΥ ΚΑΤΑ ΤΟΥ
ΕΛΚΟΥΣ
Το βισμούθιο χρησιμοποιείται για την θεραπεία των γαστροεντερικών παθήσεων εδώ
και αρκετούς αιώνες. Η πρώτη ένωση του βισμουθίου, γνωστή από τον 17ο αιώνα ως
“magisterium bismuti” είναι το υπονιτρικό βισμούθιο (ΙΙΙ), [Bi6O4(OH)4](NO3)6 το οποίο είχε
χρησιμοποιηθεί ως καλλυντικό. Όλες οι φαρμακευτικές του ενώσεις όπως το κολλοειδές
υποκιτρικό βισμούθιο, τα σαλικυλικά και τα νιτρικά άλατα του βισμουθίου περιλαμβάνουν το
βισμούθιο στη κατάσταση Bi(III) κι οι δομές τους δεν είναι πλήρως διευκρινισμένες. Η
γεωμετρία των ενώσεων αυτών δεν είναι η συνηθισμένη και οι αριθμοί συναρμογής είναι
κυμαίνονται μεταξύ 3 και 10. Το Bi(III) είναι ισχυρά όξινο στο νερό (pKa ~ 1.5) και έχει τη
τάση να σχηματίζει σταθερά πολυπυρηνικά συγκροτήματα αποτελούμενα από υδρόξυ- και
όξο-γέφυρες, όπως φαίνεται στα παρακάτω σχήματα.
Δομή υπονιτρικού βισμουθίου (ΙΙΙ).
Τρικαλιούχο δικιτρικό βισμούθιο
Tripotassium Dicitrato Bismuthate
Εμπορική ονομάσια: De-nol
Το τρικαλιούχο δικιτρικό βισμούθιο (ή υποκιτρικό βισμούθιο) αποτελεί κολλοειδή
σύμπλοκη ένωση βισμουθίου και κιτρικού οξέος. Η ένωση βοηθά στην επούλωση του
πεπτικού έλκους ασκώντας τοπική προστατευτική δράση.
Στην επούλωση του πεπτικού έλκους σημαντικό ρόλο παίζουν η κινητοποίηση και
ενίσχυση μηχανισμών, που ασκούν κυτταροπροστατευτική δράση.
Tα τελευταία χρόνια έχει δοθεί μεγαλύτερη έμφαση στο φάρμακο χάρις στη χρήση
του, σε συνδυασμό με αντιμικροβιακά, στη θεραπεία εκρίζωσης του ελικοβακτηριδίου του

ΧΡΗΣΗ ΕΝΩΣΕΩΝ ΣΥΝΑΡΜΟΓΗΣ ΣΤΗ ΘΕΡΑΠΕΙΑ
115
πυλωρού (helicobacter pylori) με φάρμακα (μετρονιδαζόλη, αμπικιλλίνη, αμοξυκιλλίνη, κ.ά.)
σε τριπλά σχήματα.
1. Χημική δομή-Μηχανισμός δράσης
Από άποψη δομής το σύμπλοκο του βισμουθίου(ΙΙΙ) με τα κιτρικά είναι διμερείς
επαναλαμβανόμενες μονάδες [(cit)BiBi(cit)]2-
με γέφυρες κιτρικού ανιόντος. Τα διμερή αυτά
σχηματίζουν επίπεδα φύλλα, τα οποία μέσω δεσμών υδρογόνου μεταξύ του κιτρικού ανιόντος
και ύδατος σχηματίζουν πολυμερή συσσωματώματα που εναποτίθενται στην επιφάνεια του
έλκους και εμποδίζουν τα οξέα του στομάχου να έρθουν σε επαφή με τα τοιχώματα του
στομάχου. Τα συγκροτήματα αυτά του βισμουθίου(ΙΙΙ) και του κιτρικού άλατος είναι
σταθερά από pH περίπου 3,5 έως 7,5. Το [ΒiIII
(Hcit)] μπορεί να διαλυτοποιηθεί από πλήθος
αμινών.
Από βιολογική άποψη οι ενώσεις του βισμουθίου έχουν την ικανότητα να δεσμεύονται
στις πρωτεϊνες και τα ένζυμα. Αν και η ιονική ακτίνα του BiIII
(1.03Å) είναι μεγαλύτερη από
αυτή του FeIII
(0.64Å), το βισμούθιο δεσμεύεται από τη πρωτεϊνη μεταφοράς του σιδήρου στο
πλάσμα, τρανσφερρίνη. Επιπλέον θειόλες όπως η κυστεϊνη και η γλουταθειόνη φαίνεται ότι
είναι ουσιώδεις στη μεταφορά του βισμουθίου στα κύτταρα και τα βιολογικά υγρά, ενώ οι
θειόλες παρεμποδίζουν τη καταβύθιση του κολλοειδούς υποκιτρικού βισμουθίου (CBS) σε pH
2.0. Η δραστικότητα του βισμουθίου (ΙΙΙ) κατά του έλκους επίσης σχετίζεται με την
αντιμικροβιακή του δράση έναντι του βακτηριδίου helicobacter pylori.
Αν και η δράση του είναι τοπική, εντούτοις, μικρή ποσότητα (0.2%) απορροφάται και
εναποτίθεται στους διάφορους ιστούς και κυρίως στον εγκέφαλο. Η αποβολή του γίνεται από
τους νεφρούς σε διάστημα μεγαλύτερο του τριμήνου. Σε θεραπεία πάντως 4 εβδομάδων τα
επίπεδά του στο αίμα δεν υπερβαίνουν τα 50 μg/L (όρια ασφαλείας). Σε νεφρική ανεπάρκεια

ΚΕΦΑΛΑΙΟ 4
116
υπάρχει κίνδυνος πρόκλησης εγκεφαλοπάθειας. Η βραδεία αποβολή του φαρμάκου και η
εναπόθεσή του στους ιστούς αποκλείουν τη χρήση του για μακρά θεραπεία συντήρησης
(πρόληψη υποτροπών).
2. Χρήσεις-Δοσολογία-Παρενέργειες-Αντενδείξεις
Χρησιμοποιείται για την αντιμετώπιση του γαστροδωδεκαδακτυλικού έλκους. Οι
ανεπιθύμητες ενέργειες του φαρμάκου είναι σπάνιες κι αναφέρονται ναυτία, ξηροστομία,
δυσκοιλιότητα, επιγαστρική δυσφορία, επίταση του πόνου του έλκους, εξανθήματα.
Σπανιότατα και σε επανειλημμένους κύκλους θεραπείας με υψηλές δόσεις, περιγράφεται
εγκεφαλοπάθεια. Μπορεί να παρατηρηθεί επίσης κατά τη διάρκεια λήψης του φαρμάκου
παροδική αμαύρωση οδόντων και γλώσσας. Το φάρμακο αυτό παρουσιάζει αλληλεπιδράσεις
με αντιόξινα, τροφές ή γάλα γιατί σχηματίζονται χηλικές ενώσεις του βισμουθίου, που
μειώνουν την αποτελεσματικότητά του. Η προκαλούμενη επίσης αύξηση του pH εμποδίζει
την κατακρήμνιση του βισμουθίου στις ελκωτικές βλάβες.Το φάρμακο αυτό δεν πρέπει να
χορηγείται σε άτομα με νεφρική ανεπάρκεια καθώς και κατά τη διάρκεια της κύησης.
Χορηγείται σε δόσεις των 300 mg 4 φορές την ημέρα ή 600 mg 2 φορές. Σε ανθεκτικά έλκη
μπορούν να χορηγηθούν 300 mg 6 φορές ημερησίως.
Μια άλλη φαρμακευτική ένωση που χρησιμοποιείται για τη κυτταροπροστατευική της
δράσης έναντι του έλκους είναι και η:
Σουκραλφάτη
Sucralfate
Η σουκραλφάτη είναι σύμπλοκη ένωση υδροξειδίου του αργιλίου με θειωμένη
σακχαρόζη, με χημικό τύπο C12H14O11(SO3Al(OH)2)8·(Al(OH)3)x·(H2O)y, όπου x = 8-10 και y
= 22-31. Η ένωση αυτή είναι αδιάλυτη στο ύδωρ και την αλκοόλη. Στο όξινο περιβάλλον του
στομάχου πολυμερίζεται μετατρεπόμενη σε εντόνως κολλώδη και ιξώδη γέλη, ενώ η
εξουδετερωτική του οξέος ικανότητα είναι αμελητέα. Η σχηματιζόμενη γέλη προσκολλάται
στο επιθήλιο του γαστρικού βλεννογόνου και τις ελκωτικές επιφάνειες σχηματίζοντας
προστατευτική στιβάδα. Η απορρόφηση του φαρμάκου από το έντερο είναι πολύ μικρή (3-

ΧΡΗΣΗ ΕΝΩΣΕΩΝ ΣΥΝΑΡΜΟΓΗΣ ΣΤΗ ΘΕΡΑΠΕΙΑ
117
5%) και η αποβολή του γίνεται από τους νεφρούς. Σε νεφρική ανεπάρκεια υπάρχει κίνδυνος
από τις αυξημένες τιμές του αργιλίου στο αίμα.
1. Χρήσεις- Ανεπιθύμητες ενέργειες- Αλληλεπιδράσεις- Δοσολογία
Χρησιμοποιείται για την αντιμετώπιση του γαστροδωδεκαδακτυλικού έλκους κι
ανήκει στά κυτταροπροστατευτικά φάρμακα κατά του έλκους. Το ποσοστό των ανεπιθύμητων
ενεργειών είναι χαμηλό (4.7%) λόγω έλλειψης, ουσιαστικώς, συστηματικής δράσης. Η
δυσκοιλιότητα είναι η συνηθέστερη από αυτές (2.2%). Επίσης, σε ποσοστό < 1%
αναφέρονται ξηροστομία, διάρροια, ναυτία, επιγαστρική δυσφορία, εξανθήματα, ζάλη,
μετεωρισμός, κεφαλαλγία, αϋπνίες.
Μπορεί να μειώσει τη βιοδιαθεσιμότητα της βαρφαρίνης, διγοξίνης, θεοφυλλίνης,
νορφλοξασίνης, ρανιτιδίνης, σιμετιδίνης, σιπροφλοξασίνης, τετρακυκλίνης, φαινυτοΐνης και
πιθανώς και άλλων εξαιτίας των προσροφητικών ιδιοτήτων της.
Δεν πρέπει να χορηγείται σε περιπτώσεις νεφρικής ανεπάρκειας καθώς και με
ταυτόχρονη χορήγηση αντιόξινων. Να χορηγείται 1 ώρα πριν ή 2 ώρες μετά τα γεύματα για
την αποφυγή δέσμευσής της από τις πρωτεΐνες των τροφών.
Συνήθης δόση 1 g 4 φορές την ημέρα. Σε ανθεκτικές περιπτώσεις μέχρι 8 g/24ωρο σε
κατανεμημένες λήψεις. Διάρκεια θεραπείας 4 εβδομάδες ή μέχρι να επουλωθεί το έλκος.
Μέγιστη διάρκεια θεραπείας, 12 εβδομάδες.
Ρανιτιδίνη κιτρικό βισμούθιο
Ranitidine Bismuth Citrate
Εμπορικές ονομασίες: Pylorid, Tritec
Χημική ονομασία: Ν-2-[5-διμεθυλαμινομεθυλο-2-φουρανυλομεθυλοθειο]αιθυλο-Ν΄-μεθυλο-
2-νιτροαιθενοδιαμίνη 2-υδροξυλο-1,2,3-προπανοτρικαρβοξυλικό οξύ βισμούθιο (ΙΙΙ).

ΚΕΦΑΛΑΙΟ 4
118
Η ένωση αυτή ανήκει στους ανταγωνιστές των υποδοχέων ισταμίνης Η-2 και δρα
προκαλώντας αναστολή στην έκκριση των γαστρικών υγρών. Ταυτόχρονα παρουσιάζει και τη
κυτταροπροστατευτική δράση στα τοιχώματα του στομάχου όπως και το θποκιτρικό
βισμούθιο. Σχηματίζεται κατά την επίδραση του οργανικού ανταγωνιστή ισταμίνης ρανιτιδίνη
στο υποκιτρικό βισμούθιο (ΙΙΙ). Η στοιχειομετρία του μορίου δεν έχει πλήρως διευκρινιστεί,
θεωρείται όμως ότι η ρανιτιδίνη και το κιτρικό οξύ δεν βρίσκονται σε ισομοριακή αναλογία.
Η ένωση αυτή περιλαμβάνει ένα πενταμελή δακτύλιο που σχηματίζεται κατά τη συναρμογή
της ρανιτιδίνης με το βισμούθιο μέσω του αζώτου NMe2 και του οξυγόνου του φουρανίου.
1. Χρήσεις-Βιολογική δράση
Θεραπεία εκρίζωσης ελικοβακτηριδίου σε περιπτώσεις γαστροδωδεκαδακτυλικού
έλκους (θεραπεία επούλωσης και πρόληψης υποτροπών), σε συνδυασμό με αντιμικροβιακό.
Η ρανιτιδίνη είναι ένας ανταγωνιστής των υποδοχέων ισταμίνης Η2 και δρα
δεσμεύοντας τους H2-υποδοχείς της ισταμίνης στη μεμβράνη των τοιχωματικών κυττάρων
του στομάχου, αναστέλλοντας έτσι την έκκριση οξέος. Οι H2-ανταγωνιστές αποτελούν
σταθμό στη θεραπευτική αντιμετώπιση του έλκους, χάρις στα ιδιαίτερα πλεονεκτήματά τους,
δηλαδή τη ταχεία υποχώρηση των ενοχλημάτων, τη ταχεία επούλωση του έλκους (σε 4-8
εβδομάδες), και τη πολύ καλή ανοχή από τους ασθενείς (περιορισμένες ανεπιθύμητες
ενέργειες). Tα τελευταία χρόνια έχει δοθεί μεγαλύτερη έμφαση στην ένωση αυτή χάρις στη
χρήση της, σε συνδυασμό με αντιμικροβιακά, φάρμακα (μετρονιδαζόλη, κλαριθρομυκίνη,
αμοξυκιλλίνη, κ.ά.) σε τριπλά σχήματα στη θεραπεία εκρίζωσης του H.p.
2. Δοσολογία – Παρενέργειες – Αντενδείξεις
Χορηγείται σε δισκία των 400 mg με δόση δύο φορές την ημέρα για 2 εβδομάδες σε
συνδυασμό με αντιμικροβιακό (π.χ. κλαριθρομυκίνη 1-1.5 g ή αμοξυκιλλίνη 2 g) και για
άλλες 2 εβδομάδες μόνο του.
Παρενέργειες του φαρμάκου μπορεί να είναι ναυτία, διάρροια, κεφαλαλγία. Αλλά η
εμφάνισή τους δεν είναι συχνή. Το φάρμακο δε πρέπει να χορηγείται όταν υπάρχει νεφρική
ανεπάρκεια, ηπατική ανεπάρκεια ή οξεία πορφυρία. Επίσης δε πρέπει να λαμβάνεται
ταυτόχρονα με ηρεμιστικά, αντιπηκτικά, φενυντοϊνες και καρβαζεπίνη, αντιδιαβητικά
φάρμακα λαμβανόμενα από το στόμα και αντιμηκυτιασικά.

ΧΡΗΣΗ ΕΝΩΣΕΩΝ ΣΥΝΑΡΜΟΓΗΣ ΣΤΗ ΘΕΡΑΠΕΙΑ
119
ΙV. ΕΝΩΣΕΙΣ ΣΥΝΑΡΜΟΓΗΣ ΓΙΑ ΤΙΣ ΚΑΡΔΙΑΓΓΕΙΑΚΕΣ ΠΑΘΗΣΕΙΣ
Νιτροπρωσσικό νάτριο
Πεντακυανονιτροζυλοσιδηρικό Νάτριο
Nitroprusside Sodium Dihydrate (Nipride)
1. Χημική Δομή – Σύνθεση
Το νιτροπρωσσικό νάτριο, (Na2[Fe(CN)5NO]), είναι ένα οκταεδρικό σύμπλοκο του
Fe2+
χαμηλού spin, που περιέχει τη νιτρόζυλο ομάδα +Ν=Ο. Η νιτρόζυλο ομάδα
συναρμόζεται με το σίδηρο δίνοντας το ελεύθερο ζεύγος ηλεκτρονίου που διαθέτει το άζωτο
προς το μέταλλο, ταυτόχρονα όμως συνδέεται με π-σύνδεση, όπου ο Fe επαναχορηγεί
ηλεκτρονική πυκνότητα στο π* κενό τροχιακό του νιτρόζο κατιόντος. Είναι ένα κόκκινο
κρυσταλλικό στερεό που κρυσταλλώνει με δύο μόρια νερού, Na2[Fe(CN)5NO]·2Η2Ο.
Διαλύεται καλά στο νερό και λιγότερο καλά στην αιθανόλη. Εν διαλύσει βρίσκεται υπό
μορφή ανιόντος [Fe(CN)5NO]-2
, ενώ η δραστική του ομάδα είναι η σιδηρο-νιτροζυλο ομάδα.
Εμφανίζει αγγειοδιασταλτική δράση και χορηγείται κλινικά σε επείγουσες περιπτώσεις
υπέρτασης, εμφράγματος καθώς και στις εγχειρήσεις.
Σύνθεση: Ένας τρόπος σύνθεσης είναι από θειικό δισθενή σίδηρο με επίδραση
κυανιούχου καλίου και στη συνέχεια με θέρμανση με νιτρώδες κάλιο.
5 KCN + 2 FeSO4 K[Fe2(CN)5] + 2 K2SO4
2 K[Fe2(CN)5] + 2 NaNO2 Na2[Fe(CN)5(NO)] + KNO2 + FeO
2. Μηχανισμός Δράσης
Ο μηχανισμός δράσης του νιτροπρωσσικού νατρίου βασίζεται στην απελευθέρωση
μονοξειδίου του αζώτου (ΝΟ). Το μονοξείδιο του αζώτου είναι ελεύθερη ρίζα, η οποία

ΚΕΦΑΛΑΙΟ 4
120
φυσιολογικά παράγεται από τα ενδοθηλιακά κύτταρα των αιμοφόρων αγγείων με επίδραση
του ενζύμου συνθετάση του μονοξειδίου του αζώτου στην L-αργινίνη. Το ενδοθήλιο
χρησιμοποιεί το ΝΟ για τη μεταφορά μηνύματος στους περιβάλλοντες λείους μυες για
χαλάρωση, με αποτέλσμα τη διαστολή του αγγείου και την αύξηση της ροής του αίματος2.
Δεν είναι ακριβώς γνωστός ο μηχανισμός απελευθέρωσης του ΝΟ από το μόριο του
νιτροπρωσσικού νατρίου. Θεωρείται ότι το σύμπλοκο απελευθερώνει ΝΟ, το μέταλλο
οξειδώνεται από Fe(II) και Fe(III) καθώς και ανταλλάσσονται ιόντα κυανίου από τη σφαίρα
συναρμογής του. Ο κυριότερος μεταβολισμός του νιτροπρωσσικού νατρίου λαμβάνει χώρα
στα ερυθροκύτταρα και στο ήπαρ. Στα ερυθρά αιμοσφαίρια απελευθερώνονται κυανιούχα από
το σύμπλοκο με αποτέλεσμα η αιμογλοβίνη να μετατρέπεται σε κυανομεθαιμογλοβίνη. Στο
ήπαρ ιόντα κυανίου μετατρέπονται με επίδραση θειοθειικών από το ένζυμο ροδανάση, σε
θειοκυανιούχα (SCN-). Τα θειοκυανιούχα απεκκρίνονται από τα νεφρά το οποίο κι αποτελεί
μηχανισμός αποτοξίνωσης του οργανισμού. Όταν τα επίπεδα θειοθειικών στον οργανισμό δεν
είναι αρκετά, τότε τα κυανιούχα φτάνουν γρήγορα τοξικά επίπεδα. Το νιτροπρωσσικό
εμφανίζει τη δράση του εντός μερικών δευτερολέπτων κι ο χρόνος ημιζωής του είναι
λιγότερος από 10 λεπτά, ενώ ο χρόνος ημιζωής των απεκκρινόμενων θειοκυανιούχων είναι
αρκετές ημέρες. Η διάρκεια της θεραπείας δε πρέπει να ξεπερνά τις 72 ώρες ενώ τατυτόχρονα
πρέπει να παρακολουθούνται τα επίπεδα θειοκυανιούχων στο αίμα.
3. Ενδείξεις- Αντενδείξεις: Αλληλεπιδράσεις- Ανεπιθύμητες ενέργειες
Χρησιμοποιείται σε περιπτώσεις υπερτασικής κρίσης, για τον έλεγχο υπέρτασης κατά
τη διάρκεια χειρουργείου, καθώς και στην οξεία ή χρόνια καρδιακή ανεπάρκεια. Το
νιτροπρωσσικό ελαττώνει τη πίεση του αίματος στα επιθυμητά επίπεδα, ρυθμίζοντας και τη
ροή των αρτηριών αλλά και των φλεβών εντός μερικών λεπτών μετά την έγχυση. Μπορεί να
εφαρμοστεί έτσι και σε περιπτώσεις καρδιογενούς καρδιακής ανεπάρκειας, όπου αυξάνει το
ρυθμό της καρδιάς. Σε περιπτώσεις που ο ρυθμός του καρδιακού μυ είναι φυσιολογικός τότε
προκαλεί μείωση της πίεσης του αίματος. Παρότι μπορεί να έιναι τοξικό λόγο των
κυανιούχων που απελευθερώνει, χρησιμοποιείται ακόμα στη κλινική πρακτική σε περιπτώσεις
2 Η αποσαφήνιση του ρόλου του ΝΟ στο καρδιαγγειακό σύστημα από τους R.F. Furchgott, L.J. Ignarro, F.
Murad, βραβεύτηκε με το Νόμπελ Ιατρικής, Φυσιολογίας το 1998.

ΧΡΗΣΗ ΕΝΩΣΕΩΝ ΣΥΝΑΡΜΟΓΗΣ ΣΤΗ ΘΕΡΑΠΕΙΑ
121
κακοήθους υπέρτασης (όπου παρουσιάζονται σοβαρή ηπατική δυσλειτουργία, έλλειψη
βιταμίνης Β12, οπτική ατροφία του Leber, κρανιακοί όγκοι, μεταβολική εγκεφαλοπάθεια).
Ανεπιθύμητες ενέργειες που συνοδεύονται από τη χορήγηση νιτροπρωσσικού νατρίου
είναι κεφαλαλγία, ζάλη, ναυτία, ερυγές, κοιλιακό άλγος, εφίδρωση, αίσθημα παλμών,
ανησυχία, οπισθοστερνική δυσφορία-υποχωρούν με ελάττωση του ρυθμού έγχυσης.
Αντενδύκνειται η χορήγησή του σε περιπτώσεις υποθυρεοειδισμού, σοβαρής νεφρικής
δυσλειτουργίας, σε ηλικιωμένους, σε διαταραχές της εγκεφαλικής κυκλοφορίας. Λόγω της
ταχείας έναρξης δράσης η χορήγησή της πρέπει να γίνεται σε μονάδα εντατικής
παρακολούθησης. Κατά την παρατεταμένη χορήγησή της χρειάζεται παρακολούθηση των
επιπέδων των κυανιούχων του πλάσματος (όριο μέχρι 10 mg / dl). Εάν αυξηθούν περαιτέρω
μπορεί να προκληθεί αίσθημα εξάντλησης, ναυτία, αποπροσανατολισμός μέχρι ψυχώσεως. Η
υποψία τίθεται εάν εμφανισθεί μεταβολική οξέωση. Αντιμετωπίζεται με διακοπή της
χορήγησης, ενώ σαν αντίδοτα χρησιμοποιούνται αρχικά 4-6 mg νιτρικού νατρίου 35% σε 2
min και ακολούθως 50 ml διαλύματος θειοθειϊκού νατρίου 25%. Αναφέρεται πρόληψη με
ταυτόχρονη χορήγηση υδροξυκοβαλαμίνης.
4. Δοσολογία και χορήγηση:
Χορηγείται με ενδοφλέβια έγχυση μέσω ογκομετρικής αντλίας, σε διάλυμα 5%
δεξτρόζης, αρχικά 0.3-1 μg/kg/min και προσαρμογή της δοσολογίας ανάλογα με το
αποτέλεσμα, με συνήθη δόση 0.5-6 μg/kg/ min και μέγιστη δόση 8 μg/kg/min. Στην καρδιακή
ανεπάρκεια: Αρχικά 10-15 μg/ min και αύξηση ανά 5-10 min. Συνήθης δόση 10-200 μg/min
και μέγιστη δόση 280 μg/ min (4 μg/min). Η σύριγγα πρέπει να φυλλάσσεται μακριά από το
φως και όχι για περισσότερο από 24 ώρες. Το νιτροπρωσσικό είναι φωτο-ευαίσθητο και όταν
παραμείνει αρκετή ώρα στο φως διασπάται απελευθερώνοντας κυανιούχα.

ΚΕΦΑΛΑΙΟ 4
122

ΧΡΗΣΗ ΕΝΩΣΕΩΝ ΣΥΝΑΡΜΟΓΗΣ ΣΤΗ ∆ΙΑΓΝΩΣΗ
123
ΚΕΦΑΛΑΙΟ 5
ΧΡΗΣΗ ΕΝΩΣΕΩΝ ΣΥΝΑΡΜΟΓΗΣ ΣΤΗ ∆ΙΑΓΝΩΣΗ
Οι ενώσεις συναρµογής που βρίσκουν εφαρµογή στην διάγνωση ασθενειών, είναι
κυρίως ενώσεις συναρµογής ραδιονουκλιδίων (µεταλλικά ραδιοφάρµακα) ή ενώσεις
συναρµογής παραµαγνητικών µετάλλων ως αντιδραστήρια αντίθεσης MRΙ.
Οι ενώσεις αυτές όπως και όλα τα αντιδραστήρια που χρησιµοποιούνται στην
απεικόνιση οργάνων ή ιστών του σώµατος, πρέπει να τηρούν τα εξής βασικά κριτήρια:
1. Πρέπει να συγκεντρώνονται εκλεκτικά σε όργανα ή περιοχές οργάνων ή ιστών έτσι
ώστε να επιτυγχάνεται η απεικόνιση συγκεκριµένου οργάνου και η διάκριση
µεταξύ υγιών και µη περιοχών. Η εκλεκτική συγκέντρωση εξασφαλίζεται από τις
φυσικοχηµικές ιδιότητες των ενώσεων συναρµογής καθώς και από τις
φαρµακοφόρες οµάδες που φέρει ο συναρµοτής που συναρµόζεται µε το µέταλλο.
Για το λόγο αυτό το µεταλλικό ιόν θα πρέπει να έχει χηµικές ιδιότητες που να
παρέχουν την δυνατότητα σύνθεσης ποικιλίας ενώσεων συναρµογής.
2. ∆εν πρέπει να παρουσιάζουν τοξικότητα στις συγκεντρώσεις εκείνες, που
εξασφαλίζουν τη δυνατότητα απεικόνισης.
3. Πρέπει να αποβάλλονται από τον οργανισµό σε σύντοµο χρονικό διάστηµα µετά
την χορήγηση, χωρίς να παρέχουν τοξικά προϊόντα µεταβολισµού.
4. Στις περιπτώσεις που το µεταλλικό ιόν ή ο συναρµοτής εµφανίζουν τοξικότητα, θα
πρέπει οι ενώσεις συναρµογής να χαρακτηρίζονται από µεγάλη in vivo
σταθερότητα.

ΚΕΦΑΛΑΙΟ 5
124
Ι. ΑΠΕΙΚΟΝΙΣΗ ΜΕ ΧΡΗΣΗ ΡΑ∆ΙΟΝΟΥΚΛΙ∆ΙΩΝ
Τα ραδιονουκλίδια που χρησιµοποιούνται στις τεχνικές απεικόνισης είναι ασταθή
νουκλίδια τα οποία διασπώνται µε την εκποµπή β+, γ ακτινοβολίας ή µε β- και γ
ακτινοβολία ταυτόχρονα. Είναι κατά κανόνα τεχνητά ραδιενεργά νουκλίδια τα οποία
παράγονται σε πυρηνικούς αντιδραστήρες ή κύκλοτρα µε βοµβαρδισµό σταθερών
νουκλιδίων µε σωµατίδια. Στο κεφάλαιο αυτό θα ασχοληθούµε µε ραδιοφάρµακα που
εκπέµπουν γ ακτινοβολία.
Τα ραδιοφάρµακα γενικά, είναι ανόργανες ή οργανικές ενώσεις ραδιονουκλιδίων
που προορίζονται για ασφαλή και χρήσιµη χορήγηση στον άνθρωπο, µε σκοπό την
διάγνωση ή θεραπεία. (Radiopharmaceuticals ή Radioactive drugs).
Εκτός από τα γενικά κριτήρια που αναφέρθηκαν παραπάνω, τα ραδιονουκλίδια που
θα χρησιµοποιηθούν στην σύνθεση διαγνωστικών ραδιοφαρµακευτικών ενώσεων, θα
πρέπει επίσης να πληρούν τους παρακάτω όρους:
1. Αποκλειστική εκποµπή γ ή Χ ακτινοβολίας, χωρίς ταυτόχρονη εκποµπή
σωµατιδιακής ακτινοβολίας (α ή β-)
2. Μονοενεργειακή ακτινοβολία γ και ανιχνεύσιµη από τις χρησιµοποιούµενες
ανιχνευτικές διατάξεις µε µια βέλτιστη τιµή 100-300 KeV.
3. Χρόνο υποδιπλασιασµού του ραδιονουκλιδίου κατάλληλο ώστε να είναι δυνατή η
σύνθεση του φαρµάκου, η διεκπεραίωση της εξέτασης και η σύντοµη αποβολή του
από τον οργανισµό. (Μακρόβια ραδιονουκλίδια πρέπει να αποφεύγονται διότι
ακτινοβολείται άσκοπα ο ασθενής.)
4. Τα θυγατρικά νουκλίδια που προκύπτουν από την διάσπαση των ραδιονουκλιδίων
είναι επιθυµητό να µην είναι ραδιενεργά, ή εάν είναι, να έχουν µικρό χρόνο
ηµιζωής
5. Η µέθοδος παρασκευής του ραδιονουκλιδίου να είναι σχετικά απλή και χαµηλού
κόστους, το δε παραγόµενο ραδιονουκλίδιο να είναι υψηλής ειδικής ραδιενέργειας,
και να µπορεί να διατίθεται εύκολα στα νοσοκοµεία.
Θα πρέπει να τονιστεί ότι η υψηλή ειδική ραδιενέργεια ενός ραδιονουκλιδίου
περιορίζει σηµαντικά την τοξικότητα του ραδιοφαρµάκου καθόσον η τελική
επισηµασµένη ένωση είναι της τάξης των mg ή µg.
Στην σύγχρονη διαγνωστική χρησιµοποιείται ένας µεγάλος αριθµός ενώσεων
συναρµογής ραδιενεργών µετάλλων. Το 80% περίπου των διαγνωστικών εξετάσεων µε
ραδιονουκλίδια σήµερα, γίνεται µε ραδιοφαρµακευτικές ενώσεις του τεχνητίου-99m.

ΧΡΗΣΗ ΕΝΩΣΕΩΝ ΣΥΝΑΡΜΟΓΗΣ ΣΤΗ ∆ΙΑΓΝΩΣΗ
125
Προηγουµένως όµως θα αναφερθούµε περιληπτικά στις σύγχρονες απεικονιστικές
διατάξεις που χρησιµοποιούν ραδιονουκλίδια γ-ακτινοβολίας.
1. Απεικονιστικές διατάξεις για in vivo µέτρηση της γ-ακτινοβολίας
Η βασικότερη ανιχνευτική διάταξη που χρησιµοποιείται για την ανίχνευση των
µορφολογικών αλλοιώσεων που προκαλούνται από όγκους ή άλλες παθολογικές
καταστάσεις είναι ο µετρητής ραδιενέργειας ο οποίος καταγράφει τον αριθµό κρούσεων
από µια περιοχή του σώµατος, µετά από χορήγηση ενός ραδιοφαρµάκου. Ο πιο
συνηθισµένος µετρητής ραδιοενέργειας είναι ο σπινθηριστής ΝaΙ που αποτελείται από ένα
µικρό κρύσταλλο ΝaΙ (Τl) διαµέτρου 2.5 ιντσών, συνδεδεµένο µε φωτοπολλαπλασιαστή.
Κατά τη διέγερση του κρυστάλλου λόγω της ακτινοβολίας, παράγονται ηλεκτρόνια, τα
οποία ενισχύονται µέσω του φωτοπολλαπλασιαστή και λαµβάνεται τελικά το ηλεκτρικό
σήµα (παλµός) που αντιστοιχεί στην ένταση της προσπίπτουσας στο κρύσταλλο
ακτινοβολίας. Ο ρυθµός των παραγόµενων σηµάτων (ή κρούσεων) καταγράφεται µε
αριθµούς, υπό τη µορφή πινάκων.
Ο κρύσταλλος φέρει θωράκιση από µόλυβδο µε οπές καθορισµένης διαµέτρου για
την ανίχνευση της ακτινοβολίας από τη επιθυµητή περιοχή. Το σύστηµα κρύσταλλος και
θωράκιση, γνωστό ως κατευθυντήρας (collimator), τοποθετείται πάνω από την προς
εξέταση περιοχή ή όργανο για τη µέτρηση της ακτινοβολίας, ενώ καταγράφεται ο ρυθµός
των παραγόµενων σηµάτων.
Η εξέλιξη της τεχνολογίας και η εισαγωγή των ηλεκτρονικών υπολογιστών
βοήθησαν σηµαντικά τον τοµέα εφαρµογής ραδιονουκλιδίων στην Πυρηνική Ιατρική έτσι
ώστε να προκύψουν πολύπλοκες ανιχνευτικές διατάξεις µεγάλης ευκρίνειας και να
αναπτυχθούν µέθοδοι λεπτοµερειακής απεικόνισης περιοχών του σώµατος.
Μια τέτοια σύγχρονη µετρητική διάταξη είναι η γ-camera τύπου Anger (1956).
Αποτελείται από τα εξής µέρη:
α) Τράπεζα εξέτασης του ασθενή µε µηχανική κίνηση προς όλες τις κατευθύνσεις.
β) Ανιχνευτή (στατικό) ο οποίος δεν εκτελεί σάρωση. Αποτελείται από 7 κρυστάλλους
NaI(Tl), µεγάλης διαµέτρου, σε κατάλληλη διάταξη µε τους αντίστοιχους
φωτοπολλαπλασιαστές.
γ) Σύστηµα ενίσχυσης και επεξεργασίας των σηµάτων που παράγονται από την
ανιχνευτική διάταξη (ηλεκτρονικές διατάξεις).
δ) Σύστηµα αποτύπωσης αποτελεσµάτων και οθόνη παρακολούθησης της εξεταζόµενης
περιοχής ή οργάνου.

ΚΕΦΑΛΑΙΟ 5
126
Τα σπινθηρογραφήµατα που λαµβάνονται µε γ-camera είναι δύο διαστάσεων και
δεν παρέχουν πληροφορίες ως προς το βάθος του οργάνου. Η δυσδιάστατη απεικόνιση
παρέχει πληροφορίες για την έκταση της βλάβης όχι όµως και για την ακριβή της θέση
µέσα στον ιστό. Για να προσδιοριστεί το βάθος, απαιτείται η συλλογή µεγάλου αριθµού
πληροφοριών ή δεδοµένων από διαδοχικές θέσεις της γ-camera γύρω από την εξεταζόµενη
περιοχή. Ο συνδυασµός των δεδοµένων και η µελέτη τους ώστε να εντοπιστεί η θέση της
βλάβης ως προς το βάθος είναι µια διαδικασία επίπονη, πρακτικά µη εφαρµόσιµη ώστε να
θεωρείται βασικό µειονέκτηµα της µεθόδου. Επίσης ένα δεύτερο σηµαντικό µειονέκτηµα
είναι η παρεµβολή της ακτινοβολίας υποστρώµατος (background), που προέρχεται από
τους ιστούς γύρω από το εξεταζόµενο όργανο, µε συνέπεια τη µείωση της διακριτικής
ικανότητας της ανιχνευτικής διάταξης και τη λήψη µη ευκρινών σπινθηρογραφηµάτων.
Οι δυσκολίες αυτές αντιµετωπίστηκαν µε την εισαγωγή νέων προηγµένων µεθόδων
απεικόνισης και ανιχνευτικών διατάξεων όπως η Υπολογιστική Τοµογραφία
Μονοφωτονικής Εκποµπής (SPECT).
Η Υπολογιστική Τοµογραφία Μονοφωτονικής Εκποµπής (SPECT, Single
Photon Emission Computerized Tomography) αποτελεί σύγχρονη απεικονιστική µέθοδο.
Εδώ χρησιµοποιούνται ραδιονουκλίδια τα οποία εκπέµπουν µονοενεργητική ακτινοβολία-
γ και µέση ενέργεια περίπου 150 KeV όπως είναι το 99mTc, το 123I, το 111In.
Κατά τη µέθοδο αυτή, ανιχνευτικές διατάξεις τύπου γ-camera προσαρµόζονται σε
άξονα, ώστε το ανιχνευτικό σύστηµα να περιστρέφεται γύρω από τον ασθενή µε
κατάλληλο κινητήρα και να λαµβάνονται προβολές της κατανοµής του ραδιοφαρµάκου
στην περιοχή εξέτασης. Τα αποτελέσµατα παρουσιάζονται στον ηλεκτρονικό υπολογιστή
είναι δε δυσδιάστατες εικόνες που αναπαριστούν την κατανοµή του ραδιοφαρµάκου στο
εξεταζόµενο όργανο σε εγκάρσιες τοµές (ξεχωριστές επίπεδες επιφάνειες). Κατ’αυτόν τον
τρόπο προσδιορίζεται η θέση και η έκταση της βλάβης, ενώ δύναται να προσδιοριστεί η
ποσοστιαία πρόσληψη του ραδιοφαρµάκου σε οποιαδήποτε περιοχή του υπό µελέτη
οργάνου.

ΧΡΗΣΗ ΕΝΩΣΕΩΝ ΣΥΝΑΡΜΟΓΗΣ ΣΤΗ ∆ΙΑΓΝΩΣΗ
127
2. Τεχνήτιο -99m (99mTc)1
Το τεχνήτιο είναι το 43ο στοιχείο του περιοδικού πίνακα. Ανήκει στην τέταρτη
περίοδο και δεύτερη σειρά των στοιχείων µεταπτώσεως όπου µε το µαγγάνιο (Mn) και το
ρήνιο (Re) απαρτίζουν την VIIΒ υποοµάδα. Ο Mendeleev είχε προβλέψει τη θέση του στο
περιοδικό σύστηµα η οποία παρέµενε κενή. Το 1937 οι Perrier και Serge ανακάλυψαν το
τεχνήτιο συµπληρώνοντας τη θέση του στο περιοδικό σύστηµα. Ανακαλύφθηκε κατά το
βοµβαρδισµό του µολυβδαινίου από δευτερόνια σε κύκλοτρο. Οι ερευνητές πρότειναν την
ονοµασία τεχνήτιο (technetium, Tc) από την ελληνική λέξη “τεχνητός” επειδή ήταν το
πρώτο στοιχείο που παρασκευάστηκε τεχνητά. Σύµφωνα µε τον κανόνα του Mattauch ‘δύο
στοιχεία µε διαδοχικούς ατοµικούς αριθµούς και ίδιους µαζικούς, δεν µπορεί να είναι και
τα δύο σταθερά’. Έτσι το τεχνήτιο δεν είναι σταθερό, εφόσον τα γειτονικά του ισοβαρή
νουκλίδια, µολυβδαίνιο και ρουθήνιο, είναι σταθερά.
Το 99mTc παράγεται κατά τη διάσπαση του µητρικού ραδιονουκλιδίου 99Mo, το
οποίο παράγεται σε πυρηνικό αντιδραστήρα µε βοµβαρδισµό του 98Μο µε θερµικά
νετρόνια2. Το 99Mo (T½ =67 ώρες3) διασπάται µε εκµποµπή β-ακτινοβολίας4
(β3=1,23MeV, 85%) προς το µετασταθερό ραδιονουκλίδιο 99mTc (T½=6,02 ώρες). Το
τελευταίο διασπάται µε εκποµπή γ-ακτινοβολίας5 (140KeV, ισοµερής µετάπτωση) προς το
ψευδοσταθερό 99Tc, το οποίο, στη συνέχεια, υφίσταται µεταστοιχείωση προς το σταθερό
ρουθήνιο (99Ru) µε εκποµπή β-ακτινοβολίας (T½ =2,1×105 έτη).
67 ώρες 6 ώρες 2,1×105 έτη 99
42Mo 99m
43Tc 99
43Tc 99
44Ru
β γ β
Το τεχνήτιο παραλαµβάνεται από τις γεννήτριες µολυβδαινίου-99/τεχνητίου-99m. Η
γεννήτρια 99Mo/99mTc είναι µια χρωµατογραφική στήλη αλούµινας (Al2O3) στην οποία
1 Συµβολισµός ραδιονουκλιδίων: AZQN, A=µαζικός αριθµός:αρ. πρωτονίων (Ζ) + αρ. νετρονίων (Ν). Ο αριθµός πρωτονίων Ζ λέγεται ατοµικός αριθµός. 2 Κατά το βοµβαρδισµό µε νετρόνια ο πυρήνας του Mo προσλαµβάνει 1 νετρόνιο και ο µαζικός αριθµός αυξάνει κατά ένα Α=98+1=99. 3 Χρόνος ηµιζωής ραδιονουκλιδίου Τ1/2 είναι ο χρόνος που χρειάζεται για τη διάσπαση των µισών πυρήνων Νο/2. 4 β-ακτινοβολία: εκποµπή β σωµατίδιων, δηλαδή ηλεκτρονίων που προέρχονται από το πυρήνα. β σωµατίδια δηµιουργούνται κατά τη διάσπαση ενός νετρονίου σε πρωτόνιο και ηλεκτρόνιο: n p + β, κι έχουν ως αποτέλεσµα ο θυγατρικός πυρήνας να βρίσκεται στο περιοδικό πίνακα µια θέση δεξιά: Ζ+1. 5 γ-ακτινοβολία: εκποµπή ηλεκτροµαγνητικής ακτινοβολίας από το πυρήνα (γ: λ <10-8cm)

ΚΕΦΑΛΑΙΟ 5
128
είναι επιστοιβαδευµένο µολυβδαινικό νάτριο (Νa2ΜοΟ4). Κατά τη β-διάσπαση του
µολυβδαινίου παράγεται το τεχνήτιο-99m µε τη µορφή υπερτεχνητικού νατρίου,
Na99mTcO4. Η παραλαβή του τεχνητίου-99m γίνεται µε έκλουση της γεννήτριας µε
φυσιολογικό ορό, υπό κενό. Στο υπερτεχνητικό νάτριο, το τεχνήτιο βρίσκεται στην
οξειδωτική κατάσταση VII. Για να χρησιµοποιηθεί περαιτέρω για τη παρασκευή
ραδιοφαρµάκων πρέπει να αναχθεί στην επιθυµητή οξειδωτική κατάσταση.
Χρήσεις ραδιοφαρµάκων του τεχνητίου.
Οι ραδιοφαρµακευτικές ενώσεις του τεχνητίου-99m βρίσκουν ευρεία εφαρµογή στην
απεικόνιση της αιµάτωσης τους µυοκαρδίου, του εγκεφάλου, των νεφρών. Καθώς και
χρησιµοποιούνται για την ανίχνευση παθήσεων του ήπατος, των οστών, των πνευµόνων,
του θυροειδούς και επιπλέον στη διάγνωση του καρκίνου.
3. Γάλλιο (Ga) και Ίνδιο (In)
Τα στοιχεία αυτά βρίσκονται µαζί µε το αργίλιο, Al, και το θάλλιο, Tl στην
οµάδα ΙΙΙΑ του περιοδικού πίνακα. Τα στοιχεία αυτά στη φύση βρίσκονται σε
ιχνοποσότητες σε κοιτάσµατα βωξίτη, Al2O2.n H2O.
Παραλαµβάνονται στη µεταλλική κατάσταση µε ηλεκτρόλυση υδατικών
διαλυµάτων των αλάτων τους. Τα µέταλλά τους είναι µαλακά, λευκής χροιάς και
Σχήµα 1. Χηµική δοµή κυριότερων ραδιοφαρµάκων του τεχνητίου-99m

ΧΡΗΣΗ ΕΝΩΣΕΩΝ ΣΥΝΑΡΜΟΓΗΣ ΣΤΗ ∆ΙΑΓΝΩΣΗ
129
δραστικά. ∆ιαλύονται εύκολα σε οξέα. Το γάλλιο είναι επίσης διαλυτό σε
υδροξείδιο του νατρίου.
Το γάλλιο και το ίνδιο είναι ισχυρά οξέα κατά Lewis, έτσι υδατικά
διαλύµατά τους είναι όξινα, σύµφωνα µε την αντίδραση:
[Μ(H2O)6]3+ [Μ(H2O)5(OH)]2+ + H+, Ka: In=2x10-4, Ga=2.5 x10-3
Ιδιότητες υδροξειδίων: τo υδροξείδιo του γαλλίου, όπως και του αργιλίου,
είναι αµφοτερικά. Έτσι σε pH 3-9,5, σχηµατίζεται το δυσδιάλυτο τριοξείδιο του
γαλλίου, Ga(OH)3, σε pH> 9,5 όµως, το οξείδιο διαλυτοποιείται σε Ga(OH)4-:
Ga(OH)3 + OH- Ga(OH)4-
Τα υδροξείδια του ινδίου είναι δυσδιάλυτα σε pH> 3.5, όπου σχηµατίζεται το
κολλοειδές δυσδιάλυτο In(OH)3.
Χηµεία συναρµογής: Το γάλλιο(ΙΙΙ) έχει ιονική ακτίνα 76Å (όµοια µε του
Fe(III) 74Å) και σχηµατίζει ενώσεις συναρµογής µε αριθµό συναρµογής (ΑΣ) 6. Το
ίνδιο έχει ιονική ακτίνα 94 Å και σχηµατίζει σύµπλοκα µε ΑΣ 7. Είναι σκληρά οξέα
και συναρµόζονται µε πολυκαρβοξυλικά οξέα όπως κιτρικό, τρυγικό κλπ αλλά και
µε αµινοκαρβοξυλικούς συναρµοτές π.χ. EDTA, DTPA κλπ.
Ραδιονουκλίδια γαλλίου και ινδίου: Τα ισότοπα του ινδίου που
χρησιµοποιούνται στη πυρηνική ιατρική είναι τα In-113m, Ιn-111, In-115, τα οποία
εκπέµπουν γ ακτινοβολία και είναι κατάλληλα για διάγνωση. Πιο ευρέως
χρησιµοποιούµενο είναι το In-111 που παράγεται σε κυκλοτρόνιο από βοµβαρδισµό
καδµίου-111 µε δευτερόνια. Το In-111 διασπάται µέσω σύλληψης ηλεκτρονίου στο
κάδµιο-111 και παράγονται ακτίνες Χ ενέργειας 171, 245 keV. Ο χρόνος ηµιζωής
του ινδίου-111 είναι 2,8 ηµέρες.
Αντίστοιχα, τα ισότοπα του γαλλίου που χρησιµοποιούνται στη πυρηνική
ιατρική για διάγνωση είναι τα Ga-67, Ga-68. Το Ga-67 παράγεται σε κυκλοτρόνιο
από βοµβαρδισµό Zn-67 µε δευτερόνια. ∆ιασπάται µέσω σύλληψης ηλεκτρονίου
στον ψευδάργυρο-67 και παράγονται ακτίνες Χ ενέργειας 94, 184 και 296 keV. Ο
χρόνος ηµιζωής του γαλλίου-67 είναι 79,2 ώρες.
Μεγαλύτερο ενδιαφέρον παρουσιάζει, σήµερα, το γάλλιο-68 το οποίο
παράγεται σε γεννήτρια γερµανίου-68/γαλλίου-68. Το γάλλιο-68 διασπάται σε
ψευδάργυρο-68 µέσω εκποµπής ποζιτρονίου, ενέργειας 1,89 MeV και 0,822 MeV
και χρόνο ηµιζωής 1,1 ώρες. Το ποζιτρόνιο κατά την αλληλεπίδραση µε σωµατίδια

ΚΕΦΑΛΑΙΟ 5
130
της ύλης εξαϋλώνεται µε αποτέλεσµα την παραγωγή γ ακτινοβολίας, ενέργειας 511
keV.
Βιολογικές ιδιότητες του γαλλίου και ινδίου: Λόγω του ότι το γάλλιο και
το ίνδιο είναι τρισθενή κατιόντα µε ιοντικές ακτίνες όµοιες του τρισθενούς σιδήρου,
Fe3+ (74Å), Ga3+(76 Å), In3+ (94 Å) στο αίµα συµπεριφέρονται όπως ο σίδηρος και
συνδέονται µε τη πρωτεΐνη µεταφοράς του σιδήρου, τρανσφερρίνη. Έτσι οι ενώσεις
συναρµογής τους πρέπει να είναι σταθερότερες από τις αντίστοιχες ενώσεις τους µε
την τρανσφερρίνη. Επιπλέον, καθώς το γάλλιο και το ίνδιο είναι ισχυρά οξέα, οι
ενώσεις τους δε πρέπει να υδρολύονται στο pH του αίµατος, γιατί σχηµατίζουν
δυσδιάλυτα υδροξείδια.
Χρήσεις: α) Το InCl3 χρησιµοποιείται για την απεικόνιση της δεξαµενής του
αίµατος και τη διάγνωση παθήσεων του αίµατος. Η χρήση του βασίζεται στο
γεγονός ότι το In3+ συνδέεται µε τη τρανσφερίνη του αίµατος, αντικαθιστώντας το
τρισθενή σίδηρο.
β) Η ένωση συναρµογής του ινδίου µε το DTPA, έχει µεγάλη σταθερότητα
στο αίµα, και ως υδρόφιλη αποβάλλεται από τα νεφρά έτσι χρησιµοποιείται για τη
µελέτη της σπειραµατικής διήθησης των νεφρών.
γ) Τα κολλειδή υδροξείδια Ιn(OH)3 και Ga(OH)3 χρησιµοποιούται για τη
µελέτη της λειτουργίας του ήπατος και του σπλήνα. Καθώς και για τη διάγνωση
λεµφωµάτων και λευχαιµίας.
δ) Οι ενώσεις συναρµογής του ινδίου και γαλλίου µε το διδραστικό
συναρµοτή, 8-υδροξυκινολίνη, In-(υδροξυκινολίνη)3 και Ga-(υδροξυκινολίνη)3
χρησιµoποιούνται για την επισήµανση λευκών αιµοσφαιρίων ή αιµοπεταλίων. Το
ουδέτερο και λιπόφιλο σύµπλοκο Ιn/Ga(υδροξυκινολίνη)3 διαπερνά τη µεµβράνη
των λευκών αιµοσφαιρίων και δεσµεύεται στο εσωτερικό του κυττάρου. Με αυτό
το τρόπο επιτυγχάνεται η επισήµανση των λευκών αιµοσφαιρίων και γίνεται δυνατή
η διάγνωση και η εντόπιση της φλεγµονής.
N
OIn
NON
O

ΧΡΗΣΗ ΕΝΩΣΕΩΝ ΣΥΝΑΡΜΟΓΗΣ ΣΤΗ ∆ΙΑΓΝΩΣΗ
131
ΙΙ. ΑΠΕΙΚΟΝΙΣΗ ΜΕ ΤΗ ΜΕΘΟ∆Ο ΤΟΥ ΠΥΡΗΝΙΚΟΥ MΑΓΝΗΤΙΚΟΥ
ΣΥΝΤΟΝΙΣΜΟΥ (MRI)
Οι ενώσεις συναρµογής που χρησµοποιούνται στην τεχνική του MRI αποτελούν
αντιδραστήρια αντίθεσης, έχουν δηλαδή σαν σκοπό την ενίσχυση του σήµατος στις
περιοχές όπου συγκεντρώνονται.
Πριν εκτεθεί αναλυτικά ο τρόπος επιλογής των µεταλλικών ιόντων και των
συναρµοτών που χρησιµοποιούνται για την παρασκευή των αντιδραστηρίων αντίθεσης θα
γίνει περιληπτική αναφορά στην απεικονιστική τεχνολογία MRI.
1. Μαγνητική Τοµογραφία ( Magnetic Resonance Imaging, MRI)
Η τεχνολογία Απεικόνισης Μαγνητικού Συντονισµού στηρίζεται στον συντονισµό
πυρήνων υδρογόνου (Nuclear Magnetic Resonance, NMR ή Proton Magnetic Resonance,
PMR). Στηρίζεται δηλαδή στην ίδια αρχή µε τη γνωστή τεχνολογία NMR που
χρησιµοποιείται για την ταυτοποίηση ενώσεων.
Εκτός από τα ηλεκτρόνια που παρουσιάζουν ηλεκτρονιακό spin S, και οι πυρήνες,
ανάλογα µε το συνδυασµό ατοµικού και µαζικού αριθµού, εµφανίζουν πυρηνικό spin I και
παρουσιάζουν πυρηνική µαγνητική ροπή µ.
• Πυρήνες µε άρτιο µαζικό και ατοµικό αριθµό παρουσιάζουν: Ι = 0
• Πυρήνες µε περιττό µαζικό αριθµό παρουσιάζουν: ηµιπεριττό spin I=1/2, 3/2, 5/2
• Πυρήνες µε άρτιο µαζικό και περιττό ατοµικό αριθµό παρουσιάζουν: ακέραιο spin I=1, 2, 3.
• Πυρήνες µε Ι=0 δεν εµφανίζουν µαγνητική ροπή (µ = 0).
• Πυρήνες που παρουσιάζουν spin διάφορο του µηδενός Ι ≠ 0 εµφανίζουν µαγνητική ροπή και
µπορούν να υποστούν το φαινόµενο του πυρηνικού µαγνητικού συντονισµού.
Απ’ αυτούς ιδιαίτερο ενδιαφέρον για την εφαρµογή του φαινόµενου του
συντονισµού για την εξαγωγή χρήσιµων αποτελεσµάτων, παρουσιάζουν οι πυρήνες µε Ι =
½ και ιδιαίτερα ο πυρήνας του υδρογόνου, δηλ.το πρωτόνιο 1H. To πρωτόνιο αποτελεί το
99,98% του φυσικού στοιχείου υδρογόνου. Για την τεχνική MRI ιδιαίτερα σηµαντικό είναι
το γεγονός οτι το 1H απαντάται στο νερό αλλά και σε όλα τα µακροµόρια του οργανισµού.
Όταν πυρήνες υδρογόνου (Ι = ½) βρεθούν σε ισχυρό µαγνητικό πεδίο έντασης Ηο
προσανατολίζονται, ώστε η µαγνητική τους ροπή τείνει να γίνει παράλληλη του πεδίου.
Παράλληλα οι πυρήνες αρχίζουν να εκτελούν µεταπτωτική κίνηση γύρω από τον άξονα
του ισχυρού µαγνητικού πεδίου. Η συχνότητα, ν, της µεταπτωτικής αυτής κίνησης
(συχνότητα Larmor), εξαρτάται από τη µαγνητική ροπή µ, του πυρήνα και από την ένταση

ΚΕΦΑΛΑΙΟ 5
132
του πεδίου Ηο (ν=2µΗο/h).
Στην κατάσταση αυτή οι πυρήνες βρίσκονται στην βασική τους κατάσταση που
αντιστοιχεί σε Ενέργεια Ε1 µικρότερη από την ενέργεια που είχαν εκτός πεδίου, οπότε
είχαν τυχαίο προσανατολισµό. Στην βασική αυτή κατάσταση χαµηλής ενέργειας
αντιστοιχεί µια διεγερµένη κατάσταση υψηλής ενέργειας Ε2 που χαρακτηρίζεται από
αντίθετο πυρηνικό spin (I = -1/2) και αντίθετο προσανατολισµό. Η ενέργεια που απαιτείται
για τη µετάβαση από τη µία κατάσταση στην άλλη είναι:
∆Ε = Ε2-Ε1 = h ν = 2 µ Ηο.
Σχήµα 2. Προσανατολισµός πυρήνων υδρογόνου µέσα σε µαγνητικό πεδίο και ενέργεια
θεµελειώδους και διεγερµένης καταστάσεως.
Για να προκαλέσουµε διέγερση των πυρήνων εφαρµόζουµε µαγνητικό πεδίο
µικρότερη έντασης, µε ένταση H1 κάθετη στην Ho και συχνότητα της τάξης των
ραδιοσυχνοτήτων. Όταν η συχνότητα του µεταβλητού πεδίου Η1 γίνει ίση µε τη
συχνότητα της µεταπτωτικής τροχιάς του πυρήνα (συντονισµός), παρατηρείται µετάβαση
πυρήνων από τη βασική στη διεγερµένη κατάσταση µε ταυτόχρονη απορρόφηση
ενέργειας. Το µαγνητικό πεδίο έντασης Η1 παράγεται συνήθως από πηνίο και ο
συντονισµός γίνεται αντιληπτός από τη µεταβολή της έντασης του ρεύµατος στο κύκλωµα
του πηνίου.
Για να είναι δυνατή η εµφάνιση του σήµατος θα πρέπει οι διεγερµένοι πυρήνες να
µπορούν να αποδιεγείρονται γρήγορα ώστε ο λόγος n+/n- των πυρήνων που βρίσκονται
στη βασική κατάσταση προς τους πυρήνες που βρίσκονται στη διεγερµένη κατάσταση να
είναι πάντα ελαφρώς µεγαλύτερος από τη µονάδα. Η αποδιέγερση των διεγερµένων
πυρήνων χωρίς εκποµπή ακτινοβολίας γίνεται µε δύο τρόπους: α) µε αλληλεπίδραση spin-
πλέγµα και β) µε αλληλεπίδραση spin-spin.
Κατά την αποδιέγερση spin-πλέγµα η ενέργεια µετατρέπεται σε θερµική µε
Η1 Eβασική
Ε∆ιεγερµένη I = - 1/2 I = 1/2
H1
0 Ho
E I = - 1/2
I = + 1/2
z z΄
x
Ho

ΧΡΗΣΗ ΕΝΩΣΕΩΝ ΣΥΝΑΡΜΟΓΗΣ ΣΤΗ ∆ΙΑΓΝΩΣΗ
133
αποτέλεσµα την αύξηση της κινητικότητας και περιστροφής γειτονικών µορίων. Η
αποτελεσµατικότητα αυτής της αποδιέγερσης δηλώνεται µε το χρόνο αποδιέγερσης Τ1. Η
αποδιέγερση spin-πλέγµα σε πυρήνες µε Ι=1/2 πραγµατοποιείται µε:
i) αλληλεπίδραση µε άλλους µαγνητικούς πυρήνες µε Ι=1/2.
ii) αλληλεπίδραση µε µαγνητικούς πυρήνες που εµφανίζουν τετραπολική ροπή
(Ι>1) και
iii) αλληλεπίδραση πυρηνικού spin µε spin ηλεκτρονίων.
Σηµαντική µείωση του χρόνου αποδιέγερσης παρατηρείται στις περιπτώσεις ii) και iii).
Κατά την spin-spin αποδιέγερση η ενέργεια µεταφέρεται σε γειτονικό πυρήνα µε
αποτέλεσµα της σταδιακή µείωση της µαγνήτισης. Η αποτελεσµατικότητα αυτής της
αποδιέγερσης δηλώνεται µε το χρόνο αποδιέγερσης Τ2.
Α Β Γ
Σχήµα 3. Α) Στοιχειώδης διάταξη NMR µε ένα πηνίο, RF: ραδιοποµπός, Α: ανιχνευτής, Ε: ενισχυτής,
Κ: καταγραφέας, Ρ: Probe (θέση δείγµατος) Β) ∆ιάταξη MRI, Γ) MRI εγκεφάλου.
Κατά την εφαρµογή της τεχνολογίας MRI, ενδιαφέρει η απεικόνιση ενός οργάνου
του ανθρώπινου σώµατος. Το δείγµα, που είναι το ανθρώπινο σώµα ή µια περιοχή του,
τοποθετείται εντός του ισχυρού µαγνητικού πεδίου και γίνεται καταγραφή του σήµατος
του οργάνου για κάθε σηµείο ενός επιπέδου. Στη συνέχεια οι σηµειακές αυτές ενδείξεις
ενώνονται µε τη βοήθεια υπολογιστή και προκύπτει µία επίπεδη εικόνα που καλείται
µαγνητική τοµογραφία. Με την εφαρµογή της τεχνολογίας αυτής χρησιµοποιήθηκαν
ενώσεις που βοηθούν τον ακριβέστερο χαρακτηρισµό παθήσεων των διαφόρων
παρεγχυµατικών οργάνων, την απεικόνιση των αγγείων αλλά και των χοληφόρων και του
γαστρεντερικού σωλήνα.
2. Αντιδραστήρια αντίθεσης MRI

ΚΕΦΑΛΑΙΟ 5
134
Οι φαρµακευτικές ουσίες που µπορούν να χρησιµοποιηθούν για την βελτίωση της
εικόνας της µαγνητικής τοµογραφίας χωρίζονται σε δύο κατηγορίες:
Α) Θετικά αντιδραστήρια αντίθεσης: είναι ουσίες που προκαλούν αύξηση του σήµατος
και χρησιµοποιούνται για να κάνουν εντονότερη της εικόνα ενός οργάνου ή ιστού και να
επιτρέψουν την εµφάνιση αλλοιώσεων σ’ αυτό (π.χ. καρκινωµάτων). Είναι συνήθως
παραµαγνητικές ενώσεις ή αντιδραστήρια µικρού χρόνου αποδιέγερσης Τ1 ή συνδυασµός
αυτών.
Οι ιδιότητες που πρέπει να έχει ένα παραµαγνητικό σύµπλοκο για την εφαρµογή
του ως αντιδραστήριο αντίθεσης για ενίσχυση του σήµατος NMR είναι: α) ρυθµός
αποδιέγερσης. Το σύµπλοκο να εµφανίζει σηµαντική ικανότητα να αυξάνει το ρυθµό
αποδιέγερσης των µορίων του νερού. Ο ρυθµός αποδιέγερσης του νερού αυξάνει όταν το
νερό είναι συναρµοσµένο στο σύµπλοκο κι έχει ταχύ χρόνο ανταλλαγής. Επίσης, ο ρυθµός
αποδιέγερσης του νερού αυξάνεται κι όταν βρίσκεται στη δευτερογενή σφαίρα του
συµπλόκου, δηλαδή συγκρατείται µε δεσµούς υδρογόνου µε πολικά άτοµα των
συναρµοτών (Σχήµα 4). 10-20% µείωση στο χρόνο Τ1 θεωρείται ικανοποιητική. β) In-vivo
ειδική κατανοµή: η κατανοµή του παραµαγνητικού αντιδραστηρίου στον ιστό-στόχο να
είναι µεγαλύτερη από τους υπόλοιπους ιστούς. γ) in-vivo σταθερότητα, τοξικότητα.
Συνήθως τα σύµπλοκα των παραµαγνητικών µετάλλων είναι τοξικά στις συγκεντρώσεις
που χρησιµοποιούνται για να επιφέρουν ενίσχυση σήµατος. Γι’ αυτό απαραίτητα
προϋπόθεση είναι οι ενώσεις τους να είναι σταθερές in vivo. Η τοξικότητά τους είναι
συνδεδεµένη µε τη σταθερότητα των συµπλόκων τους. Επιπλέον ένα διαγνωστικό
αντιδραστήριο πρέπει να αποβάλλεται από των οργανισµό εντός µερικών ωρών µετά τη
χορήγησή του.
Σχήµα 4. Μόρια νερού συναρµοσµένα (εσωτερικής σφαίρας), εξωτερικής σφαίρας και µόρια
νερού στο περιβάλλον του συµπλόκου.
Συναρµοσµένο µόριο νερού (Εσωτερικής σφαίρας) Μη συναρµοσµένο
µόριο νερού (Εξωτερικής σφαίρας)

ΧΡΗΣΗ ΕΝΩΣΕΩΝ ΣΥΝΑΡΜΟΓΗΣ ΣΤΗ ∆ΙΑΓΝΩΣΗ
135
Ως αντιδραστήρια αντίθεσης για την ενίσχυση του σήµατος στις µαγνητικές
τοµογραφίες χρησιµοποιήθηκαν κυρίως ενώσεις συναρµογής του µαγγανίου, Mn(II) και
του γαδολινίου, Gd(III). Κυρίαρχη θέση ωστόσο στα θετικά αντιδραστήρια αντίθεσης
κατέχουν οι ενώσεις συναρµογής του γαδολινίου.
Β) Αρνητικά αντιδραστήρια αντίθεσης: είναι ουσίες που προκαλούν µείωση του
σήµατος και χρησιµοποιούνται τοπικά για να εµποδίσουν την απεικόνιση ενός ιστού
προκειµένου να φανεί καλύτερα η απεικόνιση ενός άλλου (π.χ. καρκινικών κυττάρων και
φυσιολογικών κυττάρων του ίδιου ιστού). Προκαλούν µείωση του χρόνου αποδιέγερσης
Τ2. Πάλι η αλλαγή αυτή στο ρυθµό αποδιέγερσης αφορά στα µόρια νερού τα οποία
αλληλεπιδρούν µε το αντιδραστήριο αντίθεσης. Ως τέτοια αντιδραστήρια
χρησιµοποιούνται υπερπαραµαγνητικές ενώσεις οξειδίων του σιδήρου(ΙΙΙ) µεγέθους 1-10
nm.
3. Ιδιότητες Ενώσεων του Γαδολινίου
Η πρώτη παραµαγνητική ουσία που χρησιµοποιήθηκε ως θετικό αντιδραστήριο
αντίθεσης µε τη τεχνολογία MRI είναι το γαδολίνιο (1988). Το γαδολίνιο (ΙΙΙ), είναι ένα
στοιχείο που ανήκει στη σειρά του Λανθανίου (λανθανίδες) µε ηλεκτρονική διαµόρφωση
Xe 4f7 που διαθέτει επτά µονήρη ηλεκτρόνια και εµφανίζει µαγνητική ροπή 7.9,
µεγαλύτερη από άλλα παραµαγνητικά στοιχεία. Μαζί µε τον Fe(III) και το Mn(II), το
γαδολίνιο αποτελεί ένα από τα καταλληλότερα παραµαγνητικά στοιχεία για χρήση ως
αντιδραστήριο αντίθεσης MRI, αφού ο επιτυγχανόµενος χρόνος αποδιέγερσης Τ1 είναι της
τάξης του 10-8 έως 10-10 s που είναι πολύ κοντά στη συχνότητα Larmor, προκαλώντας
ενίσχυση του σήµατος.
Αν και το ελεύθερο ιόν του Gd(III) είναι εξαιρετικά τοξικό, όπως όλα τα βαρέα
µέταλλα και σχηµατίζει ενώσεις συναρµογής, µε συνήθεις αριθµούς συναρµογής έξι, επτά
ή εννιά που παρουσιάζουν υψηλή σταθερά σταθερότητας και αποµακρύνονται άµεσα από
τον οργανισµό, µε αποτέλεσµα να µειώνεται κατά πολύ η τοξικότητα, ενώ δεν επηρεάζεται
η παραµαγνητικότητά του.
Η τοξικότητα του γαδολινίου έχει συνδεθεί µε τη δυνατότητα ανταλλαγής του
γαδολινίου, στα σύµπλοκά του, µε µεταλλικά ιόντα που βρίσκονται φυσιολογικά στον
οργανισµό όπως Zn, Cu, Ca και Fe µε κυριότερα τα ιόντα του Zn. Για το λόγο αυτό νέες
ενώσεις του γαδολινίου ελέγχονται πρώτα για τη δυνατότητα ανταλλαγής του Gd των
ενώσεων αυτών , κυρίως µε Zn. Επίσης, η οµοιότητα της ιονικής του ακτίνας µε αυτή του
Ca2+ προκαλεί τη συσσώρευση του ελεύθερου γαδολινίου στα οστά.
Η ένωση συναρµογής του Gd µε DTPA (διαιθυλενο-τριαµινο-πεντα-οξικό οξύ) µε

ΚΕΦΑΛΑΙΟ 5
136
σταθερά σταθερότητας 1023, ήταν η πρώτη ένωση του γαδολινίου που εγκρίθηκε για
φαρµακευτική χρήση στην USA, ήδη από το 1988. Η ένωση συναρµογής Gd µε DTPA
είναι ευρύτερα γνωστή µε την ονοµασία gadopentetate dimeglumine και κυκλοφορεί µε τις
εµπορικές ονοµασίες Magnevist και Μagnograf.
Αλλες ουσίες για τη δέσµευση του γαδολινίου αναφέρονται παρακάτω.
Χηµική ∆οµή ενώσεων του Γαδολινίου: Το σύµπλοκο [Gd(DTPA)(H2O)]-2 είναι
ανιονικό µε φορτίο -2 και αριθµό συναρµογής 9: περιέχει τρία άτοµα αζώτου, πέντε άτοµα
οξυγόνου των καρβοξυλικών οµάδων κι ένα συναρµοσµένο µόριο νερού. Η γεωµετρία
του συµπλόκου είναι τριγωνικό πρίσµα (Σχήµα 5) µε το νερό συναρµοσµένο στη θέση 2.
Άλλο διανιονικό σύµπλοκο ανάλογης δοµής είναι το[Gd(ΒΟPTA)(H2O)]-2. ∆ιαµιδικά
ανάλογα του DTPA είναι τα Γαδολίνιο(III) δις(µεθυλοαµιδο)-διαιθυλενοτριαµινο-
πενταοξικό οξύ, [Gd(BMA-DTPA)(H2O)], Gadodiamide, Omniscan και [Gd(BMΕA-
DTPA)(H2O)], OptiMark (Σχήµα 5).
Όλα τα σύµπλοκα του γαδολινίου µε ανάλογα του DTPA έχουν την ίδια γεωµετρία
τριγωνικού πρίσµατος.
Σχήµα 5. Γεωµετρική δοµή ενώσεων του γαδολινίου (ΙΙΙ).
Το σύµπλοκο [Gd(DΟΤΑ)(H2O)]-, µε το συναρµοτή 1,4,7,10-τετρα-αζα-
κυκλοδωδεκάνο- N,N',N'',N''',-τετραοξικό οξύ (1,4,7,10-tetraazacyclododecane
N,N',N'',N''',-tetraacetic acid, DOTA), είναι ανιονικό µε φορτίο -1 και αριθµό συναρµογής
9: περιέχει τέσσερα άτοµα αζώτου, τέσσερα άτοµα οξυγόνου των καρβοξυλικών οµάδων
κι ένα συναρµοσµένο µόριο νερού. Η γεωµετρία του συµπλόκου είναι τετραγωνικό
αντίπρισµα, µε το νερό συναρµοσµένο στη θέση 2. Ανάλογα της δοµής του DOTA έχουν
και τα σύµπλοκα του γαδολινίου µε συναρµοτές τα 1,4,7-τρις(καρβοξυµεθυλο)-10-(2'-
υδροξυπροπυλο)- 1,4,7,10-τετρα-αζα-κυκλοδωδεκάνο- N,N',N'',N''',-τετραοξικό οξύ
(1,4,7-tris(carboxymethyl)-10-(2'-hydroxypropyl)-1,4,7,10-tetra-aza-cyclododecame,
HPDO3A) και 1,4,7-τρις(καρβοξυµεθυλο)-10-(2'-(1 ,3΄,4΄-τριυδροξυ)-βουτυλο)- 1,4,7,10-
τετρα-αζα-κυκλοδωδεκάνο- N,N',N'',N''',-τετραοξικό οξύ (1,4,7-tris(carboxymethyl)-10-

ΧΡΗΣΗ ΕΝΩΣΕΩΝ ΣΥΝΑΡΜΟΓΗΣ ΣΤΗ ∆ΙΑΓΝΩΣΗ
137
(2'-(1 ,3΄,4΄-trihydroxy)-butyl)-1,4,7,10-tetra-aza-cyclododecame, DO3A-butrol). Τα
σύµπλοκα όµως [Gd(DO3A-butrol)(H2O)] και [Gd(HPDO3A)(H2O)] είναι ουδέτερα
(Σχήµα 6).
Σχήµα 6. Χηµική δοµή κυριότερων αντιδραστηρίων αντίθεσης του γαδολινίου(ΙΙΙ) και του
µαγγανίου(ΙΙ) που χρησιµοποιούνται στη Μαγνητική Τοµογραφία.
Χρήσεις-Μηχανισµός δράσης: Οι ενώσεις αυτές περιέχουν ένα µόριο νερού
συναρµοσµένο µε το γαδολίνιο. Η ταχύτητα ανταλλαγής του νερού είναι µεγάλη και λόγω
του ότι το Gd(III) είναι παραµαγνητικό προκαλεί την αύξηση του χρόνου αποδιέγερσης
του νερού στους ιστούς που αυτό βρίσκεται. Οι ενώσεις αυτές κατανέµονται στο
εξωκυττάριο υγρό και χρησιµοποιούνται για την ενίσχυση σήµατος στη Μαγνητική
Τοµογραφία. Έχουν γενική χρήση και χρησιµοποιούνται για την εξαγωγή συµπερασµάτων
που αφορούν την ύπαρξη όγκων, φλεγµονής και αγγειακών αλλοιώσεων, τον
προσδιορισµό της έκτασης και τη διαφοροποίηση τέτοιων αλλοιώσεων και την εµφάνιση
των άµεσα γειτονικών περιοχών (µαστοί, θώρακας, άνω κοιλιακός και πλευρικός χώρος.
[Mn(DPDP)]4-, Teslascan

ΚΕΦΑΛΑΙΟ 5
138
Τρόπος χορήγησης – ∆οσολογία. Η χορήγηση των ενώσεων του γαδολινίου
γίνεται µε τη µορφή µίας ενδοφλέβιας ένεσης. Οι δόσεις που χρησιµοποιούνται για τις
περισσότερες µελέτες είναι 0,1 mmol/Κg βάρους σώµατος. Η µαγνητική τοµογραφία
µπορεί να αρχίσει αµέσως µετά την χορήγηση. Τα βέλτιστα αποτελέσµατα επιτυγχάνονται
45 min µετά την χορήγηση.
Εφόσον είναι δυνατό η ενδοφλέβια χορήγηση γίνεται ενώ ο ασθενής είναι
ξαπλωµένος. Μετά την ένεση ο ασθενής πρέπει να µείνει υπό ιατρική παρακολούθηση
για τουλάχιστον µισή ώρα.
Aνεπιθύµητες ενέργειες: ∆ιακρίνονται σε ήπιες µέτριες έως και σοβαρές
αντιδράσεις. Στις ήπιες αντιδράσεις αναφέρεται ναυτία και έµετος (0.42%), κεφαλαλγία
(0.26%) και τοπικός πόνος (0.41%). Μέτριες έως σοβαρές αντιδράσεις όπως
βρογχόσπασµος, λαρυγγόσπασµος, οίδηµα προσώπου, ταχυκαρδία, αρρυθµία, διάχυτη
κνίδωση σε ποσοστό 1/5000 περίπου.
Aντενδείξεις: Oι σκιαγραφικές ουσίες στη Mαγνητική Tοµογραφία δεν πρέπει να
χορηγούνται σε ασθενείς µε γνωστή υπερευαισθησία σε αυτές. Πρέπει επίσης να
αποφεύγεται η χρήση τους σε ασθενείς µε νεφρική ανεπάρκεια και σε παιδιά. Εάν η χρήση
τους σε νεφροπαθείς ασθενείς κριθεί απαραίτητη θα πρέπει να προγραµµατίζεται
αιµοκάθαρση στις επόµενες 24 ώρες. Σε µια συνεδρία αιµοκάθαρσης αποµακρύνεται το
70% περίπου της χορηγηθείσας δόσης. Oι παραµαγνητικές σκιαγραφικές ουσίες επίσης θα
πρέπει να αποφεύγονται σε εγκύους και παιδιά κάτω των 2 ετών, όπου η ασφαλής
χορήγηση δεν έχει τεκµηριωθεί.
Τύχη στον οργανισµό: Τα σύµπλοκα του γαδολινίου δεν αλληλεπιδρούν µε
πρωτεϊνες ή άλλους βιολογικούς στόχους. Κατανέµονται γρήγορα στον εξωκυττάριο χώρο
και αποµακρύνονται χωρίς να µεταβολισθούν µέσω των νεφρών.
Μετά τη χορήγηση 0.1 mmol gadopentetate/kg βάρους σώµατος, η συγκέντρωση
του συµπλόκου φθάνει τα 0.6 mmole/L 3 min µετά την χορήγηση και τα 0.24 mmole/L
σε 60 min. Το 83% του φαρµάκου αποµακρύνεται από τα ούρα 6 ώρες µετά την ένεση
ενώ το 91% αποµακρύνεται 5 µέρες µετά την ένεση. Λιγότερο του 1% αποµακρύνεται από
τα ούρα.
4. Αντιδραστήρια αντίθεσης µαγγανίου και σιδήρου.
Άλλα αντιδραστήρια αντίθεσης που βρίσκονται σήµερα σε χρήση ή σε κλινικά
στάδια, περιλαµβάνουν ενώσεις του γαδολινίου, του µαγγανίου και του σιδήρου για ειδική

ΧΡΗΣΗ ΕΝΩΣΕΩΝ ΣΥΝΑΡΜΟΓΗΣ ΣΤΗ ∆ΙΑΓΝΩΣΗ
139
χρήση: α) ενώσεις λιπόφιλες που απεκκρίνονται µέσω του ηπατοχολικού και
χρησιµοποιούνται για την εκτίµηση καρκίνου του ήπατος, όπως το Mn-DPDP (σχήµα 5),
β) ενώσεις που προσλαµβάνονται από το δικτυοενδοθηλιακό σύστηµα (∆ΕΣ) των
κυττάρων Kupffer του ήπατος και χρησιµοποιούνται για την ενίσχυση σήµατος σε
περιπτώσεις καρκίνων του ήπατος που δεν περιέχουν ∆ΕΣ. Περιλαµβάνουν τις
σιδηροµαγνητικές ενώσεις οξειδίων σιδήρου(ΙΙΙ), όπως Endorem (AMI-25) και γ) για την
σκιαγράφηση του γαστρεντερικού σωλήνα όπου χρησιµοποιούνται σκιαγραφικά µε λήψη
από το στόµα ή από τον ορθό. Χρησιµοποιούνται ουσίες που προκαλούν αρνητική
σκιαγράφηση (χαµηλή ένταση σήµατος- π.χ. Ferristene-Abdoscan, Fetumoxsil-Lamirem)
και ουσίες για την θετική σκιαγράφηση (υψηλή ένταση σήµατος) µε βάση το γαδολίνιο
(gadopentetate-Magnevist R enteral).

ΚΕΦΑΛΑΙΟ 5
140

ΒΙΒΛΙΟΓΡΑΦΙΑ
1. Anuraj H Shankar and Ananda S Prasad. Zinc and immune function: the biological
basis of altered resistance to infection. Am J Clin Nutr 1998; 68 (suppl): 447S-63S.
Printed in USA 1998 American Society of Clinical Nutrition.
2. Beard, J. Dawson, H., Pinero, D.; Iron Metabolism: A Comprehensive Review.
Nutrition Reviews. 1996;54:295-317.
3. Bothwell, T.H. Overview and Mechanisms of Iron Regulation. Nutrition Reviews.
1995;53:237-245
4. Caravan P., Ellison J.J., McMurry T J. Lauffer .RB. Gadolinium(III) Chelates as MRI
Contrast Agents, Structure, Dynamics and Applications. Chem. Rev. 1999, 99, 2293-
2352.
5. Cohen Gary L, Bauer, William R. Banon Jacqueline K., Lippard Stephen J. Binding of
cis- and trans- Dichlorodiammineplatinium(II) to DNA: Evidence for Unwinding and
Shortening of the Double Hellix. Science, Vol. 203, 9 March 1979.
6. Darnel J., Lodish H.; Baltimore D, Molecular Cell Biology Second Edition, ISBN 0-
7167-207S-7, Scientific and American Books, N. York U.S.A. 1990.
7. E.R.Jamieson, S.J.Lippard, Structure, Recognition and Processing of cisplatin-DNA
adducts, Chem. Rev., 1999, 99, 2467-2498.
8. Frausto da Silva J.J.R. Williams, R.J.P., The Biological Chemistry of the elements.
The inorganic Chemistry of Life. Clarendon Press, Oxford, 1991.
9. Harris, Z. L., Takahashi, Y., Nfiyajima, R, Serizawa, M., MacGillivray, R. T. A., and
Gitlin, J- D. (1995).Aceruloplasminemia: Molecular characterization of this disorder
of iron metabolism. Proceedings of the National Academy of Sciences (USA) 92,
2539-2543.
10. Herbert FIeish; Bisphosphonates: Mechanism of action. Endocrine Reviews, 19(1): 80-
100
11. Lawrence Que. Metal Chisiers in Proteins. The American Chemical Society, 1988.

142
12. Lawson, D. M, Artymiuk, p. J., Yewdall, S. J., Livingstone, J. C., Treffry, A,
Luzzago, A., Levi, S., Arosio, P., Cesareni, G, Thomas, C. D., Shaw, W., and
Harrison, P. M. (1991). Solving the structure of human H ferritin by genetically
engineering intermolecular crystal contacts. Nature 349, 541.
13. Le Brun, N.E., Andrews, S.C., Guest, J.R., Harrison, P.M., Moore, G.R. and Thomson,
AJ. (1995) Identification of the ferroxidase centre of Escherichia Coli bacterioferritin.
Biochem. J. 312, 385-392.
14. Levi, S., Luzzago, A., Cesareni, G., Cozzi, A., Franceschinelli, F., Albertini, A., and
Arosio, P. (1988), Mechanism of ferritin iron uptake: activity of the H-chain and
deletion mapping of the ferro-oxidase site. A study of iron uptake and ferro-oxidase
activity of human liver, recombinant H-chain ferritins, and two H-chain deletion
mutants. J. Biol. Chem. 263, 18086.
15. Linde C. M., Goode C. A. Plenum Press New York and London
16. Lothar Rink and Holger Kirchner. Zic-Altered Immune Function and Cytokine
Production. International workshop "Zinc and Health: Current Status and Future
Directions" Bethesda, November 4-5, 1998 (Published as a supplement to The Journal
of Nutrition).
17. Low, H., Grebing, C.; Lindgren, A., Tally, M., Sun, I. L.., and Crane, F. L. (1987).
Involvement of transferrin in the reduction of iron by the transplasma membrane
electron transport system. J. Bioenerg. Biomembr. 19, 535.
18. Martin T. J. and Grill V. Bisphosphonates-mechanism of action. Australian Prescriber
Vol. 23 No. 6 2000.
19. Mustacich D. and Powis G. Thioredoxin reductase Reviw article. Biochem. J. 346. 1-8,
2000 (Printed in Great Britain).
20. Paterson, S., Armstrong, N. J., lacopetta, B. I, McArdle, H. J., and Morgan, E.H.
(1984). Intravesicular pH and iron uptake by immature erythroid cells. Journal of
Cellular Physiology 120, 225-32.
21. R. Sugiura, S.Oand T. Kuno. Molecular genetic analysis of the calcineurin signaling
pathways. Cell Mol. Life Sci. 58 (2001) 278-288.

143
22. Reedijk, J., "Improved understanding in platinum antitumor chemistry, "Chemical
Communications, 801, 1996.
23. Russell R.G., Rogers M.J, Biphosphonates: from the laboratory to the clinic and back
again. Bone 1999 Jul; 25(1):97-106.
24. Ruth S. MacDonald. The rofe of Zinc in Growth and Cell Proliferation. International
workshop "Zinc and Helth: Current Status and Future Directions" Bethesda, November
4-5, 1998 (Published as a supplement to The Journal of Nutrition).
25. Shongwe, M. S., Smith, C. A., Ainscough, E. W., Baker, H. M., Brodie, A.M., and
Baker, E. N. (1992). Anion binding by human lactoferrin: Results from
crystallographic and physicochemical studies. Biochemistry 31, 4451.
26. Song L, Hobaugh MR, Shustak C, Cheley S, Bayley H, Gouaux JE. Structure of
staphylococcal alpha-hemolysin, a heptameric transmembrane pore. Science Dec 13;
274(5294): 1859-66, 1996.
27. Stryer L. Biochemistry Third Edition. ISBN 0-7167-1843-X, W.H. Freeman and
Company, New York, 1988.
28. Yamashiro, D. J-, Tycko, B., Fluss, S. R., and Maxfield, F. R. (1984). Segregation of
transferrin to a mildly acidic (pH 6.5) para-Golgi compartment in the recycling
pathway. Cell 37, 789-800.
29. Yoshida, K., Furihata, K, Takeda, S., Nakamura, A., Yamamoto, K., Morita, H.,
Hiyamuta, S., Ikeda, S., Shimizu, N., and Yanagisawa, N. (1995). A mutation in the
ceruloplasmin gene is associated with systemic hemosiderosis in humans. Nat. Genet.
9, 267-273.
30. Zhai Xiaoquan, BeckmannHolger, Jantzen Hans-Michael, Essigmann John M.
Cisplatin-DNA Adducts Inhibit Ribosomal RNA Synthesis by Hijacking the
Transcription Factor Human Upstream Binding Factor. Biochemistry, 37, 1998.
31. Δήμητρα Κοβαλά-Δεμερτζή. Φάρμακα με βάση το μέταλλο. Βιοανόργανη Χημεία ΙΙ.
Πανεπιστημιακές Εκτυπώσεις. Ιωάννινα 1999.
32. Okano T, [Effects of essential trace elements on bone turnover-in relation to the
osteoporosis] Nippon Rinsho, 54(l):148-54 1996 Jan

144
33. Bockman RS; Boskey AL; Blumenthal NC; Alcock NW; Warrell RP Jr Gallium
increases bone calcium and crystallite perfection of hydroxyapatite. Calcif Tissue Int,
39(6):376-81 1986 Dec
34. Seligman PA; Moran PL; Schleicher RB; Crawford ED Treatment with gallium
nitrate: evidence for interference with iron metabolism in vivo. Am J Hematol,
41(4):232-40 1992 Dec
35. Μανουσάκη Γ.Ε. « Γενική και Ανόργανη Χημεία» Εκδ. Οίκος Αφ.
Κυριακίδη, Θεσσαλονίκη,1984.
36. ΜανουσάκηΓ. Κεσίσογλου Δ. « Βιοανόργανη Χημεία» Εκδ. Οίκος Αφ.
Κυριακίδη, Θεσσαλονίκη, 1999.
37. Ιωάννη Α. Τοσίδη « Χημεία Ενώσεων Συναρμογής» Υπηρεσία Δημοσιευμάτων
Α.Π.Θ., Θεσσαλονίκη, 1986..
38. Silvia S. Jurisson, J. D. Lydon. Potential Technetium Small Molecule
Radiopharmaceuticals, Chem. Rev. 1999, 99, 2205-2218
39. Carolyn J. Anderson, Michael J. Welch, Radiometal-Labeled (Non- Technetium)
for Diagnostic Imaging, Chem. Rev. 1999, 99, 2219-2234.
40. Wynn A Volkert, Timothy J. Hoffman, Therapeutic Radiopharmaceuticals, Chem.
Rev. 1999, 99, 2269-2292.
41. Peter Caravan, Jeffrey J. Ellison, Thomas J. McMurry, Randal B. Lauffer,
Gadolinium(IH) Chelates as MRI Contrast Agents: Structure, Dynamics and
Applications, Chem. Rev. 1999, 99, 2293-2352.
42. Ernest Wong, Christen M. Giandomenico, Current Status of Platinum-Based
Antitumor Drugs, Chem. Rev, 1999, 99, 2451-2466.
43. K.H.Thompson, J. H. McNeill, C. Orvig, Vanadium Compounds as Insulin Mimics,
Chem. Rev., 1999, 99, 2561-2571.
44. Jan Reedijk, Why does Cisplatin Reach Guanine-N7 with Competing S-Donor Ligands
Available in the Cell, Chem. Rev., 1999, 99, 2499-2510.
45. Michael J. Clarke, Fuchun Zhu, Dominic R. Frasa, Non-Platinum Chemotharapeutic

145
Metallopharmaceuticals, Chem. Rev. 1999, 99, 2511-2533.
46. Bibudhendra Sarkar, Treatment of Wilson and Menkes Diseases, Chem. Rev.
1999,99,2535-2544.
47. F.A. Cotton, G. Wilksinson, C.A. Murillo, M. Bochmann, Advanced Inorganic
Chemistry, Wiley, 6th
Ed. 1999
48. F.A. Cotton, G. Wilkinson, P.L.Gaus, Basic Inorganic Chemistry, Wiley, 3rd Ed. 1995
49. R. B. Lauffer, Paramagnetic Metal Complexes as water Proton Relaxation agents for
NMR Imaging: Theory and Design, Chem. Rev. 1987, 87, 901-27.
50. G.G. Briand, N. Burford, Bismuth Compunds and preparations with biological or
medicinal relevance, Chem. Rev., 1999, 99, 2601-2657.
51. O. Andersen, Principles and Recent developments in Chelation Therapy of Metal
Intoxication, Chem. Rev., 1999, 99, 2683-271.
52. D.P.Riley, Functional Mimics of Syperoxide Dismutase Enzymes as therapeutic
agents, Chem. Rev., 1999, 99, 2573-2587.
53. Z.Guo, P.J. Sadler, Metals in Medicine, Angew. Chemie. Int.. Ed., 1999, 38, 1512-
1531.
54. P.J. Sadler, Z.Guo, Metals Complexes in Medicine: Design and Mechanism of action,
Pure and Appl. Chem., 1998, 70, 863-871.
55. Brown, J. P., Henwick, R- M_ and al., e. (1982). Human melanoma-associated antigen
p97 is structurally and functionally related to transferrin. Nature 296, 171.
56. Van Renswoude, J.3 Bridges, K. R., Harford, J. B., and Klausner, R. D.
(1982).'Receptor-mediated endocytosis and the uptake of iron in K562 cells:
/Identification of a non-Iysosomal acidic compartment. Proceedings of the
National Academy of Sciences (USA) 79, 6186-90.
57. Cox, J.W., Berners-Price, SJ, Davies, MS., Qu, Y., Farrell, N., 2001, "Kinetic Analysis
of the Stepwise Formation of a Long-Range DNA Interstrand Cross-link- by a
Dinuclear Platinum Antitumor Complex: Evidence for Aquated Intermediates and
Formation of Both Kinetically and

146
Thermondynamically Controlled Conformers," JACS, 123, pp. 1316-1326.
58. Henrissat B., Saloheimo M, Lavaitte S., Knowles J.K.C. Proteins 8:251-
257(1990).
59. Martindale, The Extra Pharmacopoeia, The Pharmaceutical Press, 28th
Ed.1982.
60. Μανουσάκης Γ. Γενική κι Ανόργανη Χημεία Β’ έκδοση, ISBN 960-343-271-7 Αφοί
Κυριακίδη, Θεσσαλονίκη, 1999.
61. J.A. Cowan, Inorganic Biochemistry, 2nd
Ed. Wiley, 1997
62. G. Thomas, Medicinal Chemistry: An introduction, Wiley, 2001
63. R. M. Roat-Malone, Bioinorganic Chemistry, Wiley, 2002
64. Εθνικό Συνταγολόγιο, 2003.
65. E.Χιωτέλλης, Ραδιοφαρμακευτική Χημεία, Εκδ. Πήγασος, Θεσ/νίκη 2004.
66. Ε.Χιωτέλλης, Φ. Ελευθερίου, «Κεφάλαια Βιοανοργάνου Φαρμακοχημείας», 2η εκδ.
Τμήμα Εκδόσεων Α.Π.Θ., Θεσ/νίκη 2005.
67. F. Shaw, Gold Therapeutics, Chem. Rev., 1999, 99, 2589-2600.